Present-day methods for intraocular pressure reduction (Overview article with test questions and credit points)
doi: 10.55342/szemhungarica.2025.162.2.53
Original scientific paper
Summary
The surgical management of glaucoma is currently undergoing significant advancements, driven by the increasing prevalence of glaucoma and the continuous pursuit of surgical techniques that minimise patient burden. Furthermore, the growing demand for an improved quality of life among patients plays an increasingly critical role in the evolution of treatment modalities and surgical interventions. The objective of minimally invasive glaucoma surgery (MIGS) is to achieve sustained and effective intraocular pressure (IOP) reduction while preserving ocular anatomy and minimising tissue disruption. This can be accomplished at the level of the trabecular meshwork, Schlemm’s canal, or the suprachoroidal space through the implementation of aqueous humour drainage implants or surgical techniques. Recently, novel implants have been introduced that facilitate aqueous outflow toward the subconjunctival space, similar to trabeculectomy, but with greater efficiency and a lower rate of surgical complications. In addition to monotherapy with topical hypotensive agents, selective laser trabeculoplasty (SLT) has been incorporated into international guidelines as a first-line treatment for primary open-angle glaucoma (POAG). Moreover, clinical studies investigating excimer and femtosecond laser trabeculotomy have demonstrated promising outcomes. Cyclodestructive laser procedures, historically reserved for refractory glaucoma, have significantly improved in safety and efficacy due to optimised energy delivery, enhanced intraoperative visualisation, and precise dosing, resulting in more predictable therapeutic outcomes.
Összefoglaló
A glaukóma sebészeti kezelése napjainkban jelentős fejlődésen megy keresztül, amelyet egyrészt a glaukómában szenvedő páciensek számának folyamatos növekedése, másrészt az orvostudomány azon törekvése indokol, hogy a műtéti technikák kevesebb megterheléssel járjanak. Ezen túlmenően a betegek igénye a jobb életminőség iránt is egyre fontosabb szerepet tölt be a kezelések és beavatkozások fejlődésében. A minimál invazív glaukómasebészet (MIGS) célja a szemen komolyabb anatómiai destrukció nélkül hosszú távú, hatékony szemnyomáscsökkentés elérése, jobb terápiás kontroll kialakítása. Ez történhet a trabekuláris hálózat, a Schlemm-csatorna vagy a suprachorioideális tér szintjén, csarnokvíz-elvezetést segítő implantátumok vagy műtéti technikák által. Napjainkra megjelentek olyan implantátumok is, amik a trabeculectomiához hasonlóan a subconjunctivális tér felé vezetik el a csarnokvizet az elülső csarnokból nagy hatékonysággal, mindezt alacsonyabb műtéti szövődményrátával. A szemcsepp-monoterápia mellett a primer nyílt zugú glaukóma (POAG) elsővonalbeli terápiájaként a szelektív lézer trabekuloplasztika (SLT) is szerepel a nemzetközi ajánlásokban. Az excimer és femtoszekundum lézer trabekulotomiával végzett klinikai vizsgálatok szintén ígéretes eredményekkel zárultak. Az eddig refrakter glaukóma kezelésére alkalmazott ciklodestruktív lézeres beavatkozások biztonsági profilja és hatékonysága az optimalizált energialeadás és az intraoperatív vizualizáció miatt a kiszámítható dozírozásnak köszönhetően szignifikánsan javult. A közlemény célja, hogy röviden összefoglalja azokat az eljárásokat, amik a glaukóma terápiájának modernkori szemléletéhez elengedhetetlenek.Keywords
minimal invasive, glaucoma surgery, implant, laser
Kulcsszavak
minimálinvazív, glaukómasebészet, implantátum, lézer
Bevezetés
A zöldhályog a retina ganglionsejtjeit érintő progresszív optikus neuropátiát okozó heterogén betegségcsoport, amely kezeletlen esetben visszafordíthatatlan látásvesztéshez vezethet. Az Egészségügyi Világszervezet (WHO) a zöldhályogot a világ egyik vezető vaksági okaként tartja számon. Becslések alapján 2020-ban világszerte több mint 76 millió ember lehetett érintett, és ez a szám 2030-ra várhatóan 94 millió főre fog emelkedni (1, 2).
A zöldhályog kezelésének legfőbb célja a látásfunkció megőrzése a betegség progressziójának lassításával vagy megállításával. Az Európai Glaukóma Társaság (EGS) 2021-ben megjelent terápiás irányelvei szerint a legfőbb befolyásolható rizikófaktor – továbbra is – az intraokuláris nyomás (IOP), ezért ennek csökkentése jelenti a kezelés elsődleges célját (3). Az elsővonalbeli kezelések közé tartoznak a szemcseppek és a lézeres eljárások, azonban előrehaladott esetekben sebészeti beavatkozás válhat szükségessé (4). Az elmúlt évtizedekben előtérbe kerültek kevésbé invazív glaukómaműtétek, amelyek felvetik a kérdést azzal kapcsolatban, hogy a sebészeti beavatkozások korábbi alkalmazása előnyösebb lehet-e a betegségmenedzsment, valamint a páciensek életminőségének szempontjából (5).
A glaukómasebészet története több mint egy évszázadra nyúlik vissza, azonban a legjelentősebb mérföldkövet a trabeculectomia 1968-as megjelenése jelentette (6). Ez a filtrációs műtét antimetabolitok alkalmazásával a mai napig aranystandardnak tekintendő a glaukóma műtéti kezelésében. Ugyanakkor a beavatkozás intra- és posztoperatív szövődményekkel, például túlzott hipotóniával vagy a filtrációs párna elégtelenségével járhat. A filtrációs műtétek mellett különböző egyéb sebészeti megoldások, csarnokvíz-elvezető hosszú tubusos implantátumok (Ahmed-sönt, Molteno-sönt, Baerveld-sönt) és nem filtrációs eljárások (deep sclerectomia, viscocanalostomia) is megjelentek. A ciklodestruktív módszerek, mint a cyclophotocoagulatio vagy cyclocryopexia, szintén szerepet játszanak a glaukóma kezelésében, de ezek általában nem első- vagy másodvonalban alkalmazott eljárások (7).
Az utóbbi években egyre nagyobb teret nyert a minimálisan invazív glaukómasebészet (MIGS), amely rövidebb műtéti időt és gyorsabb posztoperatív felépülést kínál. Ezek a technikák kevésbé radikális beavatkozást jelentenek a hagyományos filtrációs műtétekhez képest, és kisebb szövődményrátával rendelkeznek (5). Azonban nem minden esetben alkalmazhatók, hatékonyságuk trabeculectomiával összevetve korlátozott, és gyakran drága implantátumokat vagy speciális műszerparkot igényelnek. Fontos azt is megemlíteni, hogy a jelenleg rendelkezésre álló randomizált, kontrollált klinikai vizsgálatok alapján egységes terápiás ajánlás felállítása még nem lehetséges a MIGS tekintetében. Ennek ellenére a glaukómás betegek számának folyamatos növekedése miatt egyre nagyobb az igény az új, biztonságosabb és kevésbé invazív sebészeti megoldások iránt.
Minimál invazív glaukómasebészet (MIGS)
Az EGS 2022-es ajánlása alapján a minimál invazív glaukómasebészet fogalma alatt azokat a beavatkozásokat értjük, amelyeket ab-interno (csarnokzug vagy trabekuláris hálózat felőli) megközelítésből, filtrációs párna képzése nélkül végeznek. Ezek lehetnek implantátumok, amik a trabekuláris hálózatba vagy suprachorioideális térbe kerülnek beültetésre, vagy olyan eljárások, amelyek során a csarnokvíz konvencionális elfolyási útját alkotó képletek normál anatómiai szerkezetét módosítják különböző eszközökkel (1. táblázat). Fontos tisztában lenni azzal, hogy az alábbi eljárások vagy implantátumok jelenleg államilag támogatott formában nem elérhetők Magyarországon, bár számos európai országban rutinszerű az alkalmazásuk, korábban hazai közlemény is foglalkozott már hat implantátum részletes ismertetésével (30).
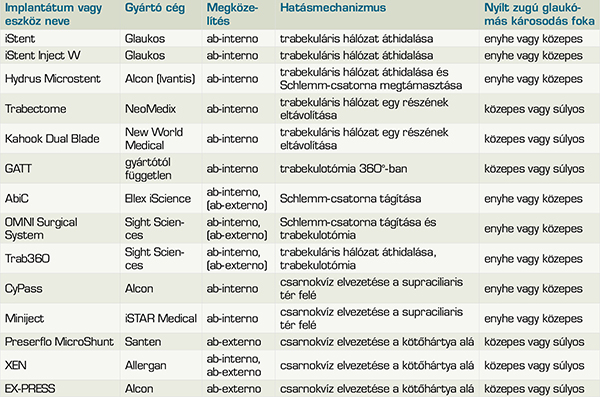
Trabekuláris hálózatot célzó eljárások
A trabekuláris hálózat áthidalására alkalmazott iStent (Glaukos) egy apró, titánium implantátum, amelyet a trabekuláris hálózatba helyeznek, hogy javítsa a csarnokvíz elvezetését a Schlemm-csatorna felé. Az iStent Inject W (Glaukos) rendszer két stentet tartalmaz, amelyeket egyetlen beavatkozás során ültetnek be (1. ábra). Szintén a trabekuláris hálózat áthidalására alkalmas a Hydrus Microstent (Alcon) (2. ábra). A flexibilis nitinol implantátum képes 90°-ban megtámasztani a Schlemm-csatorna falát, ezzel elősegítve a csarnokvíz elvezetését. Egy prospektív randomizált klinikai tanulmány alapján a Hydrus Microstenttel hatékonyabb szemnyomáscsökkentés volt elérhető, mint az iStent implantátumokkal (8). Az említett eszközök beültetését gyakran szürkehályog ellenes műtéttel kombináltan végzik (9). Az eljárás indikációs körébe olyan nyílt zugú glaukómával kezelt páciensek tartoznak, akiknél a betegség okozta funkcionális károsodás enyhe vagy közepes mértékű (10).

Forrás: optohellas.com/product/ophthalmology/trabecular-micro-by-pass/glaukos-istent-inject-w

Forrás: myalcon.com/professional/glaucoma/hydrus-microstent
A Trabectome (Neomedix) és a Kahook Dual Blade (New World Medical) működési elve a trabekuláris hálózat szerkezeti integritásának megbontásán alapszik. A Trabectome egy magas frekvenciájú mikroelektro-kauterizációra alkalmas eszköz, amellyel a trabekuláris hálózat és a Schlemm-csatorna belső fala 60-120°-ban eltávolítható (3). Előnye, hogy a műtét során keletkező vérzést képes csillapítani, valamint irrigálás-aspirálás révén a szövettörmeléket eltávolítani. Hátránya, hogy a Schlemm-csatorna endotheliuma a beavatkozás során károsodhat (3. ábra). Hasonló elven működik a Kahook Dual Blade, ami a műszer végén párhuzamosan elhelyezkedő kettős penge kialakítás révén precíz kimetszést tesz lehetővé, minimális károsodást okozva a környező szövetekben. Hátránya, hogy vérzés léphet fel alkalmazása során (4. ábra) (14). A trabekuláris hálózat szöveti integritását megbontó eljárások közül még kiemelendő a GATT (Gonioscopy-Assisted Transluminal Trabeculotomy vagy gonioszkópia irányításával végzett transzluminális trabekulotomia). A beavatkozás során a csarnokzug felől egy kis bemetszésen keresztül a Schlemm-csatornába 360°-ban bevezetett megvilágított mikrokatéter visszahúzásával vagy a csatornába bevezetett 5-0-ás vagy 6-0-ás polipropilén monofilamentum meghúzásával körkörös trabekulotomia végezhető. Ezen eljárások akár önállóan, de jobb szemnyomáscsökkenés elérésének érdekében szürkehályog ellenes műtéttel kombinálva is alkalmazhatók nyílt zugú glaukómában közepes és előrehaladott károsodás esetén (12).

Forrás: store.microsurgical.com/PublicStore/product/TrabectomePack,6,106.aspx

Forrás: newworldmedical.com/kdb-glide
A Schlemm-csatornát célzó eljárások
Az AbiC (Ab Interno Canaloplasty, Ellex iScience), az OMNI Surgical System (Sight Sciences) és a TRAB360 (Sight Sciences) olyan MIGS-eszközök, amelyek a Schlemm- csatorna megnyitásával vagy dilatációjával segítik a csarnokvíz elfolyását, ez által csökkentve a szemnyomást. Ezek az eljárások különböző mechanizmusokkal működnek, és eltérő előnyöket kínálnak a páciensek egyéni igényeinek megfelelően.
Az AbiC egy ab-interno eljárás, amely során a Schlemm-csatornába mikrokatéter kerül bevezetésre, majd azt 360°-ban vezetik végig rajta. A katéter visszahúzásakor egy időben viszkodilatáció is történik, ami segít fenntartani a csatorna nyitottságát és javítja az elfolyást a gyűjtő csatornák felé. Előnye, hogy megőrzi a Schlemm-csatorna integritását, és mivel nem igényel implantátumot vagy nagyobb beavatkozást, minimális a szövődmények kockázata. Ennek eredményeként különösen enyhe és közepesen súlyos primer nyílt zugú glaukómában lehet hatékony.
Az OMNI Surgical System egy kombinált eszköz, amely kanaloplasztikára és trabekulotomiára egyaránt alkalmazható. Az eljárás első lépése a Schlemm-csatorna tágítása viszkodilatációval, majd a trabekuláris hálózat részleges vagy teljes megnyitása, ami jelentősen fokozza a csarnokvíz elfolyását. Az OMNI egyik legnagyobb előnye a rugalmassága: a sebész dönthet arról, hogy csak a kanaloplasztikát végzi el, vagy kiegészíti azt a trabekulotomiával, így az eljárás egyénre szabható a páciens állapotának megfelelően. Az implantátum hiánya miatt a hosszú távú szövődmények kockázata alacsony és hatékonyabb lehet az előrehaladott nyílt zugú zöldhályogos esetekben is (5. ábra).
A TRAB360 egy egyszer használatos eszköz, ami kizárólag trabekulotomia végzésére szolgál. Az eljárás során a Schlemm-csatornába bevezetett műszert 180°-ban vagy 360°-ban végighúzzák, majd a trabekuláris hálózatot átszakítják, megnyitva az elfolyási utat. Ez az eljárás gyorsabb és egyszerűbb, mint az OMNI vagy az AbiC, és nagyobb szemnyomáscsökkentő hatás érhető el vele, mivel teljes trabekulotomiát végez. Hátránya, hogy gyakrabban alakul ki hyphaema, és következményes szemnyomás-kiugrás, valamint, mivel nem történik viszkodilatáció, a Schlemm-csatorna állapotát kevésbé befolyásolja.

Forrás: omnisurgical.com
Suprachorioidealis tér felé vezető implantátumok
Az elülső csarnok és a suprachorioidealis tér összekötésével az uveoscleralis elfolyás javítását célzó implantátumokról kevés hosszú távú eredmény áll rendelkezésünkre, a klinikai vizsgálatok jelenleg is zajlanak. Ennek a csoportnak volt egyik képviselője a CyPass Micro-Stent (Alcon). Habár a szemnyomást jelentősen csökkentette, 48 hónappal a műtétet követően szignifikáns cornealis endothelsejt-veszteség volt megfigyelhető feltételezhetően az implantátum pozíciója miatt, így 2018-ban kivonták a forgalomból (13).
A jelenleg az egyetlen kereskedelmi forgalomban lévő supraciliaris teret célzó implantátum a Miniject (iSTAR Medical), egy mikroporózus, flexibilis szilikonból készült eszköz, amellyel akár 40%-os szemnyomáscsökkenés is elérhető 24 hónappal a beültetését követően (14). A suprachorioidealis tér vastagsága változó, amelyet befolyásolhat az érhártyának vagy a szemnyomásnak a változása, ami bizonyos esetekben ezen eszközök elzáródásához vezethet (15) (6. ábra).
Nagyobb mértékű szemnyomáscsökkentő hatásuk miatt ezeknek az eljárásoknak az alkalmazása inkább közepesen súlyos és előrehaladott nyílt zugú glaukóma esetén javasolt (10).
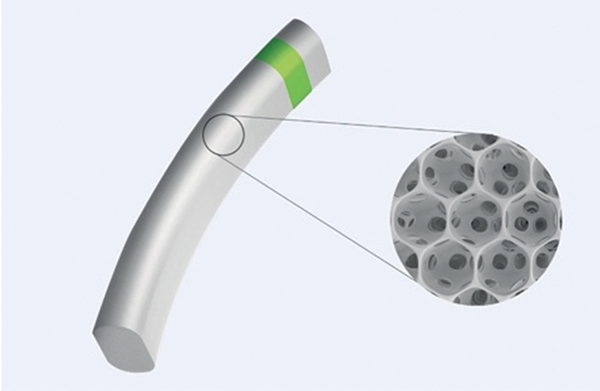
istar-medical.com/treatments/miniject-migs
Subconjunctivalis bleb képző eljárások
A trabeculectomiához hasonlóan céljuk a csarnokvíz alternatív úton történtő elvezetése a subconjunctivalis tér felé. Beültetésük során filtrációs párna képzése szükséges, valamint hegesedést gátló citotoxikumok (5-Fluorouracil, Mitomycin-C) alkalmazását javasolják. Mindezek alapján a subconjunctivalis bleb képző műtétek az EGS által meghatározott MIGS-definíciónak nem tesznek eleget, külön csoportként kezelendők.
Jelenleg Magyarországon az egyetlen kereskedelmi forgalomban elérhető képviselőjük a Preserflo MicroShunt (Santen) (7. A ábra). A 8,5 mm hosszú, 350 μm külső, és 70 μm lumen átmérővel rendelkező flexibilis biokompatibilis implantátumot ab-externo megközelítésből egy sclera-alagúton át vezetik be az elülső csarnokba. Nagy előnye a trabeculectomiával szemben, hogy a posztoperatív hipotónia rizikója alacsonyabb, valamint gyorsabb posztoperatív felépülést biztosít. Habár hatékonyságában nem múlja felül az aranystandardnak tekintendő filtrációs műtétet, kedvezőbb biztonsági profilja és a viszonylag gyors és könnyen elsajátítható műtéti technika miatt vonzó alternatívát jelenthet, különösen azoknál a betegeknél, akiknél a hagyományos műtét fokozott kockázattal járna (16) (7. B ábra).
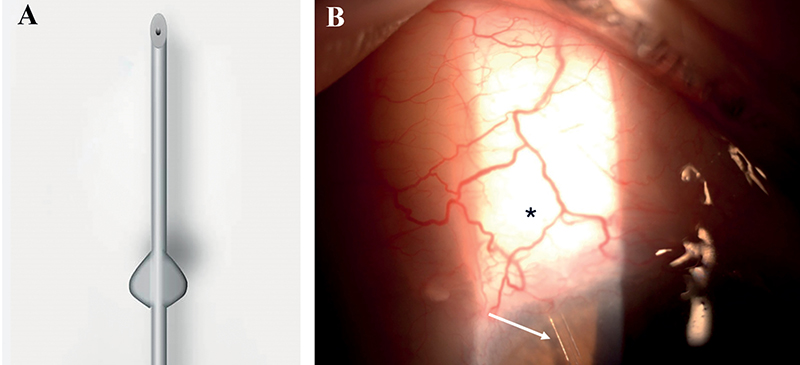
Forrás: santennederland.nl (A) PTE KK Szemészeti Klinika képanyaga (B)
Megemlítendő továbbá a Xen (Allergan) gél stent és az EX-PRESS Glaukóma Filtrációs Eszköz (Alcon), amelyek akár trabekulectomiához hasonló szemnyomáscsökkenést is tudnak biztosítani lényegesen kisebb intra- és posztoperatív szövődményráta mellett (17, 18). Mind a Xen-t, mind az EX-PRESS-söntöt több lumenátmérővel helyezték forgalomba. A XEN gél stent beültetése ab-interno és ab-externo megközelítésből is történhet, míg az EX-PRESS-sönt beültetése csak ab-externo módon javasolt (3).
Mindhárom eljárás magas szemnyomáscsökkentő potenciállal bír, azonban a posztoperatív gondozás terén fokozottabb odafigyelést igényelnek, mint a MIGS-csoportba tartozó beavatkozások. Beültetésük elvégezhető phacoemulsificatioval kombináltan is, és alkalmazásuk közepesen súlyos és előrehaladott zöldhályogos károsodás esetén javallott (10).
Lézeres eljárások
A lézeres beavatkozások kiemelkedő szerepet játszanak a glaukóma kezelésében, akár a csarnokvíz termelődésének vagy elvezetésének dinamikai tulajdonságait befolyásolva, akár manuális műtét kiegészítéseként.
A csarnokvíz elfolyásának elősegítését célzó eljárások
A szelektív lézer trabekuloplasztika (SLT) a jelenleg is érvényben lévő EGS-ajánlás alapján elsővonalbeli terápiás lehetőség a szemcsepp-monoterápia mellett a primer nyílt zugú glaukóma és okuláris hipertenzió kezelésében (19). A Nd: YAG-lézer a trabekuláris hálózat endothelsejtjei által fagocitált melanin szemcséket célozza, amelyek a lézer energiájának hatására szétesnek. Az impulzus időtartama rövidebb (3 nanoszekundum), mint a melanin szemcsék relaxációs ideje, így az erősen pigmentált sejtek szétesését váltja ki, és a környező struktúrákban nem okoz hegesedést. Az extracelluláris mátrix átalakítása következtében a trabekuláris hálózat porózusabb szerkezetűvé válik, csökken az ellenállás a csarnokvíz elfolyásának területén, így a szemnyomás is. A kezelés hatása a szövetek átalakulását követően tapasztalható, hozzávetőlegesen négy héttel a beavatkozás után. Az SLT ismételhető eljárás, körülbelül 20-25%-os szemnyomáscsökkenést lehet vele elérni, elsővonalbeli kezelésként és meglévő terápia kiegészítésére is alkalmas. Indikációs körébe nemcsak a primer nyílt zugú, hanem egyéb szekunder nyílt zugú glaukóma típusok (pigment glaukóma, pszeudoexfoliációs glaukóma) is tartoznak (20).
Míg az SLT a trabekuláris hálózat szerkezetének sejtszintű átalakulásait idézi elő, addig a lézeres trabeculectomiák a szövetek eltávolítása által hoznak létre elvezető utat az elülső csarnok és a Schlemm-csatorna között. Az excimer lézer trabeculectomia (ELT) során clear cornea seben keresztül ab-interno megközelítésből történik a csatorna kialakítása egy 308 nm hullámhosszú xenon lézerrel, intraoperatív gonioszkópia segítségével. A rendelkezésre álló szakirodalmi adatok alapján a szemnyomáscsökkentő hatása 20 és 40% közé tehető annak függvényében, hogy a beavatkozás önállóan vagy phacoemulsificatioval kombináltan történik (21).
Hasonló elven alapszik, mégis invazivitás szempontjából jóval kedvezőbb eljárás a FLIGHT (Femtosecond Laser Image-Guided High-precision Trabeculotomy), amely a nevéből adódóan 800 nm hullámhosszú femtoszekundum lézert alkalmaz, és a szemgolyó megnyitása nélkül képes kialakítani egy 500 μm × 200 μm széles, 400 μm hosszú csatornát az elülső csarnok és a Schlemm-csatorna között nagy felbontású gonio-kamera segítségével. A módszer kifejlesztésében Nagy Zoltán Zsolt professzor és munkacsoportja is részt vett: 12 páciens 18 szemén végezték el a beavatkozást és publikálták eredményeiket 24 hónappal a lézerterápiát követően, ami alapján az átlagos szemnyomáscsökkenés 34,6% volt, és a betegek több mint 80%-ánál hatékonynak bizonyult a kezelés (22).
A csarnokvíz termelődését csökkentő eljárások
Az eddig tárgyalt módszerek vagy implantátumok műtéti indikációjukat tekintve elsősorban nyílt zugú glaukómás betegek esetén alkalmazhatók, mivel a csarnokvíz elvezetésének valamilyen módját próbálják megvalósítani a meglévő anatómiai adottságokhoz igazodva.
A jelenlegi ajánlások alapján a ciklodestruktív eljárások a terápiás algoritmus végén helyezkednek el, a csarnokzug állapotától függetlenül elvégezhetők. A konvencionális, folyamatos lézersugárral végzett transscleralis cyclophotocoagulatio (CW-TSCPC) mellett ma már elérhetők a mikropulzus (MP3) lézer készülékek is. Előnyük, hogy míg a CW-TSCPC a sugártest kapillárisainak elzárása által roncsolja a csarnokvíz termeléséért felelős hámsejteket, addig a mikropulzus lézer részletekben adja le az energiát és három különböző módon (uveoscleralis elfolyás fokozódása, musculus ciliaris kontrakció és hámsejtnekrózis), a szövetek szerkezetének megváltoztatásán keresztül csökkenti a szemnyomást (23). Összehasonlítva a CW-TSCPC-vel, szemnyomáscsökkentő hatásuk közel azonos (40-45%), viszont a mikropulzus lézerkezelés hosszabb távon hatékonyabbnak és biztonságosabbnak bizonyult (24).
Míg a CW-TSCPC és az MP3 kezelés során a sugártesti nyúlványok helyzetét csak az anatómiai pozíciót ismerve, a limbushoz viszonyítva tudjuk meghatározni, addig endoszkópos cyclophotocoagulatio (ECP) során a kezelendő terület láthatóvá válik, pontos dozírozást lehetővé téve. Az ECP során is a transscleralis lézerhez hasonlóan a 810 nm hullámhosszú diódalézer alkalmazandó. A sugártest nyúlványainak megközelítése történhet a szaruhártya felől kettő clear cornea seben keresztül, vagy a pars plana felől kettő vitrectomiás kapun át. A hátsó megközelítés annyiban korlátozza lehetőségeinket, hogy pseudophakias szemek esetén lehet csak elvégezni. Összehasonlítva a hatékonyságát a trabeculectomiával és a hosszú tubusos implantátumokkal, az ECP-t követő szemnyomáscsökkenés szignifikánsan nem különbözött a konvencionális beavatkozásoktól (25). Szemmegnyitó műtét révén az ezzel járó kockázatokat magában hordozza, azonban mindezt figyelembe véve is biztonságos beavatkozásnak tekinthető (26).
CLASS (CO2 laser assisted sclerotomy surgery – CO2 lézerasszisztált sclerotomia)
A mély sclerectomia (DS) a trabeculectomiával ellentétben nem jár az elülső csarnok közvetlen megnyitásával, azonban a trabekulo-Descemet (TDM) membrán épségének megőrzése komoly sebészi precizitást igényel. Ennek megkönnyítésére fejlesztettek ki egy CO2 lézeralapú rendszert, amely segíti a Schlemm-csatorna feltárását, miközben csökkenti a TDM perforációjának kockázatát. A CO2 lézer energiáját a víz nagyrészt elnyeli, így amint a csarnokvíz átszivárog a kezelt területen, csökken a környező szövetekre gyakorolt hatása (27). A CLASS és a konvencionális DS-műtét a szemnyomáscsökkentés céljából hasonló eredményekkel bír (28). Hatása gyengébb a trabeculectomiához viszonyítva, posztoperatív szövődmények és felépülés szempontjából kedvezőbb tulajdonságokkal rendelkezik (29).
Megbeszélés
A XXI. században a glaukóma terápiájának területén paradigmaváltás figyelhető meg. A lézeres és minimál invazív sebészeti technológiák rohamos fejlődése a glaukóma kezelésében számos új eszközt és technikát eredményezett, amelyek eltérő mechanizmusokon keresztül képesek csökkenteni a szemnyomást. Ezek az innovatív eljárások ígéretes alternatívát kínálnak, de elérhetőségüket jelenleg gyakran korlátozza magas költségük vagy a széles körű hozzáférés hiánya.
Ugyan a szemnyomáscsökkentő hatásuk általában mérsékeltebb, mint a hagyományos trabekulectomia vagy a hosszú tubusos csarnokvíz-elvezető implantátumoké, alkalmazásuk mellett szól a kisebb műtéti kockázat és a gyorsabb posztoperatív felépülés. Emellett fontos kiemelni, hogy ezek az eljárások nemcsak a szemnyomás, hanem gyakran a szemcsepp-használat csökkentését is lehetővé teszik, jelentős életminőség-javulást biztosítva a betegek számára.
Nyilatkozat
A szerzők kijelentik, hogy a továbbképző, pontszerző tanulmány megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Tham YC, et al. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology 2014; 121(11): 2081–2090.
https://doi.org/10.1016/j.ophtha.2014.05.013
2. World Health Organization: World Report on Vision (2019)
3. Europen Glaucoma Society: A guide on surgical innovation for glaucoma (2023)
4. Jonas JB, Aung T, Bourne RR, Bron AM, Ritch R, Panda-Jonas S. Glaucoma. Lancet 2017; 390(10108): 2183–2193.
https://doi.org/10.1016/S0140-6736(17)31469-1
5. Saheb H, et al. Micro-invasive glaucoma surgery: current perspectives and future directions. Curr Opin Ophthalmol 2012; 23(2): 96–104.
https://doi.org/10.1097/ICU.0b013e32834ff1e7
6. Cairns JE. Trabeculectomy. Preliminary report of a new method. Am J Ophthalmol 1968; 66(4): 673–679.
7. Dastiridou AI, et al. Cyclodestructive Procedures in Glaucoma: A Review of Current and Emerging Options. Adv Ther 2018; 35(12): 2103–2127.
https://doi.org/10.1007/s12325-018-0837-3
8. Ahmed IIK, et al. A Prospective Randomized Trial Comparing Hydrus and iStent Microinvasive Glaucoma Surgery Implants for Standalone Treatment of Open-Angle Glaucoma: The COMPARE Study. Ophthalmology 2020; 127(1): 52–61.
https://doi.org/10.1016/j.ophtha.2019.04.034
9. Salimi A, et al. Three-Year Outcomes of a Schlemm Canal Microstent (Hydrus Microstent) with Concomitant Phacoemulsification in Open-Angle Glaucoma. Ophthalmol Glaucoma 2023; 6(2): 137–146.
https://doi.org/10.1016/j.ogla.2022.08.012
10. Balas M, et al. Minimally Invasive Glaucoma Surgery: A Review of the Literature. Vision 2023; 7(3): 54.
https://doi.org/10.3390/vision7030054
11. Fliney GD, et al. Kahook Dual Blade versus Trabectome (KVT): Comparing Outcomes in Combination with Cataract Surgery. Clin Ophthalmol 2023; 17: 145–154.
https://doi.org/10.2147/OPTH.S391527
12. Bozkurt E, et al. The efficacy of gonioscopy-assisted transluminal trabeculectomy combined with phacoemulsification. Int Ophthalmol 2021; 41(1): 35–43.
https://doi.org/10.1007/s10792-020-01550-x
13. Reiss G, et al. Safety and Effectiveness of CyPass Supraciliary Micro-Stent in Primary Open-Angle Glaucoma: 5-Year Results from the COMPASS XT Study. Am J Ophthalmol 2019; 208: 219–225.
https://doi.org/10.1016/j.ajo.2019.07.015
14. Tan JCK, et al. Meta-Analysis of MINIject vs. Two iStents as Standalone Treatment for Glaucoma with 24 Months of Follow-Up. J Clin Med 2024; 13(24): 7703.
https://doi.org/10.3390/jcm13247703
15. Achiron A, et al. Micro-invasive glaucoma surgery. Harefuah 2014; 153(10): 581–625. PMID: 255 18075.
16. Governatori L, et al. PreserFlo MicroShunt versus trabeculectomy: an updated meta-analysis and systematic review. Graefes Arch Clin Exp Ophthalmol Publikálva online: October 12, 2024.
https://doi.org/10.1007/s00417-024-06649-w
17. Ansari E. Five-year outcomes of ab interno Xen 45 gel stent implantation. Graefes Arch Clin Exp Ophthalmol 2024; 262(4): 1263–1269.
https://doi.org/10.1007/s00417-023-06294-9
18. Nicolai M, et al. EX-PRESS Glaucoma Filtration Device: Management of Complications. Vision (Basel) 2020; 4(3): 39.
https://doi.org/10.3390/vision4030039
19. Europen Glaucoma Society: Terminology and guidelines for glaucoma 5th ed. (2021)
20. Gazzard G, et al. Laser in Glaucoma and Ocular Hypertension (LiGHT) Trial: Six-Year Results of Primary Selective Laser Trabeculoplasty versus Eye Drops for the Treatment of Glaucoma and Ocular Hypertension. Ophthalmology 2023; 130(2): 139–151.
https://doi.org/10.1016/j.ophtha.2022.09.009
21. Durr GM, et al. Current review of Excimer laser Trabeculostomy. Eye Vis (Lond) 2020; 7: 24.
https://doi.org/10.1186/s40662-020-00190-7
22. Nagy ZZ, et al. First-in-Human Safety Study of Femtosecond Laser Image-Guided Trabeculotomy for Glaucoma Treatment: 24-month Outcomes. Ophthalmol Sci 2023; 3(4): 100313.
https://doi.org/10.1016/j.xops.2023.100313
23. Ma A, et al. Micropulse laser for the treatment of glaucoma: A literature review. Surv Ophthalmol 2019; 64(4): 486–497.
https://doi.org/10.1016/j.survophthal.2019.01.001
24. Aquino MC, et al. Micropulse versus continuous wave transscleral diode cyclophotocoagulation in refractory glaucoma: a randomized exploratory study. Clin Exp Ophthalmol 2015; 43(1): 40–46.
https://doi.org/10.1111/ceo.12360
25. Kaplowitz K, et al. The use of endoscopic cyclophotocoagulation for moderate to advanced glaucoma. Acta Ophthalmol 2015; 93(5): 395–401.
https://doi.org/10.1111/aos.12529
26. Tóth M, et al. Endoscopic cyclophotocoagulation (ECP) for open angle glaucoma and primary angle closure. Cochrane Database Syst Rev 2019; 2(2): CD012741.
https://doi.org/10.1002/14651858.CD012741.pub2
27. Cutolo CA, et al. Prospective evaluation of CO2 laser-assisted sclerectomy surgery (CLASS) with Mitomycin C. Graefes Arch Clin Exp Ophthalmol 2018; 256(1): 181–186.
https://doi.org/10.1007/s00417-017-3844-1
28. Greifner G, et al. Results of CO2 Laser-assisted Deep Sclerectomy as Compared With Conventional Deep Sclerectomy. J Glaucoma 2016; 25(7): e630–e638.
https://doi.org/10.1097/IJG.0000000000000187
29. Zhang H, et al. CO2 Laser-Assisted Deep Sclerectomy Surgery Compared with Trabeculectomy in Primary Open-Angle Glaucoma: Two-Year Results. J Ophthalmol 2021; 2021: 6639583.
https://doi.org/10.1155/2021/6639583
30. Sohajda Z. Minimálisan invazív glaukóma – sebészeti mikroimplantátumok. Irodalmi áttekintés. Szemészet 2020; 157(2): 173–179.
