Bilateral hearing and visual loss (Case report)
doi: 10.55342/szemhungarica.2024.161.4.187
Case report
Summary
Purpose: To report a case of Cogan’s syndrome and Takayasu’s arteritis presented on the same patient.
Summary: A 33-year-old woman was referred to our clinic for recurrent, bilateral uveitis. For a year she had several inflammatory episodes on both eyes in the forms of anterior uveitis, episcleritis, conjunctivitis, interstitial keratitis, and scleritis. Medical history included vertigo and tinnitus of unknown origin for 2 years and hearing loss eventually requiring cochlear implants in both ears. Serological tests showed the signs of Bartonella henselae infection; despite the proper antimicrobial therapy, ocular inflammations have recurred, however. All other laboratory tests, including immunoserology, were within the normal limits. We made a clinical diagnosis of Cogan’s syndrome. Over time, the patient developed symptoms of vascular occlusion affecting several organs. Her immunological examination established the diagnosis of Takayasu's arteritis.
Discussion: Cogan's syndrome associated with large vessel vasculitis is a known but rare case in the literature. In our patient, tocilizumab, already recommended by others, proved to be an effective therapy.
Összefoglaló
Célkitűzés: Két ritka, elsőként szemészek által leírt kórkép ismertetése egyazon eset bemutatásával.Esetismertetés: 33 éves nőbetegünket kétoldali, visszatérő uveitisek miatt utalták intézetünkbe. Egy év leforgása alatt a beteg mindkét szemén számos gyulladásos epizód jelentkezett; elülső uveitis, episcleritis, conjuctivitis, interstitialis keratitis és scleritis formájában. Általános anamnéziséből kiemelendő, hogy 2 évvel ezelőtt jelentkező ismeretlen eredetű szédülést és fülcsengést követő hallásvesztés miatti cochlearis implantáció történt. Szerológiai vizsgálata Bartonella henselae fertőzést igazolt, azonban a megfelelő antibiotikumterápia ellenére is szemészeti gyulladásos epizódjai visszatértek. Egyéb laborvizsgálatai és immunszerológiája eltérést nem mutatott. Mindezek alapján Cogan-szindrómát véleményeztünk. Idővel a betegnél több szervet érintő érelzáródás tünetei jelentkeztek. Immunológiai kivizsgálása során Takayasu-arteritis igazolódott.
Megbeszélés: A nagyér vasculitisszel társuló Cogan-szindróma ismert irodalmi ritkaság. Betegünknél az irodalom által is javasolt tocilizumab hatékony terápiának mutatkozott.
Keywords
Cogan’s syndrome, Takayasu’s arteritis
Kulcsszavak
Cogan-szindróma, Takayasu-arteritis
Bevezetés
A Cogan-szindróma egy ritka, idiopátiás, multiszisztémás megbetegedés. A szindróma a nevét David D. Cogan amerikai szemészről kapta, aki 1945-ben 5 esetet dokumentált a következő tünetek együttes fennállásával: nem szifiliszes eredetű interstitialis keratitis és az audio-vestibularis rendszer diszfunkciója (1). Eddig az irodalomban összesen mintegy 400 esetet ismertettek, ezek alapján bármilyen életkorban jelentkezhet, de legfőként fiatal felnőtteket érint 25 év körüli csúcs incidenciával és mindkét nemet hasonló arányban (2, 3). Egyes feltételezések szerint Ludwig van Beethoven is ebben a kórképben veszthette el a hallását (1). A Takayasu-arteritis, más néven „pulseless disease” egy ritka, idiopátiás, granulomatosus vasculitis, amely a nagyereket érinti, főleg az aorta és az aortaívből eredő nagy artériák szűkületét, elzáródását vagy dilatációját okozva (4). A szindróma nevét Mikito Takayasu, japán szemészről kapta, aki elsőként, 1908-ban számolt be egy esetéről, ahol a szemfenéken a retinaerek malformációját figyelte meg nem tapintható brachialis pulzus mellett (5). Prevalenciája 4-15/1 millió (5). Világszerte előfordul, de főként fiatal, ázsiai nőket érint, 9:1 nő:férfi arányban, leggyakrabban húsz és negyven év között (6, 7).
Esetismertetés
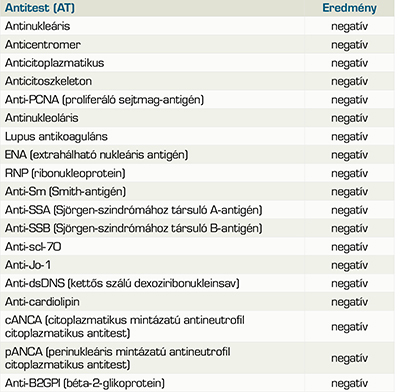
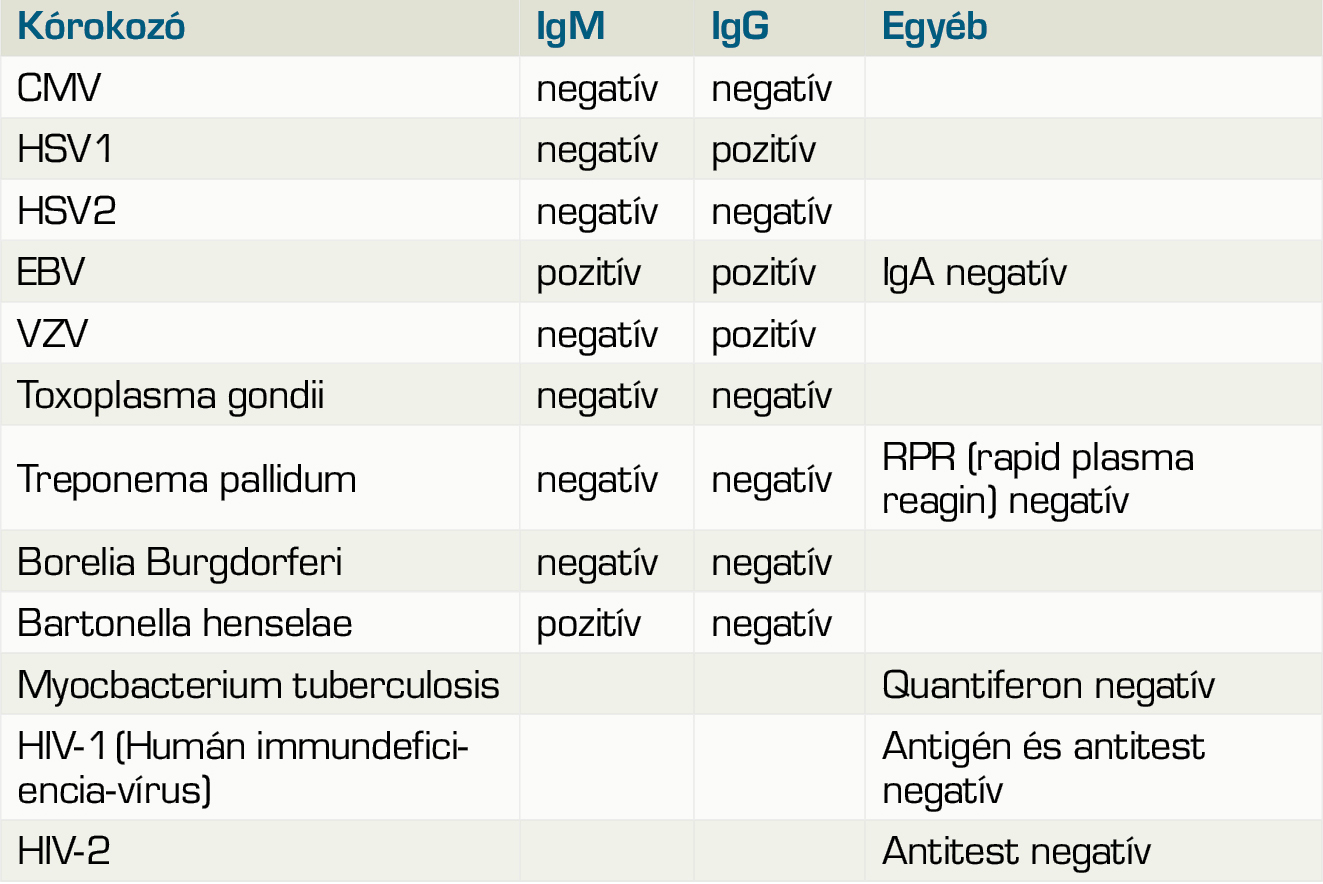
33 éves, kaukázusi nőbeteget kétoldali, visszatérő uveitises gyulladások miatt utalták klinikánkra. Általános anamnéziséből kiemelendő 2 évvel korábban jelentkező, ismeretlen eredetű, kétoldali fülzúgás, egyensúlyzavar és progresszív hallásvesztés miatti kétoldali cochlearis implantáció. Ennek kapcsán végzett teljes kivizsgálása során a családi anamnézisben szereplő sclerosis multiplex, továbbá acusticus neurinoma, thyreotoxicosis és Menièr-betegség lehetőségét kizárták, illetve immunológiai kivizsgálása során szisztémás autoimmun betegséget nem igazoltak. Klinikánkon első vizsgálata során jobb szem távoli látóélesség 1,0, bal szemén 0,25 volt. Réslámpás vizsgálata során bal szemen kevert, conjuctivalis és ciliaris injekciót, a cornea hátlapján Descemet-redőket és az elülső csarnok tyndallizációját tapasztaltuk a hátsó szegment érintettsége nélkül, normál szemnyomás mellett. A beteg általános labor- és immunszerológiai vizsgálata eltérést nem mutatott (1. táblázat), humán leukocitaantigén B27 és B51 irányú vizsgálata is negatívnak bizonyult. Infekt-szerológiai vizsgálata Bartonella henselae fertőzést igazolt (2. táblázat).
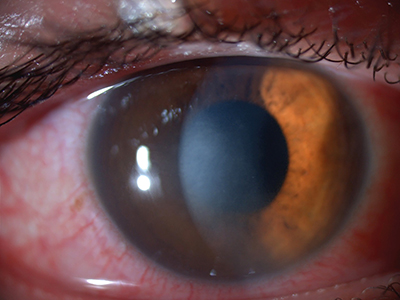
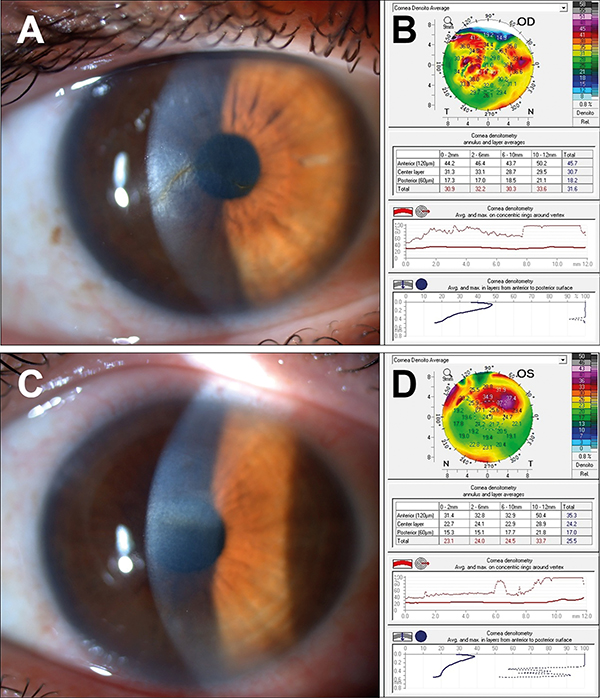
Ekkor infektológussal való konzultáció alapján szisztémásan doxycyclint kapott a beteg, illetve lokálisan dexamethason- és cyclopentolattartalmú szemcseppet. Később elvégzett Bartonella henselae és Bartonella quintana szerológiában mind az IgG (immunglobulin G), mind az IgM negatív lett. A kezelés ellenére a jobb szemen a cornea stromális infiltrációja jelent meg (1. ábra).
A cornea érzékenysége mindkét oldalon csökkent volt. Diagnosztikus elülső csarnoki punkciót végeztünk HSV (herpes simplex vírus) 1-2, VZV (varicella zoster vírus), EBV (epstein-barr vírus) és CMV (citomegalovírus) vírusfertőzés irányába PCR (polimeráz-láncreakció) vizsgálattal, amely teljesen negatívnak bizonyult. Tekintettel az ananmézisre, a klinikai képre és laborvizsgálatok eredményére; noninfektív interstitialis keratitis és a kétoldali hallásvesztésre, Cogan-szindrómát véleményeztünk. Lokális, illetve szükség szerint szisztémásan kiegészített kezelés ellenére mindkét szemen a gyulladásos epizódok visszatértek; interstitialis keratitis, elülső uveitis, scleritis, episcleritis és conjuctivitis formájában (2. ábra).
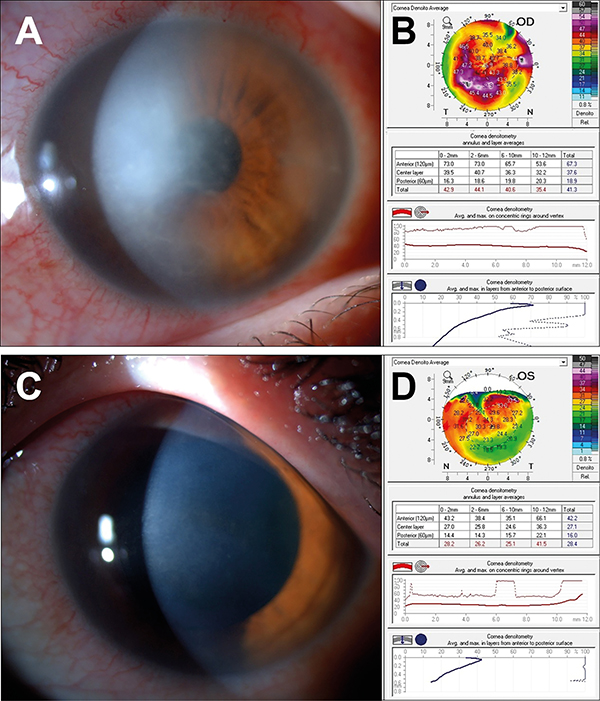
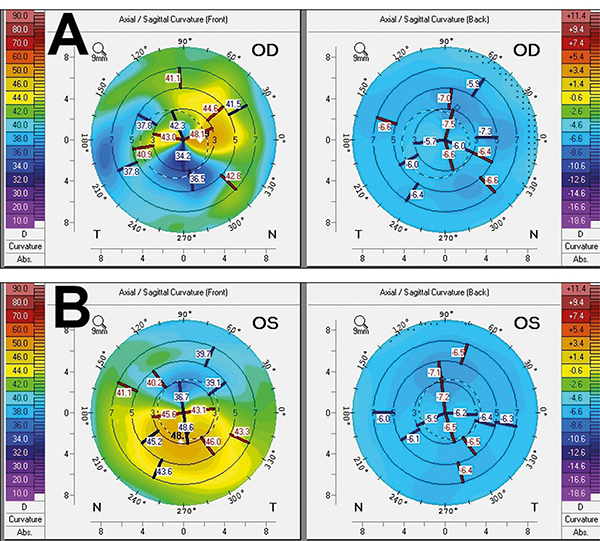
1 év alatt a jobb szemen 8, bal szemen 9 gyulladásos epizódja volt a betegnek. A beteg távoli visusa ezen idő alatt jobb szemén 1,0 és 1 méterről ujjolvasás között, bal szemén pedig 1,0 és 0,1 között változott. A keratitises epizódok során a corneahomályok mértékét és lokalizációját numerikusan a Pentacam HR-készülék fényszóródás jelenségen alapuló denzitometriás szoftverével is vizsgáltuk, amely a cornea homályosságát négy koncentrikus zónában és három rétegben elemzi, és szürkeskálás egységekben értékeli ki 0–100-ig terjedő skálán (0 = minimum, 100 = maximum visszaszóródás). A kapott értékeket az irodalmi normáladatokkal hasonlítottuk össze (8) (2–3. ábra). A szemészeti panaszokon túl a betegnek ízületi panaszai is jelentkeztek, amelynek hátterében immunológiai szakrendelésen spondyloarthritist vélelmeztek, ezért a beteg szisztémás TNFa (tumornekrózis-faktor-alfa) gátló és cicklosprinkezelésben részesült kis dózisú glükokortikoid szedése mellett. A folyamatosan progrediáló kétoldali, hátsó subcapsularis katarakta miatt mindkét szemen phaco + PCL impl. műtét történt. Időközben a betegnek újabb panaszai jelentkeztek; fejfájást, gyengeséget, szédülést, jobb lábban járás közben jelentkező klaudikációs fájdalmat, illetve fokozódó sternocostalis fájdalmat tapasztalt. Laborvizsgálata emelkedett süllyedést és C-reaktív protein értéket mutatott. Kismedencei MR (mágnesesrezonancia) angiográfia, továbbá koponya-, nyaki-, mellkasi- és hasi CT- (komputertomográfia) angiográfia készült, amelyek a bal arteria carotis communis eredésénél és az aorta alsó harmadában 50% körüli szűkületet és a jobb oldali arteria iliaca communis elzáródását mutatták ki. Mindezek alapján aktivitást mutató Takayasu-arteritist véleményeztek és a beteg nagy dózisú szteroidkezelést kapott, illetve azathioprin és IL-17 (interleukin) gátló secukinumabterápiát indítottak. Pár héttel a beteg emisszióját követően instabil anginák miatt végzett koronarográfia során a bal főtörzs és a jobb koronária súlyos eredés körüli szűkületei igazolódtak. Bal főtörzs tágítása, sztent behelyezése és IL-6-gátló, tocilizumabterápia indítása történt. A beállított kezelés mellett a beteg panaszai javultak, kontroll angiográfia és koronarográfia progressziót nem igazolt. A szisztémás és a kétoldali lokális napi 2×1 csepp dexamethason szemcsepp kezelés mellett szemészeti gyulladásos epizódjai is mérséklődtek. A beteg legutolsó szemészeti kontrollja során gyulladásos aktivitást nem tapasztaltunk, szemnyomása normáltartományban volt, távoli látóélessége jobb szemén 0,2, bal szemén 0,8 volt. A látóélesség csökkenését a cornea gyulladás utáni homályai, illetve egyenetlensége magyarázza (3–4. ábra).
Megbeszélés
A Cogan-szindóma pontos patomechanizmusa nem ismert, autoimmun eredetű, primer vasculitisnek tartják, amely a kis, közepes és nagyereket is érintheti (9). 2 klinikai formáját különítjük el; típusos és atípusos formát. Típusos forma esetén nem szifiliszes eredetű interstitialis keratitis és Menière-betegséghez hasonló audio-vestibularis tünetek (fülzúgás, hányinger, hányás, forgó jellegű szédülés és halláscsökkenés) együttes fennállása jellemző 2 éven belüli megjelenéssel. Atípusos forma esetén interstitialis keratitis nélkül vagy mellett egyéb szemészeti gyulladás (például scleritis, epsicleritis, cisztoid makulaödéma, papillaödéma) áll fenn, az audio-vestibularis tünetek Menière-betegségre nem jellemzőek, illetve a szemészeti tünetekhez képest több mint 2 év eltérés tapasztalható a prezentációjukkor (10). Diagnózisa kizárásos diagnózis, a panaszok hátterében ki kell zárni egyéb infekciózus vagy inflammatorikus okot. A betegek mintegy 80%-ának szisztémás érintettsége is van, lázat, ízületi-, neurológiai-, kardiovaszkuláris- és gasztrointesztinális panaszokat okozhatva. Aortitis a leggyakoribb szisztémás vasculitises prezentáció, a betegek mintegy 10%-ában fordul elő. Az aorta és belőle eredő ágak érintettsége esetén az alsó és felső végtag klaudikációs panaszai jelentkezhetnek (11). Kezelése a betegség súlyosságától, kiterjedésétől függ. Interstitialis keratitis jól kezelhető lokális szteroidtartalmú és cicloplégiás szemcseppekkel, ugyanakkor a sensoneuralis hallásvesztés elkerülése céljából elengedhetetlen a korai, nagy dózisú szisztémás kortikosztreroid-terápia (12). Ennek hatástalansága esetén nincs egyértelmű ajánlás, hogy milyen terápia lenne a leghatásosabb (10). Leggyakrabban használt kiegészítő immunszuppresszáns szerek az azathioprin, ciclosporin, methotrexát és a TNFa-gátlók (9). A már kialakult süketség esetén a betegnek cochlearis implantáció nyújthat segítséget (11).
A Takayasu-artertitis klinikai lefolyása 2 fázisra osztható. A preocclusiv stádiumban nem specifikus, általános tünetek jellemzőek, mint például láz, fogyás, ízületi fájdalmak. Ezt követi az occlusiv stádium, ahol a nagyérgyulladás és a következményes célszerv-iszkémia okozta panaszok dominálnak (7). A leggyakoribb társuló szemészeti eltérések is az iszkémia következtében kialakult hipoperfúzív „Takayasu”-retinopathia, ocularis iszkémia szindróma, opticus neuropathia, katarakta, illetve a renovascularis hipertónia következtében kialakult hipertenzív retinopathia (3, 5). Ritkábban előforduló szemészeti manifesztáció az uveitis, scleritis (3). A Takayasu-arteritis diagnózisa a klinikai tünetek, laboreredmények, képalkotó vizsgálat eredményein alapul, illetve felállítását az American College of Rheumatology által javasolt kritériumrendszer segítheti (13). Ezen kritériumokból legalább háromnak teljesülnie kell, amelyekből a következők voltak jelen betegünknél; a betegség kezdetekor a beteg életkora nem haladta meg a 60 éves kort, végtagi klaudikáció és abnormális arteriogram. Kezelése az aktív, gyulladásos fázisban nagy dózisú glükokortikoid (14). Adjuvánsan javasolt egyéb nem szteroid immunszuppresszáns szer, mint methotrexat, azathioprin, TNFa-gátló vagy IL-6-antagonista tocilizumab adása (15, 16). Bizonyos esetekben sebészi, endovascularis intervenció is szükségessé válik (6).
Esetünkben az ismeretlen eredetű kétoldali hallásvesztés mellett mindkét szemen jelentkező visszatérő uveitisek, scleritisek, episcleritis és keratitisek tünettana elsősorban a Cogan-szindrómának felelt meg. A szisztémás tünetek változásával a Takayasu-arteritisre jellemző klinikai kép fejlődött ki. A Cogan-szindróma és a Takayasu-arteritis együttes előfordulása ritka, de nem példátlan az irodalomban (17–19). Cogan-szindróma esetén a háttér gyulladásos citokinprofil kevésbé ismert, mindazonáltal vannak rá irodalmi adatok, hogy egyes Cogan-szindrómában szenvedő betegek szérum IL-6 szintje emelkedett volt és a tocilizumab hatásos terápiának bizonyult (20). Aktivitást mutató Takayasu-arteritis esetén az IL-6 és a szolúbilis IL-6-receptor szérumszintje is emelkedett a betegség aktivitásával korrelálva (21). Betegünknél az alkalmazott tocilizumabkezelés mind szemészetileg, mind általánosan hatékonynak bizonyult, a beteg gyulladásos jelei, panaszai remisszióba kerültek.
Mindkét betegség diagnózisa igazi kihívás lehet a szerteágazó tünetek és a specifikus biomarkerek hiánya következtében, illetve mindkét kórképben szemészeti panasz lehet az első, amivel a beteg orvoshoz fordul. Utóbbi talán nem is meglepő, annak tudatában, hogy elnevezésüket, az őket elsőként leíró szemorvosokról kapták. Mindezek miatt is különösen fontos, hogy szemészként ismerjük és gondoljunk ezen kórképekre, ugyanis mindkét betegség esetében a korai diagnózis és kezelés megelőzheti a maradandó szervkárosodást és akár letális következményeket.
Nyilatkozat
A szerzők kijelentik, hogy esetismertetésük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Iliescu DA, Timaru CM, Batras M, De Simone A, Stefan C. Cogan's Syndrome. Rom J Ophthalmol 2015; 59(1): 6–13.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5729811/pdf/RomJOphthalmol-59-06.pdf
2. Hu J, Du H, Su J, Wu T, Wu R, Zhu J. Intrathecal injection of methotrexate combined with dexamethasone for Cogan's syndrome with neurological involvement: A case report and literature review. Int J Rheum Dis 2023; 26(4): 786–8.
https://doi.org/10.1111/1756-185X.14518
3. Espinoza GM, Liu JL. Orbital Vasculitides-Differential Diagnosis. Curr Rheumatol Rep 2019; 21(10): 54. https://doi.org/10.1007/s11926-019-0853-6
4. Tombetti E, Mason JC. Takayasu arteritis: advanced understanding is leading to new horizons. Rheumatology (Oxford) 2019; 58(2): 206–19. https://doi.org/10.1093/rheumatology/key040
5. Szydelko-Pasko U, Przezdziecka-Dolyk J, Nowak L, Malyszczak A, Misiuk-Hojlo M. Ocular Manifestations of Takayasu's Arteritis-A Case-Based Systematic Review and Meta-Analysis. J Clin Med 2023; 12(11).
https://doi.org/10.3390/jcm12113745
6. Esatoglu SN, Hatemi G. Takayasu arteritis. Curr Opin Rheumatol 2022; 34(1): 18–24. https://doi.org/10.1097/BOR.0000000000000852
7. Thapa Magar M, Kafle S, Poudel A, Patel P, Cancarevic I. Takayasu's Arteritis and Its Association With Mycobacterium Tuberculosis: A Systematic Review. Cureus 2021; 13(8): e16927.
https://doi.org/10.7759/cureus.16927
8. Ni Dhubhghaill S, Rozema JJ, Jongenelen S, Ruiz Hidalgo I, Zakaria N, Tassignon MJ. Normative values for corneal densitometry analysis by Scheimpflug optical assessment. Invest Ophthalmol Vis Sci 2014; 55(1): 162–8. https://doi.org/10.1167/iovs.13-13236
9. Kahuam-Lopez N, Vera-Duarte GR, Perez-Vazquez AK, Navas A, Ramirez-Miranda A, Graue-Hernandez EO. Cogan syndrome: a case report and review of the literature. Digit J Ophthalmol 2023; 29(3): 88–93.
https://doi.org/10.5693/djo.02.2023.07.001
10. Maikap D, Pradhan A, Padhan P. A rare case of atypical Cogan's syndrome presenting as encephalitis. Mod Rheumatol Case Rep 2022; 6(2): 305–8. https://doi.org/10.1093/mrcr/rxab055
11. Wang Y, Tang S, Shao C, Liu Y. Cogan's syndrome is more than just keratitis: a case-based literature review. BMC Ophthalmol 2023; 23(1): 212.
https://doi.org/10.1186/s12886-023-02966-6
12. Padoan R, Cazzador D, Pendolino AL, Felicetti M, De Pascalis S, Zanoletti E, et al. Cogan's syndrome: new therapeutic approaches in the biological era. Expert Opin Biol Ther 2019; 19(8): 781–8.
https://doi.org/10.1080/14712598.2019.1611779
13. Grayson PC, Ponte C, Suppiah R, Robson JC, Gribbons KB, Judge A, et al. 2022 American College of Rheumatology/EULAR classification criteria for Takayasu arteritis. Ann Rheum Dis 2022; 81(12): 1654–60.
https://doi.org/10.1136/ard-2022-223482
14. Maz M, Chung SA, Abril A, Langford CA, Gorelik M, Guyatt G, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Giant Cell Arteritis and Takayasu Arteritis. Arthritis Rheumatol 2021; 73(8): 1349–65. https://doi.org/10.1002/art.41774
15. Wilson L, Chandran A, Fudge JC, Moguillansky D, Thatayatikom A, Philip J, et al. Takayasu's arteritis presenting as acute myocardial infarction: case series and review of literature. Cardiol Young 2021; 31(11): 1866–9. https://doi.org/10.1017/S1047951121001700
16. Szabó MZ, Kiss, E. Nagyérvasculitisek korszerű kezelése. Orvosi Hetilap 2017; 158(1): 5–12.
https://doi.org/10.1556/650.2017.30630
17. Raza K, Karokis D, Kitas GD. Cogan's syndrome with Takayasu's arteritis. Br J Rheumatol 1998; 37(4): 369–72.
https://doi.org/10.1093/rheumatology/37.4.
18. Morinaka S, Takano Y, Tsuboi H, Goto D, Sumida T. Familial HLA-B*52 Vasculitis: Maternal, Atypical Cogan's Syndrome with Takayasu Arteritis-mimicking Aortitis and Filial Takayasu Arteritis. Intern Med 2020; 59(15): 1899–904. https://doi.org/10.2169/internalmedicine.4067-19
19. Kawasaki Y, Uehara T, Kawana S. Cutaneous Vasculitis in Cogan's Syndrome: A Report of Two Cases Associated with Chlamydia Infection. J Nippon Med Sch 2018; 85(3): 172–7. https://doi.org/10.1272/jnms.JNMS.2018_85-25
20. Hara K, Umeda M, Segawa K, Akagi M, Endo Y, Koga T, et al. Atypical Cogan's Syndrome Mimicking Giant Cell Arteritis Successfully Treated with Early Administration of Tocilizumab. Intern Med 2022; 61(8): 1265–70. https://doi.org/10.2169/internalmedicine.7674-21
21. Kaneko Y, Takeuchi T. An update on the pathogenic role of IL-6 in rheumatic diseases. Cytokine 2021; 146: 155645.
https://doi.org/10.1016/j.cyto.2021.155645
