Allergic eye surface diseases: the latest developments in diagnosis and treatment
doi: 10.55342/szemhungarica.2025.162.4.159
Original scientific paper
Summary
The purpose of this manuscript is to present an updated version of the examination and treatment of allergic ocular surface diseases based on available scientific evidence. Describing the diagnostic steps based on pathophysiology, it focuses on clinical characteristics. Physicians treating ocular allergies should be familiar with the main types of allergic ocular surface diseases and the treatment recommendations that vary depending on severity and course. The steps of therapy are allergen avoidance and management of tear film disorders, followed by targeted anti-allergy treatment, locally if possible, or with systemic agents if necessary. The composition and additives of eye drops affect the physiology of allergic eyes, so the optimal treatment must be chosen carefully. In some cases, immunotherapy may provide causal treatment, the indication and implementation of which is possible in collaboration with other disciplines. Underdiagnosed and undertreated allergic surface inflammation of the eye can result in permanent vision impairment due to chronic progression or inappropriate treatment. Knowledge of clinical guidelines benefits patients who are satisfied and sense safety.
Összefoglaló
A közlemény célja, hogy a rendelkezésre álló tudományos bizonyítékok alapján bemutassa az allergiás szemfelszíni betegségek kivizsgálásának és kezelésének frissített változatát. A kórélettani alapokra helyezett diagnosztikai lépések ismertetésekor összpontosít a klinikai jellegzetességekre. A szemészeti allergiát kezelő orvosnak tisztában kell lennie az allergiás szemfelszíni betegségek főbb típusaival, valamint a súlyosság és a lefolyás függvényében változó kezelési javaslatokkal. A terápia lépcsői az allergénkerülés, a könnyfilm-zavarok rendezése, majd a célzott allergiaellenes kezelés, lehetőség szerint helyi, vagy szükség esetén szisztémás szerekkel. A szemcsepp összetétele és adalékanyagai hatnak az allergiás szem fiziológiájára, ezért tudatosan kell megválasztani az optimális kezelést. Egyes esetekben oki kezelést nyújthat az immunterápia, amelynek indikációja és lefolytatása a társszakmákkal együtt lehetséges. Az aluldiagnosztizált és alulkezelt allergiás szemfelszíni gyulladás tartós látásromlást eredményezhet a krónikus lefolyás, vagy a nem jól megválasztott kezelés révén. A klinikai irányelvek ismerete az elégedett, és a magát biztonságban tudó páciens előnyét szolgálja.Keywords
allergic ocular disease, seasonal allergic conjunctivitis, vernal conjunctivitis, atopic conjunctivitis, immunomodulators
Kulcsszavak
szemfelszíni allergiás szemgyulladás, szezonális allergiás kötőhártya-gyulladás, vernalis kötőhártya-gyulladás, atópiás kötőhártya-gyulladás, immunmodulátorok
Bevezetés
Az allergiás szemfelszíni betegségek aluldiagnosztizált gyulladásos kórképek. Az allergia definíció szerint túlérzékenység: olyan anyaggal szemben, amely egyébként ártalmatlan. Az allergiás betegségekben használt alapfogalmakat az 1. táblázat tartalmazza. Az allergia klinikai tünetei terhet rónak az egyénre, a családra, és tágabb értelemben a társadalomra, mert rontják az életminőséget, anyagi ráfordítást igényelnek, és komoly kapacitásokat vonnak el az egészségügyben.

Kórtan és tünettan
Az allergiás szembetegségek klinikai formáit a 2. táblázat foglalja össze.
A szemészeti allergiák kórtanának részletes tárgyalása meghaladja a közlemény kereteit. A betegség a tünetmentes szenzitizáció és a tünetes allergiás gyulladás fázisaira osztható (8, 10, 13).

A kötőhártya és a szaruhártya-epithelium nem pusztán fizikai barrier, hanem aktív felismerő hely. A dendritikus sejtek professzionális antigénprezentáló sejtek, a Th0 (naiv) sejtvonalakat Th2 irányba differenciálják. Az allergének konzervatív mintázatait felismerő innate lymphoid cell (ILC)-2 sejtek közvetlenül képesek a Th2-vonalak aktiválására. Egyes allergének közvetlenül vagy pl. a nyírpollen lipidtutajok segítségével tudnak átjutni a kötőhártya epitheliumsejtjein, amelyek aktív szereplői a szenzitizációnak. Közvetlenül aktiválják az eozinofil sejteket, odavonzzák a hízósejteket, illetve támogatják a Th2 irányba forduló immunválaszt. Léteznek olyan allergének, amelyek direkt proteáz-aktivitásuk, vagy endotoxinokkal való kapcsolódásuk révén nemcsak Th2-es, hanem Th17-es vagy Th1-es típusú immunválaszt is indukálhatnak. Az aktivációs útvonalakat főleg az IL-4, IL-5, IL-13 hírvivő anyagok mediálják. Allergiában legjellemzőbb a Th2-sejtek klonális expanziója, olyan citokin-miliőt teremtve, amelyben a naiv B-sejtek specifikus IgE-termelő aktív B-sejtekké válnak. Az aktív B-sejtek által megtermelt specifikus IgE-ellenanyagok ugyan néhány nap alatt lebomlanának a szövetekben, de a hízósejtek, bazofilek felszínéhez kötve hónapokig megmaradnak.
A tünetes fázis korai szakaszában a szervezet ismételten találkozik az adott allergénnel, a hízósejtek vagy bazofil sejtek felszínén levő specifikus IgE-molekulák keresztkötődnek, gyulladásos mediátorok szabadulnak fel, majd az eozinofil sejtekkel kiegészülve megindul az új gyulladásos mediátorok átíródása, termelődése. A már IgE-molekulát kötő hízósejt maga is termel IL-4-molekulát, amely segíti a memória B-sejtek túlélését, és újabb IgE-molekulák termelődését. Az így erősített utánpótlás fenntartja, kikapcsolhatatlanná teszi a folyamatot. Az antigénprezentáló sejt közvetlenül is képes az eozinofil-, a hízósejtek és a bazofil sejtek aktivációjára, amely újabb útvonal a folyamatosan fenntartott gyulladásra.
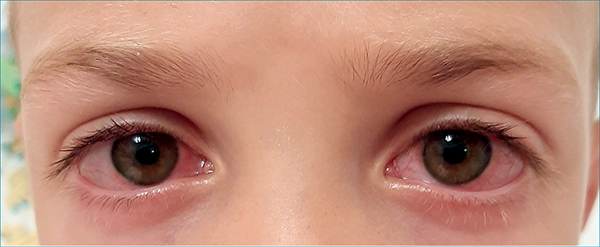
A jelátvitelben a kalciumcsatornáké a főszerep, amelyet a kromoglikátok gátolni képesek. Az ilyenkor legnagyobb mennyiségben felszabaduló mediátor a hisztamin és leukotriének, amelyek az erek tágulatát és fokozott áteresztő képességét okozzák. A vörösség, és a duzzanat mellett (1. ábra) a viszketés az allergia kardinális tünete, amelyet az idegvégződések környezetében felszabaduló hisztamin H1-receptorhoz kötődése okoz.
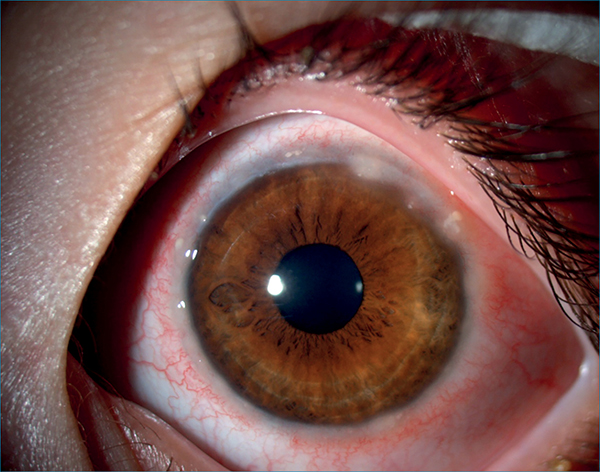
Az eozinofil eredetű fő bázikus protein (MBP), a kationos protein (ECP), és neurotoxinok roncsolják a szemfelszínt, ezáltal könnyezést, fényérzékenységet, és látásromlást eredményeznek. A sérült epitheliumsejtek és az eozinofil sejtek pontszerűen összetömörödhetnek Trantas-csomók formájában (2. ábra).
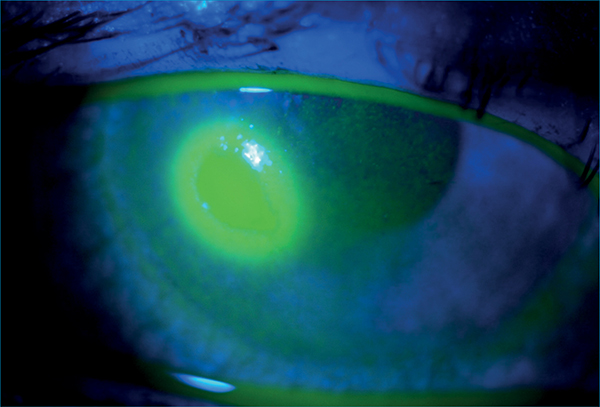
A késői, krónikus fázisban a szöveti átépülési folyamatok az allergia súlyosabb formáiban nyernek teret (13). A kollagenázok (pl. MMP-3 és -9) szöveti átépülést indukálnak, ami jellemzően óriáspapillák formájában (3. ábra) vagy a szaruhártya károsodott felszíne miatt ún. shield ulcus (4. ábra) formájában látható. Ez utóbbi pontszerű epitheldefektussal kezdődik, majd makroerózió után a keratoconjunctivitis vernalis betegek 3-10%-ában lesz shield ulcus, tartós látásromlással fenyegetve.
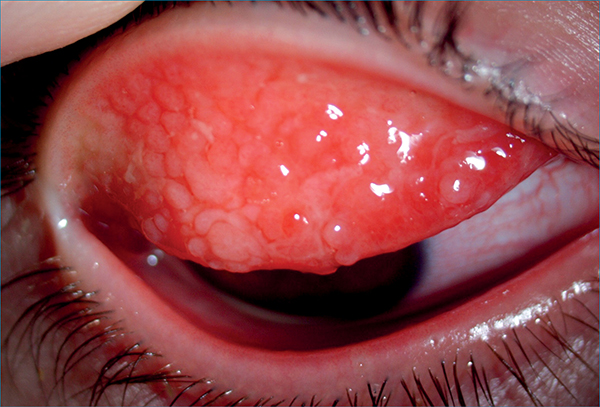
Általában a cornea felső egyharmadában, ahol az óriáspapillák folyamatosan dörzsölik az epithelt, illetve a szekretált fehérjék összefüggő réteget, plakkot alkotva gátolják a fekély alapjának behámosodását. A gyakori szemdörzsölés és a szöveti átépülés következtében a keratoconus előfordulása az átlagosnál nagyobb, 2-30% közötti allergiában (8). Még diagnosztikai dilemmát vetnek fel a keratoconushoz hasonló szaruhártya-elvékonyodások, a rezisztencia csökkenése és a deformitások, amelyek a krónikus gyulladás kísérői. A szöveti átépülés és az óriás papillák mechanikai hatásai uralkodnak a szövődmények kialakításában (3. ábra, 4. ábra). A súlyos allergiások 6%-ában tartós látásromlást eredményeznek.
Allergiás kötőhártya-gyulladás
Az allergiás kötőhártya-gyulladás immunoglobulin E (IgE) által közvetített, immunsejt-mediált hiperszenzitivitási reakció. Klasszikus értelemben vett szezonális allergia (SAC) esetén a leggyakoribb allergén a fűpollen, míg perenniális (PAC) esetben a poratkák és az állati szőr, ritkán táplálékallergén. A klímaváltozás és a poliszenzibilizáció miatt azonban a szezonális és perenniális besorolások kihívást jelenthetnek. Újabb megközelítés (8, 14, 21, 25) szerint időszakos (intermittáló) allergiát úgy definiálják, hogy a tünetek hetente kevesebb, mint 4 napig vagy kevesebb, mint 4 egymást követő héten át jelentkeznek. A tartós (perzisztáló) allergia esetén pedig a tünetek hetente több mint 4 napig, legalább 1 hónapig jelentkeznek.
Vernalis keratoconjunctivitis (VKC)
Krónikus, potenciálisan látáskárosító, súlyos szemfelszín-gyulladás. Nevéhez híven („vernal”) jórészt szezonális, de minden 4. esetben perenniális lefolyású (18), klinikai megjelenését tekintve pedig limbális, tarzális vagy kevert formája ismert (7, 8, 13). A tarzális formában a leginkább a felső szemhéjon óriáspapillák utcakőszerű rajzolata típusos (3. ábra). A részben mechanikus károsodás miatt kialakuló keratitis punctata epithelialis talaján shield ulcus (pajzs fekély) jöhet létre (4. ábra). A limbális formában zselészerű infiltrátumok (Trantas-csomók), illetve tört fényű, sárgás-fehér depozitumok (Horner–Trantas-csomók) (2. ábra) jelennek meg, amelyek tulajdonképpen eozinofil sejt infiltrátumok szöveti törmelékkel keverve. További tünet lehet a perilimbális kötőhártya pigmentációja, és a pseudogerontoxon.
Etiológiáját tekintve az I. és IV. típusú hiperszenzitivitási reakció kevert formája, különböző gyulladásos sejtek aktivitása jellemző (13): együttesen eredményezve intenzív viszketést, szemvörösséget, fényérzékenységet, váladékozást, idegentestérzést.
Atópiás keratoconjunctivitis (AKC)
Amennyiben a szemhéjak bőrén is zajlik a sejtmediált késői típusú túlérzékenységi reakció, akkor részben a mediátorok, részben a dörzsölés miatt a bőr hámló, kivörösödött, és lemezes szerkezetű lesz (5. ábra). Inkább 30-50 éves korban induló, perzisztáló gyulladás exacerbációkkal. AKC esetén jellegzetes a periorbitalis ekcéma és a kezelésre nehezen reagáló szaruhártya-szövődmények (15, 22, 23).
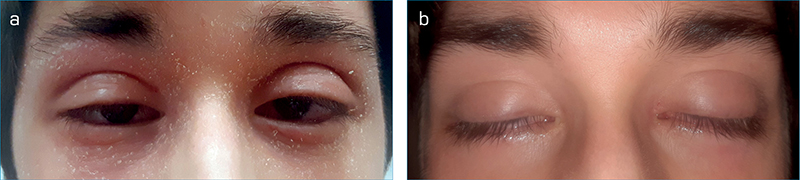
Epidemiológia
Az allergiás rhinoconjunctivitis prevalenciája a világon 5-50% közötti (8, 18, 21, 25), a kötőhártya-gyulladás a világ népességének kevesebb, mint 15%-át, ezen belül az Egyesült Államok lakosságának 30%-át, az európai lakosságnak pedig akár 50%-át is érinti (21). Az allergiás betegségek kialakulásában bizonyítottan protektív tényező a szoptatás, ugyanakkor a mikrobiológiai diverzitás és a korai háziállat-expozíció védő szerepe még vitatott (25). Az allergiás szembetegségek közül a VKC gyakorisága földrajzilag eltérő: trópusi területeken (pl. Közel-Kelet, India, Afrika) az iskoláskorú gyermekek akár 10%-a, Európa mediterrán területein kb. 3%-a, azonban a mediterrániumon kívül 0,03%-a lehet érintett. Bár a skandináv országok éghajlata hűvösebb, már 30 éve leírták, hogy a VKC-prevalencia emelkedik, és magasabb az ázsiai és afrikai etnikumú bevándorlók körében. Érdekes módon, a VKC klinikai jellemzői és súlyossága is változik a földrajzi területek szerint: Indiában és Délkelet-Ázsiában jellemző a limbus és a szaruhártya érintettsége, amelyhez a tartós, látást veszélyeztető szaruhártya-komplikációk magas kockázata társul, ugyanakkor Európában enyhébb formák jellemzőek.
A VKC megjelenése az első életévtizedre tehető, és többnyire a pubertás után megszűnik. A ritka, felnőttkorban is perzisztáló (vagy késői megjelenésű, ún. late-onset VKC) formában a gyermekkorra jellemző 4:1 vagy 2:1 férfi-nő arány kiegyenlítődik (19).
Komorbiditás, differenciáldiagnózis
Az allergiás szemgyulladás gyakran alul- és félrediagnosztizált. A vörös szem differenciáldiagnosztikájából kiemelendő az emelkedett szemnyomás, mert nemcsak primeren, akut zárt zugú glaukóma lehet a kórok, hanem a szteroid cseppek szövődményeként is emelkedhet a szemnyomás. A legfőbb nem IgE-mediált allergiának a krónikus blepharokeratoconjunctivitis tekinthető. A szárazszem-betegség primeren vagy a kezelések kapcsán másodlagosan, akár minden 2. esetben társul allergiás szemgyulladáshoz. A szemviszketés, szemvörösség, szemszárazság mindkét állapotban előfordulhat. Kizárandók az egyéb, látást veszélyeztető állapotok, mint scleritis, herpes keratitis, ocularis rosacea stb. (3. táblázat).
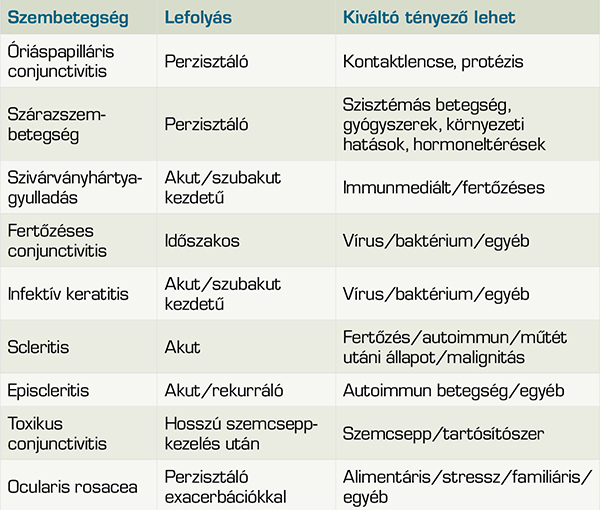
Allergiás conjunctivitis 30-50%-ban társul allergiás náthához (rhinitis allergica), továbbá ennél kisebb arányban társulhat asztma, atópiás dermatitis, eozinofil nyelőcsőgyulladás, alvási apnoe, középfülgyulladás stb. (6). Az allergiás betegségek mintegy harmadában kötőhártya-gyulladás az első tünet (4). Atópiás dermatitis eseteiben az érintettek 65%-ánál számíthatunk szem tünetekre. Földünk lakosságának mintegy 15-20%-a szenved valamilyen allergiás betegségben, és az esetek 40-60%-ában szemészeti tünetekkel számolhatunk. Keratoconus, vélhetően a szemdörzsölés eredményeképpen szintén társulhat allergiás szembetegséghez (8). Állatmodellben bizonyították (24), hogy az allergiás gyulladás a sclerában és a retinában is fenntart bizonyos fokú gyulladást, amely súlyosbítja a myopia progresszióját. Tajwani gyermekek körében a myopia kialakulásának esélye 6-12 év során 2,35-szor magasabb a nem allergiás conjunctivitises gyermekekhez képest.
Az allergiás szembetegségek differenciáldiagnózisát a 3. táblázat foglalja össze.
Genetika, epigenetika
Az allergiás megbetegedések genetikai hátterét tekintve továbbra is valószínűsíthető összefüggés egyes géncsoportokkal, de diagnosztikai vagy terápiás relevancia nincsen. A VKC különböző etnikai csoportokban eltérő előfordulási gyakorisága genetikai hajlamot jelez.
Az epigenetikai tényezők, mint pl. az anya terhesség alatti dohányzása vagy más környezeti behatások lehetnek hajlamosító tényezők, a szoptatás pedig védőfaktor. A szemfelszíni mikrobiom a szemfelszínen élő mikroorganizmusok komplex hálózata, és fontos szerepet játszik az immunhomeosztázis fenntartásában (9). Bár egy kötőhártyahámsejtre csak 0,06, míg a bélben egy nyálkahártyasejtre 10 baktériumsejt jut, tanulmányok alapján a gasztrointesztinális biodiverzitás csökkenése (pl. gyakori antibiotikumkúra, egysíkú táplálkozás) hajlamosít az allergiás szenzitizációra. Míg a mikrobiális diverzitás (pl. sok testvér, kutyatartás, háztáji gazdálkodás) védőfaktor, az urbanizált környezet épp ellenkezőleg. Úgy tűnik, hogy azok az allergének, amelyekkel magzati korban találkozunk, befolyásolják a szenzitizációt. Ha az első életévben házikedvencként madarat tartanak, az allergiás rhinoconjunctivitis kockázata több mint kétszeresére nő (25).
Az allergiák kialakulása egyre fiatalabb életkorokra tevődik és elnyújtottabban jelentkezik.
Diagnosztika
Anamnézis
Kiemelt fontosságú, ideértve a családi anamnézist, a kísérőbetegségek és a gyógyszerelés pontos ismeretét. Az allergénkutatásban sokszor a napirend, a szabadidő eltöltésének módja, az utazások ismerete vezetnek nyomra. Lehet allergiás valaki pl. a házikedvencként tartott hörcsög helyett annak eledelére, de erre csak az alapos anamnézis és a laborvizsgálatok együttese deríthet fényt.
Klinikai jellemzők
A szemészeti allergiák klinikai tünettanát részben a kórtan rész tartalmazza. A 4. táblázat foglalja össze az allergiás szembetegségek klinikai formáit. Az allergiás szembetegségek felismerése főleg klinikai alapon történik: közös és jellegzetes szubjektív tünet a viszketés, szemvörösség, könnyezés, fényérzékenység, vagy váladékozás.

A szemfelszíni allergia kóros immunválasz, amely kedvező környezetet teremt a dysbiosis kialakulásához (9). Gyermekeknél külön nehézségekbe ütközik, hogy a szubjektív panaszokat még nem tudják verbalizálni. A családban már előforduló allergiás megbetegedés (atópia, asztma, allergiás nátha) fokozott rizikót jelent (21). Gyakran indirekt jelek (irritáltság, fáradtság, figyelemzavar) vagy egyéb fizikai eltérések (sötét karikák a szem körül, allergiás üdvözlés, Denni–Morgan infraorbitalis redők) (6. ábra) szólnak az allergiás eredet mellett.
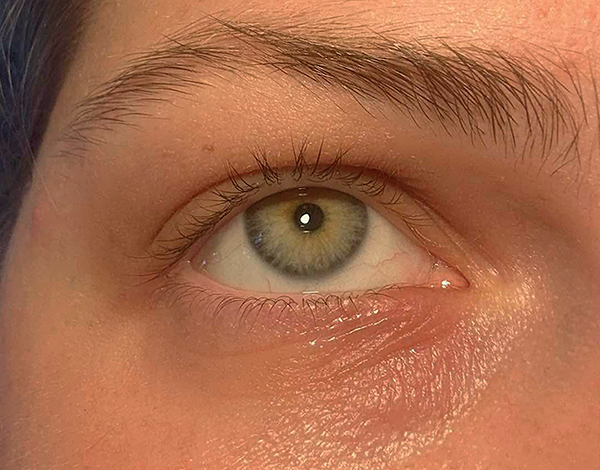
Tüneti napló
Január-februártól a fapollenek (mogyoró majd nyírfapollen és családja), májustól a fűpollenek, nyár végén a gyomok, üröm, és augusztusban parlagfű szeptember végéig virágozva okoz nagy gondot. Ősszel és egész évben is a penészgombák, lakáson belüli allergénként pedig a háziporatkák váltanak ki allergiás conjunctivitist.
Allergológiai vizsgálatok
Az ICAR-Allergic Rhinitis 2023 (25) ajánlásai különböző diagnosztikai lehetőségeket javasolnak allergiás rhinoconjunctivitis esetén. Fontos hangsúlyozni, hogy a szenzitizáció (atópia) és az allergiás tünetek egyaránt előfordulhatnak izoláltan a szemfelszínen vagy társulhatnak egyéb szerveket érintő allergiás gyulladáshoz. Ebből következik, hogy pl. asztma, allergiás rhinitis megléte ugyan segítheti az allergiás szemgyulladás felismerését, de nem feltétele annak. A jó diagnózis és kezelés záloga a kölcsönös együttműködés az allergológus, családorvos, gyermekorvos és a szemész orvos között.
Prick-bőrteszt
A vizsgálat gyors, nem okoz különösebb kellemetlenséget és mérsékelt a költségvonzata. Alkalmazási területei: az atópia igazolása, az allergén specifikálása, a diagnózis megerősítése, megfelelő gyógyszeres vagy allergén immunterápia (AIT) megkezdése, valamint az allergénkerülés javaslatának felállítása. A vizsgálatból származó nemkívánatos események: a kellemetlen érzés, viszketés, bőrpír, az allergia tüneteinek súlyosbodása, anafilaxia, pontatlan vizsgálati és félreértelmezett vizsgálati eredmények. A teszt interpretálása nem mindig egyszerű, főleg kisebb gyermekeknél (7, 20, 22, 25).
Szérumból meghatározott IgE-paraméterek
Az össz-immunoglobulin-E (IgE-) szint atópia gyanúja esetén megerősítheti a diagnózist, ugyanakkor az alacsony szintek nem zárják ki azt. A specifikus szérum-IgE-vizsgálat alkalmazható olyan betegeknél, akiknél bőrteszt nem végezhető (pl. a páciens nem tudja elhagyni antihisztamint/anti-IgE/calcineurin-gátló/benzodiazepin kezelését, vagy ekcémás, vagy nincs olyan allergénre bőrtesztünk, mint amire gyanakszunk. A nagy tisztaságú allergének vagy rekombinánsok használata növelheti a specificitást és szenzitivitást. A teljes allergénkivonattal végzett teszteléssel szemben a komponensalapú allergia diagnosztika (component resolved diagnosis – CRD) pontosabb, mert tisztított natív vagy rekombináns allergéneket használ az IgE-szenzitivitás vizsgálatára (4). CRD során a keresztreagáló alkotórészeket nem csak a tünettanért felelős epitopokat vizsgáljuk. CRD szükséges, ha a hagyományos tesztek nem vezetnek eredményre. Pollenallergiában elsősorban a specifikus immunterápia megválasztásában segít, azaz a fő allergén kiválasztását teszi lehetővé. Atkaérzékenységnél az immunterápiára megfelelően reagálók kiválasztását könnyíti meg, mert bizonyos komponens jelenlétében jobb lesz a terápiás effektus. A három módszert összevetve bár a specificitás közel egyforma (96-100%), a szenzitivitás a prickteszt esetében 8%, az IgE-titernél 16%, míg CRD esetében 48%. Magyarországon 2015 óta elérhető a komponensalapú allergia diagnosztika. Bazofil aktivációs teszt segítheti a diagnózist, ha az egyéb tesztek eredménye nem egyértelmű.
Kötőhártya-provokációs teszt
A klinikai gyakorlatban nem terjedtek el, a nasalis provokációt is elsősorban foglalkozási ártalmakkal összefüggő rhinitis kimutatására használják (1, 15).
Epikután/Patch-teszt
Allergénnel átitatott korongokat tapasztanak a hát bőrére, majd 48 óra után kimutatható, fennáll-e valamilyen kémiai anyaggal, étellel vagy légúti allergénnel szembeni túlérzékenység. Ekcémás blepharitis vagy blepharoconjunctivitis esetén felmerül késői típusú reakció, gyakran benzalkónium-klorid vagy thiomersal tartósítószerekkel szemben. Célja az allergén kerülés tárgyának meghatározása (25).
Könnyfilm-diagnosztika
A könnyfilm táplálja, nedvesíti és védi a szemfelszínt. A könnyfilm-diszfunkciót jellemezheti a könnytermelés mennyisége (Schirmer-teszt), stabilitása (könnyfilm-felszakadási idő), ozmolaritása, vagy vizsgálhatjuk kevésbé invazív módszerekkel, mint pl. meibográfiával (a Meibom-mirigyek morfológiai ábrázolása), vagy könny lipidréteg interferometriával (16). A szemfelszíni epithelium állapotát fluoreszcein vagy lissamin-zöld festéssel vizualizálhatjuk. Az allergiás gyulladás tünetes fázisában impressziós citológiával vett mintákban a kötőhártyán a hízósejtek és az eozinofil sejtek száma megnő, a könnyben és a szérumban fokozott allergénspecifikus IgE mutatható ki a betegség aktív fázisában (2).
Az allergiás szemfelszín-gyulladások kezelése
A hatékony terápia első lépése a korrekt betegtájékoztatás. Az allergén kerülésén túl a kezelés helyi terápiák együttese, beleértve a szemfelszín védelmét, az allergia ellenes gyógyszereket, gyulladáscsökkentőket, immunmodulátorokat, és a deszenzibilizációt. Sebészi kezelésre nagyon ritkán van szükség. Fő irányelv az aktuális klinikai állapothoz igazított terápiás módok kiválasztása és azok folyamatos adaptálása a lefolyástól függően. A 4 évesnél fiatalabb gyermekek kezelése külön kihívást tartogat.
Nem gyógyszeres kezelés
Minden súlyossági fokban ajánlott az allergén kerülése, akár bizonyított, akár feltételezett a kóroki szerepe. Léteznek nagy hatékonyságú részecskeszűrők, amelyekkel beltérben mérsékelhető az allergénterhelés. Applikációk segítségével valós időben követhető az aktuális pollenhelyzet, egyes alkalmazások a saját tünetek monitorozására is alkalmasak (14). Az allergiabarát növényzet kialakításakor előnyben részesítendők a rovarporozta növények a szélporozta fákkal (pl. nyír) szemben. Gyakori hajmosás, az ágynemű fagyasztása/magas hőfokon való mosása, légtisztító berendezések, szemkörnyéki hűs borogatás alkalmazása javasolt.
A gyulladásos kaszkádban módosult mucin és az elvékonyodott lipidfázis miatt a könnyfilm már nem tölti be megfelelően védő funkcióját (19, 20). Mintegy 11 000 SAC páciens adatai alapján, a szezon során markánsan megjelennek a szárazszem-tünetek (2, 14). A műkönny vagy műkönnygél-kezelés nemcsak az allergén kihigítását, hanem a barrierfunkció támogatását is szolgálja.
Orrtünetekkel kevert allergiás kötőhártya-gyulladásban a tengervizes vagy hiperozmoláris sóoldattal történő orrmosás költséghatékony, jól tolerálható, biztonságos módja az orrdugulás, tüsszögés megszüntetésének (25). A zavartalan könnyelvezetés az orr felé támogatólag hat a szemfelszín gyulladásos folyamataiban. A szemhéjakra tett hűs borogatás csökkentheti a viszkető, égő tüneteket.
A betegek részéről nagymértékű öngyógyításra lehet számítani (20). A stabilizált folyékony oxigéncseppektől kezdve a sótűrő baktériumokból kinyert stabilizáló molekulákat tartalmazó orvostechnikai eszközökig. Túlkínálat van gyógynövényalapú allergiaellenes készítményekből (pl. szalmagyopár-kivonatból), Az alternatív medicinák közül az akupunktúrás kezelésről készültek maszkolt kontrollált vizsgálatok, és allergiás náthában találták hatásosnak. Többszöri kezelések szükségesek, amelyek ára magas lehet (25). Probiotikumok adjuvánsként adva csökkenthetik a szubjektív tüneteket, bár egyelőre kevés bizonyító erejű tanulmány áll rendelkezésre. A gyógynövények és a méz fogyasztása kapcsán nincs konszenzus, sem a hatásosság, sem pedig a veszélyek tekintetében.
Gyógyszeres kezelés
Általában a családorvos által felírható készítményekkel vagy döntő többségben önkezeléssel indul az enyhe szemészeti allergiák kezelése (5. táblázat). Az alábbiakban az erős evidenciákkal bizonyított gyógyszeres kezelések következnek. A kezelőorvosoknak tisztában kell lenni azzal, hogy krónikus szemészeti allergiákban milyen zavarokat szenved a könnyfilm, illetve a szemcsepp összetétele és adalékanyagai hogyan befolyásolják az allergiás szem fiziológiáját. Előny a tartósítószer-mentesség, mert a benzalkónium-klorid súlyosbítja az alapbetegséget.
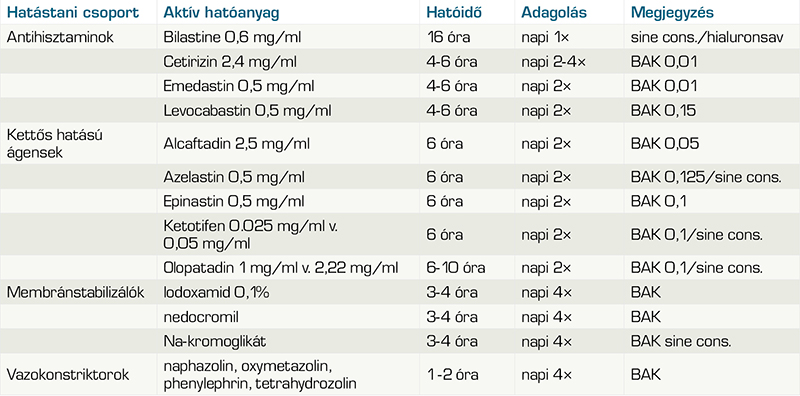
Helyi érszűkítők, dekongesztánsok
Sajnos még mindig gyakran használják a szemvörösség tüneteinek enyhítésére, holott csak rövid távú megoldást jelentenek. A hatástartamuk legfeljebb 1-2 óra, mellékhatásuk viszont számos, pl. szemirritáció, túlérzékenység, rebound hyperaemiás hatás, így csak ritkán szabad alkalmazni őket. A lokális dekongesztánsok alfa-adrenerg stimulánsok.
Helyi antihisztaminok, hízósejt-stabilizátorok
Az allergiás kötőhártya-gyulladás (SAC/PAC) helyi gyógyszeres kezelését az 5. táblázat foglalja össze. A kettős (antihisztamin + hízósejt-stabilizátor) hatású szerek jelentik az elsővonalbeli helyi gyógyszeres kezelést, napi két cseppel tünetmentességet nyújthatnak. Közvetlen összehasonlító vizsgálatok (20) kimutatták, hogy a tünetek enyhítésében és a tolerálhatóságban, a kettős hatású szerek jobban teljesítenek a placebóhoz, illetve a helyi antihisztaminokhoz vagy membránstabilizálókhoz képest. Bár enyhe és mérsékelt eseteknél nagy arányban szövődménymentes tünetmentesség érhető el lokális hízósejt membránstabilizálókkal vagy antihisztaminokkal, azok hatástartama legfeljebb 4 óra, ezért napi kétszeri, legfeljebb négyszeri adagolás javallt. Fontos hangsúlyozni, hogy a membránstabilizálók elsősorban profilaktikusan adva, hetekkel a pollenszezon előtt dozírozva hozzák a várt eredményt. Bár a mellékhatások (fejfájás, átmeneti keserű íz) előfordulhatnak, de gyengék és ritkák, hosszú távon biztonsággal adhatók.
Nagy kihívás rejlik a súlyosabb vagy kezelésre nem reagáló esetek ellátásában. Szaruhártya-szövődmények esetén fokozott szükség van helyi kortikoszteroidok és immunszuppresszív terápia alkalmazására a gyulladás megfelelő kezelése érdekében.
Szisztémás antihisztaminok
Az első generációs orális H1-receptort gátló antihisztaminokhoz képest az újabb generációs antihisztaminok kevesebb központi idegrendszeri és antikolinerg mellékhatással járnak. Az első generációs antihisztaminok mellékhatásai időskorban kifejezettebbek. A H2-receptort gátló antihisztaminok hatásosságáról még nincsenek egyértelmű adatok, H1-gátlókkal együtt hatásuk additív. Orrtünetek megléte esetén első- vagy másodvonalbeli terápiaként alkalmazhatók az intranazális antihisztaminok. A legtöbb tanulmány szerint hatékonyabbak az intranazális kortikoszteroidoknál a tüsszentés, viszketés, orrfolyás és szemtünetek kezelésében (25). A szisztémás leukotriénreceptor-antagonistáknál is hatékonyabbak. A mellékhatások enyhék és ritkák, kevésbé okoznak antikolinerg hatás miatt szárazszem-szindrómát, vagy szedációt.
Helyi glükokortikoidok
Nem szteroid gyulladáscsökkentők helyi adása nem javasolt. A szteroidok hormonként pro- és antiinflammatorikus hatásúak. Glükokortikoid-receptorok szinte minden sejten és szövetben megtalálhatóak, így nem szelektív módon a T-sejtek, az eozinofilek, bazofilek apoptózisát és a gyulladásos citokinek expresszióját gátolják (8, 18). Súlyos esetben tehát szteroidtartalmú cseppekkel lehet megelőzni a gyulladás okozta szövetkárosodást. A hatás akár 6 órán belül is jelentkezhet. A homeosztázis helyreállításának ára lehet a szteroidok proinflammatorikus hatása, a szemnyomás-emelkedés, elnyújtott sebgyógyulás, kataraktaképződés. A szteroid-reszponderek aránya akár 15-30% is lehet, ezért minden esetben, ha lokális szteroid adása elkerülhetetlen, a szoros szemészeti kontrollt is fel kell vállalni. A szemcseppben elérhető fluorometholon már 2 éves kortól adható, de minél kisebb a testtömeg, annál inkább számolhatunk szisztémás hatásokra (pl. testtömeg-növekedés, fertőzések gyakoribbá válása, Cushingoid tünetek). A dexamethason szemcsepp még erősebb hormonhatást fejt ki, ezért különösen gyermekeknél csak rövid ideig adandók. A legkevésbé szemnyomást emelő loteprednol csepp sajnos Európában nem törzskönyvezett, ellenben az Egyesült Államokban igen.
Szupratarzális injekció formájában alkalmazható triamcinolon vagy dexamethason, kifejezetten súlyos, terápiára nem reagáló esetekben jön szóba.
Nazális kortikoszteroidok
Orrtünetekkel is járó pollenallergia esetén a hatás felépüléséhez néhány nap vagy akár néhány hét is szükséges lehet. Intranazális adagolásnál mellékhatásként orrvérzés léphet fel, és a legkisebb hatásos dózis javasolt.
Orális kortikoszteroidok
Rutinszerű használatuk egyáltalán nem javasolt, ugyanakkor egyes nagyon súlyos esetekben rövid ideig tartó adagolásuk gondos megfigyelés mellett hatékony lehet. A mellékhatások közül ki kell emelni a hypothalamus-hypophysis tengely szuppressziót, amely gyermekeknél a növekedéselmaradásához vezethet (25).
Immunmodulátor-kezelések
Az immunmodulátorokat 1959 óta alkalmazzák a klinikai gyakorlatban (3), kezdetben leginkább a transzplantációs medicinában. Számos egyéb szemészeti betegség kezelésére alkalmazzák őket, beleértve a súlyos szemszárazságot, a nem fertőzéses uveitist, és egyéb, nehezen kezelhető szemfelszíni betegségeket. Az immunmodulátor-terápia szteroid-megtakarító (5, 8, 18), jól tolerálható, és kedvező biztonsági profilú, ezáltal döntő szerepet játszik a közepes és súlyos allergiás szembetegségek kezelésében.
Ciklosporin
A ciklosporin-A (CsA) a kalcineurin-foszfatáz aktivitását, ezáltal az IL-2 és más citokinek termelődését gátolja, továbbá blokkolja a T-sejtekben az antigénfelismerés jelátviteli útvonalait, és a Th2 gátlása révén az IL-4-, IL-5-szinteket is csökkenti. Japánban 2%-os, Európában 1 mg/ml és 0,9 mg/ml CsA-oldat adható eredetileg súlyos szemszárazság indikációban. A Magyarországon elérhető készítmény a Nemzeti Egészségbiztosítási Alapkezelő által kijelölt klinikai központokban, eü. emelt indikációban rendelhető adott indikációkban. A 18 év alatti páciensek számára off-label felhasználási engedéllyel, és egyedi támogatással lehet igényelni. Az Európában törzskönyvezett CsA szemcseppek között található nanoemulziós és vízmentes formula: a becseppentéskor jelentkező enyhe csípőérzés elkerülése vagy a hatóidő megnyújtása céljából. A lokális CsA jól tolerálható, hosszan adható, mellékhatások gyengén és átmenetiek, jelentős szteroidspóroló hatással bír (5).
Takrolimus 0,03/0,1% (FK-506) szemcsepp szintén kalcineurin- foszfatáz-gátló, a CsA alternatívájaként jó hatékonysággal adható mérsékelt vagy súlyos allergiás szembetegségekben (8, 13). Hatása már 4 héten belül jelentkezik, szteroidspóroló készítmény. Mintegy 36%-ban lép fel helyi, átmeneti égőérzés becseppentéskor. Takrolimus 0,1%-os krém formájában adható dermatitis esetén. Magyarországon jelenleg nem elérhető.
Dupilumab IL-4- és IL-13-gátló monoklonális IgG4-antitest, amely injekció formájában adva hatásos lehet AKC mérsékelt vagy súlyosabb eseteiben (5. ábra). Mellékhatásai a beadás helyén jelentkező bőrpír, szemhéjgyulladás, kötőhártya-gyulladás (3, 13).
Klinikai ajánlás antiallergiás szemcseppek adásához
A szemészeti allergiaellenes kezelések hatékonyságát 28 tanulmány alapján, hálózat-metaanalízissel rangsorolták (17). A fő klinikai formákban a kezelés hatásosságának valószínűsége eltérő (20). A leggyakoribb SAC és PAC esetén az olopatadin 0,1%; 88%-os valószínűséggel hatásos, szorosan követik az antihisztaminok (alkaftadin 0,25%; 86%, bepotasztin 1,5%; 84%), az új és a régebbi antihisztaminok hatékonysága egyértelműen fokozatosan csökken (pl. kromolin 72%). A súlyosabb VKC és AKC-formákban a kezelés hatékonysága tekintetében az immunmodulátorok dominálnak a rangsor élén: 0,1% tacrolimus (92%)> ciklosporin-A (85%)> szupratarzális kortikoszteroid (83%)> fluorometolon (78%)> N-acetil-aszpartil-glutaminsav (72%). Az enyhébb formáktól a súlyosabb formák felé csökken a sikeres kezelés együttes valószínűsége (SAC: 89%, PAC: 82%, VKC: 75%, AKC: 68%).
Terhesek és szoptatós anyukák medikációjával kapcsolatban továbbra sincsenek evidenciákon alapuló bizonyítékok. Az első trimeszterben a kromoglikátok biztonságosak, a már megkezdett immunterápia folytatható, de új immunkezelést terhesség alatt nem javasolt kezdeni. Az EAACI álláspontja szerint nem indokolt felfüggeszteni az allergiaellenes szerek adását a COVID- fertőzés alatt, mert jelenleg nem bizonyított, hogy rontaná a COVID- 19-fertőzés prognózisát.
Gyakorlati szempont, hogy a megfelelő terápiával történő korai beavatkozás javíthatja az eredményeket, a kezelések rendszeres monitorozásának szükségessége. A kezelés kiválasztásakor figyelembe kell venni a beteg együttműködését, a költségeket és a rendszeres nyomon követés lehetőségét. A klinikai monitorozás a mellékhatások monitorozását is jelenti, különösen hosszú távú immunmodulátor-használat esetén, az adagolás módosításának felismerése.
Sebészi kezelés
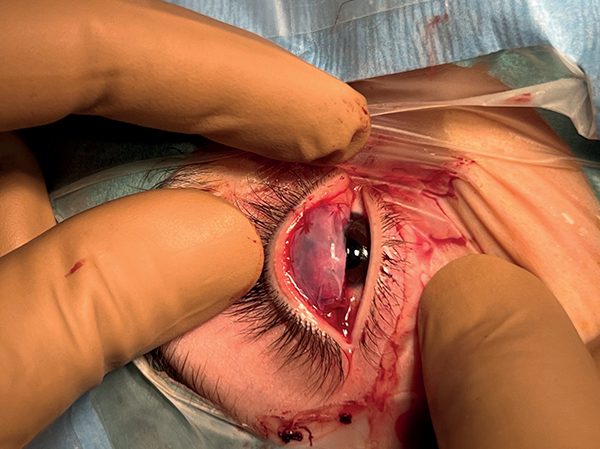
A súlyos allergiás szemgyulladásoknál ritkán sebészi beavatkozás válik szükségessé. A plakk levonása a shield ulcus felszínéről elősegítheti a perzisztáló esetekben a gyógyulást. Nagyon ritkán (esetleg pseudoptosis, visszatérő shield ulcus) esetén kerülhet sor az óriáspapillák kimetszésére (8). Steril körülmények között nyálkahártya vagy amnionmembrán graft felvarrása segítheti a rekurrencia kivédését (7. ábra). Allergiával társuló keratoconus esetén cornea cross linking (CCT) kezelés jön szóba.
Allergénspecifikus immunterápia
Az allergénkerülés, és tüneti kezelés együttesére nem kellően reagáló esetekben, a tüneti kezelés mellett az immuntolerancia kialakítása céljából alkalmazzák, amikor a tünetes időszak évente több hétig elhúzódik. Leggyakrabban nyír-, fűpollen- vagy poratkaallergén-kivonattal történik, standardizálásuk még várat magára. A poliszenzitizáció nem jelenti feltétlen poliallergiát, és a keresztreakciók is magyarázhatják a teszteredményeket. A kezelés akkor indokolt, ha egy adott szenzitizációt okozó allergén valós tüneteket is okoz.
Gondos allergológiai kivizsgálást, az allergén pontos azonosítását, precíz betegválogatást igényel az allergén immunterápia rhinitis allergica vagy rhinoconjunctivitis esetén (4, 6, 13, 25). Az allergén immunterápia indikációját, a készítmény megválasztását érdemes allergológusra vagy allergén immunterápiában járatos orvosra bízni. Szubkután immunterápia (SCIT) hazánkban allergológus-immunológus szakorvos indikációjával, intenzív osztályos háttérrel bíró intézményben végezhető. Hatásosságát számos tanulmány bizonyítja (25), költséghatékony. A súlyos szisztémás mellékhatások a hagyományos SCIT-kezelésnél ritkák, ellenben gyakoribbak a „rush” SCIT során, amikor az allergén adagolása gyorsított ütemben zajlik a mielőbbi eredményesség érdekében. A „cluster” SCIT szintén nagyobb ütemben juttatja be az allergént, ugyanakkor az előny-hátrány tekintetében megelőzi a hagyományos SCIT-kezelést, de mindenképpen premedikációt igényel. Gyermekeknél a sublingualis immunterápia (SLIT) preferált. Klinikai tapasztalat szerint a rhinitis allergica miatt adott allergénspecifikus immunterápia a komorbiditásokra is kedvező hatással van, így a conjunctivitisre is. A hatásossága már négy hónapos kezelés után kimutatható, az allergén immunterápia időtartama általában 3-5 év.
Újabb kezelési lehetőségek
SAC-pácienseknél, az akut gyulladásos tünetek megjelenése előtt, alkalmazható olyan speciális napi eldobható lágy kontaktlencse, amely ketotifen-fumarátot bocsájt ki (12). A használat csökkentette a szemtüneteket és késleltette az antiallergén szemcsepp-kezelés kezdetét. Ugyanakkor, az allergia tünetes fázisában fel kell függeszteni a kontaktlencse-viselést, részben a csökkent könnyfilm-cserélődés, részben a beszűkült mozgás miatt (12).
Az eozinofilek toborzását, kemotaxisát, adhézióját és túlélését/aktiválását célzó terápiák előnyösnek bizonyulhatnak a krónikus szemallergiában szenvedő betegek számára. A rebamipid molekula gátolja az eozinofilek toborzását, és Japánban a szárazszem-betegség kezelésére engedélyezték. A hagyományos terápiákra refrakter VKC/AKC-betegnél hasznosnak találták a rebamipid cseppeket a papilláris változások enyhítésében (23). A mepolizumab és a reslizumab, az FDA és az EMA jóváhagyásával súlyos eozinofil asztma kezelésére használatos szubkután adagolású biológiai szerek, amelyek az IL-5-öt és az IL-5-receptor révén az eozinofil aktivációt és túlélést gátolják (1). Mivel az eozinofilekkel kapcsolatos gyulladás központi útját célozzák, különösen VKC és AKC esetén lehetnek hasznosak kiegészítő terápiaként, bár a szubkután beadása korlátozza ezeknek a gyógyszereknek a szembetegségekben való alkalmazását. Az anti-IgE hatású omalizumab mérsékli az eozinofil gyulladást valószínűleg a toborzó citokinek és a dendritikus sejtek gátlása révén. Eozinofil rhinosinusitisben és súlyos asztmában sikeresen alkalmazták, míg a VKC-ben és AKC-ben szenvedő betegek klinikai tüneteinek kezeléséről csak esettanulmányok jelentek meg (11). Klinikai kísérletek zajlanak szelektív glükokortikoid-receptor-agonistákkal, illetve immunstimuláló szekvenciákkal, amelyekkel a nem várt hatások (pl. korai katarakta, glaukóma, Cushing-kór) remélhetőleg csökkenthetők.
Ezek az új terápiák további vizsgálatot igényelnek a krónikus szemallergiában szenvedő betegek betegségterhének csökkentése érdekében.
Következtetések
A szem zárt rendszer, mert bár nem teljesen immunprivilegizált, de képes szisztémás szenzitizáció esetén is tünetmentes maradni, illetve fordítva, szisztémás szenzitizáció nélkül lokálisan kialakítani specifikus immunválaszt.
Szemészeti ellátás során megkerülhetetlen az allergiás szemgyulladás, mert előfordulása gyakori és egyes formái tartós szoros követést igényelnek a látásromlás megelőzése miatt. A tünetmentesség megtartása és a munkaképesség vagy tanulási kedv visszanyerése is közös célja a betegnek és az orvosnak.
Klinikai ajánlás
A: Multidiszciplináris megközelítés javasolt, akiknél más kísérőbetegségek jelentkeznek.
B: A kezelés magában foglalja a környezeti, nem gyógyszeres, és gyógyszeres javaslatokat.
C: Első lépés az allergén elkerülése, a helyi szemészeti antihisztaminok vagy kettős hatású elsővonalbeli gyógyszerek.
D: A szemészeti oldatokban található tartósítószerek szemfelszíni károsodást okoznak, súlyosbítják az alapbetegséget.
E: A szemfelszín védelme és ápolása alappillére a kezelésnek. Előnyben részesítendők a tartósítószer-mentes, összetételükben szemfelszín regeneráló hatású készítmények.
F: Az allergiavizsgálatok elvégzése alapvető fontosságú a helyes kezelés megválasztásában.
G: A javasolt kezelés betartását elősegíti a minél kevesebb napi cseppentés és az egyszerűsített kezelési terv.
Köszönetnyilvánítás
Dr. Mezei Györgyi allergológus pulmonológus adjunktusnak iránymutató, hasznos megjegyzéseiért és a betegek iránt tanúsított elkötelezettségért.
Széles Éva alkalmazott fotográfusnak, aki töretlen türelemmel dokumentálja a páciensek állapotát.
Nyilatkozat
A szerző kijelenti, hogy az összefoglaló megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Rövidítések:
AKC: atópiás keratoconjunctivitis; COVID: koronavírus-betegség; CsA: ciklosporin-A; EAACI: European Academy of Allergy and Clinical Immunology; EMA: European Medical Agency; FDA: Food and Drug Administration; MMP: mátrix metalloproteáz; SAC: szezonális allergiás kötőhártya-gyulladás; SCIT: szubkután immunkezelés; sIgE: allergénspecifikus immunoglobulin-E; SLIT: szublingvális immunkezelés; PAC: perenniális allergiás kötőhártya-gyulladás; VKC: vernalis keratoconjunctivitis
Irodalom
1. Agach I, Beltran J, Akdis C et al. Efficacy and safety of treatment with biologicals (benral-izumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines – recommendations on the use of biologicals in severe asthma. Allergy 2020; 75: 1023 042.
https://doi.org/10.1111/all.14221
2. Akasaki Y, Inomata T, Sung J, et al. Prevalence of Comorbidity between Dry Eye and Allergic Conjunctivitis: A Systematic Review and Meta-Analysis. J Clin Med 2022; 11: 3643–3654.
https://doi.org/10.3390/jcm11133643
3. Allison AC. Immunosuppressive drugs: The first 50 years and a glance forward. Immunopharmacology 2000; 47: 63–83.
https://doi.org/10.1016/s0162-3109(00)00186-7
4. Armentia A, Sanchís E, Montero JA. Component-resolved diagnostics in vernal conjunctivitis. Curr Opin Allergy Clin Immunol 2016; 16: 498–504.
https://doi.org/10.1097/ACI.0000000000000296
5. Barcsay-Veres A, Csorba A, Kovacs I, et al. Corticosteroid-sparing topical treatment with cyclosporin for juvenile keratoconjunctivitis. Sci Rep 2025; 15: 4671.
https://doi.org/10.1038/s41598-025-85256-z
6. Bielory L, Delgado L, Katelaris CH, Leonardi A, Rosario N, Vichyanoud P. ICON – Diagnosis and management of allergic conjunctivitis. Annals of allergy, asthma and immunology 2020; 124: 118–134.
https://doi.org/10.1016/j.anai.2019.11.014
7. Bonini S, Sacchetti M, Mantelli F, Lambiase A. Clinical grading of vernal keratoconjunctivitis. Curr Opin Allergy Clin Immunol 2007; 7: 436–441.
https://doi.org/10.1097/aci.0b013e3282efb726
8. Bruschi G, Ghiglioni DG, Cozzi L, Osnaghi S, Viola F, Marchisio P. Vernal Keratoconjunctivitis: A Systematic Review. Clin. Rev. Allergy Immunol 2023; 65: 277–329.
https://doi.org/ 10.1007/s12016-023-08970-4
9. Cavuoto KM, Galor A, Zhu AY. Role of the ocular surface microbiome in allergic eye diseases. Current Opinion in Allergy and Clinical Immunology 2023; 23: 376–382.
https://doi.org/10.1097/ACI.0000000000000930
10. DiZazzo A, Micera A, De Piano M, Coassin M, Sharma S, Bonini S, Fernandes M. Adult Vernal Keratoconjunctivitis: Clinical and biochemical profile of a rare disease. Ocul Surf 2019; 17: 737–742.
https://doi.org/10.1016/j.jtos.2019.07.004
11. Doan S, Amat F, Gabison E, et al. Omalizumab in severe refractory vernal keratoconjunctivitis in children: case series and review of the literature. Ophthalmol Ther 2017; 6: 195–206.
https://doi.org/10.1007/s40123-016-0074-2
12. Fujio K, Sung J, Hirosawa K, Yamaguchi M, et al. Effect of antihistamine-releasing contact lenses on ocular symptoms and treatment behavior in patients with seasonal allergic conjunctivitis: A retrospective study. Heliyon 2024; 10: e33385.
https://doi.org/10.1016/j.heliyon.2024.e33385
13. Hehar NK, Chigbu DI. Vernal Keratoconjunctivitis: Immunopathological Insights and Therapeutic Applications of omodulators. Life (Basel) 2024; 14: 361–379.
https://doi.org/10.3390/life14030361
14. Inomat T, Nakamura M, Iwagami M, et al. Symptom-based stratification for hay fever: A crowdsourced study using the smartphone application AllerSearch. Allergy 2021; 76: 3820–3824.
https://doi.org/10.1111/all.15078
15. Kate A, Basu S, Hu V. Managing ocular allergy. Community Eye Health 2024; 37: 2–5.
16. Kayal A. The Physiology of Tear Film. Dry Eye Syndrome-Modern Diagnostic Techniques and Advanced Treatments. IntechOpen 2021; 1–9.
https://doi.org/10.5772/intechopen.98945
17. Krungkraipetch L, Tansavadi T, Krungkraipetch D. Ranking the efficacy of topical treatments for ocular allergy: A network meta-analysis of current evidence. The Ocular Surface 2025; 37: 273–282.
https://doi.org/10.1016/j.jtos.2025.05.003
18. Kumar S. Vernal keratoconjunctivitis: A major review. Acta Ophthalmol 2009; 87: 133–147.
https://doi.org/10.1111/j.1755-3768.2008.01347.x
19. Leonardi A, Lazzarini D, Motterle L, Bortolotti M, Deligianni V, Curnow SJ, Bonini S, Fregona IA. Vernal keratoconjunctivitis-like disease in adults. Am J Ophthalmol 2013; 155: 796–803.
https://doi.org/10.1016/j.ajo.2012.11.018
20. Leonardi A, Quintieri L, Presa IL, et al. Allergic Conjunctivitis Management: Update on Ophthalmic Solutions. Curr Allergy Asthma Rep 2024; 24: 347–360.
https://doi.org/10.1007/s11882-024-01150-0
21. Miyazaki D, Fukagawa K, Okamoto S et al. Epidemiological aspects of allergic conjunctivitis. Allergol Int 2020; 69: 487–495.
https://doi.org/10.1016/j.alit.2020.06.004
22. Rodrigues J, Kuruvilla ME, Vanijcharoenkarn K. The spectrum of allergic ocular diseases. Ann Allergy Asthma Immunol 2021 Mar; 126(3): 240–254.
https://doi.org/10.1016/j.anai.2020.11.01
23. Ueta M, Sotozono C, Koga A, et al. Usefulness of a new therapy using rebamipide eyedrops in patients with VKC/AKC refractory to conventional anti-allergic treatments. Allergol Int 2014; 63: 75–81.
https://doi.org/10.2332/allergolint.13-OA-0605
24. Wei CC, Kung YJ, Chen CS, et al. Allergic Conjunctivitis-induced Retinal Inflammation Promotes Myopia Progression. EBioMedicine 2018; 28: 274–286. https://doi.org/10.1016/j.ebiom.2018.01.024
25. Wise SK, Damask C, Roland LT, et al. International consensus statement on allergy and rhinology: Allergic rhinitis – 2023. Int Forum Allergy Rhinol 2023; 13: 293–859.
https://doi.org/ 10.1002/alr.23090
