Orbital pseudotumor
doi: 10.55342/szemhungarica.2024.161.4.164
Review
Summary
More than a third of orbital diseases are of inflammatory origin. Some of them are infectious inflammations, which are associated with severe, acute, local, and general symptoms. There are well-defined rules for their diagnosis and treatment.
Non-infectious inflammations form a heterogeneous group. Some of them are specific, i.e., their causes are known; most of them are non-specific, idiopathic, i.e., the cause is unknown; this is orbital pseudotumor.
Specific orbital inflammations are local manifestations of multisystem, mostly autoimmune diseases. Countless rheumatoid diseases, necrotising vasculitides, different forms of xanthogranulomatous, and spectrum diseases such as IgG4-associated disease are included here, among many other rare diseases. All of these diseases can appear in the orbit independently, or they can be part of a multi-organ disease at the same time. They can be called autoimmune-associated diseases of the orbit. The specific group also includes the well-known phenomenon when malignant tumors, lymphomas, and lymphoid hyperplasia cause inflammatory symptoms. Therapy means treating the underlying disease.
The non-specific (NSOI), idiopathic (IOI) orbital inflammation, so-called orbital pseudotumor, which makes up the largest part of orbital inflammations, is not inadvertently the focus of professional interest.
Not only is its cause unknown, but its diagnostic and therapeutic professional principles are also impossible to determine and follow in every case. The course of the disease and the reaction to treatment cannot be predicted.
The purpose of this publication is to shed light on some diagnostic and therapeutic cornerstones.
Összefoglaló
Az orbita betegségeinek több mint egyharmadát a gyulladásos tünetekkel járó kórképek alkotják. Ezek egy része fertőzések okozta infekciózus gyulladás, amelyek súlyos, akut, lokális és általános tünetekkel járnak. Kórismézésének és kezelésének jól körülhatárolt szabályai vannak. A nem infekciózus gyulladások heterogén csoportot alkotnak. Egy részük specifikus, tehát okai ismertek, nagyobbik részük nem specifikus, idiopátiás, vagyis oka ismeretlen, ez a pseudotumor orbitae. A specifikus orbitagyulladások multiszisztémás, többnyire autoimmun betegségek lokális megnyilvánulásai. Számtalan reumatoid, nekrotizáló vasculitises, xantogranulomatosisos, valamint spektrum betegségek, mint az IgG4-asszociált betegség, tartoznak ide, sok egyéb, ritka betegség mellett. Ezen betegségek mindegyike megjelenhet az orbitában önállóan, vagy lehet egyidejűleg a sokszervi betegség része. Ezeket az orbita autoimmun asszociált betegségeinek is nevezhetjük. A specifikus csoportba tartozik az az ismert jelenség is, amikor malignus tumorok, lymphomák, limfoid hiperplázia váltanak ki gyulladásos tüneteket. A terápia az alapbetegség kezelését jelenti. A nagyobbik csoportba tartozó, nem specifikus (NSOI), idiopátiás (IOI) orbitagyulladás, a pseudotumor orbitae nem véletlenül kerül a szakmai érdeklődés középpontjába. Nemcsak oka ismeretlen, de diagnosztikai és terápiás szakmai elveit sem lehet minden esetre vonatkozóan meghatározni és azt követni. A betegség lefolyása, és a kezelésre adott reakció nem kiszámítható. A közlemény célja, hogy néhány diagnosztikus és terápiás sarokpontot megvilágítson.Keywords
orbital pseudotumor, diagnosis, differential diagnosis, therapy
Kulcsszavak
pseudotumor orbitae, diagnózis, differenciáldiagnózis, terápia
Bevezetés és definíció
A pseudotumor orbitae terminus technikust Birch-Hirschfeld alkalmazta elsőként 1905-ben, Heidelbergben tartott előadásában, majd 1906-ban írt könyvének erről szóló fejezetében (1). A jó megfigyelőképességgel rendelkező szemészorvosnak ugyanis feltűnt, hogy a páciensei között vannak olyanok, akiknek orbitatünetei spontán vagy az akkori, ugyancsak korlátozott terápiás lehetőségek (higany, Kalium-jodid, arzén, kinin) használata után megszűntek. Ide sorolta azokat is, akiknél exophthalmus miatt Krönlein-műtétet végezve nem körülírt daganatot, hanem diffúz gyulladásos sejtes infiltrációt talált, valamint azokat, akiknél talált ugyan körülírt tumort, de a szövettani lelet nem neopláziát, hanem krónikus gyulladást igazolt. A „pseudotumor” elnevezés jól kifejezte azt a tényt, hogy morfológiailag tumort utánzó szövetszaporulatról van szó, amely azonban nem tumorsejtekből épül fel.
Arthur Grove 2013-ban rendkívül figyelemreméltó cikket írt a téma szakmatörténeti fejlődéséről, amelynek appendixeként közreadta az eredeti „scientific German” nyelven írt Birch-Hirschenfeld cikk angol nyelvű fordítását (2).
A pseudotumor orbitae természetének fokozatos felismerése megkövetelte a név megváltoztatását. Az 1920-as években angol–amerikai irodalomban jelent meg az „inflammatoric pseudotumor”, elnevezés, amely már kifejezte azt, hogy gyulladásos folyamatról van szó. A mai hivatalos nómeklatúrában a nem infekciózus, nem specifikus, (non-specific orbital inflammation: NSOI), vagy más néven idiopátiás orbitagyulladás (idiopathic orbital inflammation: IOI) elnevezésekkel találkozunk. A mindennapi gyakorlatban használjuk a pseudotumor orbitae megnevezést is.
Az idiopátiás orbitagyulladás (IOI) az orbita képleteinek nem infekciózus, gyulladásos eredetű térszűkítő folyamata, amelynek oka ismeretlen, és amely jól reagál szteroidkezelésre. Szövettanilag limfocitában gazdag, nem specifikus gyulladás képét mutatja, az esetek egy részében fibrózissal. Az IOI a látóideg direkt károsításának kivételével az orbita valamennyi képletét megtámadhatja. Az IOI kizárásos diagnózis, ami azt jelenti, hogy mindazokat a kórokokat, amelyek a specifikus gyulladásokban megjelennek, a diagnosztika minden szükséges eszközével ki kell zárni.
Az 1970-es évektől megjelenő képalkotó diagnosztika, majd a robbanásszerűen fejlődő immunológiai, immunhisztokémiai és genetikai ismeretek újabb és újabb csoportokat választottak le, illetve jellemző tulajdonságokat ismertek fel az IOI-val kapcsolatosan. Mindezek ellenére az IOI jelenleg is a 3. leggyakoribb orbitabetegség az endokrin ophthalmopathiát és a lymphomát követően (1. ábra).

Patofiziológia
Az IOI etiológiája és patogenezise jelenleg nem ismert. Fertőzéssel kapcsolatos elméletet vet fel, hogy egyes esetekben a felső légutakat érintő vírusos vagy bakteriális fertőzés előzi meg az IOI kialakulását, mint például Streptococcus, herpes simplex vagy az Epstein–Barr-vírusfertőzéshez kapcsolódóan. A vizsgálatok azonban ellentmondóak, egyértelmű, következetes összefüggést nem lehetett kimutatni (9).
Az IOI gyakran jelenik meg autoimmun betegségekhez kapcsolódóan, mint a Crohn-betegség, a szisztémás lupus erythematosus (SLE), a rheumatoid arthritis (RA), a myasthenia gravis, a spondilitis ankilopoetika (Bechterew-kór). Momberts már 1997-ben leírta, hogy IOI betegeinek 10%-ában talált egyidejűleg zajló autoimmun betegséget (4). 2007-ben Sobrin és munkatársai 27, myositis miatt infliximabbal kezelt betegük között 21 esetben derült ki koincidentálisan reumatológiai betegség (5). Az IOI lehet egy többszervi autoimmun betegség része, amennyiben orbitából nyert biopszia hisztológiai képe ennek megfelel. Ilyen lehet a GPA, az IgG4-RD, valamint a Sjögren-szindróma (6). Ha a szövettani vizsgálat IOI-t igazol, azonban a betegnek van más, ismert autoimmun betegsége (Crohn, RA, SLE), akkor arról van szó, hogy kettő vagy több autoimmun betegség zajlik egyidejűleg egyazon beteg szervezetében, amelyek közül az egyik az IOI. Ezek izgalmas, de mindeddig inkább elméleti kérdések. A terápiát ugyanis érdemben nem befolyásolják, amelynek alapja továbbra is nagyrészt a szteroid, illetve más immunszuppresszív, citosztatikus és biológiai terápiás szerek.
Atabay és munkatársai myositises betegekben a szemizom antigénjeivel szembeni keringő ellenanyagot mutattak ki, amelyről kiderült, hogy endokrin ophthalmopathiás betegekben is megtalálhatóak (7). Ez újabb érdekes kérdést vet fel az EOP és IOI patogenezise között, az autoimmun reakciót kiváltó antigén egyikben sem ismert.
Wladis és munkatársai a különböző citokinek, mint interleukinek, az interferonok, a tumornekrózis-faktor-alfa megemelkedését tapasztalták IOI-s betegekben (8). Az eddigi kutatások és a klinikai megfigyelések, mint a szteroidkezelés hatásossága is, az IOI etiopatogenezisének immunmediált, autoimmun mechanizmusát valószínűsítik, amelyet genetikai predispozíció és bizonyos környezeti tényezők felerősíthetnek.
Klinikai kép és szemészeti tünetek
Az IOI érintheti az orbita egy vagy több, vagy valamennyi képletét. Megkülönböztetünk lokalizált és diffúz formát. A lokalizált forma gyakorisági sorrend szerint a következő: dacrioadenitis, orbitalis myositis, perineuritis, scleritis posterior. A diffúz forma morfológiailag tumorra emlékeztet, lehet intrakonális, izomkónuszon belül elhelyezkedő, és/vagy extrakonális, az izomkónuszon kívül elhelyezkedő. A fissura orbitalis superioron keresztül a koponyabázisra vagy a sinus cavernosusba terjedhet. Az utóbbit Tolosa–Hunt-szindrómának nevezzük.
Antero-posterior irányba haladva elkülöníthetjük az elülső, a diffúz, a posterior és az apikális lokalizációt (9, 10, 12).
A orbitacsúcsban elhelyezkedő, apikális forma lokalizációja miatt a legsúlyosabb funkciósérüléseket okozza, mivel az orbitacsúcs képleteit, a nervus opticust, a szemizmok eredését és a szemmozgató agyidegeket komprimálja.
Többnyire egyoldali, de ismétlődő fellángolás esetén jelentkezhet, akár váltakozva, az ellenoldalon is, ritkábban egyszerre mindkét oldalon. Kétoldali, egyidejűleg jelentkező folyamat inkább szisztémás betegségre utal. Valamennyi lehet akut, szubakut és fokozatosan, krónikusan kezdődő. Az IOI általában féloldali, akutan fellángoló gyulladásos tünetekkel kezdődik. Jellemző a hyperaemia, ödéma, chemosis, fájdalom. A kezdet azonban lehet alattomos, elhúzódó, krónikus is, ebben az esetben a gyulladásos tünetek kevésbé kifejezettek, inkább egy mérsékelt fokú exophthalmus és a funkciósérülés dominál. Míg az akut esetben a szövettani képre a gyulladásos sejtes beszűrődés és az ödéma jellemző, a szklerotikus formában nem-specifikus fibrózis látható. Az akut eset jól reagál szteroidra, a fibrotikus típus bármely kezelési kombinációval nehezen befolyásolható. Lokalizációtól függően, az irradiációs kezelés, és/vagy a terime sebészi megkisebbítése javulást eredményezhet (10, 12, 13).
Vita folyik arról, hogy a krónikus, granulomatózus, fibrózus forma az akut gyulladás transzformációja, vagy önálló entitás. A klinikai tapasztalat inkább az utóbbit erősíti meg.
Az IOI gyanús beteg vizsgálata során a „kizárásos diagnózis” logikája szerint kell eljárnunk.
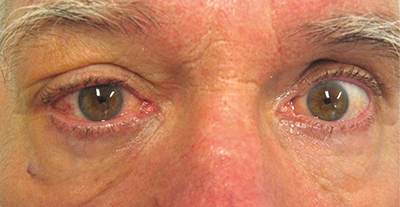
Az anamnézis felvételekor rákérdezünk a tünetek kezdetének idejére, és arra, hogy voltak-e már korábban hasonló panaszai, illetve tünetei. Volt-e, vagy van-e jelenleg is zajló autoimmun vagy malignus tumoros betegsége. Az IOI többnyire akutan indul, van azonban krónikus, granulomatózisos formája is. Rögzítjük a külső tüneteket pontos leletezéssel, lehetőség szerint fénykép készítésével is. A klinikai tüneteket részben meghatározza a folyamat lokalizácója. A gyulladásos tünetek közül leggyakoribb a hyperaemia és az ödéma, ezt követi a fájdalom és az exophthalmus. Periorbitális ödéma, hyperaemia, exophthalmus ptózissal inkább IOI-ra utal, míg endokrin ophtalmopathiában (EOP) ugyanezek a tünetek típusosan felső szemhéji retrakcióval (Graefe-tünet) társulnak. Szemmozgás-korlátozottságot, következményes kettőslátást okoz a szemizmok funkciósérülése a bennük zajló akut gyulladás vagy fibrózis miatt. Diplopia léphet fel mechanikus okból a szemgolyó diszlokációja vagy a szemizmok vongálása miatt, az utóbbit az intraorbitális térszűkület okozza. Az orbitacsúcsban elhelyezkedő folyamat következménye súlyos látásromlás lehet a nervus opticus kompressziója révén.
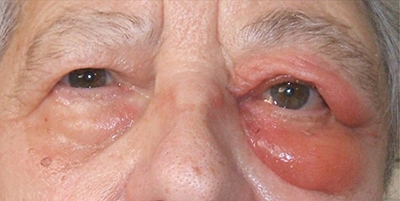
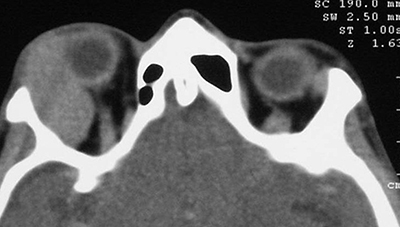
Ha szemhéjakat áttapintva az ödémásnak tűnő duzzanatban szövetszaporulatot észlelünk, a granuloma mellett felmerül a lymphoma lehetősége is (10, 12), (2. a és b ábra).

Diagnózis, differenciáldiagnózis
A diagnózis felállításában fontos szerepe van a képalkotó vizsgálatoknak. A részletekre az egyes betegségformáknál fogunk kitérni (13).
Laboratóriumi vizsgálatok közül rutinszerűen teljes vérképvizsgálatot végzünk, különösen informatívak lehetnek akut szakaszban a megemelkedett gyulladásos paraméterek: vörösvértest-süllyedés, C-reaktív-protein, CRP-vizsgálat. Az esetlegesen felmerülő autoimmun betegségek megerősítése vagy kizárása céljából immunszerológiai vizsgálatokat is kérünk. Ezek közül célszerű az ANA (antinuclear antibodies, SLE), ANCA (antineutrophil cytoplasmic antibodies: szisztémás vasculitisek, GPA) ACE (angiotensin-converting enzyme levels: szarkoidózis), szérum IgG4-szint, SS-A, SS-B (Sjögren-szindróma) és a RF (reumatoid faktor) vizsgálatok elvégzése. Az immunhisztokémiai vizsgálatokhoz szükséges vérvétel mindig a szteroidkezelést megelőzően történjen! Hangsúlyozni kell azonban, hogy a negatív eredmény nem bizonyító erejű, pozitív eredmény pedig nem csak egy bizonyos betegsége utal. A beteg tüneteit összességükben, több szakember bevonásával kell értékelni (14).
Típusos esetekben ezek a vizsgálatok elégségesek lehetnek a diagnózis felállításához és a kezelés megkezdéséhez. Biopsziára azonban az IOI megerősítéséhez vagy kizárásához gyakrabban van szükség, mint más, egyértelmű orbitabetegségeknél. Szemhéji csomók, a megnagyobbodott könnymirigy és a diffúz intraorbitális térszűkület gyakran okoz differenciáldiagnosztikai problémát. A „great mimics”: az IOI, a lymphoma és a metasztázis csak célratörő, pontos anamnézisfelvétellel és biopsziával különíthető el egymástól (3. ábra).
Ritka esetben megtörténik, hogy az IOI-s tünetek miatt végzett immunológiai vagy akár szövettani vizsgálat derít ki a betegnél egy addig nem fel nem fedezett autoimmun folyamatot. Saját anyagunkban diagnosztizáltunk diffúz orbitatumor biopsziájából GPA-t, feltételezett könnymirigy-pseudotumorból sarcoidosist és IgG4-RD-t. A látás és szemmozgások veszélyeztetése miatt myositisekben és apikális térszűkület eseteiben csak nagyon ritkán és indokolt esetben végzünk biopsziát. A beavatkozás mindig külső feltárásból történik. Tűbiopsziával nem nyerünk elegendő anyagot, mert a kóros szövet gyakran kemény, tömött, szklerotikus (1. táblázat).

Dacrioadenitis
A könnymirigy többféle betegség predilekciós helye. Lokalizált IOI leggyakrabban a könnymirigyben jelenik meg, bár alig marad el ettől a második helyet elfoglaló myositis, egyes szerzők a myositist gyakoribbnak találták. A benignus és malignus epithelialis tumorok, lymphomák, vaszkuláris léziók, infekciózus gyulladások, autoimmun szisztémás betegségek és a nem specifikus gyulladások (pseudotumor orbitae) elkülönítése felelősségteljes és nem mindig könnyű feladat.
A könnymirigyben az IOI-t követően leggyakoribbak a lymphomák, legfontosabb az életet veszélyeztető adenoid cisztikus karcinóma felismerése, és a benignus pleomorf adenoma helyes diagnózisa.
A könnymirigy valamennyi térfoglaló folyamata hasonló klinikai tünetekkel jelentkezhet. A felső szemhéj duzzadt, a duzzanat a laterális harmadban kifejezettebb, ezáltal a felső szemhéjszél fektetett S-alakú lesz. A megnagyobbodott könnymirigy tapinthatóvá válik a felső-laterális orbitaszél előtt, mellett vagy mögött. A gyulladásos granuloma és a malignus könnymirigy-tumor tömött, kemény tapintatú, a csonthoz rögzült, a lymphoma rugalmas, mobilis, retroponálható. Hyperaemiás bőr, spontán, vagy tapintásra jelentkező fájdalom gyulladásra utal. Hyperaemiás lehet a felső áthajlás külső harmada és a bulbaris conjunctiva is. Ez lehet gyulladás jele, de felveti lymphoma lehetőségét is. Lymphomában a típusos „lazac színű” szövetszaporulat is megjelenik a conjunctiva alatt.
A megnagyobbodott volumenű könnymirigy a szemgolyót befelé-lefelé diszlokálja, ezért a betegnek többnyire mérsékelt fokú exophthalmusa és kifejezett bulbus diszlokációja van. A szemmozgások ennek megfelelően kifelé-felfelé tekintéskor korlátozottak, kettőslátás jelentkezhet.
IOI-ban az MR (és/vagy CT) vizsgálat a megnagyobbodott könnymirigyet ábrázolja, a kontrasztanyagot közepes intenzitással, egyenletesen halmozza, a kontúr egyenetlen, elmosódott határú lesz. A gyulladásos folyamat meghaladhatja a könnymirigy területét, felfelé mediálisan és hátrafelé, valamint a külső egyenes szemizom mentén a zsírszövetben terjed, a szemgolyót jellemzően körbevéve. Sajnálatos módon ez a megjelenési forma granulomás folyamatra és lymphomára egyaránt jellemző. A diffúzió súlyozta MR-képalkotással nagy biztonsággal elkülöníthető a lymphoma a gyulladásos folyamattól.
A pleomorf adenoma anamnézise hosszú, hónapok, évek is lehetnek. CT- és MR-vizsgálat éles határú, kerek vagy ovális, a kontrasztanyagot kifejezetten élénken, homogénen halmozó terimét igazol. A fossa lacrimalis lehet kimélyült, de nem destruált.
Adenoid cisztikus karcinóma (ACC) anamnézise rövid, hetek, 2-3 hónap alatt progrediál. Jellemző tünete a fájdalom, a neurogén terjedés miatt. Képalkotó vizsgálatokon a tumor nagyméretű, szabálytalan alakú, elmosódott határú, a kontrasztanyagot heterogén módon halmozza, a csontot destruálja.
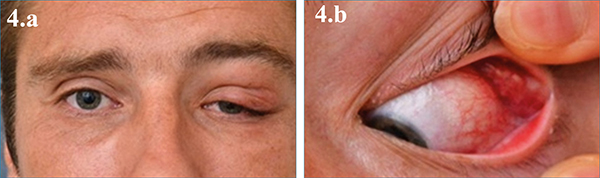
A felsorolt betegségek közül pleomorf adenoma gyanúja esetében későbbi recidívát okozó veszélye miatt tilos biopsziát végezni, a tumort tokosan kell eltávolítani. ACC gyanú esetében lehet, de többnyire nem szükséges, a preoperatív diagnózis nagy valószínűséggel a klinikai és radiológiai tünetek alapján megerősíthető, radikális műtétet kell végezni. IOI és lymphoma biztonsággal csak biopsziával különíthető el (4. a és b ábra).
Ha a betegnek szisztémás autoimmun betegségre utaló tünete nincs, és a tünetek nem infektív könnymirigygyulladásra utalnak, a szteroidkezelés elkezdhető. Immunszerológiai vizsgálatokat és/vagy biopsziát akkor is kell végezni, ha a folyamat szteroidkezelésre nem reagál kielégítően, vagy recidivál (10).
A könnymirigyben a következő autoimmun betegségek megjelenése jellemző: IgG4-RD, sarcoidosis (11), GPA, Sjögren-szindróma. Ennek megfelelően a szérum IgG4-szintet, ACE, ANCA, SS-A, SS-B szerológiai vizsgálatokat érdemes megnézni.
Myositis
Az IOI gyakoriságban másodiknak talált, de nagyságrendileg a dacrioadenitissel hasonló számú izolált formája: rövid anamnézis, fájdalom, chemosis, periorbitális és az érintett izom feletti conjunctiva hyperaemia, diplopia jellemzi. A fájdalom és a szemmozgás-korlátozottság fokozódik az érintett izom működési irányába tekintéskor. Érintett lehet egy- vagy több, esetleg valamennyi külső szemizom, lehet egy- vagy kétoldali. Az izomérintettség gyakorisági sorrendje: mediális, felső, külső, alsó egyenes szemizom.
Differenciáldiagnosztikai szempontból elsősorban az endokrin ophthalmopathia (EOP) jöhet szóba. Jellemző különbség klinikailag, hogy az EOP-ban szemmozgás-korlátozottság az érintett izom funkciójával ellentétes irányban marad el, leggyakrabban az alsó egyenes szemizom érintett, és típusos a Graefe-tünet (a felső szemhéji retrakció) jelenléte. A trakciós teszt mindkét betegségben pozitív lehet.
Képalkotó vizsgálatokkal igazolhatóan okuláris myositisben az izmok inas része is megvastagodik. Differenciáldiagnosztikai szempontból az EOP, a lymphoma és a szemizmokba adott metasztázisok jöhetnek szóba. EOP-ra jellemző a Graefe-tünet, képalkotó vizsgálatokkal az izom inas része megkímélt, az izom megvastagodása orsó alakú. A lymphoma a szemizmokat többnyire nem infiltrálja, inkább körülveszi. A mamma, a prosztatakarcinóma és a melanoma malignum adhat metasztázist a szemizmokba, klinikailag és morfológiailag általában megkülönböztethetők a myositistől.
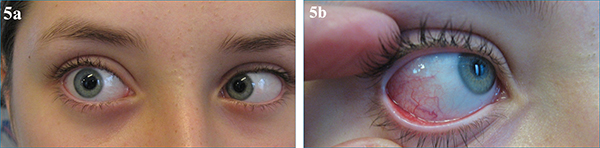
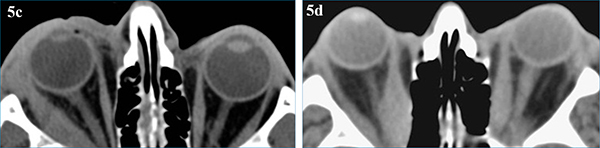
Az idiopátiás myositis is társulhat autoimmun betegségekkel, jellemzően Crohn-betegséggel (5. a, b, c, d ábra).
Ha a betegnek szisztémás autoimmun betegségre utaló tünete nincs, és a tünetek nem infektív könnymirigy-gyulladásra utalnak, a szteroidkezelés elkezdhető. Immunszerológiai vizsgálatokat és/vagy biopsziát akkor is kell végezni, ha a folyamat szteroidkezelésre nem reagál kielégítően, vagy recidivál (10).
A könnymirigyben a következő autoimmun betegségek megjelenése jellemző: IgG4-RD, sarcoidosis (11), GPA, Sjögren-szindróma. Ennek megfelelően a szérum IgG4-szintet, ACE, ANCA, SS-A, SS-B szerológiai vizsgálatokat érdemes megnézni.
Képalkotó vizsgálatokkal igazolhatóan okuláris myositisben az izmok inas része is megvastagodik. Differenciáldiagnosztikai szempontból az EOP, a lymphoma és a szemizmokba adott metasztázisok jöhetnek szóba. EOP-ra jellemző a Graefe-tünet, képalkotó vizsgálatokkal az izom inas része megkímélt, az izom megvastagodása orsó alakú. A lymphoma a szemizmokat többnyire nem infiltrálja, inkább körülveszi. A mamma, a prosztatakarcinóma és a melanoma malignum adhat metasztázist a szemizmokba, klinikailag és morfológiailag általában megkülönböztethetők a myositistől.
Az idiopátiás myositis is társulhat autoimmun betegségekkel, jellemzően Crohn-betegséggel (5. a és b ábra).
Szteroid adására gyorsan és látványosan javul. Azonban recidívára hajlamos, előfordulhatnak ismétlődő epizódok, hullámzó lefolyású javulásokkal és exacerbációkkal. Krónikus, heges állapotban a trakciós teszt pozitív lesz.
A gyógyulás, különösen akkor, ha több izmot érint a betegség, gyakran maradványtünetekkel történik. Ez azt jelenti, hogy a heges, megrövidült szemizmok miatt a szemmozgások nem válnak szabaddá, a betegnek tartós, zavaró kettőslátása marad vissza, amely akár műtéttel akár prizmás korrekcióval többnyire nem javítható kielégítően.
Scleritis posterior, perineuritis nervi opt ici
Ritka előfordulásúak. A diffúz típusú IOI terjedhet az orbitából bulbus hátsó pólusára és/vagy az optikus hüvelyre. Mindkettő fájdalommal és látásromlással jár.
A scleritis posteriorhoz myositis is társulhat. A diagnózis B-scan ultrahangvizsgálattal igazolható. A gyulladásos folyadék felszaporodik a sclera és a tenon tok között, illetve a nervus opticus kezdeti szakaszán, B-scannel vizsgálva az ún. T-sign képét rajzolva ki.
A perineuritis nervi optici az optikus hüvely gyulladásos folyamata. A gyulladás direkt módon az axonokat nem károsítja, de a megvastagodott opticushüvely kompressziója révén pangásos papillát és súlyos látásromlást okoz. Azonnali szteroid lökéskezelésre gyorsan reagál, teljes vízusjavulás érhető el.
Differenciáldiagnosztikai szempontból morfológiailag opticushüvely meningeomájára gondolhatunk. A klinikai lefolyás azonban különbözik, az exophthalmus és a látásromlás lassan, évek alatt alakul ki.
A Tolosa–Hunt-szindróma az IOI akut, lokalizált formájának tekinthető, amely a sinus cavernosus területén jelenik meg, és típusosan féloldali. Korábbi elnevezése: fájdalmas ophthalmoplegia externa, jól jellemzi a tünetegyüttest: az érintett oldal hirtelen kezdődő fájdalmával és a sinus cavernosusban futó valamennyi (III., IV., V., VI.) agyideg érintettségével jár, amelyhez exophthalmus és pangásos tünetek társulnak. Képalkotó vizsgálattal jól látható a sinus cavernosus kiszélesedettsége. Szteroidkezelésre jól gyógyul, kiújulásra kevéssé hajlamos.
Az orbita nem infekciózus gyulladásaihoz gyakran kapcsolódó autoimmun, szisztémás betegségek
Mint többször hangsúlyoztuk, az IOI kizárásos diagnózis, a következőkben felsoroljuk azokat a gyakrabban előforduló betegségeket, amelyeknek az IOI-ban szerepük van.
Limfoproliferatív betegségek és lymphoma
A lymphoma az orbita leggyakoribb daganata. Az összes szemkörnyéki lymphoma közel fele az orbitában, másik fele a conjunctivákban és a szemhéjakban lokalizálódik. Keletkezhet primeren az orbitában, a könnymirigyban és a szemhéjakban, vagy lehet szekunder módon a szisztémás lymphomabetegség lokális tünete. Előfordulhat egy- vagy mindkét oldalon, szemhéji lokalizáció esetén akár mind a négy szemhéjban megjelenhetnek. A szemhéjakban a granuloma tömöttebb, kemény tapintatú, a lymphoma rugalmas, mobilis, hurkaszerű. A könnymirigy IOI kapcsán már említettük, hogy morfológiájában a két folyamat nagy hasonlóságot mutat (23).
Bármely lokalizációban is van a lymphoma gyanús elváltozás, biztos diagnózis csak biopsziával nyerhető. A szövettani eredménynek ugyanis a terápia megtervezésében is döntő szerepe van. Biopszia végzésekor fontos szempont, hogy a szemhéjban lévő lymphoma subperiorbitális elhelyezkedésű.
Döntő többségük alacsony malignitású, B-sejtes non-Hodgkin-lymphoma. Az orbitában nyirokcsomók nincsenek, a szem és adnexumainak lymphomái extranodális marginális zóna lymphomák, amelyek a nyálkahártyához kapcsolódó limfoid szövetekből (mucosa-associated lymphoid tissue – MALT) keletkeznek. Kimutatták, hogy a könnymirigy acinusaiban, a conjunctivában és a kanalikuszokban is van MALT, amely főleg T-sejtekből épül fel (18). A diffúz nagy B-sejtes malignus lymphoma (DLBCL) ebben a régióban ritka megjelenésű (6. a, b és c ábra).


lymphoma
Granulomatosis polyangitissel (GPA)
Poliszisztémás granulomatózus betegség, nekrotizáló vasculitissel. Típusosan az orrban és az orrmelléküregekben, valamint a tüdőkben kezdődik. Az orbitára szekunder módon terjedhet a melléküregekből, vagy külön gócként, akár első tünetként is jelentkezhet. IOI differenciáldiagnosztikai szempontból ez utóbbi jelenthet kihívást. Korai stádiumban a szemüregi diagnózis konfúzus, részben a szövettani kép miatt, részben mert az egyébként diagnosztikai jelentőségű ANCA-teszt a korai fázisban nem mindig pozitív. Az orbitából nyert minta ugyanis, ha nem elég mély, nem mindig tartalmazza a típusos vasculitises képet, viszont lehetnek benne IgG4-pozitív plazmasejtek. Sokszervi érintettség mellett a betegség súlyos lefolyású, láz, fájdalom, általános gyengeség jellemzi. Immunszuppresszív kezelés tartós remissziókat eredményezhet, de a végső kimenetel fatális.
Immunglobulin-4-asszociált betegség, (IgG4 related disease, IgG4-RD)
Az utóbbi 2-3 évtizedben került az érdeklődés középpontjába. Japán szakemberek észlelték, hogy az autoimmun pancreatitisek (AIP) egy részében a szérum IgG4-szintje jelentősen megemelkedett, szteroidterápia hatására viszont normalizálódott. Így egy eddig ismeretlen és jól mérhető adattal lehetett jellemezni az AIP betegségcsoportot. Később kiderült, hogy az emelkedett IgG4-szinttel járó IgG4-RD nemcsak az AIP-hez kötődik, hanem multiszisztémás betegségként csaknem valamennyi szervben, elsősorban a külső elválasztású mirigyekben jellemző szövettani képpel rendelkező pseudotumor-szerű szövetszaporulatokat okoz. A leggyakrabban megtámadott szerv a hasnyálmirigy, ezt követi a könnymirigy, és a nyálmirigyek, az epevezeték (cholangitis), a vese, a retroperitoneum és az aorta. Infiltrálja a nyirokcsomókat, a menixeket, a prosztatát, a pajzsmirigyet (24), a pericardiumot és a bőrt. Poliszisztémás formája súlyos betegség, a korai diagnózis és a személyre szabott immunszuppresszív kezelés az életminőség szempontjából kiemelkedő jelentőségű.
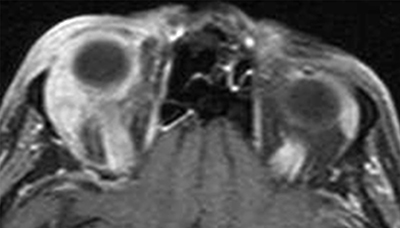
Szemészeti szempontból az IOI differenciáldiagnosztikájában játszik szerepet. Az IgG4-RD jelentkezhet az orbitában önállóan, vagy multiszisztémás betegség részeként. Az IgG4-hez társult orbitatünetek jellemzően akutan kezdődnek kifejezett gyulladásos tünetekkel. Elsősorban a könnymirigyet betegíti meg, lehet egy- vagy mindkét oldali. Kevésbé gyakran, de megnyilvánulhat a szemizmokban myositisként, vagy az orbita zsírszövetében keletkező diffúz formában. Bizarr megjelenési formája a nervus infraorbitalis megvastagodottsága, amely képalkotó vizsgálatok koronális metszetein jól megfigyelhető. Klinikai és radiológiai tünetek alapján – kivétel ez utóbbi tünet, amely igen ritka – nem differenciálható el az idiopátiás orbitagyulladástól. IgG4 szérumszintjének mérését érdemes elvégezni, azonban a normálszint nem zárja ki a betegség lehetőségét.
Andron és munkatársai 2017-ben 105 olyan beteg klinikai és hisztológiai adatait vizsgálták újra, akiket korábban pseudotumor orbitaeval, reaktív limfoid hiperpláziával és lymphomával diagnosztizáltak (28). 18 beteg diagnózisa bizonyult IgG4-nek (17,75%), akik közül 8 beteg korábbi diagnózisa volt IOI, 5 betegé limfoid hiperplázia, 2 betegé lymphoma. Ez utóbbi azért nem meglepő, mert ismert tény, hogy az IgG4-betegség talaján megjelenik a lymphoma. Ez a tanulmány is arra hívja fel a figyelmet, hogy ezen 3 betegség elkülönítése szövettanilag is nehézséget okozhat. A biopsziának és a szövettani leletnek terápiás konzekvenciája viszont csak akkor van, ha az eredmény lymphoma lesz, illetve ha az IgG4-RD multiszisztémás megjelenésű. Az egyéb szervekhez viszonyítottan könnyebb hozzáférhetőség miatt könnymirigy-biopsziára diagnosztikus céllal szükség lehet, ha az IgG4-RD szisztémás betegségként jelentkezik. Ilyen esetben az érintett szervre vonatkozó klinikai tünetek is megjelennek (7. a és b ábra).
Diagnózis csak biopsziával lehetséges
Bár szövettani képe jellemző és diagnosztikus értékű (masszív limfocitás, IgG4+ plazmasejtes beszűrődés és a kórképre típusos örvénylő [storiform] fibrózis), kiderült, hogy több autoimmun betegség esetében is a szövettani vizsgálat során nagyszámú IgG4-et tartalmazó plazmasejtet lehet találni. Ezek a GPL, a limfoid hiperplázia és az extranodális marginális zona lymphoma. A zavaró átfedések különösen felhívják a figyelmet arra, mennyire fontos a hisztológiai, immunhisztológiai képet, a klinikai tüneteket és a radiológiai vizsgálatok eredményeit együttesen mérlegelni.
Régóta ismert, hogy a lymphomák olykor korábbi gyulladásos környezetben alakulnak ki. Az IgG4-RD előtérbe kerülése óta kiderült, hogy a lympomák gyakran lépnek fel éppen zajló, vagy már lezajlott IgG4-RD talaján.
Itt érdemes megemlíteni, hogy a korábban Mikulicz-betegségként ismert, a könny- és nyálmirigyeket érintő, limfo-plazmocitás gyulladásos beszűrtséggel jellemzett betegségről kiderült, hogy az IgG4-RD-csoportba sorolható.
Terápiájában az első választás itt is a szteroid, kiderült azonban, hogy a Rituximabnak kiemelkedően jó terápiás effektusa van az IgG4-RD kezelésében (15, 16, 17, 23, 26, 28).
Sarcoidosis
Idiopátiás, gyulladásos eredetű multiszisztémás betegség, amely gyakran érinti a szemet és a szemüreget. A szemben leggyakrabban elülső és hátsó uveitis formájában jelentkezik, de apró granulomákat a conjunctiván és a corneán is okozhat.
Szemüregi manifesztációja leggyakoribb a könnymirigyben. Az orbitában a térszűkület klinikai tünetei korán észrevehetőek, az anamnézis aránylag rövid, sőt lehet rapid. Az orbitában a diffúz infiltráció inkább utal szisztémás érintettségre, a könnymirigyet beszűrő formához általában nem társul sokszervi érintettség. A képalkotó vizsgálat nem, csupán a szövettani kép diagnosztikai értékű, amely a sarcoidosisra jellemző sajátos konfluáló granulomás képet mutatja. A diagnózis tehát biopsziával igazolható.
A belszervi érintettség sokáig tünetmentes maradhat. Leggyakoribb manifesztációja a tüdő és a hiláris nyirokcsomók, de csaknem valamennyi szervet megtámadhatja.
Az orbitából diagnosztizált sarcoidosis esetén szerológiai (ACE) és szisztémás (mellkas CT) kivizsgálásra van szükség.
A sarcoidosis hajlamos spontán regresszióra, ellenkező esetben szteroid- és/vagy immunszuppresszív kezelésre van szükség.
Sjögren-szindróma
A Sjögren-szindróma vagy a Sjögren-kór az autoimmun epithelitis krónikus formája, amelyet a külső elválasztású mirigyek, különösen a nyál- és könnymirigyek lymphocytabeszűrődése jellemez, ami progresszív mirigyműködési zavarokhoz, majd xerostomiához és xerophthalmiához vezet. Egyéb gyakori tünetek közé tartozik a fájdalom, a fáradtság, és különféle szisztémás megnyilvánulások. A non-Hodgkin-lymphoma a Sjögren-szindrómás betegek között 5-ször gyakoribb, mint az átlag populációban.
A betegség lefolyása során kezdetben mindkét könnymirigy megnagyobbodhat, majd méretük fokozatosan csökken, végül a normálisnál kisebb méretű is lehet. A diagnózist a szövettani és immunszerológiai vizsgálatok (pozitív ANA, SS-A, SS-B ellenanyagok) mellett döntően segítik az ismert klinikai tünetek.
Szisztémás lupus erythematosus (SLE)
Szemészeti manifesztációja gyakori, 30-50% közötti. Legsúlyosabb a retinopathia és a szárazszem-szindróma. Ez utóbbiban Sjögren-szindrómának is része lehet, igazolva az autoimmun betegségek társulási hajlamát.
Az orbitában megjelenő formája a szemizmok gyulladásos folyamata (21, 22).
Histiocytosisok
Diffenciáldiagnosztikai szempontból a Langerhans-sejtes hisztiocyrosisok közül az eozinofil granulomának van jelentősége. Többnyire az orbita laterális felső részében okoz osteolytikus defektust, csekély fájdalommal és szemhéji hyperaemiával. Terápiája súlyosságtól függően obszerváció, szteroid vagy műtét.
A Rosai–Dorfman-betegség (RDD), más néven sinus histiocytosis masszív lymphadenopathiával a histiocytosis X-csoportba tartozó benignus, reaktív histiocytaproliferáció. A nyirokcsomók megnagyobbodnak, a szövettani vizsgálat a subcapsuláris sinusokban nagy, S-100 pozitív, histiocyter sejteket mutatnak, amelyek citoplazmájában limfociták invaginálódtak (emperipolesis). Különös módon ez a betegség is összefonódhat más hematológiai betegséggel, mint azt az IgG4-RD és a lymphomák kapcsolatában említettük. A RDD a krónikus limfoid leukémia talaján alakulhat ki. Az esetek nagyjából fele extranodális megjelenésű, amelyek között a bőrmanifesztáció a leggyakoribb. Munkacsoportunk egy fiatal leány szemizmaiban évek óta krónikusan zajló és kezelt, korábban kétoldali, klinikailag myositisnek megfelelő, extrém módon megvastagodott, hegesedett szemizmának műtéti korrekcióját végezte. A szövettani vizsgálat Rosai–Dorfman-betegséget diagnosztizált.
Az Erdheim–Chester-betegség (ECD) egy ritka szisztémás xantogranulomatosis, a nem-Langerhans-sejtes histiocytosisok közé tartozik. Súlyos, kétoldali intraorbitális, diffúz infiltrációt képes okozni, amelynek diagnózisa és differenciáldiagnózisa nehéz, terápiára nem reagál, vaksághoz vezet. A fatális kimenetelt az egyéb szervi megbetegedések okozzák. Szokatlan szemészeti tünetekkel megjelenő formáját magyar szerzők írták le (31).
Terápia
A pseudotumor orbitae (IOI) kezelése mind a mai napig a szteroidterápián alapszik. Mivel spontán javulás az esetek egy részében előfordul, enyhébb esetekben, ha jelentős fájdalom és funkciósérülés nincs, a kezelés megkezdésével lehet várakozni. Ugyancsak megkísérelhető szteroidkezelés helyett nem szteroid gyulladáscsökkentők adása.
Myositisek esetében nem szoktunk a szteroidkezeléssel várakozni. Az okuláris myositis erős fájdalommal és igen kellemetlen kettőslátással jár. Myositisben, dacrioadenitisben és diffúz intraorbitális folyamatban is a megfelelő kivizsgálást követően, amennyiben azok az IOI gyanúját megerősítik, elkezdjük a szteroidkezelést. Az irodalmi adatokban az ajánlás általában 1,0-1,5 mg/kg/nap vagy 50-100 mg/nap kortikoszteroid 1-2 hétig, majd fokozatosan csökkentve 5-8 hét alatt. Gyakorlatunkban a folyamat súlyosságától függően 125-250 mg metilprednizolon is lehet a kezdőadag, amelyet intravénásan adunk 5-6 napig, majd további 1-2 hét alatt csökkentünk 32-64 mg per os dózisra. A recidíva elkerülése és a tartós remisszió elérése érdekében a tünetmentességet biztosító 12-8 mg fenntartó dózist 2 hónapon át javasolt adni. Amennyiben relapszus következik be, a dózist visszaemeljük 32-64 mg-ra néhány napra, majd ismét csökkentjük. A szteroidkezelés irányítása az orvos tapasztalatán és a betegség viselkedésén alapul (8. a és b ábra).


Radioterápiás kezelés akkor jön szóba, ha a betegség a szteroidterápiára rezisztens vagy intoleráns, illetve, ha a betegség recidivál. Az ödémát és a gyulladásos tüneteket lassabban, de tartósabban csökkentheti, mit a szteroid, azonban az irradiáció sem eredményes minden esetben. A használatos dózis 20-30 Gy, 2 Gy/nap frakciókban.
A szteroidkezelés az IOI-esetek kb. felében eredményes és tartós. Ha biopszia nélkül kezdtünk szteroidterápiát adni, rezisztencia vagy recidíva esetén biopsziát kell végezni. A további kezelés immunológus szakorvos bevonásával, és a szteroid mellett más immunszuppresszív és citosztatikus szerek adásával történik. Gyakorlatunkban azathioprint (Imurán) kapnak a betegek, kis dózisú Medrollal együtt. A Rituximab, mint monoklonális antitest, B-sejt-depléciót okoz, adása egyéni elbírálást igényel, amelynek kivitelezése hosszadalmas (26, 29).
A célzott biológiai terápiás szerek alkalmazása akkor igazán eredményes, ha ismerjük a betegség exakt patofiziológiáját. Ebben a tekintetben állandó kutatások folynak, és néhány szer alkalmazásával jó eredményeket lehetett elérni. Ilyen az infliximab, amely monoklonális antitest és TNS-alfa-gátló. Kedvező eredményeket lehetett elérni a tocilizumabbal is. A kezelt betegek száma azonban igen csekély, amelynek oka az is, hogy a költség igen magas, a mellékhatások sem hagyhatók figyelmen kívül, ezért messzemenő következtetéseket nem lehet még levonni (9, 29, 30).
Külön érdemes megemlíteni azt a ritkaság számba menő, de gyakorlatunkban előforduló néhány esetet, amikor a beteg gyorsan progrediáló látásromlással jelentkezik. Amennyiben a képalkotó vizsgálatok a látásromlás okaként a nervus opticus kompresszióját igazolják, amelyet non-specifikus gyulladás vagy lymphoma okozott, azonnal mega dózisú, 1 g Solu-Medrolt kell adni, majd akut műtétként biopsziát végezni. A kimenetel kedvezőbb, ha a betegnek lymphomája van, amely a szteroidra jól és gyorsan reagál, ellentétben a fibrotikus granulomával, amely nem zsugorodik olyan gyorsan, hogy a nervus opticus funkciója megőrizhető legyen.
Következtetések
A pseudotumor orbitae a szemüregi gyulladások nem infekciózus, nem specifikus csoportjába tartozik. Oka ismeretlen, de jól azonosíthatók azok a kórképek, amelyektől el kell határolódni, hogy az IOI diagnózisa kimondható legyen. Az IOI kizárásos diagnózis. Több tényező is utal autoimmun természetére. Az IOI tehát a számos ismert autoimmun betegségek sorában azt a helyet foglalja el, amely csak a szemüregi képleteket betegíti meg. Ily módon rokonságba hozható az EOP-pal, annak ellenére, hogy mind a társbetegség, mind az EOP-tünetek különbözőek és jól elkülöníthetőek. Az IOI elsősorban szteroiddal és más immunszuppresszív szerekkel változó eredményességgel kezelhető. Egyre inkább előtérbe kerülnek a célzott, biológiai terápiák is.
Nyilatkozat
A szerzők kijelentik, hogy az eredeti, összefoglaló, továbbképző közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Birch-Hirschfeld A. Zur Diagnostik und Pathologie der Orbitaltumoren. Ber 32 ersamm Ophthal Ges Heidelberg (1905). 1906; 32: 127–35.
2. Grove A, Weber A. Orbital Pseudotumor–Historical Origin and Modern Relevance. Ophthalmic Plastic and Reconstructive Surgery 2013; 29(5): 341–346.
3. Fang Y, Shen B, Dai Q, et al. Orbital inflammatory pseudotumor: new advances in diagnosis, pathogenesis, and treatment. Eur J Med Res 2023; 28: 395.
https: //doi.org/10.1186/s40001-023-01330-0
4. Mombaerts I, Koornneef L. Current status in the treatment of orbital myositis. Ophthalmology 1997; 104(3): 402–408.
https: //doi.org/10.1016/s0161-6420(97)30301-7
5. Sobrin L, Kim E, Christen W et al. Infliximab therapy for the treatment of refractory ocular inflammatory disease. Arch Ophthalmol 2007; 125: 895–900.
https://doi.org/10.1001/archopht.125.7.895
6. Stagner AM. Histopathologic clues to the etiopathogenesis of orbital inflammatory disease: Idiopathic, IgG4-related, neoplastic, autoimmune and beyond. Seminars in Diagnostic Pathology 2024 March; 41(2): 66–71.
https://doi.org/10.1053/j.semdp.2024.01.011
7. Atabay C, Tyutyunikov A, Scalise D, et al. Serum antibodies reactive with eye muscle membrane antigens are detected in patients with nonspecific orbital inflammation. Ophthalmology 1995; 102: 145–153.
https: //doi.org/10.1016/s0161-6420(95)31066-4
8. Wladis EJ, Iglesias BV, Adam AP, Nazeer T, Gosselin EJ. Toll-like receptors in idiopathic orbital inflammation. Ophthalmic Plast Reconstr Surg 2012 Jul–Aug; 28(4): 273–6. https://doi.org/10.1097/IOP.0b013e3182565c59
9. Ronquillo Y, Zeppieri M, Patel BC. Nonspecific Orbital Inflammation. [Updated 2024 May 6]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from:
https: //www.ncbi.nlm.nih.gov/books/NBK551576/
10. Mombaerts I, Bilyk JR, Rose GE, McNab AA, Fay A, Dolman PJ, Allen RC, Devoto MH, Harris GJ; Expert Panel of the Orbital Society. Consensus on Diagnostic Criteria of Idiopathic Orbital Inflammation Using a Modified Delphi Approach. JAMA Ophthalmol 2017 Jul 1; 135(7): 769–776. PMID: 28570731; PMCID: PMC5710199. https://doi.org/10.1001/jamaophthalmol.2017.1581
11. Rabinowitz MP, Halfpenny CP, Bedrossian EH Jr. The frequency of granulomatous lacrimal gland inflammation as a cause of lacrimal gland enlargement in patients without a diagnosis of systemic sarcoidosis. Orbit 2013 Jun; 32(3): 151–5. Epub 2013 Mar 12. PMID: 23480843
https://doi.org/10.3109/01676830.2013.771676
12. Foti R, Foti R, Zeppieri M, Gagliano C. Analyzing histopathological aspects and cell populations in orbital inflammatory involvement in systemic diseases: A case series from the Rheumatologist's perspective. Cytojournal 2024 Jul 12; 21: 23. PMID: 39108466; PMCID: PMC11302219.
https://doi.org/10.25259/Cytojournal_21_2024
13. Pakdaman MN, Sepahdari AR, Elkhamary SM. Orbital inflammatory disease: Pictorial review and differential diagnosis. World J Radiol 2014 Apr 28; 6(4): 106–15. PMID: 24778772; PMCID: PMC4000606.
https://doi.org/10.4329/wjr.v6.i4.106
14. Swamy BN, McCluskey P, Nemet A, Crouch R, Martin P, Benger R, Ghabriel R, Wakefield D. Idiopathic orbital inflammatory syndrome: clinical features and treatment outcomes. Br J Ophthalmol 2007 Dec; 91(12): 1667–70. Epub 2007 Jul 9. PMID: 17620331; PMCID: PMC2095535.
https://doi.org/10.1136/bjo.2007.124156
15. Berry-Brincat A, Rose GE. Idiopathic orbital inflammation: a new dimension with the discovery of immunoglobulin G4-related disease. Curr Opin Ophthalmol 2012 Sep; 23(5): 415–9. PMID: 22729180.
https://doi.org/10.1097/ICU.0b013e32835563ec
16. Takahira M, Goto H, Azumi A. The 2023 revised diagnostic criteria for IgG4-related ophthalmic disease. Jpn J Ophthalmol 2024; 68: 293–301.
https://doi.org/10.1007/s10384-024-01072-4
17. Patel U, Saxena A, Patel D, Ayesha IE, Monson NR, Klair N, Yu AK. Therapeutic Uses of Rituximab and Clinical Features in Immunoglobulin G4-Related Disease: A Systematic Review. Cureus 2023 Sep 11; 15(9): e45044. PMID: 37701160; PMCID: PMC10494991.
https://doi.org/10.7759/cureus.45044
18. Knop E, Knop N. Lacrimal drainage-associated lymphoid tissue (LDALT): a part of the human mucosal immune system. Invest Ophthalmol Vis Sci 2001 Mar; 42(3): 566–74. PMID: 11222512.
19. Yuen SJ, Rubin PA. Idiopathic orbital inflammation: distribution, clinical features, and treatment outcome. Arch Ophthalmol 2003 Apr; 121(4): 491–9. PMID: 12695246.
20. Jenkins PO, Soper C, MacKinnon AD, O'Sullivan E, Nitkunan A. Systemic Lupus Erythematosus Presenting as Orbital Myositis. Neuroophthalmology 2014 Aug 8; 38(5): 264–267. PMID: 27928311; PMCID: PMC5123171.
https://doi.org/10.3109/01658107.2014.923915
21. Serop S, Vianna RN, Claeys M, De Laey JJ. Orbital myositis secondary to systemic lupus erythematosus. Acta Ophthalmol (Copenh) 1994 Aug; 72(4): 520–3. PMID: 7825423.
https://doi.org/10.1111/j.1755-3768.1994.tb02807.x
22. Puskás T, Henits I. Az onkológiai megbetegedések diffúzió-súlyozott MR képalkotása. Kezdeti tapasztalatok, eredmények I. IME 2012; 11(2): 42–47.
23. Aryasit O, Tiraset N, Preechawai P, Kayasut K, Sanghan N, Sittivarakul W. IgG4-related disease in patients with idiopathic orbital inflammation. BMC Ophthalmol 2021 Oct 8; 21(1): 356. PMID: 34625052; PMCID: PMC8499436.
https://doi.org/10.1186/s12886-021-02115-x
24. Erdei A. G4-immunglobulinnal társult endokrin betegségek [Immunoglobulin G4-related endocrine diseases]. Orvosi Hetilap 2022; 163(30): 1175–1180.
https://doi.org/10.1556/650.2022.32527
25. Rose GE, Wright JE. Exenteration for benign orbital disease. Br J Ophthalmol 1994 Jan; 78(1): 14–8.
https://doi.org/10.1136/bjo.78.1.14
26. Altman A, Liss JA. Idiopathic Orbital Inflammation: Diagnosis and Management Neuro-Ophthalmology/Orbit: FEB 01, 2022
27. Hedgire SS, McDermott S, Borczuk D, Elmi A, Saini S, Harisinghani MG. The spectrum of IgG4-related disease in the abdomen and pelvis. AJR Am J Roentgenol 2013 Jul; 201(1): 14–22. PMID: 23789654.
https://doi.org/10.2214/AJR.12.9995
28. Andron A, Hostovsky A, Nair AG, Sagiv O, Schiby G, Simon GB. The impact of IgG-4-ROD on the diagnosis of orbital tumors: A retrospective analysis. Orbit 2017 Dec; 36(6): 359–364.
https://doi.org/10.1080/01676830.2017.1337192. Epub 2017 Aug 22. Erratum in: Orbit. 2018 Feb; 37(1): x. PMID: 28829660.
https://doi.org/10.1080/01676830.2017.1371930
29. Grant H. Moore & Daniel B. Rootman Orbital inflammatory disease management. Expert Review of Ophthalmology 2016; 11(6): 415–428.
https://doi.org/10.1080/17469899.2016.1233399
30. Al-Ghazzawi K, Neumann I, Knetsch M, Chen Y, Wilde B, Bechrakis NE, Eckstein A, Oeverhaus M. Treatment Outcomes of Patients with Orbital inflammatory Diseases: Should Steroids Still Be the First Choice? J Clin Med 2024; 13: 3998.
https://doi.org/10.3390/ jcm13143998
31. Kósa É, et al. Szokatlan szemészeti tünetek ritka manifesztációjú malignus histiocytosisban – Erdheim–Chester-betegségben. Szemészet 2014; 151(2): 83–87.
