Ophthalmological aspects of pseudotumor cerebri
doi: 10.55342/szemhungarica.2024.161.3.107
Ophthalmological aspects of pseudotumor cerebri
Summary
Pseudotumor cerebri (PC), also known as idiopathic intracranial hypertension (IIH), is an intracranial hypertension of unknown etiology, typically affecting young, overweight women. The leading ophthalmoscopic finding is papilledema, which without treatment leads to progressive atrophy of the optic nerve, resulting in blindness. The incidence of the disease varies among countries, but it follows the incidence of obesity in a given country. Although pseudotumor cerebri mostly affects young females, males and children can also develop the disease. PC is a diagnosis of exclusion, necessitating the systematic exclusion of other causes of intracranial hypertension. Diuretics are the first-line treatment. In cases of progressive optic nerve axon loss, surgical intervention should be considered. in order to treat PC, neurointerventional procedures are being performed in an increasing number in Hungary as well.
Összefoglaló
A pseudotumor cerebri (PC), más néven idiopátiás intracranialis hipertenzió (IIH) ismeretlen etiológiájú koponyaűri nyomásfokozódás, amely jellemzően fiatal, túlsúlyos nőket érint. Vezető szemészeti tünete a papillaödéma, ami kezelés nélkül hosszú távon a látóideg progresszív atrófiájához, ezáltal vaksághoz vezet. A betegség incidenciája országonként eltérő, de adott országban az elhízás incidenciájával párhuzamot mutat. Bár a pseudotumor cerebri legtöbbször fiatal nőket érint, férfiaknál és gyermekeknél is kialakulhat a betegség. A PC kizárásos diagnózis, azaz az intracranialis nyomásfokozódás egyéb okainak szisztematikus kizárása szükséges. A kezelés elsővonalbeli terápiáját a diuretikumok jelentik. Amennyiben a látóideg axonvesztése progrediál, sebészi beavatkozás mérlegelendő. Ma már hazánkban is egyre több centrumban végeznek neurointervenciós beavatkozásokat a pseudotumor cerebri gyógyítása céljából.Keywords
pseudotumor cerebri, idiopathic intracranial hypertension, papilledema
Kulcsszavak
pseudotumor cerebri, idiopátiás intracranialis hipertenzió, papillaödéma
Bevezető
A pseudotumor cerebri (PC), más néven idiopátiás intracranialis hipertenzió (IIH), egy ismeretlen okból kialakuló, emelkedett koponyaűri nyomással járó kórkép (1, 2). Leggyakrabban fiatal, fogamzóképes korú nők betegsége, akik jelentősen túlsúlyosak (3). Korábban a betegséget – nyilvánvaló intracranialis patológia hiányában – benignus intracranialis hipertenziónak is nevezték, habár a betegség korántsem jóindulatú (4). A nyomásfokozódás következtében fellépő fejfájás lényegesen ronthatja az életminőséget (5). A korábban jellegzetesnek gondolt fejfájási „mintázat” (ébredéskor, fekvő helyzetben fokozódó fájdalom) helyett manapság egyre inkább az epizodikus, illetve krónikus migrénre hasonlító fejfájást tartják jellemzőnek. Ennek kezelése önmagában is nehéz lehet, amit sokszor tovább ront a túlzott gyógyszerhasználat miatti fejfájás (6).
Az emelkedett koponyaűri nyomás jellegzetes szemtükri lelete a kétoldali papillaödéma (1, 7). Az elhúzódó papillaödéma – hasonlóan a glaukómához – kezdetben a perifériás látótér szűkületét okozza, ami a betegben nem feltétlenül tudatosul (1. ábra).
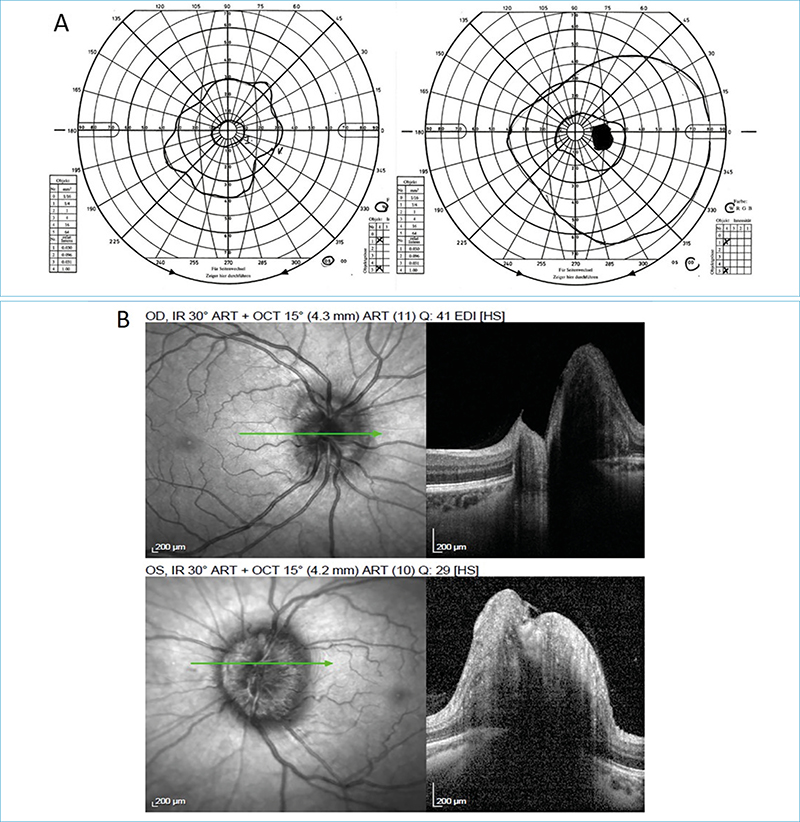
A: Goldmann perimetria során kétoldali, előrehaladott, koncentrikus látótér szűkületet rögzítettünk. Jobb oldalon a vakfolt megnagyobbodott, bal oldalon a súlyos fokú látótér-szűkület miatt nem is volt regisztrálható.
B: A kétoldali papillaödéma infravörös és keresztmetszeti OCT-képe
Amennyiben nem társul fejfájás a betegséghez, még nehezebben épül fel a betegségtudat. Ezért van kiemelt jelentősége, hogy a szemorvos a betegnél és a társszakmák képviselőinél is tudatosítsa a papillaödéma jelentőségét, mielőtt a perifériás látás irreverzibilisen károsodik. Amikor már a centrális látás is érintetté válik, a teljes kétoldali vakság elkerülése komoly kihívás (1, 7, 8).
A kóros elhízás előfordulási gyakoriságának növekedésével számolnunk kell a betegek számának emelkedésével (9). A betegség kezelése jelentős terhet jelent a betegnek és az ellátórendszernek egyaránt (10).
A pseudotumor cerebri kizárásos diagnózis. A jellemző betegcsoporton túl egyéb életkorban, férfiak és gyermekek esetében is találkozhatunk pseudotumor cerebrivel (11, 12). Ezekben az esetekben még körültekintőbben kell a kivizsgálás során eljárnunk, hogy a koponyaűri nyomásfokozódás hátterében megbúvó esetleges egyéb okokat tisztázhassuk. Ugyanígy a fenti állítás megfordítva is igaz: ha egy fiatal, túlsúlyos nőbeteg szemfenéki vizsgálata során papillaödémát látunk, az intracranialis nyomásfokozódás egyéb okainak kizárása elengedhetetlen, mielőtt a pseudotumor cerebri diagnózisát kimondjuk (1, 7).
Közleményünkben bemutatjuk a pseudotumor cerebri kórélettani hátterét, kialakulásának igazolt és feltételezett mechanizmusait, jellemző tüneteit. Részletezzük a diagnózis lépéseit és áttekintjük a terápiás lehetőségeket.
Kórélettan
Az agy artériás és vénás keringése, liquor cerebrospinalis
Az agy vérellátását a két arteria carotis interna és a két arteria vertebralis biztosítja, amelyek az agyalapon a circulus arteriosus Willisiit képezik. A két arteria carotis interna a féltekék elülső kétharmadát, a vertebro-basilaris rendszer a hátsó agyterületeket látja el vérrel (13).
A vénás vér a dura mater által határolt, endothellel bélelt öblökbe, a durális sinusokba ömlik. A sinus sagittalis superior a nagyagysarló (falx cerebri) felső szélében halad hátrafelé, majd – miután a sinus sagittalis inferior is csatlakozott hozzá – a jobb és bal oldali sinus transversusban, majd a sinus sigmoideusban folytatódik. Az agyalapi vénák vérét a vena cerebri magna gyűjti össze. A vénás vér nagy része a vena jugularis internán keresztül hagyja el a koponyát (13).
A liquor cerebrospinalis az agykamrák üregeit, valamint az agyat és a gerincvelőt körülvevő subarachnoidealis teret kitöltő világos, színtelen folyadék. Normál körülmények között a liquor nyomása reprezentálja az intracranialis nyomást a központi idegrendszerben. Az agykamrákat bélelő érfonat, a plexus chorioideus termeli. Ionösszetétele a vérplazmáéhoz hasonló, glükóz koncentrációja a vérplazmáénak fele, fehérjét pedig csak nyomokban tartalmaz. A koponyaűri nyomás szabályozásán kívül fontos szerepe van az agy mechanikai védelmében és az agyszövet táplálásában, illetve toxikus anyagcsere-végtermékek eltávolításában is (14).
A koponya belső térfogata összesen ~1700 ml, az agy (~80%), vér (~10%) és liquor (~10%) tölti ki. A Monro–Kellie-elv szerint a koponya egy merev falú tartály, nincs lehetősége térfogati növekedésre. Ha valamelyik intracranialis komponens térfogata növekszik, valamelyik másik összetevő(k) térfogatának csökkennie kell az egyensúly érdekében. Ha ez a kompenzatorikus mechanizmus kimerül, a koponyaűri nyomás szükségszerűen nő. Így okozhatnak intracranialis nyomásemelkedést a koponyán belüli térfoglaló folyamatok, különböző etiológiájú agyödémák (vazogén, citotoxikus, interszticiális), a vénás elfolyás akadályozottsága, illetve a különböző okokból megnövekedett liquortér. Ez utóbbi hátterében az agy-gerincvelői folyadék termelődésének és felszívódásának/elvezetésének egyensúlyzavarai állhatnak (15, 16, 17).
A pseudotumor cerebri kialakulásában szerepet játszó feltételezett mechanizmusok
Egy feltételezett mechanizmus a sinus transversus disztális szakaszának vagy a sinus sigmoideusnak a szűkülete (2. ábra) (18). Ez cerebrális vénás nyomásfokozódást és csökkent liquor felszívódást okozhat. Farb és munkatársai a vizsgált PC-betegek 93%-ában találtak kétoldali vénás sinus szűkületet, szemben a kontrollcsoportban leírt 7%-kal. Hasonló eredményre jutottak más szerzők is (19).
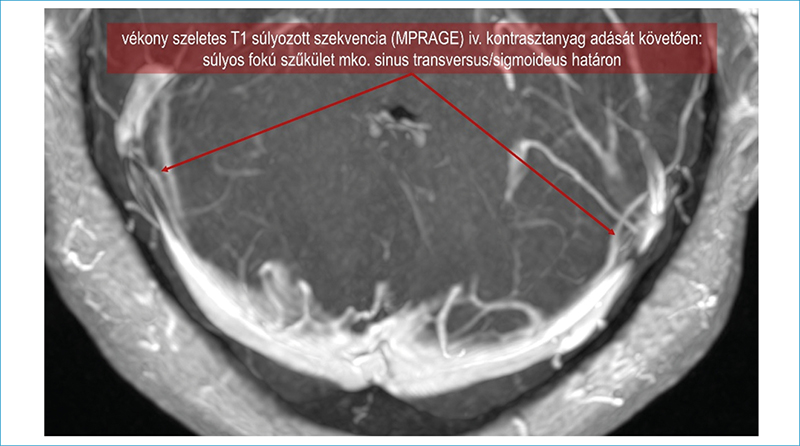
Vékony szeletes T1 súlyozott szekvencia (MPRAGE) iv. kontrasztanyag adását követően: súlyos fokú szűkület mindkét oldalon a sinus transversus/sigmoideus határon (nyilak)
Jelenleg még nem tisztázott, hogy a sinusszűkület elsődleges oka lenne az intracranialis nyomásfokozódásnak, vagy inkább annak következményének tartható. Egyre több publikáció jelenik meg azonban olyan eredményekkel (és saját betegeinkkel szerzett tapasztalatok is megerősítik azokat), hogy a vénás sinusok szűkületének sebészi megoldása az intracranialis nyomás normalizálódásához vezetett PC-betegekben (lásd bővebben a Terápia részben).
Egy másik elmélet szerint a betegség kialakulásában az obesitas következtében megnövekedett abdominális nyomás játszhat szerepet (20). Az ennek következtében megemelkedő centrális vénás nyomás gátolhatja az agy felől a vénás vér visszaáramlását, ennélfogva okozhat intracranialis vénás nyomásemelkedést. Ezt az elméletet támasztja alá az a tény is, hogy a leghatékonyabb terápia napjainkban is a testsúlycsökkentés (21, 22). A két teória össze is kapcsolódhat oly módon, hogy az elhízás kapcsán emelkedett vénás nyomás bizonyos predilekciós helyeken a sinusok összenyomódását okozza, és az így kialakult szűkület aztán tovább súlyosbítja a vénás elfolyás akadályozottságát. Ezt támasztják alá azok az adatok is, amelyek szerint az elhízás mértéke egyenes arányban áll a sinusszűkületek mentén mérhető nyomásgrádienssel (23).
Oki szerepet tulajdonítanak továbbá az A-vitaminnak és származékainak (pl. retinol), miután PC-betegek liquormintáiban jellemzően magasabb A-vitamin, retinol, illetve retinolkötő fehérje (RBP) szintet találtak. Feltételezések szerint ezek az anyagok a liquor felszívódását gátolhatják (24).
A pseudotumor cerebri tünetei, diagnózisa
Klinikai tünetek
A betegek leggyakoribb panaszai a következők: fejfájás, hányinger/hányás, pulzusszinkron fülzúgás, kettőslátás, tranziens vizuális obskuráció (3, 7). Ez utóbbi – főleg helyzetváltoztatást követően észlelt – pár másodpercig tartó látáskiesést jelent, amelyet a látóidegfő átmeneti iszkémiája okoz. A fejfájás és a hányinger a dura mater feszülésének következménye. A fejfájás jellege a krónikus migrénnel mutathat hasonlóságot, ezért elhúzódó fejfájás kivizsgálása során az idiopátiás intracranialis nyomásfokozódásra is érdemes gondolni (25).
A kettőslátás hátterében a nervus abducens parézise állhat (27). A VI. agyideg érintettsége úgynevezett „nem lokalizáló” neurológiai jel, nem fokális gócjel. Az agyideg a híd és a nyúltvelő határán elhagyva az agytörzset szabadon halad a subarachnoidealis térben. A clivus tetején, a Dorello-csatornán áthaladva az ideg kötőszöveti szalagokkal rögzített, ezért intracranialis nyomásemelkedés során, amikor az egész agytörzs lefelé (kaudális irányban) tolódik, a vékony ideg vongálódhat. A nervus abducens a laterális egyenes szemizom beidegzéséért felelős. Csökkent működésének következtében az érintett oldalon a bulbus befelé fordul, horizontális mozgások során abdukcióban elmarad. Ez okozza a kettőslátást.
Szemészeti vizsgálat során kétoldali papillaödémát látunk a szemfenéken (1, 7). Az emelkedett intracranialis nyomás ún. passzív ödémát okoz, vagyis nem az érfal károsodása a folyadékfelhalmozódás elsődleges oka. Mivel a koponyán belül és a nervus opticus körül a subarachnoidealis tér folytonos, az intracranialisan megemelkedett nyomás áttevődik erre a folyadéktérre és gátolja a nervus opticus rostjaiban az axoplazma áramlását, ami így megrekedve okozza a papillaödéma jellegzetes képét. A következő jellemzőket érdemes figyelni: elmosódott papillaszél, kitöltött értölcsér mellett a papilláris idegrostréteg ödémája, vérbősége; a vénák kanyargóssá válnak, vérzések, gyapottépés gócok jelenhetnek meg; peripapilláris cirkumferenciális retinaredők jelezhetik az ödéma lap szerinti terjedését, illetve choroidea-redők láthatóak, ha a hátsó bulbusfal kifejezetten deformálódik. Amennyiben a papillaödéma krónikusan fennáll, az axonvesztés és a látóidegfő kötőszövetes átépülése következtében a papilla ödémája csökken, ezzel együtt dekolorálttá válik. Ebben a stádiumban a koponya képalkotó vizsgálata is a látóideg atrófiáját mutatja (27).
A funduskép alapján a papillaödéma aktuális mértéke a Frisén-skála szerint rögzíthető a leletben. A skála 0-tól 5-ig terjed, az egészséges papillaképtől a súlyos fokú papillaödémáig (3. ábra) (28).
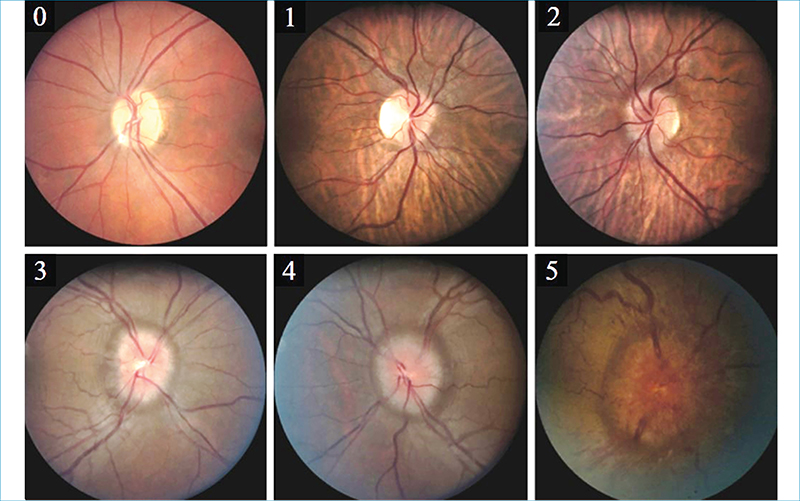
Számszerűsítve a papilla prominenciájának mértékét megadhatjuk dioptriában (direkt szemtükör Rekoss-korongjával mérve), vagy a manapság már széles körben elterjedt OCT-készülék ad lehetőséget az idegrostréteg-vastagság, a teljes prominencia, illetve a következményes ganglionsejt-veszteség még pontosabb mérésére és követésre (29).
Az ödéma mértékének számszerűsítése mellett a látótérvizsgálat a leglényegesebb vizsgálati módszer a betegség követésére és a progresszió megítélésére (1, 7). Kezdetben a kétoldali megnagyobbodott vakfolton kívül látótérkiesés nem tapasztalható. A krónikusan fennálló emelkedett intracranialis nyomás azonban a perifériás látótér fokozatos beszűkülését okozza, míg végül a centrális látótér elvesztésével a teljes vakság fenyeget (1. A ábra). A preferált vizsgálati módszer a kinetikus (Goldmann) perimetria, amivel pontosan kirajzolhatók a látótérhatárok és scotomák.
Diagnosztikus kritériumok
A pseudotumor cerebri kizárásos diagnózis. A diagnosztikai kritériumokat Dandy állította fel 1937-ben (30), amelyet többször átdolgoztak, és jelenlegi formájában, mint módosított Dandy-kritériumok ismertek (1). Ezek a következők:
- Intracranialis nyomásfokozódás jelei és tünetei észlelhetők a betegnél.
- Nincs neurológiai eltérés (kivéve a n. abducens parézisét és a papillaödémát).
- A koponya képalkotón nem látható eltérés kivéve, ami megfelel az emelkedett intracranialis nyomás következményének („empty sella”, kiszélesedett opticus hüvely, a hátsó bulbusfal ellapulása).
- Emelkedett lumbális liquor nyitónyomás (>25 vízcm) mérhető.
- Normál liquor laboratóriumi lelet (sem sejtszámbeli, sem kémiai eltérés nem igazolható).
- Az emelkedett intracranialis nyomás semmilyen egyéb okkal nem magyarázható.
Differenciáldiagnosztika
A pseudotumor cerebri vezető szemészeti tünete a kétoldali pangásos papilla. Egyoldali papilladuzzanat, ödéma hátterében számos eltérés állhat: hipertenzív retinopátia, a látóideg(fő) gyulladása (fertőzéses vagy immun eredettel), iszkémia (elülső iszkémiás opticus neuropátia), vénás törzselzáródás, tumoros vagy nem-tumoros infiltratív folyamatok (glioma, leukémia, limphoma, szarkoidózis), a látóideg kompressziója, metabolikus eltérések (pl. diabéteszes papillopathia), toxikus ágensek, genetikai rendellenességek (pl. Leber-féle örökletes látóidegbántalom – LHON), bulbus hipotónia. Promineáló papilla képét utánozhatja a papilladrusen is.
A koponya képalkotó vizsgálatnak egyértelműen ki kell zárnia a hydrocephaliát, térfoglaló folyamatot, meningeális érintettséget, a vénás sinusok trombózisát vagy bármilyen strukturális és vaszkuláris eltérést, ami emelkedett koponyaűri nyomást okozhat (1). Ezek alapján a legmegbízhatóbb képalkotó a kontrasztanyag adásával kiegészített koponya MRI-vizsgálat, MR-venográfiával (MRV) (18).
A tipikus PC-beteg fiatal, túlsúlyos nő. Amennyiben a beteg ebbe a kategóriába nem illik (férfi, gyermek, vékony alkatú vagy menopauza utáni életkorban lévő nő), ki kell zárni azokat az intracranialis nyomásfokozódást kiváltó tényezőket is, amelyek ún. szekunder pseudotumor cerebri szindrómát okozhatnak: A-vitamin-túladagolás, bizonyos gyógyszerek (pl. tetraciklin típusú antibiotikumok, szteroidok vagy szteroid hirtelen, nem megfelelő ütemű leépítése), nagyfokú vérszegénység, veseelégtelenség (hemodialízis szövődményeként kialakuló centrális vénás nyomásemelkedés), alvási apnoe, endokrin betegségek (Addison-kór, mellékpajzsmirigy-alulműködés), lupus (SLE) (7, 12, 31).
Terápia
Testsúlycsökkentés
Elhízás mellett jelentkező pseudotumor cerebri esetén a leghatékonyabb terápia a fogyás (32, 33). Különösen a centrális elhízás csökkentése jár határozott előnyökkel (34). Nagyon fontos ezért, hogy a betegünk megértse betegségének lényegét és tudatosítsuk benne, hogy kizárólag a fogyás jelenti az állapot egyetlen „oki” terápiáját. A testsúlycsökkenés mértéke egyenes arányban áll az intracranialis nyomás csökkenésével (35). Ezzel párhuzamosan csökken a papillaödéma mértéke, javulnak a vizuális funkciók, csökken a fejfájás gyakorisága és mértéke, összességében javul az életminőség (21, 35). Sajnos a kilók leadásánál talán csak megtartani nehezebb az elért testsúlyt, és a legtöbb beteg 2-5 év alatt visszahízza a korábbi feleslegét (36, 37). Természetesen a súlycsökkenéstől csak elhízott betegek esetében várhatjuk a tünetek javulását. A fogyás sikerességéig rendszerint más kezelés is szükséges.
Gyógyszeres kezelés
A Pseudotumor cerebri elsővonalbeli gyógyszeres terápiáját a szájon át szedett acetazolamid jelenti (38). A gyógyszer a plexus choroideusban akár 50%-kal csökkentheti a liquor termelődését a karboanhidráz-enzim gátlásán keresztül (39). Igaz, e hatás eléréséhez a hagyományos diuretikumként való alkalmazás során megszokott dózis többszöröse szükséges (40). Az acetazolamid hatásosságát pseudotumor cerebriben multicentrikus, randomizált, placebokontrollált vizsgálattal igazolták (41). Terhesség, máj-, illetve veseelégtelenség jelent kontraindikációt. A kezdő dózis – a betegség előrehaladottságának függvényében – 2× vagy 3×500 mg, amit fokozatosan emelhetünk a napi maximális dózis eléréséig, ami 4 gramm naponta. Vérkép, máj- és vesefunkciók, elektrolitok szintjének rendszeres ellenőrzése szükséges (22, 41), rendszerint folyamatos K-pótlás szükséges szájon át.
A topiramát elsősorban anti-epileptikumként és a migrén kezelésében használt hatóanyag. Egyéb tulajdonságai miatt azonban egyre gyakrabban alkalmazzák a pseudotumor cerebri kezelésében is (42). Karboanhidráz-gátló hatással bír, ezáltal csökkenti a liquor termelődését. Emellett mellékhatásként étvágycsökkenésről számoltak be, ami szintén előnyös PC-ben, és a társuló fejfájást is csökkentheti. Hatásosságát nagy esetszámú tanulmányban nem igazolták. Mellékhatásprofilja nem igazán kedvező, paresztézia, hányinger, fáradtság mellett chorioidealis effúziós szindróma is előfordulhat következményesen az elülső csarnok sekéllyé válásával és szekunder glaukómával (43).
Néhány éve elérhetőek a glukagon-típusú peptid-1 (GLP-1) analóg gyógyszerek, amelyek elsősorban antidiabetikumként kerültek kifejlesztésre, de „mellékhatásként” jelentős testsúlycsökkenést is megfigyeltek (44, 45). A GLP-1 az emésztőrendszer által természetes módon kiválasztott hormon, amely mind emésztőrendszeri, mind pedig központi idegrendszeri folyamatok révén képes befolyásolni a kalóriabevitelt: A hasnyálmirigy inzulin kiválasztásának fokozásával csökkenti a vércukorszintet. A hypothalamusban, illetve az agytörzsben hatva mérsékeli az éhséget és fokozza a teltségérzetet, emellett lassítja a gyomor kiürülését, ami összességében csökkent kalóriabevitelt és súlycsökkenést okoz. Jelenleg Magyarországon két hatóanyag van forgalomban, a liraglutid és a szemaglutid. Ezek közül hazánkban testsúlycsökkentés indikációjával a liraglutid rendelhető, ezért elhízott pseudotumor cerebri betegek esetében is egyre többször alkalmazzák (45, 46).
Sebészi kezelési lehetőségek
Sebészi beavatkozás szükséges, amennyiben konzervatív módon a fejfájás nem uralható, illetve a látásromlás progressziója nem megállítható. Mivel a diagnosztikai folyamat során, végzett lumbálpunkció kapcsán a betegek időnként a panaszok enyhüléséről számolnak be, konzervatív terápia mellett lehetőség van időszakosan ismételt gerinccsapolást végezni. Ez természetesen csak átmeneti javulással járhat és az eredménye bizonytalan (47), ezért manapság nem végzik. Amennyiben a vizuális funkciók romlása progrediál, tartós megoldást hozó beavatkozásra van szükség. Dandy 1937-ben temporális cranialis dekompressziót végzett betegeinél (30). Ma már ez a beavatkozás nem javasolható. A választott sebészi megközelítéseket nagyban befolyásolja a beteg panaszainak mértéke. Amennyiben a beteg általános közérzete kielégítő, fejfájásának mértéke tolerálható, az emelkedett intracranialis nyomás „csupán” látásromlást okoz, a nervus opticus agyhártya burkának megnyitása (opticus hüvely fenesztráció) a nervus opticusra nehezedő túlnyomást megszüntetheti és így a látóidegrostok túlélését biztosíthatja (48, 49). A megfelelő gyakorlattal és technikával elvégzett opticus hüvely fenesztrációt biztonságos és hatékony eljárásként jegyzik az irodalomban. Meglepő módon az egy oldalon elvégzett fenesztrációs műtét több esetben mindkét oldali papillaödémát, sőt a fejfájásos panaszokat is enyhítette (50). Magyarországon ez a beavatkozás nem terjedt el.
Az elmúlt évtizedekben a legelterjedtebb megoldást a söntműtétek jelentették. A sönt egy vékony szilikon csőrendszer, amelyet a bőr alá beültetve képes elvezetni az agykamrákban rekedt, veszélyes túlnyomást okozó agyvizet egy másik testüregbe, ahol akadálytalanul felszívódhat. A legjobb eredményeket a hasüregbe vezetett ventriculo-peritonealis söntökkel publikálták (51). Magyarországon is sikerrel végzik ezt a beavatkozást (8). A söntműtét a manapság leggyakrabban alkalmazott műtéti megoldás pseudotumor cerebriben, eredményei meggyőzők. Sajnos azonban ritkán szövődményként fertőzés léphet fel, illetve a sönt anyaga is kiválthat immunreakciót (52). Veszélyt jelenthet továbbá a sönt esetleges elzáródása, szakadása is, ezért a betegnek kerülnie kell a szár nyúlásával, feszülésével járó mozgásformákat és az erős fizikai megterhelést.
Az elmúlt években, hazánkban is egyre gyakrabban végeznek neurointervenciós beavatkozást a pseudotumor kezelésére igazolt cerebrális vénás szűkület esetén (53). Amennyiben a koponya MRI-vizsgálata felveti a sinus transversus vagy a sigmoideus szűkületét az intracranialis nyomásemelkedés hátterében, cerebrális katéteres venográfia során végzett manometria igazolhatja, hogy az érintett sinus szűkülete valóban jelentős nyomásgrádienst (>8 Hgmm) okoz. Ha ez bizonyítást nyer, egy következő ülésben történik meg a vénás stent beültetése szintén katéteres úton. A beültetést követően ismételt manometriával igazolható a nyomásgrádiens sikeres megszüntetése (18).
Extrém mértékű elhízás (a testtömegindex >35 kg/m2) esetén testsúlycsökkentő (bariátriai) műtét elvégzésének lehetősége is felmerül (54, 55, 56). A gyomor térfogatának csökkentésével elérhető az a mértékű testsúlyvesztés, amely a beteg panaszainak (különösen a fejfájás) megszűnését, a papillaödéma visszahúzódását, ezáltal kifejezett életminőség-javulást okozhat (57).
Következtetések
A pseudotumor cerebri a látás elvesztésével fenyegető és az életminőséget lényegesen rontó betegség. A szemorvos felelőssége a vizsgálat során a papillaödéma diagnózisa, majd a beteg neurológushoz irányítása, ahol az emelkedett koponyaűri nyomásfokozódás okai tisztázódhatnak. Amennyiben az emelkedett intracranialis nyomás hátterében nem találnak okot, a gyógyszeres terápiát el kell indítani, amellett, hogy a beteget fel kell világosítani a testsúlycsökkentés kiemelt fontosságáról. A papillaödéma mértékének rögzítése mellett a látótér rendszeres vizsgálata szükséges, mert a betegség progressziójának egyetlen jele a látótér szűkülete lehet. Ha a beteg kezelését neurológus kollégákra is bízzuk, a beteg rendszeres szemészeti kontrollvizsgálatáról a fentiek miatt nem szabad lemondanunk. Amennyiben a látási funkciók a gyógyszeres kezelés mellett is romlanak, a beteget magasabb szintű ellátóhelyre kell irányítani, ahol a sebészi terápia szükség esetén elvégezhető. Az „elhízás-járvány” terjedésével várhatóan egyre nagyobb számban találkozhatunk a mindennapi gyakorlatunkban pseudotumor cerebri beteggel, ezért a klinikai kép és a kezelés lépéseinek ismerete elengedhetetlen.
Nyilatkozat
A szerző kijelenti, hogy eredeti, összefoglaló, továbbképző közleménye megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Friedman DI, Liu GT and Digre KB. Revised diagnostic criteria for the pseudotumor cerebri syndrome in adults and children. Neurology 2013; 81: 1159–1165.
https://doi.org/10.1212/WNL.0b013e3182a55f17
2. Friedman DI, Jacobson DM. Idiopathic intracranial hypertension. J Neuroophthalmol 2004; 24: 138e45
https://doi.org/10.1097/00041327-200406000-00009.
3. Wall M, Kupersmith MJ, Kieburtz KD, et al.; for the NORDIC Idiopathic Intracranial Hypertension Study Group. The idiopathic intracranial hypertension treatment trial: clinical profile at baseline. JAMA Neurol 2014; 71: 693–701. https://doi.org/10.1001/jamaneurol.2014.133
4. Digre KB. Not so benign intracranial hypertension. BMJ 2003 Mar 22; 326(7390): 613–4.
https://doi.org/10.1136/bmj.326.7390.613
5. Mulla Y, Markey KA, Woolley RL, et al. Headache determines quality of life in idiopathic intracranial hypertension. J Headache Pain 2015; 16: 521.
https://doi.org/10.1186/s10194-015-0521-9
6. Mollan SP, Hoffmann J, Sinclair AJ. Advances in the understanding of headache in idiopathic intracranial hypertension. Curr Opin Neurol 2019 Feb; 32(1): 92–98.
https://doi.org/10.1097/WCO.0000000000000651
7. Mollan SP, Davies B, Silver NC, et al. Idiopathic intracranial hypertension: consensus guidelines on management. J Neurol Neurosurg Psych 2018; 89: 1088–1100.
https://doi.org/10.1136/jnnp-2017-317440
8. Salomváry B, Pánczél Gy, Markia B, et al. Az idiopathiás intracranialis hipertenzió korszerű diagnózisa és kezelése. Ideggyogy Sz 2017 Sep 30; 70(9–10): 321–332.
https://doi.org/10.18071/isz.70.0321
9. Kilgore KP, Lee MS, Leavitt JA, et al. Re-evaluating the incidence of idiopathic intracranial hypertension in an era of increasing obesity. Ophthalmology 2017; 124: 697e700
https://doi.org/10.1016/j.ophtha.2017.01.006
10. Mollan https://doi.org/10.1038/s41433-018-0238-5SP, Aguiar M, Evison F Frew E, et al. The expanding burden of Idiopathic Intracranial Hypertension. Eye 2018 Oct 24.
https://doi.org/10.1038/s41433-018-0238-5
11. Bruce BB, Kedar S, Van Stavern GP, et al. Idiopathic intracranial hypertension in men. Neurology 72: 304–309.
https://doi.org/10.1212/01.wnl.0000333254.84120.f5
12. Svart K, Jensen RH, Høgedal L, et al. Phenotyping non-idiopathic pseudotumor cerebri syndrome – A prospective cohort study. Cephalalgia 2022 Dec; 42(14): 1510–1520.
https://doi.org/10.1177/03331024221120073
13. Szentágothai J, Réthelyi M. (2002): Funkcionális anatómia. Budapest: Medicina Kiadó; III. kötet 121. oldal ISBN: 9789632425641
14. Bothwell SW, Janigro D, Patabendige A. Cerebrospinal fluid dynamics and intracranial pressure elevation in neurological diseases. Fluids Barriers CNS 2019 Apr 10; 16(1): 9.
https://doi.org/10.1186/s12987-019-0129-6
15. Monro A (1783). Observations on the structure and function of the nervous system. Edinburgh: Creech & Johnson.
16. Kelly G. “Appearances observed in the dissection of two individuals; death from cold and congestion of the brain”. Trans Med Chir Sci Edinb1: 1824; 84–169.
17. Mokri B. The Monro-Kellie hypothesis: applications in CSF volume depletion. Neurology 2001; 56: 1746e8.
https://doi.org/10.1212/wnl.56.12.1746
18. Fargen KM, Liu K, Garner RM, et al. Recommendations for the selection and treatment of patients with idiopathic intracranial hypertension for venous sinus stenting. J Neurointerv Surg 2018 Dec; 10(12): 1203–1208.
https://doi.org/10.1136/neurintsurg-2018-014042
19. Farb RI, Vanek I, Scott JN, et al. Idiopathic intracranial hypertension: the prevalence and morphology of sinovenous stenosis. Neurology 2003; 60: 1418–1424. https://doi.org/10.1212/01.wnl.0000066683.34093.e2
20. Daniels AB, Liu GT, Volpe NJ, et al. Profiles of obesity, weight gain, and quality of life in idiopathic intracranial hypertension (pseudotumor cerebri) Am J Ophthalmol 2007; 143: 635–641.
https://doi.org/10.1016/j.ajo.2006.12.040
21. Johnson LN, Krohel GB, Madsen RW, et al. The role of weight loss and acetazolamide in the treatment of idiopathic intracranial hypertension (pseudotumor cerebri). Ophthalmology 1998; 105: 2313–2317.
https://doi.org/10.1016/S0161-6420(98)91234-9
22. Mollan SP, Mitchell JL, Ottridge RS, et al. Effectiveness of bariatric surgery vs community weight management intervention for the treatment of idiopathic intracranial hypertension: a randomized clinical trial. JAMA Neurol 2021; 78: 678–686.
https://doi.org/10.1001/jamaneurol.2021.0659
23. Raper DMS, Ding D, Buell TJ, et al. Effect of Body Mass Index on Venous Sinus Pressures in Idiopathic Intracranial Hypertension Patients Before and After Endovascular Stenting. Neurosurgery April 2018; 82(4): 555–561.
https://doi.org/10.1093/neuros/nyx186
24. Libien J, Kupersmith MJ, Blaner W, et al. NORDIC Idiopathic Intracranial Hypertension Study Group. Role of vitamin A metabolism in IIH: Results from the idiopathic intracranial hypertension treatment trial. J Neurol Sci 2017 Jan 15; 372: 78–84.
https://doi.org/10.1016/j.jns.2016.11.014
25. Raoof N, Hoffmann J. Diagnosis and treatment of idiopathic intracranial hypertension. Cephalalgia 2021 Apr; 41(4): 472–478.
https://doi.org/10.1177/0333102421997093
26. Korsbæk JJ, Jensen RH, Høgedal L, et al. Diagnosis of idiopathic intracranial hypertension: A proposal for evidence-based diagnostic criteria. Cephalalgia 2023 Mar; 43(3): 3331024231152795.
https://doi.org/10.1177/03331024231152795
27. Corbett JJ, Savino PJ, Thompson HS, et al. Visual loss in pseudotumor cerebri. Follow-up of 57 patients from five to 41 years and a profile of 14 patients with permanent severe visual loss. Arch Neurol 1982; 39: 461e74.
https://doi.org/10.1001/archneur.1982.00510200003001
28. Wall M. Update on Idiopathic Intracranial Hypertension. Neurol Clin 2017 Feb; 35(1): 45–57.
https://doi.org/10.1016/j.ncl.2016.08.004.
29. Athappilly G, García-Basterra I, Machado-Miller F, et al. Ganglion Cell Complex Analysis as a Potential Indicator of Early Neuronal Loss in Idiopathic Intracranial Hypertension. Neuro-Ophthalmology 2019; 43(1): 10–17.
https://doi.org/10.1080/01658107.2018.1476558
30. Dandy WE. “Intracranial pressure without brain tumor - diagnosis and treatment”. Annals of Surgery October 1937; (4): 492–513.
https://doi.org/10.1097/00000658-193710000-00002
31. Mackay DD, Takacs SM. Central Venous Obstruction-Induced Intracranial Hypertension in Hemodialysis Patients: An Underrecognized Cause of Elevated Intracranial Pressure. J Neuroophthalmol 2020 Jun; 40(2): 218–225.
https://doi.org/10.1097/WNO.0000000000000964
32. Sinclair AJ, Burdon MA, Nightingale PG, et al. Low energy diet and intracranial pressure in women with idiopathic intracranial hypertension: prospective cohort study. BMJ 2010; 341: c2701. https://doi.org/10.1136/bmj.c2701
33. Mollan SP, Tahrani AA, Sinclair AJ. The Potentially Modifiable Risk Factor in Idiopathic Intracranial Hypertension: Body Weight. Neurol Clin Pract 2021.
https://doi.org/10.1212/CPJ.0000000000001063
34. Hornby C, Botfield H, O’Reilly MW, et al. Evaluating the Fat Distribution in Idiopathic Intracranial Hypertension Using Dual-Energy X-ray Absorptiometry Scanning. Neuroophthalmology 2017; 42: 99–104.
https://doi.org/10.1080/01658107.2017.1334218
35. Mollan SP, Mitchell JL, Yiangou A, et al. Association of Amount of Weight Lost After Bariatric Surgery With Intracranial Pressure in Women With Idiopathic Intracranial Hypertension. Neurology 2022 Sep 13; 99(11): e1090–e1099.
https://doi.org/10.1212/WNL.0000000000200839
36. Fildes A, Charlton J, Rudisill C, et al. Probability of an obese person attaining normal body weight: cohort study using electronic health records. Am J Public Health 2015; 105(9): e54–e59.
https://doi.org/10.2105/AJPH.2015.302773
37. Hall KD, Kahan S. Maintenance of Lost Weight and Long-Term Management of Obesity. Med Clin North Am 2018 Jan; 102(1): 183–197.
https://doi.org/10.1016/j.mcna.2017.08.012
38. Piper RJ, Kalyvas AV, Young AMH, et al. Interventions for idiopathic intracranial hypertension. Cochrane Database Syst Rev 2015.
https://doi.org/10.1002/14651858.cd003434.pub3
39. Rubin RC, Henderson ES, Ommaya AK, et al. The production of cerebrospinal fluid in man and its modification by acetazolamide. J Neurosurg 1966; 25(4): 430–436. https://doi.org/10.3171/jns.1966.25.4.0430
40. Gücer G, Viernstein L. Long-term intracranial pressure recording in the management of pseudotumor cerebri. J Neurosurg 1978; 49(2): 256–263.
https://doi.org/10.3171/jns.1978.49.2.0256
41. NORDIC Idiopathic Intracranial Hypertension Study Group Writing Committee; Wall M, McDermott MP, Kieburtz KD, et al. Effect of acetazolamide on visual function in patients with idiopathic intracranial hypertension and mild visual loss: the idiopathic intracranial hypertension treatment trial. JAMA 2014 Apr 23–30; 311(16): 1641–51.
https://doi.org/10.1001/jama.2014.3312
42. Goyal A. Should topiramate be initial therapy in the management of idiopathic intracranial hypertension?: A literature review. Zarroli K. Medicine (Baltimore) 2023 Oct 20; 102(42): e35545.
https://doi.org/10.1097/MD.0000000000035545
43. Adelman J, Freitag FG, Lainez M, et al. Analysis of safety and tolerability data obtained from over 1,500 patients receiving topiramate for migraine prevention in controlled trials. Pain Med 2008; 9: 175–85.
https://doi.org/10.1111/j.1526-4637.2007.00389.x
44. van Can J, Sloth B, Jensen CB, et al. Effects of the oncedaily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond) 2014; 38: 784–93.
https://doi.org/10.1038/ijo.2013.162
45. Krajnc N, Itariu B, Macher S, et al. Treatment with GLP-1 receptor agonists is associated with significant weight loss and favorable headache outcomes in idiopathic intracranial hypertension. J Headache Pain 2023; 24(1): 89.
https://doi.org/10.1186/s10194-023-01631-z
46. Simonyi G, Bedros JR, Wittmann I. Az elhízás modern szemlélete és korszerű kezelése. Lege Artis Medicinae 32(6–7): 255–264.
https://doi.org/10.33616/ lam.32.020
47. Yiangou A, Mitchell J, Markey KA, et al. Therapeutic lumbar puncture for headache in idiopathic intracranial hypertension: Minimal gain, is it worth the pain? Cephalalgia 2019 Feb; 39(2): 245–253.
https://doi.org/10.1177/0333102418782192
48. Kalyvas AV, Hughes M, Koutsarnakis C, et al. Efficacy, complications and cost of surgical interventions for idiopathic intracranial hypertension: a systematic review of the literature. Acta Neurochir 2016b; 159: 33–49.
https://doi.org/10.1007/s00701-016-3010-2
49. Kalyvas A, Neromyliotis E, Koutsarnakis C, et al. A systematic review of surgical treatments of idiopathic intracranial hypertension (IIH). Neurosurg Rev 2021 Apr; 44(2): 773–792.
https://doi.org/10.1007/s10143-020-01288-1
50. Hagen SM, Wegener M, Toft PB, et al. Unilateral Optic Nerve Sheath Fenestration in Idiopathic Intracranial Hypertension: A 6-Month Follow-Up Study on Visual Outcome and Prognostic Markers. Life (Basel) 2021 Jul 31; 11(8): 778.
https://doi.org/10.3390/life11080778
51. Orlando de Melo Jr. J, da Mata Pereira PJ, Neilho PN. Freehand Ventriculoperitoneal Shunt for Idiopathic Intracranial Hypertension: Technical Note for Slit-Like Ventricle Puncture Cureus 2023 Feb; 15(2): e34583. Published online 2023 Feb 3.
https://doi.org/10.7759/cureus.34583
52. Azad TD, Zhang Y, Varshneya K, et al. Lumboperitoneal and ventriculoperitoneal shunting for idiopathic intracranial hypertension demonstrate comparable failure and complication rates. Clin Neurosurg 2020; 86: 272–280.
https://doi.org/10.1093/neuros/nyz080
53. Bussière M, Falero R, Nicolle D, et al. Unilateral transverse sinus stenting of patients with idiopathic intracranial hypertension. AJNR Am J Neuroradiol 2010; 31: 645–650.
https://doi.org/10.3174/ajnr.A1890
54. Abbott S, Chan F, Tahrani AA, et al. Weight Management Interventions for Adults With Idiopathic Intracranial Hypertension: A Systematic Review and Practice Recommendations. Neurology 2023 Nov 21; 101(21): e2138–e2150.
https://doi.org/10.1212/WNL.0000000000207866
55. Egan RJ, Meredith HE, Coulston JE, et al. The effects of laparoscopic adjustable gastric banding on idiopathic intracranial hypertension. Obes Surg 2010; 21: 161–166.
https://doi.org/10.1007/s11695-010-0307-8
56. Mahendran V, Ricart P, Levine F, et al. Bariatric Surgery as a Viable Treatment for Idiopathic Intracranial Hypertension: a Case Series and Review of Literature. Obes Surg 2021; 31(10): 4386–4391. Published online 2021 Jul 28.
https://doi.org/10.1007/s11695-021-05587-4
57. Mollan SP, Mitchell JL, Ottridge RS, et al. Effectiveness of bariatric surgery vs community weight management intervention for the treatment of idiopathic intracranial hypertension: a randomized clinical trial. JAMA Neurol 2021; 26: 678–686.
https://doi.org/10.1001/jamaneurol.2021.0659
58. Carey AR. Papilledema. In: Henderson AD, Carey AR. (eds) Controversies in Neuro-Ophthalmic Management. Springer; 2021. Cham.
https://doi.org/10.1007/978-3-030-74103-7_6
