Seventeen-year experience with intravitreal anti-vascular endothelial growth factor (VEGF) injection for retinal capillary haemangiomatosis (Case report)
doi: 10.55342/szemhungarica.2024.161.4.200
Case report
Summary
Introduction: Retinal capillary haemangiomatosis (RCH) is a histologically capillary haemangioma mass located in retinal tissue. It occurs alone or in several foci, on the periphery of the retina, or around the optic nerve head; its exudative appearance can make it similar to Coats disease. The lesion may be accompanied by vitreoretinal trakción, vitreous haemorrhage, epiretinal membrane, and retinal detachment; progressive in nature.
Case report: The male patient, 43 years old at first appearance is under our control since 2002, i.e. for 22 years. RCH foci were detected in both eyes; one in preclinical form peripapillary on the right side, and several more developed forms in the left eye, located on the central retinal periphery. As a result of the exudation in the right eye, vitreous clouding, subretinal mass production, and incipient tractional retinal detachment began. Irradiation brachytherapy and then pars plana vitrectomy surgery were performed, adding cryotherapy to the foci and supplementing with laser coagulation. The eye later transformed into a painless hypotonic atrophic state. The slowly progressing lesion in the right eye was treated with various intravitreal anti-VEGF injections, predominantly bevacizumab; following this, beyond the 135th intervention, the functional state of the eye was preserved (VA=0.8 – 0.6).
Conclusion: In our case, the treatment of RCH with intravitreal anti-VEGF therapy gave favorable results in the long term, and we did not experience any significant side effects.
Összefoglaló
Bevezetés: A retinalis capillaris haemangiomatosis (RCH ) a retinalis-szövetben elhelyezkedő, szövettanilag capillaris haemangioma-tömeg. Egymagában, vagy több gócban, a retina perifériáján, illetve a látóidegfő környezetében fordul elő. Exsudativ megjelenése a Coats-betegséghez teheti hasonlóvá. Az elváltozást vitreoretinalis trakció, üvegtesti vérzés, epiretinalis membrán és retinaleválás kísérheti. Progresszív természetű.Esetismertetés: A jelentkezésekor 43 éves férfi beteg 2002 óta (22 éve) áll ellenőrzésünk alatt. Mindkét szemben RCH-gócokat észleltünk; a jobb oldalon peripapillarisan egy preklinikai állapotút, a balban több kifejlett léziót, a retinalis középperiférián. Utóbbiak exsudatiója nyomán üvegtesti borússág, majd subretinalis anyaglerakódás és kezdődő tractiós retinaleválás indult. Irradiációs brachytherapia, majd pars plana vitrectomiás műtét történt, a gócok fagyasztásával, illetve lézeres koagulálásával kiegészítve. A szem később fájdalommentes hypoton atrófiás állapotba került. A jobb szemben lassan progrediáló elváltozás kezelése különböző, túlnyomórészt bevacizumab hatóanyagú intravitreális anti-VEGF-injekciókkal történt. Ennek nyomán túl a 135. beavatkozáson, a szem funkcionális állapota megőrizhető maradt (látóélesség = 0,8–0,6).
Következtetések: Esetünkben az RCH kezelése az intravitreális anti-VEGF-terápiával hosszú távon jó eredményt adott, számottevő mellékhatást nem tapasztaltunk.
Keywords
retinalis capillaris haemangiomatosis
Kulcsszavak
retinalis capillaris haemangiomatosis
Bevezetés
A retinalis capillaris haemangiomatosis (RCH) a phacomatosisok csoportjába sorolt elváltozás, gyakran a Von Hippel–Lindau-betegség (VHL) részjelensége. 1904-ben Eugen von Hippel fedezett fel szemben haemangiomát; 1927-ben pedig Arvid Lindau a kisagyban és a gerincvelőben. A VHL-terminológia, ami a két szerzőt összekapcsolva, mint külön szindrómát tárgyalja a betegséget, először 1936-ban kerül használatba, általánosan az 1970-es évektől említik. Szövettanilag retinaszövetben elhelyezkedő tömeges capillaris haemangioma, jellemzően egymagában a látóidegfő környezetében, vagy több gócban, perifériás helyzetben fordul elő. A capillaris haemangiomát felépítő epithel-pericita hálózatot lipid-vacuolákkal telt „habos” stromasejtek veszik körül. A burjánzó erek falainak – retinalis erektől eltérő – fokozott permeabilitási tulajdonságai miatt exsudativ jelenségek kísérik, ezért szemfenéki tükrözéskor látott képe sokban hasonlít a Coats-betegségben látottakhoz; sub- és intraretinalis tömeges lipiddepozíció; kisebb bevérzések, exsudativ lokális retinaleválások tarkítják a szemfenéki képet. A Coats-betegségben azonban bizonyos retinalis területeken kialakult capillarisfal zárási gyengeség nyomán keletkező teleangiectasiákból erednek az exsudatio tömeges jelei, míg RCH esetében ezek eredete a tumoros érszövet, és jellegzetes a tumor felé tartó és onnan elvezetést biztosító, kiszélesedett tápláló- és visszér. A krónikus, érfalon átszivárgó exsudatio nyomán a felszaporodó anyagok progrediáló retinaelemelkedéshez, sub- és epiretinalis trakciós elemek, epiretinalis lemez képződéséhez vezetnek, illetve üvegtesti bevérzések fordulhatnak elő.
A Hippel–Lindau-betegség a 3p25.3 kromoszómán található VHL-tumorszupresszor gén mutációja okán keletkezik, kb. 20%-ban de novo-, 80%-ban autoszóm domináns öröklődéssel adódik át (1, 2). Jellemző a többszervi érintettség, főképpen visceralis ciszták és benignus tumorok formájában, malignus transzformációs hajlammal. Az angiomatosis gócok – haemangioblastomák – tipikusan a retinában keletkeznek.
Egyéb megjelenései: phaeochromocytoma, vesesejt-karcinóma, pancreas serosus cystadenoma, endolymphaticus-tágulati tumorok, papillaris lymphadenoma – utóbbi férfiakon az epidydimisen, nőkön a széles méhszalagon jellegzetes. Következményesen gyakori a kardiális infarktus és egyéb kardiovaszkuláris betegségek megjelenése. 2015-ben a Szemészet folyóiratban két eset ismertetése kapcsán a betegség igen részletes elemző-bemutatása jelent meg (3).
Kezelésére cryo-, lézerkoagulációs-, transpupillaris thermotherapia, fotodinámiás és direkt irradiációs technikák mellett a tumor pars plana műtét közbeni endoreszekciója, illetve újabban az antivaszkuláris endothelialis growth-faktor (VEGF) szerek alkalmazása jön szóba. Az érelváltozás ruténium plakk-beültetéssel történt besugárzása nyomán normalizálódó intraocularis hemodinamikai paraméterekről hazánkban Balázs és munkatársai 1989-ben számoltak be. Az irodalmi hivatkozások többnyire jó morfológiai, de hosszabb távon kevéssé pozitív funkcionális eredményeket mutatnak be (4–8).
Esetismertetés
A jelentkezésekor (2002-ben) 43 éves férfi beteg szemeiben már előrehaladott elváltozásokat találtunk, látása jobb oldalon teljes, a balon 0,4 volt. Mindkét oldalon RCH-gócokat észleltünk; a jobbon egy enyhén értágulatos papillaszéli területet, ami még nem mutatott egyértelmű RCH-ra utaló jeleket; a balban pedig több, a retinalis periférián elhelyezkedő érgomolyt láttunk, a jellegzetesen tágult tápláló- és visszerekkel. Utóbbiak exsudatiója nyomán tömegesen látszott subretinalis lipiddepozíció; benne csillogó koleszterinszemcsékkel (1. a és 1. b ábra). A rendelkezésre álló aktuális irodalmi beszámolások alapján a tumoros lézió és a hozzá futó értágulatok 532 nm-es lézerkoagulálási kísérlete történt. Ennek nyomán a szemtükri képen mindegyik góc határozott atrofizálódási jellegzetességeket mutatott, felszínük elfehéredett és néhány hét múlva határozott fibrosis jelei alakultak ki (1. c és 1. d ábra). Sajnos a nagyobb gócok környezetében az eredeti exsudativ aktivitás jelei mégsem csökkentek, sőt néhány hét után fokozott exsudativ jelek voltak megfigyelhetők rajtuk. Ez arra utalt, hogy csak felszíni atrofizálódást sikerült a hőhatással elérni és a mélyben az erek nem koagulálódtak, illetve gyorsan visszaformálódtak. Az ismételt lézerkezelések nem változtattak a helyzeten. Ekkor krio-applikációval próbáltuk a tumorok elzáródását elérni; ami csarnokpunkcióval elősegített masszív bedomborítás mellett is technikailag nehezen volt kivitelezhető és a jónak látszó peroperatív elfehéredések ellenére javuláshoz nem vezetett, néhány hét elteltével a kezelés eredménytelensége nyilvánvalóvá vált.
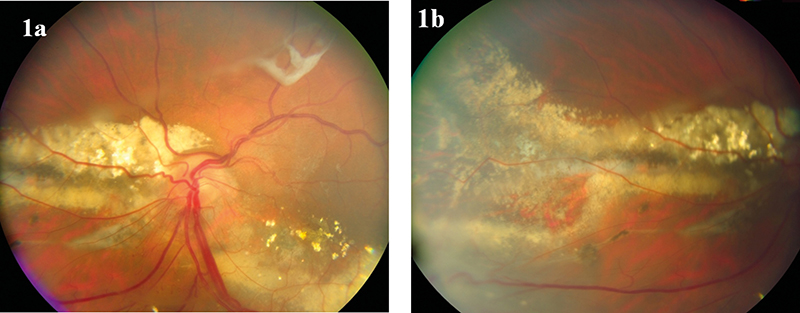
A következő néhány hónap során kifejezett progressziót lehetett megfigyelni. Az egyre tömegesedő lipidlerakódások mellett megjelentek az elvékonyodott retinalis szöveten áttűnő, choriocapillaris atrófiára utaló, jellegzetesen megmaradt nagyér-rajzolatok, pigmentrögök és formálódó subretinalis kötegek. Utóbbiak feszülő szárítókötélhez hasonlóan beljebb emelték az üvegtesti térbe a retinalis elemelkedéseket. Ezek mellett fokozódó üvegtesti borússág is indult és az exsudativ retinaleválás mellett a trakciós elem is progrediálni látszott.
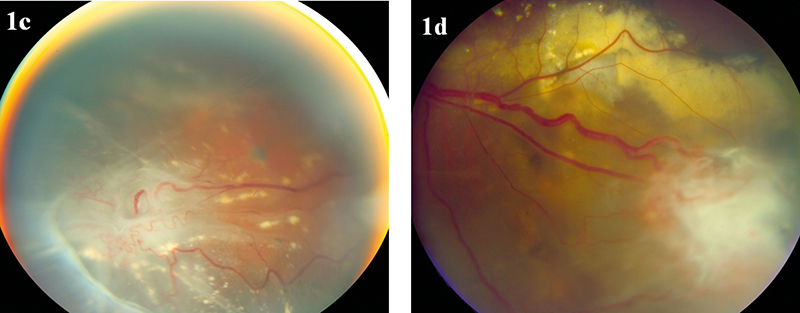
A beteget a Debreceni Szemklinikára irányítottuk, ahol a két megmaradt, nagyobb méretű perifériás tumor brachyterápiában részesült. Kezdeti remisszió után az üvegtesti borússág erősen fokozódott, a trakciós retinaleválás progressziója mellett. Pars plana vitrectomiás műtét mellett döntöttek, a gócok fagyasztásával, illetve lézeres koagulálásával kiegészítve; szilikonolaj-feltöltéssel sikerült elérni a retina centrális területének a visszafekvését. A perifériás tumorok teljes fibrosis jeleit mutatták, a tápláló-erek beszűkülésével. A trakciós elemek egy része azonban subretinalisan is perzisztált, illetve progrediált (2. ábra).
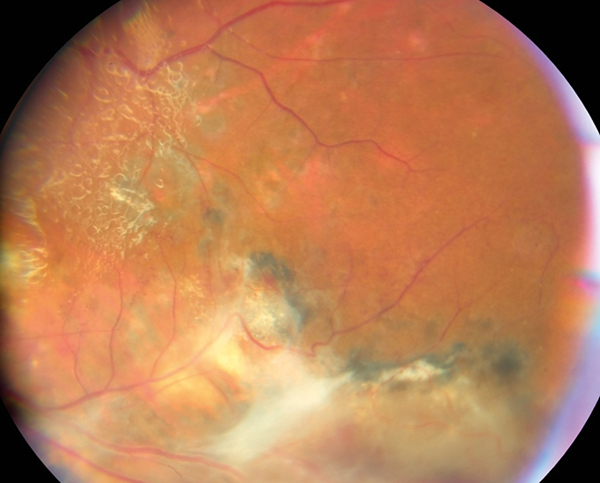
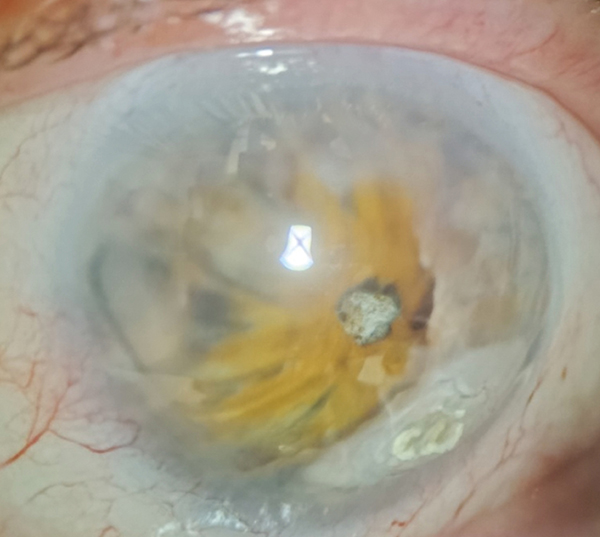
A szem gyulladáscsökkentő intenzív kezelés ellenére néhány hónap alatt hipotónná vált, az elülső szegmentumban letapadásokkal és a bombáló irisen megjelenő neovaszkuláris erekkel. Az aktuális lehetőségek és a prognózis részletes megbeszélését követően a beteg kérésére újabb beavatkozás nem történt. Pár hónap alatt a beszűkült pupilla területében fehéres, erezett membrán képében a retina egy része vált láthatóvá; az imperatív intenzitású retinalis rövidülés, tölcséres leválás és a szilikonolaj retro-retinalis helyzetbe kerülésének egyértelmű jeleként. Később a corneán opacitás zonularis jelent meg a hipotón, fényérzés nélküli, de fájdalmatlan szemen. Ez az állapot rögzült (3. ábra).
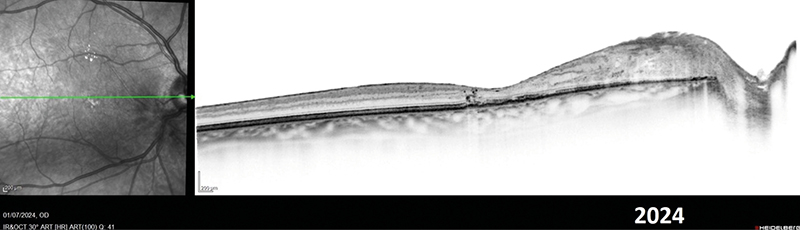
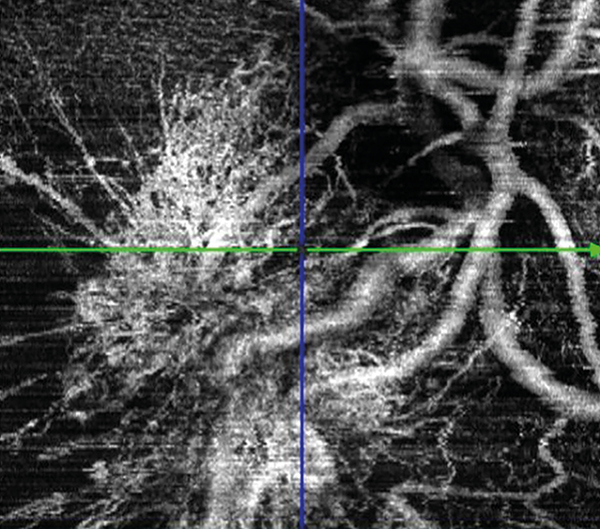
2006-ban a jobb szemben eközben a lassan progrediáló elváltozás kezdte felvenni a parapapillaris angiomatosis jellemző képét; tágult tápláló- és visszérrel. Funkcionális panasza a betegnek nem volt, az elváltozás is csak minimális változásokat mutatott, ezért csak obszerváltuk. 2007-ben látásában homályosodást tapasztalt, látóélessége 0,8-re esett vissza (4. a és 5. a ábra). Szemfenéki képén parapapillarisan lipiddepozitumok kezdtek halmozódni. Stratus OCT-vizsgálattal a területi retina szerkezeti elrendeződésének megbomlása és kezdődő cisztózussága volt megfigyelhető, ami az exsudatio fokozati növekedését jelezte. Tekintettel a bal szemmel nyert negatív tapasztalatokra, az akkor teljesen új anti-VEGF, a pegaptanib (Macugen) intravitreális adását kíséreltük meg. Erre enyhe, de pozitívnak tűnő reakciót kaptunk; az OCT-n markáns makuláris visszarendeződést észleltünk, látóélessége 1,0-re javult. A hatás közel fél évig tartott, amikor ismét látásgyengülést jelzett a beteg és az OCT a cisztózusság megjelenését és a makula irányába való terjedését igazolta. Ismételt kezelése ranibizumabbal (Lucentis) történt; amire drámaian pozitív választ láttunk mind a látási élmény, mind a szemtükri- és az OCT-képeken. Mellékhatást nem észleltünk. A látás kb. 3 hónap után ismét gyengült (0,8-re), ami miatt az injekciós kezelést ismételtük és hasonlóan jó reakciót észleltünk. A későbbiekben a ranibizumab elérhetősége problematikussá vált és bevacizumab (Avastin) injekciót adtunk. A ranibizumabbal gyakorlatilag megegyezően pozitív reakciót észleltünk, a hatás erőssége és tartama tekintetében egyaránt, ezért, a könnyebb hozzáférhetőség okán a továbbiakban bevacizumab adásánál maradtunk. A megfigyelés során arra a következtetésre jutottunk, hogy a kezelések után ugyan nagymértékben visszarendeződik a retinalis morfológia, de némi fibrosis, illetve feltételezhető neurosensoros atrófia marad utána. Emiatt az injekciók adását 2011 után sűríteni kellett, 1,5-2 havonkénti adagolásra (4. b ábra). A hatástartam gyengülését az jelezte, hogy betegünk látásában homályosodást kezdett észlelni; ilyenkor vizsgálatra jelentkezett. Az elvégzett OCT-vizsgálat a látásélességgel párhuzamba hozható recidív ödémásodást mutatott (6. a és 7. a ábra). A későbbiekben, 2014-ben 1-1 hosszabb (2-3 hónapos) időtartamú kezelési szünet negatív tapasztalata alapján áttértünk az állapottól független havonkénti szúrásra (4. c ábra). A kezelések 9. évében (2016-ban) a progrediáló lencsehomályok miatt phacoemulsificatiós műtét történt, hátsó csarnoki műlencse-beültetéssel. Próbaképpen aflibercept (Eylea) és faricimab (Vabysmo) injekció adása is történt néhány alkalommal, amikre ugyan jól reagált, de a hatások erősségében és időtartamában nem volt érdemi különbség a bevacizumabhoz képest. Az időközben fokozódó üvegtesti opacitások a szemfenéki leképezést egyre jobban nehezítik. Jelenleg (2024. okt.) a bal szem fájdalmatlan, fényérzés nélküli hipotón volta és a jobb szem 0,8–0,6 között ingadozó látása mellett havonta bevacizumab injekciók adása történik (4. f és 5. b ábra).
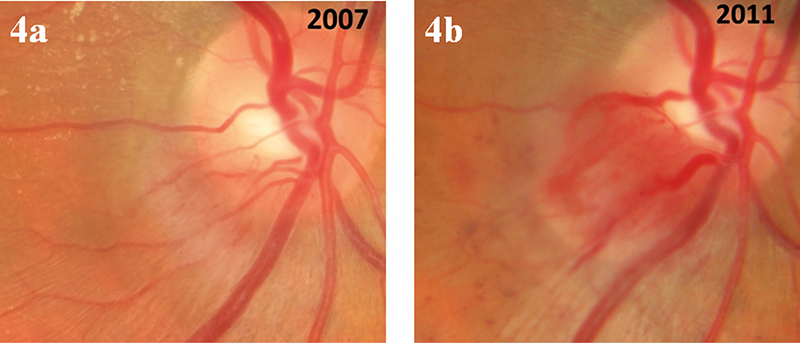
4. a ábra: 2007-ben az angioma még nem nevezhető jól felismerhetőnek; a parapapillaris exsudativ depozitumok jelzik az abnormis érhálózat jelenlétét. (Ezt akkor angiográfia is igazolta, de sajnos a felvételek nem elérhetőek).
4. b ábra: A tumor tápláló- és elvezető erei jellegzetes vastagodásukkal, a duzzanat hajszálereinek szabálytalan lefutásával már a haemangioblastoma képét kezdi mutatni. 2011-re a jellegzetességek kifejezettebbé válása mellett a stromalis szövet szaporodása előemelkedővé teszi a léziót; egyben körülhatároltabb megjelenést is ad
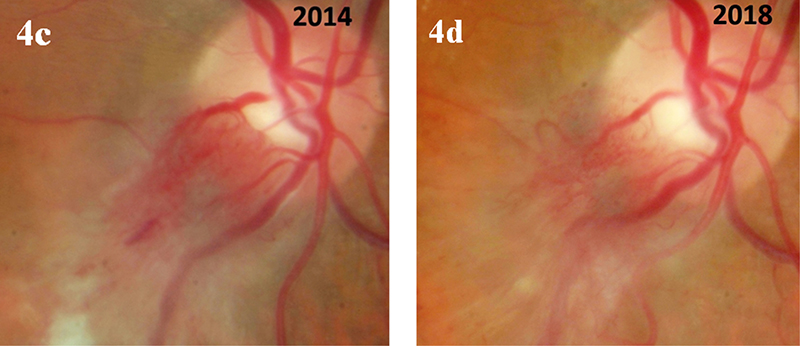
4. d ábra: 2018-ban a papillaszéli fibrosis előrehaladott volta mellett az atrófiás jelek is fokozottan megfigyelhetők; maga az elváltozás sokat lapult; a papilla területéből kiszorult; az erek a masszív húzó hatás nyomán erősen kanyargósakká, megtörtté és beszűkültté váltak, a környező fibrosis miatt kontúrjuk nehezebben kivehető
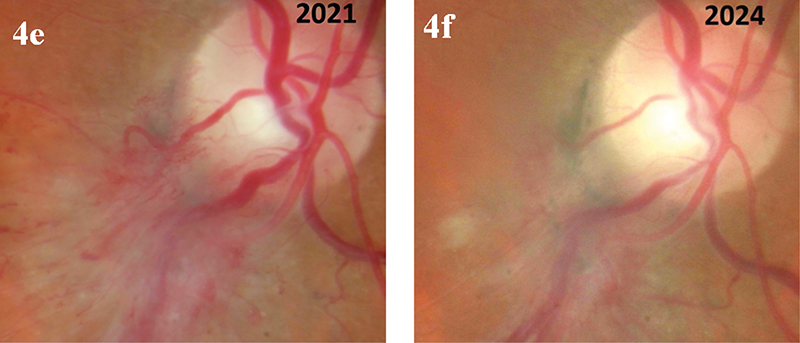
4. f ábra: 2024-ben a papilla területéről teljesen kiszorult a tumorszövet, gyakorlatilag fibrotizálódott az elváltozás. Ennek eredményeként atrófiás-ellapult, gliotikus szövet látható; a trakciót kísérő apró intraretinalis vérzésekkel. Az OCT-képen még látható exsudativ jelenségekről már nehéz eldönteni, hogy azok az eredeti tumorerek falának permeábilitási elégtelenségének, vagy a trakciós hatásnak tudhatók inkább be
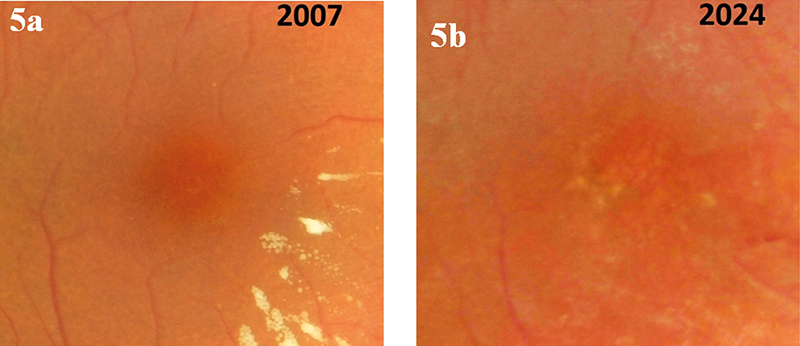
5. b ábra: A 2024-ben ugyanitt finom belfelszíni redőzöttség és egyenetlen csillogás látható; ami az ERM jelenlétére utal, A tápláló erek elvékonyodtak, a chorioideális rajzolat foltossá vált; a fovea környezetében kifejezett pigmentegyenetlenség és kopásos foltok láthatók
A betegünk kezelése vesefunkció-eltérései miatt történt kivizsgálása policisztás multiplex vesét talált; emiatt rendszeres nefrológiai ellenőrzést kezdtek. Mindeddig malignus transzformáció nem derült ki. Leánygyermekének haemangioblastomás cisztás elváltozása keletkezett a cerebellumban. Sikeres műtéte megtörtént, jó felépüléssel, teljes funkciókkal. Az apa és leánygyermek genetikai vizsgálata mindkettőjükben kimutatta a VHL-gén 1 típusát.
Eredmény, megbeszélés
Az elmúlt 17 év alatt, összesen 135 alkalommal történt intravitreális szúrás nyomán a teljes értékű életvitelt biztosító funkcionális állapot megmaradt (0,8 – 0,6 közötti monocularis visus); mellette a morfológiai állapot lassú, ám a kiindulásihoz képest markáns változásokon ment keresztül. Legfontosabb eredménynek a progresszív hajlamú papillaszéli szoliter tumor teljes kifejlődésének a gátlása, illetve esetleges újabb tumorgóc kialakulásának a megakadályozása tekinthető. A morfológiai eltérések részben a fibrosis, részben az atrófia jelenségeiből tevődnek össze.
A szemfenéki képen az alapszínváltozás – a műlencsés állapot és üvegtesti opálosság mellett – az általános keringési jellemzők gyengülésére utalnak. A látóidegfő halványabbá vált, ami az eltelt évek fiziológiai mértékénél kissé kifejezettebb mértékű idegrostvesztést jelez, főleg a temporális területekről. A papillaszéli képződmény és környezete erősen zsugorodott, nem alakult ki tipikus érgomoly, de a retina gliotikus átépülése szembetűnő; ami a környező szövetek és az erek jelentős elhúzását eredményezi. Valószínűleg ennek a trakciós hatásnak tudhatók be a retinalis szövetben esetenként megjelenő petechiák, illetve mikroinfarktusok gyapottépés gócai. A lézió tápláló- és elvezető erei mostanra nagymértékben beszűkültek. A makula fénytelenné vált; benne pigment-rögösödések, környezetében néhány fehér pontszerű lipiddepozitum alakult ki (4. a, b, c, d, e, f, ábra és 5. a, b ábra).
Az OCT-képeken a papilla érintett széli területei, illetve az azzal közvetlen szomszédos területek kompaktabbá és vékonyabbá váltak. A belső rétegek szöveti állományában nagymértékű szerkezeti átrendeződés keletkezett; benne a gliosisra jellemző rost-szerkezeti kép dominál, a külső retinalis rétegek kárára, azokat is jelentősen átszőve. A belső rétegek húzó hatása nyomán a külsőbb rétegek is számottevően átépültek, itt a vékonyodás és szerkezeti egyenetlenné válás mérsékelt sejtvesztésre utal. A tumoros képződmény érhálózata a zsugorodás és szöveti tömörödés nyomán gomolyszerűről vesszőseprűre emlékeztető rajzolatúvá vált. A papillomacularis zónában főként a középső rétegek vissza-visszatérő cisztózus ödémája nyomán alakult ki néhány krónikus, atrófiás folyadék-üreg, emellett a rétegek ellapulása és szerkezeti szegényedése jellegzetes. A fovea környéki neurosensoriumban számottevő mértékben deponálódtak a denz rögök, ami a lipid exsudatio besűrűsödéséből, illetve azok feldolgozási- és elszállítási képességének elégtelen voltából fakadhat, de a Henle-réteg relatíve megtartott. A pigmenthám és fotoreceptorok extrafoveális részeinek rétegzettsége nagyrészt megmaradt, azonban a foveális területen finom rögös hullámosság alakult ki. Mindez a fundusfotó-felvételeken markáns változás formájában követhetők nyomon (6. a, b, 7. a, b és 8. ábra).



A VHL-gén a 3. kromoszóma rövid karján található, a 3p25-26 régióban. Az általuk kódolt fehérjék fő feladata a sejt oxigénellátottságától függő szabályozás: normoxiás körülmények között enzimatikus kaszkádrendszeren keresztül akadályozzák az erythropoetin, VEGF, vérlemezke-eredetű növekedési faktor (PDGF) termelődését. A mutáció a VHL-fehérje funkcióvesztéséhez vezet, ezért megemelkednek az érképződést promotáló növekedési faktorok (VEGF, PDGF), amelyek érújdonképződést indukálnak. Ezzel magyarázható a VHL-asszociált tumorok kifejezetten bő erezettsége. Anti-VEGF-kezelésünk eredményessége is ennek tudható be; a megemelkedett, érújdonképződést promotáló tényezők lokális blokkolása révén.
A betegünk és leánya esetében a kimutatott VHL-gén 1 típusa igazolódott; ami mellett phaeochromocytoma kifejlődése kevéssé valószínű, de fokozott a veserák kockázata és várhatók egyéb lokalizációkban is angiomák, illetve haemangioblastomák kifejlődése. Ezért mindketten rendszeres szűrővizsgálatokra lettek irányítva. (A 2 típus phaeochromocytomára kifejezetten hajlamosít A variánsa csökkent-, B variánsa fokozott kockázatot jelent veserák kialakulásra; a C variánsban phaeochromocytomán kívül más tumor nem fordul el (9).
Következtetések
Esetünkben betegünk egyik szemében az előrehaladott RCH-gócok a hagyományos kezelésnek tekinthető irradiációs, krio- és lézer-beavatkozásokkal nem bizonyultak eredményesen kezelhetőnek és a szem funkcionális állapotát elvesztette. A másik szem enyhe látáspanaszai jelentkezésekor a funkciók szempontjából legérzékenyebb területen identifikáltuk a tumor kezdeti, de határozott jellegzetességeit. A régebbről alkalmazott eljárások itt nem jöhettek szóba. A folyamatosan és rendszeresen végzett intravitreális anti-VEGF-terápiával hosszú távon jó funkcionális eredményt értünk el, számottevő mellékhatást nem tapasztaltunk. Bár gyógyulás nem történhetett és a szemfenéken a kezelés 17 éve alatt markáns változások következtek be, de újabb góc nem keletkezett és nem alakult ki a tumor florid formája, sőt gliotikus-atrófiás transzformálódása involúciós jellegként értékelhető. Többfajta forgalomban lévő anti-VEGF-szert alkalmaztunk, ezek hatásosnak bizonyultak, és hatáserősségük, illetve tartamuk tekintetében nem észleltünk számottevő különbséget.
Köszönetnyilvánítás
Ezúton mondunk köszönetet dr. Damjanovics Juditnak, aki a Debreceni Szemklinika radioterápiás és műtéti lehetőségeit lehetővé tette a beteg számára. Ugyanígy köszönettel tartozom dr. Somfai Gábornak, aki a 2007 előtti időszakban a kórházunkban nem elérhető OCT-vizsgálatokat végezte el.
Nyilatkozat
A szerző kijelenti, hogy az esetismertetés megírásával kapcsolatban nem áll fenn vele szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Losonczy G, Fazakas E Pfliegler G, et al. Three novel germ-line VHL mutations in Hungarian von Hippel-Lindau patients, including a nonsense mutation in a fifteen-year-old boy with renal cell carcinoma. BMC Medical Genetics 2013; 14: 3.
https://doi.org/10.1186/1471-2350-14-3
2. Latif E, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor-suppressor gene. Science 1993; 260: 1317–1320.
https://doi.org/10.1126/science.8493574
3. Horváth H, Dunai Á, Récsán Zs. Von Hippel-Lindau szindróma – esetbemutatás, elkülönítő diagnosztika. Szemészet 2015; 152(4): 180–1B9.
4. Balázs E, Berta A, Rózsa L, Kolozsvári L, Rigó Gy. Haemodynamikai változások HippelangiomatosisRuthenium irradiációja után. Szemészet 1989(5): 79–84.
5. Szabó A, Gehl Zs, Seres A. Photodynamic (verteporfin) therapy for retinal capillary haemangioma, with monitoring of feeder and draining blood vessel diameters. Acta Ophthalmol Scand 2005; 83(4): 512–513.
https://doi.org/10.1111/j.1600-0420.2005.00476.x
6. Ketkar M, Raval VR, Reddy PVA, Kannan K, Kaliki S. Indocyanine green-enhanced transpupillary thermotherapy for juxtapapillary retinal capillary hemangioblastoma. Indian J Ophthalmol 2024 Aug 1; 72(8): 1150–1155. Epub 2024 Mar 8.PMID: 8454849
https://doi.org/10.4103/IJO.IJO_1684_23
7. Otero-Marquez O, Chui TY, Pinhas A, Castanos Toral MV, Zhou BD, Migacz J, Rosen RB. 3-D OCT angiographic evidence of Anti-VEGF therapeutic effects on retinal capillary hemangioma. Am J Ophthalmol Case Rep 2022 Feb; 7: 101394. eCollection 2022 Mar.
https://doi.org/10.1016/j.ajoc.2022.101394
8. Zhang X, Wen Y, Yang Y, Xiao H, Peng J, Zhao P. Vitreoretinal Surgery for Retinal Capillary Hemangiomas With Retinal Detachment. Asia Pac J Ophthalmol (Phila) 2023 Nov-Dec; 12(6): 623–625. Epub 2022 Dec 13.
https://doi.org/10.1097/ APO.0000000000000588
9. Lonser RR, Glenn GM, Walther M, et al. Von-Hippel-Lindau disease. Lancet 2003; 361: 2059–2067.
https://doi.org/10.1016/S0140-6736(03)13643-4
