Management and follow-up of cystoid macular oedema after targeted oncotherapy for disseminated cutaneous melanoma
doi: 10.55342/szemhungarica.2024.161.2.94
Original scientific paper
Summary
Introduction: Medications given during the treatment of malignant melanoma can cause a number of ophthalmic side effects. Timely recognition, ophthalmological treatment, and control of these complications are paramount in the care of patients with cancer.
Case study: A case of a 52-year-old male patient has been reported who developed bilateral macular oedema as an ocular side effect of molecularly targeted oncotherapeutic agents given during the treatment of metastatic cutaneous melanoma. He underwent adjuvant nivolumab immunotherapy after surgical local radiotherapy for malignant metastatic cutaneous melanoma. After two years of remission due to novum brain and cutaneous metastasis, he underwent stereotactic radiotherapy and immunotherapy, and combined molecularly targeted onkotherapy. Due to severe anemia, which developed as a side effects of oncotherapeutic agents, blood transfusions and a change of therapy (dabrafenib/trametinib) were necessary. Subsequently, the patient had a gradual visual loss after 2 months. An ophthalmological examination was performed for bilateral blurred vision, which confirmed cystoid macular oedema and serous retinal detachment. Intravitreal aflibercept therapy was initiated for the treatment of macula oedema. His vision improved steadily with treatment, and macular complications were resolved.
Conclusion: The healing of ophthalmological complications caused by oncotherapeutic agents used in the treatment of malignant melanoma can be accelerated by ophthalmological therapy, in addition to reducing or eliminating the dose of the agents.
Összefoglaló
Bevezetés: A melanoma malignum kezelése során adott gyógyszerek számos szemészeti mellékhatást okozhatnak. A kialakult szövődmények időben történő felismerése, szemészeti kezelése és kontrollja fontos a daganatos betegek ellátása során.Esetismertetés: A szerzők egy 52 éves férfi beteg esetét ismertetik, akinél áttétes cutan melanoma kezelése során kapott molekulárisan célzott onkoterápiás szerek szemészeti mellékhatásaként kétoldali makulaödéma alakult ki. A páciens áttétes cutan melanoma malignum miatt sebészeti, lokális radioterápiás kezelést követően adjuváns nivolumab immunterápiában részesült. Két évig tartó remisszió után nóvum agyi és cutan metasztázis miatt sztereoataxiás sugár és immunterápiás kezelés, illetve kombinált molekulárisan célzott onkoterápiás kezelés történt. Az onkoterápiás szerek mellékhatására kialakult súlyos anémia miatt vérátömlesztésre és terápiaváltásra (dabrafenib/trametinib) volt szükség. Ezt követően a betegnél 2 hónap múlva fokozatos látásromlás következett be. A kétoldali homályos látás miatt szemészeti vizsgálat történt, amely cisztoid makulaödémát és szerózus retinaleválást igazolt. A makulaödéma kezelésére intravitrealis aflibercept terápia elindítására került sor. Látása a kezelés hatására folyamatosan javult, a makulában kialakult szövődmények megszűntek.
Következtetés: A melanoma malignum kezelése során alkalmazott onkoterápiás készítmények hatására kialakuló szemészeti szövődmények gyógyulását – a készítmények dóziscsökkentése, vagy elhagyása mellett – az adott szemészeti terápia segítette, gyorsította.
Keywords
malignant melanoma, MEK-inhibitor, macular oedema
Kulcsszavak
melanoma malignum, MEK-inhibitor, makulaödéma
Bevezetés
A melanoma malignum a bőr pigmenttermelő sejtjeinek, a melanocytáknak a kóros transzformációja során kialakuló rosszindulatú daganat, amely a jelenleg ismert legagresszívebb és legletálisabb bőrdaganat (7). A melanoma incidenciája világszerte folyamatosan emelkedik, az újonnan diagnosztizált rosszindulatú daganatok körülbelül 1,7%-át teszi ki, míg a melanomában elhunyt betegek az összes rákos halálozás közel 0,7%-át adják. Más szolid daganatoktól eltérően a melanoma leginkább fiatal- és középkorú egyéneknél jelentkezik. A diagnózis felállításának időpontjában az átlagos életkor 57 év (12).
Napjainkban a melanomát multifaktoriális betegségnek tekintik, amely a genetikai érzékenység és a különböző környezeti ártalmak közötti kölcsönhatásból ered. Az egyéni rizikófaktorok közé sorolható a melanocyták és naevusok száma és gyakorisága, a genetikai prediszpozíció (világos bőr és hajszín, kék szem), illetve a családi anamnézisben szereplő melanoma. A külső környezeti ártalmak közül a legfontosabb kiemelni az UV-A sugárzást – közvetlen DNS-károsító hatása miatt – és a korábban elszenvedett napégések számát, súlyosságát (7, 12).
A előrehaladott melanomában szenvedő betegek számára a radioterápia és a kemoterápia mellett ma már az immunterápia és a célzott molekuláris terápia hatékony kezelési lehetőséget jelent. Az alkalmazott gyógyszerek molekuláris mechanizmusaik révén szabályozzák, megváltoztatják a szervezet immunválaszában részt vevő sejtnövekedési és proliferációs útvonalakban részt vevő fehérjéket. Ezek a molekuláris kölcsönhatások azonban fokozott immunológiai aktivitást, tüneteket eredményezhetnek egy olyan szervben is, mint az immunprivilegizált szem (3).
Esetbemutatásunk célja felhívni a figyelmet és rövid összefoglalót nyújtani a cutan melanoma kezelése során használt egyes adjuváns gyógyszerek lehetséges szemészeti mellékhatásairól. Ezen felül esetünkkel összefüggésben szeretnénk bemutatni a gyakrabban előforduló, retinalis elváltozásokkal járó MEK-inhibitor-asszociált retinopathiát (MEKAR) és ennek lehetséges kezelési lehetőségét.
Esetismertetés
Az esetismertetésünkben bemutatott 52 éves férfi beteg áttétes cutan melanoma kezelése során kapott, molekulárisan célzott onkoterápiás gyógyszer ismert szemészeti mellékhatása (kétoldali makulaödéma) miatt került kivizsgálásra klinikánkon.
Onkodermatológiai panaszaival először 2013-ban kereste fel a Semmelweis Egyetem Bőrgyógyászati Klinikáját, nemi szervén, a glans területén megjelent hiperpigmentált folt miatt. Az elváltozásból szövettani mintavétel alapján genitális lentigo-t diagnosztizáltak. A két évvel később elvégzett kontroll biopszia eredménye azonban már melanoma malignumot írt le, amely miatt glans-reszekció történt. A daganat stádiuma ekkor – Breslow: 0,8 mm; Clark III. volt. A további vizsgálatok (mellkasi, hasi, kismedencei CT) áttétképződésre utaló jelet nem találtak.
2017-ben február és június között a beteg 3×3 ME interferon alfa-2a adjuváns terápiában részesült. Egy évvel később PET-CT-vizsgálattal áttétképződés volt igazolható. Sebészeti (blokkdisszekció) és lokális sugárterápiás kezelés történt, illetve adjuváns kezelésként nivolumab immunterápiát indítottak, amelyet a beteg 25 alkalommal kapott. Két évig tartó remisszió után azonban a teljes test CT nóvum agyi és cutan áttétképződést igazolt. Az agyi áttétek miatt sztereoataxiás sugárkezelés történt.
A cutan metasztázisból vett core biopszia BRAF V600E mutáció pozitivitást mutatott. Négy adag ipilimumab-nivolumab immunterápiás kezelést követően további hét adag nivolumab került beadásra. Egy évvel később a többszöri agyi áttét miatt BRAF V600E mutáció pozitivitás esetén adható, molekulárisan célzott onkoterápiás szerek, vemurafenib és cobimetinib kombinációs terápiájának indítását tervezték.
A lehetséges szemészeti mellékhatások (pl. BRAF-inhibitor: uveitis, iritis, BRVO; MEK-inhibitor: szerózus retinopathia) miatt a terápia indítása előtt a beteg szemészeti vizsgálatát kérték. Ekkor a betegnek szemészeti panasza nem állt fenn. A szemészeti vizsgálat során eltérés nem igazolódott, a páciens legjobb korrigált látóélessége megtartott volt.
A makula optikai koherencia tomográfiás (MOCT) felvételén a makulában mindkét oldalon ép retinaszerkezet látszott.
A szemészeti kivizsgálás alapján a molekulárisan célzott az onkoterápiás kezelés elindításának nem állt fenn kontraindikációja, így azt elindították.
1 hónappal később azonban a onkoterápiás szerek mellékhatásaként kialakult súlyos anémia miatt (hemoglobin: 70 g/l) egy másik BRAF-MEK-inhibitor (dabrafenib/trametinib) kombinációs terápiára váltottak. A terápiás váltást követően a páciensnél fokozatos látásromlás alakult ki, amely miatt újabb szemészeti vizsgálat történt. Legjobb korrigált látóélessége ekkor a jobb szemen 0,7; a bal szemen 0,6 volt. Réslámpás vizsgálattal kétoldali békés elülső szegmens mellett, a hátsó póluson pigmentzavar és makulaoödéma volt látható. Az ekkor készült MOCT-felvételen cisztoid makulaödémát és szerózus retinaleválást láttunk (1. ábra).
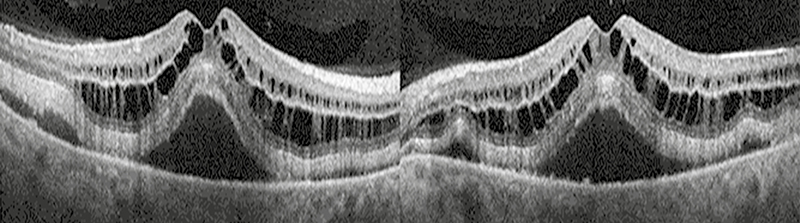
A szemészeti ultrahangvizsgálat a makulaödémának megfelelő belső fali kontúregyenetlenséget ábrázolt. Intraocularis áttétképződésre utaló jel nem volt látható.
A makulaödéma kezelésére intravitrealis afliberceptterápia elindítása mellett döntöttünk intravitreális injekció formájában. Fontos kiemelni, hogy a szemészeti mellékhatások fellépése miatt a beteg a dabrafenib/trametinib kombinációs terápiát a továbbiakban csökkentett dózisban kapta, nem került leállításra.
A páciens mindkét szemébe 2-2 aflibercept injekciót kapott. Ezt követően látásában jelentős javulás következett be. Az intravitreális injekciók beadását követően legjobb korrigált látóélessége a jobb szemen 1,0; a bal szemen 0,8 volt. Az MOCT-felvételeken a cisztoid ödéma már nem látszódott, szerózus leválás és szubfoveoláris folyadék azonban még mindkét oldalon látható volt (2. ábra).
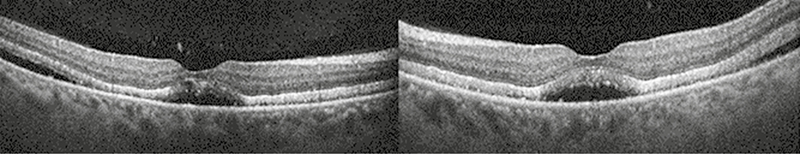
Ezt követően a kezelés melletti újabb agyi recidívák megjelenése miatt nivolumab-monoterápiára tértek át. A páciens a következő négy hónapban a jobb szemébe további kettő, bal szemébe egy adag aflibercept injekciót kapott. Látása a kezelés hatására tovább javult. Legjobb korrigált látóélessége a jobb szemen ekkor 0,8; a bal szemen 1,0 volt. Az ekkor készült MOCT-képeken sem szerózus retinaleválás, sem makulaödéma nem ábrázolódott (3. ábra). A szemészeti kezelés ideje alatt a betegnél további agyi, illetve a vékonybeleket és mesenterális nyirokcsomókat is érintő áttétek jelentkeztek.
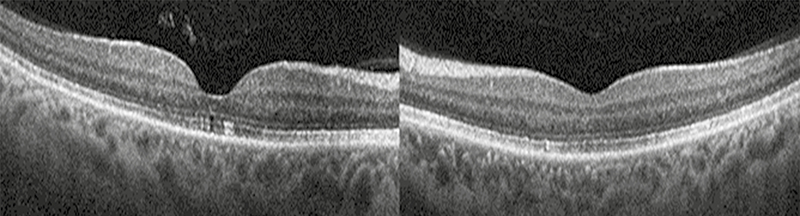
Megbeszélés
A melanoma korai felismerése és kezelése kulcsfontosságú tényezője a sikeres terápiának. A rosszindulatú bőrelváltozás időben történő felismerése érdekében fontos a páciensek önvizsgálata. A gyanús elváltozások vizsgálata során elengedhetetlen a dermatoszkópos vizsgálat (9, 21). A melanoma definitív diagnózisát kórszövettani vizsgálat adja, amely a daganat osztályozásában, a kockázatszámításban és a kezelési irány megválasztásában is segítséget nyújt (11, 16).
Az elsődleges kezelési modalitás általában az elváltozás sebészi úton történő eltávolítása, főként a reszekábilis primer cutan melanoma esetén. Amennyiben a daganat már nyirokcsomó-érintettséget mutat vagy távoli áttétet ad, a kezelés során adjuváns terápia válik szükségessé. A radioterápia és kemoterápia mellett megjelenő molekuláris célzott (target) terápia (BRAF/MEK-inhibitorok) nagyban javítja a metasztatikus, előrehaladott III., IV. stádiumú melanomás betegek kezelési válaszait és hosszú távú túlélését (7, 20, 23).
A bőrben az egyik leggyakrabban előforduló génmutáció a BRAF V600 (V600E/V600K). Az onkogén BRAF-mutációk a melanomák megközelítőleg 40%-ában kimutathatók, és a MAPK szignalizációs útvonal túlaktiválását okozzák (14, 23). A MAPK-útvonal mutáció miatti túlaktiválódása okozza a tumorsejtek gyors transzformációját, proliferációját. A szignalizációs lánc tagjai a BRAF és MEK1/2 protein-kinázok (7, 21).
A BRAF-enzim gátlása a tumorsejtek proliferációját csökkenti, ezzel a tumor gyors regresszióját eredményezi. A MEK-kináz egyidejű gátlása pedig csökkenti a fellépő rezisztenciát és a lehetséges toxicitás erősségét. A kombinált BRAF- és MEK-inhibitor terápia jobb túlélési eredményeket mutat BRAF V600E/K pozitív mutáció, illetve irreszekábilis vagy metasztatikus melanoma esetén, mint a monoterápiaként használt BRAF-gátló terápia. Ilyen BRAF/MEK kombinációs párosítások: dabrafenib és trametinib, vemurafenib és cobimetinib (4, 8, 13).
A disszeminált bőr melanoma malignum kezelésében alkalmazott checkpoint-inhibitorok, illetve célzott onkológiai kezelések ismert szemészeti tüneteket, mellékhatásokat okozhatnak (10, 22).
Ezen készítmények alkalmazása esetén a betegeknek rendszeres, kötelező szemészeti vizsgálaton kell részt venniük. A nemzetközi protokollok 3 havonta javasolnak szemészeti vizsgálatot. Akutan, frissen fellépő szemészeti panasz jelentkezése esetén, soron kívül OCT-felvétel készítése és általános szemészeti vizsgálat indokolt. A lehetséges szemészeti tünetek ismerete, felismerése, illetve az onkológus és a szemészorvos közötti információs kapcsolat kulcsfontosságú a mellékhatások korai diagnosztizálásához és a kezelés időbeni elkezdéséhez (5, 10, 22).
A BRAF-kináz-inhibitorok közé tartozó vemurafenib alkalmazásakor a leggyakrabban felmerülő szemészeti mellékhatások közé tartozik a szárazszem-szindróma, a conjunctivitis, illetve az uveitis (2, 3). Súlyosabb esetben kialakulhat panuveitis, amelyet akár retinaleválás vagy makulaödéma is kísérhet (6). A szemhéjon jelentkezhet laphámsejtes karcinóma és verruca vulgaris (24). A szintén BRAF-kináz-inhibitor dabrafenib alkalmazásakor mellékhatásként száraz szem, uveitis, iritis és cisztoid makulaödéma alakulhat ki (1).
A MEK-inhibitorok monoterápiában történő alkalmazása során megfigyelt mellékhatások közül kiemelendő a centrális szerózus chorioretinopathia (CSCR), a szerózus retinaleválással kísért uveitis (3) valamint a vena centralis retinae elzáródása (1, 15).
A MEK-inhibitorok előrehaladott melanoma kezelésénél BRAF-inhibitorokkal kombinálhatók. A kombinációs terápia alkalmazásakor poszterior uveitist, kétoldali panuveitist, multifokális chorioiditist, chorioidea neovaszkularizációt, illetve szerózus retinaleválást figyeltek meg egyes esetekben (1, 3, 15). Az úgynevezett MEK-inhibitor asszociált retinopathia egy gyűjtő elnevezés, amely a MEK-inhibitor kezelés hatására fellépő dózis- és időfüggő retinalis elváltozásokat, tüneteket foglalja magába. A MEK-inhibitor-kezelés alatt, a kezelt betegek 5-38%-ánál jelentkezett valamilyen szemészeti mellékhatás (19, 22).
A tünetek általában akut formában jelentkeznek, az első kezelést követő egy héten belül. A klinikai megjelenés mindig kétoldali és gyakran szimmetrikus. Szubjektív panaszok a homályos látás, fényérzékenység, megváltozott színérzékelés, metamorphopsia és káprázásos látás (19). A pontos diagnózis felállításához elengedhetetlen a szemfenék vizsgálata pupillatágítás mellett. A retinalis eltérések megítélése céljából célszerű az MOCT-felvételek elkészítése is. A fluoreszcein-angiográfiás (FLAG) vizsgálat elvégzése megfontolandó azoknál a betegeknél, akiknél a szemfenéki vizsgálat és a MOCT-vizsgálatok nem egyértelműek, vagy a klinikai tünetek súlyosak.
A cisztoid makulaödéma cisztaszerű folyadékterületként definiálható, amely az éleslátás helyén, a makula területén jelenik meg. A folyadékfelhalmozódás az ideghártya külső plexiform és a belső nukleáris rétege között alakul ki. Az ideghártya fiziológiai működését a vér-retina gát biztosítja. A gát normál működését számos betegség megzavarhatja, következményes folyadékáteresztést, makulaödémát eredményezve. A makulaödéma gyakori oka az akut vagy krónikus látásélesség-csökkenésnek számos szembetegség esetén, mint például az időskori makuladegeneráció, diabéteszes retinopathia, vagy a vena centralis retinae elzáródása. Szisztémás betegségekben, illetve gyógyszermellékhatás tüneteként is jelentkezhet. Legfőbb szubjektív tünetei a homályos látás, metamorphopsia és centrális látótérkiesés (17, 18).
Következtetés
Esetbemutatásunk során a cutan melanoma kezelésére adott célzott kombinációs terápia hatására kialakult szemészeti mellékhatást és kezelési lehetőségét mutattuk be. A páciens rossz általános állapota és az előrehaladott onkológiai betegsége miatt a jelentkező szemészeti mellékhatások ellenére sem került teljes felfüggesztésre a megkezdett onkológiai terápia. A súlyos mértékű és gyors ütemben kialakuló kétoldali makulaödéma okozta látásromlás kezelésére a kezelőorvos a terápia részeként intravitreális aflibercept injekció beadása mellett döntött, bízva a jelentkező szemészeti tünetek gyorsabb mérséklődésében. A szemészeti terápia hatására már a harmadik hónapban jelentős látásjavulás volt észlelhető, a beteg szubjektív panaszai 8 hónap alatt nagymértékben csökkentek, elmúltak. Az elvégzett szemészeti vizsgálati eredmények alapján a kezelés sikeressége igazolódott.
Az adott aflibercept injekció gyorsította a kialakult makulaödéma visszahúzódását, a beteg látásjavulását, ezzel életminőségét nagyban javította.
A melanoma terápiájában használt onkológiai gyógyszerek többségének van szemészeti toxikus mellékhatása. Fontos a társszakmák figyelmének felhívása a szemtünetek jelentkezésére, a mellékhatások monitorozásának szükségességére. Az onkológusok, bőrgyógyászok és a szemészek közötti kapcsolattartás, konzultáció kulcsfontosságú a szemkárosodás megelőzésében, korai diagnosztizálásában és sikeres kezelésében.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Bindiganavile SH, Bhat N, Lee AG, et al. Targeted Cancer Therapy and Its Ophthalmic Side Effects: A Review. J Immunother Precis Oncol 2021; 4(1): 6–15.
https://doi.org/10.36401/JIPO-20–21
2. Choe CH, McArthur GA, Caro I, et al. Ocular toxicity in BRAF mutant cutaneous melanoma patients treated with vemurafenib. Am J Ophthalmol 2014; 158(4): 831–837.
https://doi.org/10.1016/j.ajo.2014.07.003
3. Eikenberry J, Harris A, Torabi R, et al. Ocular side effects of target therapy and immunotherapy in patients with cutaneous malignant melanoma. Eur J Ophthalmol 2021; 31(3): 1391–1398.
https://doi.org/10.1177/1120672120930688
4. Eroglu Z, Ribas A. Combination therapy with BRAF and MEK inhibitors for melanoma: latest evidence and place in therapy. Ther Adv Med Oncol 2016; 8(1): 48–56.
https://doi.org/10.1177/1758834015616934
5. Gavric AU, Ocvirk J, Mekjavic PJ. Ocular Changes in Metastatic Melanoma Patients Treated with MEK Inhibitor Cobimetinib and BRAF Inhibitor Vemurafenib. Radiol Oncol 2018 Jan 24; 52(2): 213–219.
https://doi.org/10.2478/raon-2018-0002
6. Guedj M, Quéant A, Funck-Brentano E, Uveitis in patients with late-stage cutaneous melanoma treated with vemurafenib. JAMA Ophthalmol 2014; 132(12): 1421–5.
https://doi.org/10.1001/jamaophthalmol.2014.3024
7. Guo W, Wang H, Li C. Signal pathways of melanoma and targeted therapy. Signal Transduct Target Ther 2021; 20; 6(1): 424.
https://doi.org/10.1038/s41392-021-00827-6
8. Long GV, Flaherty KT, Stroyakovskiy D, et al. Dabrafenib plus trametinib versus dabrafenib monotherapy in patients with metastatic BRAF V600E/K-mutant melanoma: long-term survival and safety analysis of a phase 3 study. Ann Oncol 2017; 28(7): 1631–1639.
https://doi.org/10.1093/annonc/mdx176
9. Marghoob NG, Liopyris K, Jaimes N. Dermoscopy: A Review of the Structures That Facilitate Melanoma Detection. J Am Osteopath Assoc 2019; 119(6): 380–390.
https://doi.org/10.7556/jaoa.2019.067
10. Mettler C, Monnet D, Kramkimel N, et al. Ocular Safety Profile of BRAF and MEK Inhibitors: Data from the World Health Organization Pharmacovigilance Database. Ophthalmology 2021 Dec; 128(12): 1748–1755.
https://doi.org/10.1016/j.ophtha.2021.05.008
11. Plótár V, Orosz Z, Tóth-Molnár E, et al. Histopathological prognostic factors of malignant melanoma [A melanoma malignum hisztopatológiai prognosztikus faktorai]. Magy Onkol 2007; 51(1): 39–46. [Hungarian]
12. Rastrelli M, Tropea S, Rossi CR, et al. Melanoma: epidemiology, risk factors, pathogenesis, diagnosis and classification. In Vivo 2014; 28(6): 1005–11.
13. Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372(1): 30–9.
https://doi.org/10.1056/NEJMoa1412690
14. Rubinstein JC, Sznol M, Pavlick AC, et al. Incidence of the V600K mutation among melanoma patients with BRAF mutations, and potential therapeutic response to the specific BRAF inhibitor PLX4032. J Transl Med 2010; 8: 67.
https://doi.org/10.1186/1479-5876-8-67
15. Sarny S, Neumayer M, Kofler J, et al. Ocular toxicity due to Trametinib and Dabrafenib. BMC Ophthalmol 2017; 17(1): 146.
https://doi.org/10.1186/s12886-017-0541-0
16. Schadendorf D, van Akkooi ACJ, Berking, et al. Melanoma. Lancet 2018; 15: 392.
https://doi.org/10.1016/S0140-6736(18)31559-9
17. Scholl S, Augustin A, Loewenstein A, et al. General pathophysiology of macular edema. Eur J Ophthalmol 2011; 21(6): S10–9.
https://doi.org/10.5301/EJO.2010.6050
18. Scholl S, Kirchhof J, Augustin AJ. Pathophysiology of macular edema. Ophthalmologica 2010; 224(1): 8–15.
https://doi.org/10.1159/000315155
19. Stjepanovic N, Velazquez-Martin JP, Bedard PL. Ocular toxicities of MEK inhibitors and other targeted therapies. Ann Oncol 2016; 27(6): 998–1005. https://doi.org/10.1093/annonc/mdw100
20. Swetter SM, Tsao H, Bichakjian CK, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol 2019; 80(1): 208–250.
https://doi.org/10.1016/j.jaad.2018.08.055
21. Teixido C, Castillo P, Martinez-Vila C, et al. Molecular Markers and Targets in Melanoma. Cells 2021; 10(9): 2320.
https://doi.org/10.3390/cells10092320
22. Tyagi P, Santiago C. New features in MEK retinopathy. BMC Ophthalmol 2018; 18(1): 221.
https://doi.org/10.1186/s12886-018-0861-8
23. Wada-Ohno M, Ito T, Furue M. Adjuvant Therapy for Melanoma. Curr Treat Options Oncol 2019; 20(8): 63.
https://doi.org/10.1007/s11864-019-0666-x
24. Yin VT, Wiraszka TA, Tetzlaff M, et al. Cutaneous Eyelid Neoplasms as a Toxicity of Vemurafenib Therapy. Ophthalmic Plast Reconstr Surg 2015; 31(4): 112–5.
https://doi.org/10.1097/IOP.0000000000000140
