Diagnosis and therapeutic options for uveal effusion in a case report
doi: 10.55342/szemhungarica.2025.162.2.87
Case report
Summary
Introduction: Choroidal effusion is considered a rare disease. Intraocular interventions, such as the complication of glaucoma surgeries, can lead to choroidal effusion; however, this condition may also result from inflammatory and infectious diseases, trauma, tumours, drug reactions, scleral abnormalities, or venous stasis.
Objective: To describe the aetiology, the diagnostics and the therapeutic possibilities of choroidal effusion through a case report.
Case report: In November 2023, a 73-year-old female patient was examined with suspected retinal detachment. During her admission, the best corrected visual acuity (BCVA) was 0.5. Her ophthalmological anamnesis included moderate hypermetropia and bilateral cataract surgery; general anamnesis included treated high blood pressure. During biomicroscopy, the anterior segment was normal, but fundoscopy revealed that a massive choroidal detachment appeared in all four quadrants of the posterior pole, extending to the ora serrata. After ultrasound and UBM examination, idiopathic, type III. choroidal effusion syndrome was confirmed. Oral acetazolamide therapy was indicated in addition to local cycloplegics and anti-inflammatory drugs. She received 500 mg of methylprednisolone infusion therapy 3 times, after which we used oral methylprednisolone in a decreasing dose. Due to the lack of any signs of regression, anterior chamber reconstruction was made, and the fluid was drained from the suprachoroidal space. Considering the persistent cystoid macular oedema, anti-VEGF injection treatment was used. At the last visit, leopard- spot retinopathy was visible in the affected eye, the cystoid macular oedema and the suprachoroidal fluid resolved, and the BCVA was 1.0.
Conclusion: Idiopathic choroidal effusion is a relatively rare disease. Its diagnosis requires the exclusion of several ocular and systemic pathologies. Treatment should be considered between conservative and surgical management, taking into account the aetiology of the disease.
Összefoglaló
Bevezetés: Az uveális effúzió ritka kórkép, amely általában intraokuláris műtétek, kifejezetten a filtrációs műtétek szövődménye lehet, de gyulladásos, fertőző betegségek, traumák, daganatok, gyógyszer-interakciók, abnormális scleramegvastagodás és vénás pangás következtében is kialakulhat.
Célkitűzés: A chorioidea-effúzió etiológiájának, diagnosztikájának és terápiás lehetőségeinek áttekintése egy eset kapcsán.
Esetismertetés: 2023 novemberében, egy 73 éves nőbeteg került osztályos felvételre látóideghártya-leválás gyanújával. Felvétele során az érintett szemen a legjobb korrigált látóélesség (BCVA) 0,5. Szemészeti anamnézisében közepes fokú hypermetropia és kétoldali szürkehályogműtét, általános anamnézisében kezelt magas vérnyomás szerepelt. Réslámpás vizsgálata során békés elülső szegmentum mellett, láthatóvá vált a hátsó pólus mind a négy kvadránsában, az ora serrataig terjedő chorioidea-elemelkedés. Ultrahang- és ultrabiomikroszkópia (UBM) vizsgálatot követően idiopátiás chorioidea-effúziós szindróma III. típusa igazolódott. Bennfekvése során lokális cycloplegikum, és tobramycin-dexamethason szemcsepp mellett, orális acetazolamid-terápiában részesült. Három alkalommal 500 mg metilprednizolon infúziós terápiát kapott, amelyet orális szteroid fenntartó kezelés követett. Állapota változatlansága miatt elülső csarnok rekonstrukció és a suprachorioideális folyadék lebocsátása történt. Az érintett szemen perzisztáló cisztoid makulaödéma miatt anti-VEGF injekciós kezelést alkalmaztunk. A kontrollok alkalmával az érintett oldalon leopárd mintázatú retinopathia vált láthatóvá. A suprachorioideális folyadék és a cisztoid makulaödéma megszűnt, a legjobb korrigált látóélesség (BCVA) 1,0.
Következtetés: Az idiopátiás chorioideális effúzió egy relatív ritka megbetegedés. Diagnosztizálása során számos szemészeti és szisztémás kórkép kizárása szükséges. Ellátása során konzervatív és sebészi kezelés között szükséges mérlegelni, figyelembe véve a betegség etiológiáját.
Keywords
idiopathic choroidal effusion, scleral puncture, sclerostomy, sclerectomy, leopard spot retinopathy
Kulcsszavak
idiopátiás chorioideális effúzió, sclerotomia, sclerectomia, leopárd retinopathia
Bevezetés
Chorioideális effúziónak nevezzük azt a jelenséget, amelyben folyadék halmozódik fel a virtuális suprachorioideális térben. Klinikailag von Graefe említette 1858-ban; szövettanilag Verhoeff és Waite írta le először (5). Stephens és Brockhurst publikálta 1963-ban (25), illetve 1982-ben Gass és Jallow használta először az idiopátiás uveális effúziós szindróma (IUES) terminust egy olyan esetleírás kapcsán, amelynél nem volt azonosítható másodlagos ok az effúzió hátterében (7). A chorioideális effúzió egy ritka kórkép, elsősorban esettanulmányokban kerül említésre. Az alacsony gyakoriság miatt a pontos prevalenciáját nehéz meghatározni, és a rendelkezésre álló adatok általában eseti megfigyeléseken alapulnak. Egy, az Egyesült Királyságban készült tanulmány szerint az idiopátiás uveális effúzió szindróma előfordulási gyakorisága 1,2 eset 10 millió lakosra nézve (27). A legtöbb tanulmány a szekunder, a zöldhályog műtéti ellátása kapcsán jegyzett adatokat elemzi, amelyek szerint az érhártya-effúzió előfordulási aránya 3,0% és 18,8% között van trabeculectomiát követően, 13% és 15% Ahmed™, illetve 11,7–14,0% Baerveldt-sönt beültetést követően (37). Az InnFocus MicroShunt Versus Trabeculectomy Study (ClinicalTrials. gov Identifier: NCT01881425) 4,6%-os posztoperatív chorioidea-effúzió előfordulási arányt talált a MicroShunt-tanulmányban, a trabeculectomiás csoport 6,1%-ához képest. Az érhártya-effúziók aránya a XEN-gél-stent behelyezését követően 1,3% és 19,8% az alkalmazott technikától függően (37).
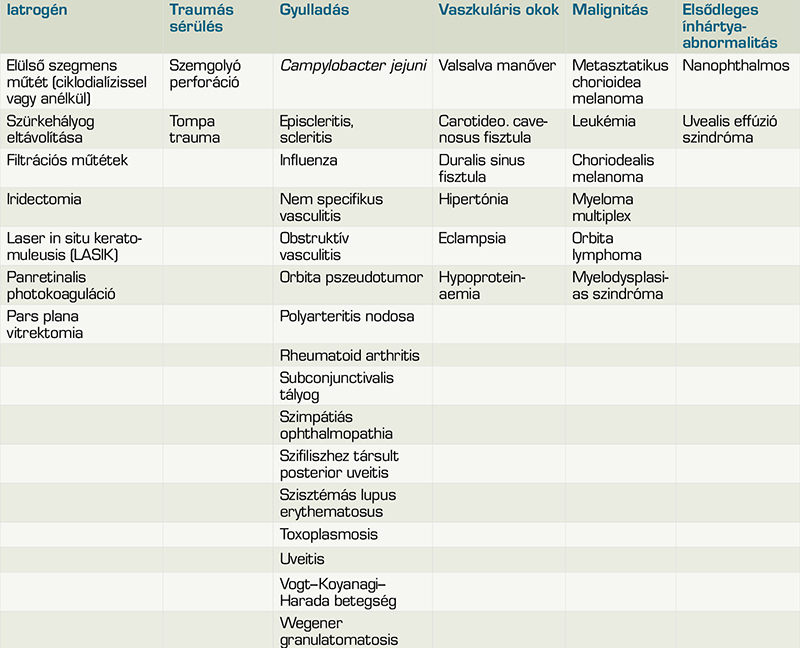
A chorioideális effúzió kialakulásának hátterében számos tényező állhat, amelyeket az 1. táblázatban foglaltuk össze. Az etiológiai szempontból hat csoportot tudunk létrehozni: iatrogén, trauma, gyulladás, malignitás, vaszkuláris és scleralis abnormalitások (37).
Mindezek mellett a perioperatívan alkalmazott antimetabolitokat és a csarnokvíztermelés-gátlókat egyaránt az érhártya-effúzió lehetséges kockázati tényezőjeként azonosították. Az antimetabolitok – különösen a mitomycin C (MMC) – alkalmazása a trabekulectomia során jelentős kockázati tényezőt jelent az elhúzódó intraokuláris hipotónia miatt (12). Azoknál a betegeknél, akiket trabeculectomia vagy drenázs eszköz beültetését követően csarnokvíztermelés-gátló (pl.: timolol vagy dorzolamid) szemcseppel kezeltek, megnövekedett az intraokuláris hipotónia és ezáltal a chorioideális effúzió kialakulásának kockázata (3). Számos egyéb szisztémás gyógyszer, mint például az antikonvulzív szerek, diuretikumok, szelektív reuptake-gátlók, biszfoszfonátok, monoklonális antitestek, tetraciklinek összefüggéseiről számoltak be érhártya-effúzió és másodlagos csarnokzug-elzáródással kapcsolatban (2). Ezekben az esetekben a gyógyszeres kezelés abbahagyása általában az effúzió megszűnéséhez vezetett (2). Rizikótényezők közé sorolandó az idősebb életkor, a szisztémás magas vérnyomás, a hyperopia, Sturge–Weber-szindróma (24), pszeudoexfoliatív glaukóma, a pseudophakia és az átlagosnál magasabb központi szaruhártya-vastagság is (14).
A chorioideális folyadékgyülemek fiziológiáját a suprachorioideális tér és a choriocapillaris közötti hidrosztatikus és ozmotikus erők vezérlik. A legtöbb ciliochorioideális effúziót patofiziológiai szempontból négy csoportba lehet sorolni. Hidrodinamikai, gyulladásos, neoplasztikus okok miatt, illetve abnormális ínhártyához kötődően kialakuló formák különíthetők el (15). Fiziológiás körülmények között egyensúly van a transzmurális hidrosztatikus nyomás (vérnyomás és az intraokuláris nyomás különbsége) és a choriokapillárisok kolloid ozmotikus nyomása (nagyobb részben az album ki/be áramlás által fenntartott) között (30). Fiziológiailag dehidrált állapotban, a suprachorioideális tér körülbelül 30 μm vastag. Ebben a térben nincsenek kapillárisok vagy nyirokerek, amelyek elvezetnék az itt felhalmozódó folyadékot, emiatt a termelődött folyadék az érhártya vénás rendszerén keresztül a vortex vénákon, az ínhártyán vagy az ínhártya perivaszkuláris és perineuralis terein keresztül távozik (13). Okuláris hipotónia esetén a transmuralis hidrosztatikus nyomás csökken, így a magasabb kapillárisnyomás hatására, kiváltképp, ha az gyulladásos állapothoz is társul, a choriokapillarisokból fehérje- és folyadékszivárgás történik. Ezáltal a suprachorioideális térben folyadékgyülem alakulhat ki, különösen filtrációs műtéteket követően (37). Az idiopátiás uveális effúziós szindróma kialakulásának hátterében elsődlegesen az ínhártya rendellenessége feltételezhető (37). A glükozaminoglikánok abnormális lerakódása a sclera belsejében gátolhatja a normális transscleralis folyadékáramlást, és hozzájárulhat az ínhártya megvastagodásához. Egy munkacsoport négy chorioideális effuzióval diagnosztizált beteg esetében megerősítette a glükozaminoglikánok felhalmozódását a sclera területén (5). Hisztokémiai vizsgálatok azt mutatták, hogy ennek az anyagnak a többsége proteodermatan-szulfát, kisebb mértékben pedig proteokondroitin-szulfát, míg az elektronmikroszkópos vizsgálatok a kollagénrostok vastagságának növekedését igazolták. Másodlagos, késői változások is megfigyelhetők voltak a retina pigmenthámjában, amelyek megfeleltek az effúzió kapcsán a jellegzetes „leopárdfolt” fundus megjelenésének (5).
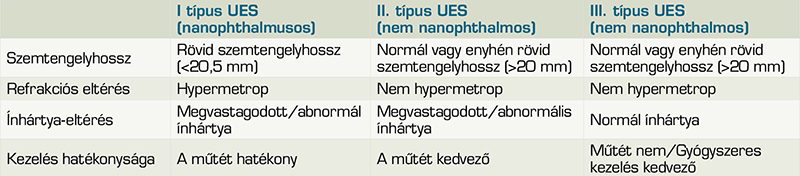
Csoportosítása többféleképpen lehetséges. Történhet etiológia, patofiziológia szerint vagy a folyadék minősége (serosus és vérzéses) szerint is, illetve Uyama és munkatársai (31) az uveális effúziós szindróma három típusát határozta meg, amelyet a 2. táblázatban tűntettünk fel. A felosztásban kiemelt jelentőségű a szemgolyóhossz mértéke (nanophthalmus vagy nem nanophthalmus), és az ínhártya képalkotó diagnosztikai és/vagy szövettani vizsgálat alapján meghatározott megvastagodása, abnormalitása (31). Klinikai tünetek között szerepel a fokozatos látásromlás, scleralis vérbőség, hipotónia, sekély elülső csarnok, myopiás shift, a chorioidea diffúz ödémája, későbbiekben Verhoeff-csíkok. Fundusvizsgálatot követően, a ciliochorioideális leválások szilárd, utómozgást nem mutató, barna-narancssárga megjelenésű sima felszínű, domború kiemelkedésekként ábrázolódnak. Korai vagy enyhe esetekben, az ora serrata látható, scleralis depresszió nélkül, a pars plana és a perifériás chorioidea lapos kiemelkedése miatt (2, 18, 22). Ahogy az effúzió előrehalad, gyűrűs vagy lebenyes érhártyaleválás is megfigyelhető. A jellegzetes négylebenyes konfiguráció, a chorioidea a vortex vénák ampullájánál való szoros tapadásából adódik. A folyadék mennyisége mindig nagyobb elől, mivel az elülső összekötő rostok, amelyek a chorioideát a sclerához kötik, hosszúak és érintőlegesen helyezkednek el, ellentétben a hátsó rostokkal, amelyek rövidek és közvetlenebben futnak az uveától a scleráig (2, 18, 22). Az effúzió hosszas fennállása esetén, a retinalis pigmentepithelium dekompenzálódik, amely subretinalisan folyadék és fehérje megjelenéséhez vezet. Progresszív folyadékkiáramlás esetén teljes serosus retinaleválás alakulhat ki.
A chorioideális effúzió súlyosságának megítélése során figyelembe kell vennünk a beteg szubjektív tüneteit, a fizikális vizsgálat eredményeit, valamint a modern képalkotó technológiák adta objektív információkat. Az ultrahang és az OCT kiemelt szerepet játszik a diagnózis pontosításában és a kezelés irányításában. Ultrahanggal vagy ultrahang-biomikroszkópiával (UBM) értékelhető, különösen az elülső szegmens érintettsége esetén. Az effúzió sötét (hipoechogén vagy anechogén) területként jelenik meg az ínhártya és az érhártya között a folyadékfelhalmozódás következtében (10). Az érhártya sima, kupolaszerű módon megemelkedik, amely jellemzően serosus vagy vérzéses leválásokban figyelhető meg. Megfigyelhető a sugártest duzzanata vagy leválása, amely gyakran a sugárnyúlványok (processus ciliares) előrefelé történő elmozdulását okozza, hozzájárulva a másodlagos zárt zugú glaukóma kialakulásához. A sugártest és az ínhártya közötti tér kiszélesedhet a folyadékfelhalmozódás miatt és hipoechogén területként ábrázolódhat az UBM-képen (6). Jelentős effúzió esetén az elülső csarnok sekélynek vagy laposnak tűnhet, mivel a lencse-írisz diafragma előrefelé tolódik. Ha az effúzió vérzéses, belső szeptációk vagy törmelékek figyelhetők meg a chorioideális leválásban, amely megkülönbözteti azt, az egyszerű serosus effúziótól.
Célkitűzés
Közleményünk célja egy idiopátiás chorioideális effúziós beteg esetének ismertetése, a differenciáldiagnosztika és az ellátási lehetőségek ismertetésével.
Esetismertetés
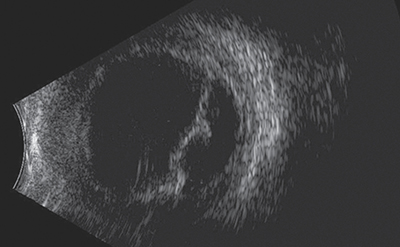
Betegünk egy 73 éves nőbeteg, akit más intézetből küldtek osztályunkra jobb szem retinaleválás műtéti megoldása céljából. Általános anamnézisében magas vérnyomás, illetve szemészeti anamnézisében korábban közepes fokú hypermetropia, kétoldali szövődménymentes szürkehályogműtét szerepelt, amely beavatkozás, a tünetek megjelenése előtt 2 hónappal történt. Felvétele során az érintett, jobb szemen a legjobb korrigált látóélesség (BCVA) 0,5. Intraokuláris nyomása normáltartományban volt. Réslámpás vizsgálata során az elülső szegmentumot békésnek, gyulladásmentesnek találtuk. Fundusvizsgálatot követően, jobb szemén láthatóvá vált az utómozgást nem mutató, narancssárga-barnás színű, sima felszínű bikonvex képlet. Ultrahang (1. ábra) vizsgálata során átlagos bulbushossz (21,32 mm) mellett chorioideális effúzió képét találtuk, illetve ultrabiomikroszkópos (UBM) (2. ábra) vizsgálat során a sugártest vastagsága megnövekedett, és mérsékelt mennyiségű folyadék látszott az érhártya rétegei között. A sclera vastagsága a normáltartományba esett (0,8 mm).
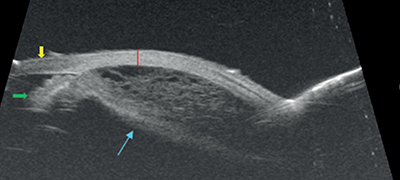
A sárga nyíl jelöli a szaruhártyát, a zöld nyíl jelöli a szivárványhártyát, a piros vonal jelöli az ínhártya vastagságát (0,8 mm), a kék nyíl rámutat a ciliochorioidealis leválás területére
Az érintett oldali makula optikai koherencia tomográfia (OCT) felvételén (3. ábra), a foveola területében subretinalis folyadékgyülem ábrázolódott. Szisztémásan eltérést nem találtunk. Teljes vérkép, CRP, süllyedés vizsgálata negatív eredményt hozott. A klinikai tünetek és objektív vizsgálatok alapján, az idiopátiás chorioideális effúziós szindróma III. típusa igazolódott, amely miatt konzervatív lokális és szisztémás kezelés mellett döntöttünk.
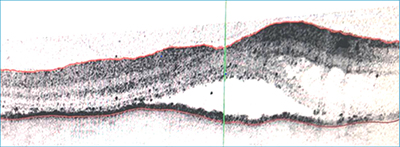
folyadék diffúz és cystoid makula
ödémával
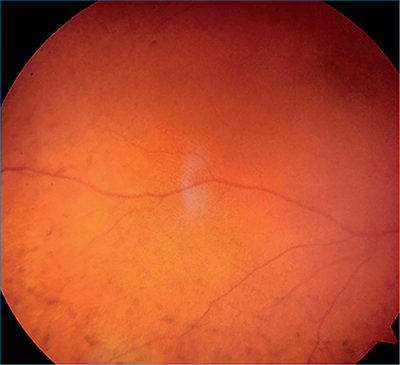
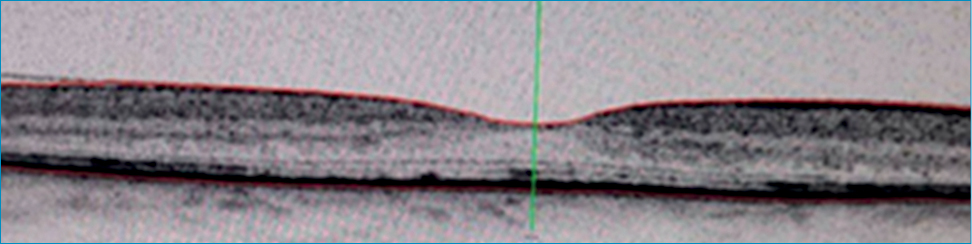
Atropin 1%, neosynephrin és tobramycin-dexamethason kombinációs szemcsepp alkalmazása mellett, per os acetazolamid-terápiát indítottunk. Ezzel párhuzamosan 3 alkalommal intravénásan 500 mg metilprednizolon-kezelést kapott, amelyet 64 mg orális metilprednizolon-terápiával folytattunk, csökkenő dózisban. A konzervatív terápia alkalmazása ellenére, a suprachorioideális folyadékgyülem nem csökkent, így bennfekvése 10. napján, elülsőcsarnok-rekonstrukciót végeztünk, majd a suprachorioideális térből a serosus folyadék nagyrészét lebocsátottuk a sclera megnyitását követően. A műtét végén az üvegtesti térbe C3F8 gázt injektáltunk. A kezelés hatására az effúzió a korai posztoperatív szakban megszűnt. Posztoperatív kezelésként lokálisan Atropin 1% és tobramycin-dexamethason kezelést alkalmaztunk csökkenő dózisban leépített orális kortikoszteroid-kezelés mellett. Három hónappal a műtétet követően a beteg intravitreális anti-VEGF-kezelésben részesült perzisztáló makulaödéma miatt. Az osztályos bennfekvést követő 10 hónapban a beteg állapota stabil volt az érintett szemen; normál szembelnyomás-értékek mellett, a legjobb korrigált látóélesség (BCVA) 1,0. Az érintett oldal fundusvizsgálata során leopárd mintázatú retinopathia vált láthatóvá (4. ábra). Az érhártya körben az alapján feküdt, a suprachorioideális térben folyadék nem volt látható és a foveoláris subretinalis folyadék felszívódott (5. ábra). Az effúzió első megjelenését követő 11. hónapban a betegség recidivált. Ismételt kivizsgálása során továbbra sem tudtunk az effúzió hátterében álló okot igazolni. Az idiopátiás effúziós szindróma, konzervatív terápia mellett, átmenetileg gyógyult.
Megbeszélés
Az uveális effúzió és azon belül az idiopátiás uveális effúziós szindróma egy ritka kórkép. A diagnózis felállítása kizárásos alapon történik, kezelése a betegség kialakulásának okától függ. Amennyiben gyógyszerindukált effúzióval állunk szemben, a gyógyszeres kezelés azonnali felfüggesztése javasolt. Gyulladásos eredet esetén, mint például uveitis, vasculitis, a betegség célzott kezelése szükséges. Amennyiben a betegség kialakulására hajlamosító tényezők állnak fenn, mint például egy nanophtalmusos szem, profilaktikus sclerotomia szükségessége merül fel filtrációs műtét előtt, megelőzve a hirtelen intraoperatív nyomáscsökkenést (34). Az uveális effúziók nagy része filtrációs műtétet követően alakul ki. Kisméretű elváltozás esetén obszerváció vagy konzervatív terápia (lokális szteroid szemcsepp, cycloplegikum, parabulbaris vagy szisztémás kortikoszteroid-kezelés) mellett gyógyulnak (33). A procedurális eljárások filtrációs műtétet követően a hipotónia megszűntetését célozzák, amely elérhető az elülső csarnok kohezív viszkoelasztikus anyaggal való feltöltésével, vagy SF6 gáz elülső csarnokba történő injektálásával. Amennyiben fájdalom, látásromlás, hipotóniás retinopathia vagy papillakárosodás látható, szükséges lehet a bleb vagy a nem szelepes implantátumok zárása és a suprachorioideális térben levő folyadék lebocsátása (37). Betegünk esetén a szisztémás státuszából a magas vérnyomás emelhető ki, mint az uveális effúzió rizikótényezője. Az uveális effúziós szindróma az érintett oldal szürkehályogműtétjét követően 8 héttel alakult ki. A szürkehályogműtét és az uveális effúzió kapcsolatát először O’Brien írta le 1935-ben. Tanulmánya szerint az uveális effúzió a műtétek 93%-ában jelentkezett, főleg intracapsularis műtétek kapcsán (20). Shah és munkatársai 500 extracapsularis beavatkozást követően 2,6%-os incidenciát találtak (26). A modern szürkehályog-sebészetben, ahol kis bemetszésen keresztül történik a beavatkozás és a műtét során az intraokuláris nyomás kontrollált módon változik, az uveális effúzió előfordulása nagymértékben csökkent (23). Sabti és munkatársai 207 szürkehályogműtéten átesett beteget vizsgáltak ultrahang B-scan segítségével az első posztoperatív napon és két héttel később. A betegek 5,8%-ában alakult ki chorioideális effúzió, amelyből egy volt klinikailag egyértelműen detektálható. Az effúzió kialakulása korrelált a seb dehiszcencia miatt kialakuló hipotóniával, illetve a műtét utáni acetazolamid- és pilokarpingél használattal. Előfordulása nem mutatott összefüggést az intraoperatív szövődményekkel és a phacoemulsifikáció időtartamával sem. Minden effúzió kisméretű volt és obszerváció mellett megszűnt. Ezen vizsgálat során a műtéteket a bemetszés alapján három csoportba sorolták, ami alapján a műtétek közel fele scleralis alagút seben keresztül történt. 92 esetben történt 3 mm-es clear cornealis seben, míg 7 esetben limbális behatolás történt, amelyet varrattal zártak (23). Manapság a szürkehályogműtétek egy része mikroincíziós (MICS) technikával, 2,2 mm alatti sebnagysággal készül, amely teoretikusan tovább csökkentheti a seb dehiszcencia miatti hipotónia kialakulási gyakoriságát, ezáltal a chorioideális effúzió rizikóját is. Mikroincíziós szürkehályogműtétet követően előforduló chorioidea-effúzióra vonatkozó incidenciaadatot a szakirodalomban jelenleg nem találtunk. Esetünkben az effúzió szövődménymentes szürkehályogműtétet követően 2 hónappal jelent meg, emiatt nem hoztuk összefüggésbe a műtéttel. Uyama és munkatársai (31) csoportosítása szerint betegünknél III-as típusú idiopátiás uveális effúziós szindrómát állapítottunk meg, amely esetén az elsősorban javasolt terápia a gyógyszeres kezelés, amelyre nincs egységes ajánlás a szakirodalomban. Shields és munkatársai tanulmánya szerint kortikoszteoridok használata minden kezelési mód (lokális, periokuláris, orális) (19) esetén előnyösebb volt, mint az obszerváció. A kezelt betegek 95%-a javulást mutatott a kezelés során és csak 5%-ban volt szükség műtéti ellátásra (28). Kisfokú effúzió esetén lokális, míg nagyobb kiterjedésűek esetén periokuláris és/vagy szisztémás kezelés megkezdése is szükséges. Ez a szakirodalmi adatok szerint alacsony-közepes dózist jelent (36), de Kanamato és Takamatsu a szteroidlökés-terápia sikeres alkalmazását is leírta uveális effúziós szindróma esetén (17). Topikális cycloplegikumok használata elősegíti a lencse-írisz diaphragma posterior rotációját. A prosztaglandin-analógok előnyeit Andrijevic Derk és munkatársai (1) mutatták be három uveális effúziós szindrómában szenvedő beteg esetében. A prosztaglandin-analógok fokozzák az ínhártya metalloproteináz enzim transzkripcióját és ezáltal csökken annak kollagén mennyisége, amely által fokozódik permeabilitása (32). Az acetazolamid csökkenti a csarnokvíz-termelést, és egy pumpamechanizmuson keresztül fokozza a retinalis pigmentepitheliumon keresztül a folyadék eltávolítását (1). Anti-VEGF-et kis esetszámú tanulmányok során használtak és előnyösnek találták, habár a pontos terápiás hatásmechanizmusa nem ismert. Egyik hipotézis erre vonatkozóan, hogy az emelkedett interleukin (IL)-6, IL-8 és VEGF- szintek miatt fokozódik az érpermeabilitás (11). Az uveális effúziós szindróma kezelése minden esetben folyamatos monitorizálást igényel, hogy elkerüljük a progressziót, amely makuláris érintettséghez vagy másodlagos zárt zugú glaukómához vezethet. Amennyiben egy előrehaladott effúzióval állunk szemben, illetve, ha a konzervatív kezelés nem bizonyul elégségesnek vagy makulaérintettség, fájdalom, perzisztáló szaruhártya-ödéma áll fenn, műtéti beavatkozás szükséges. Betegünk esetén lokális cycloplegicum és antibiotikummal kombinált kortikoszteroid-terápia mellett acetazolamid-kezelést, valamint a lökés szteroidterápiát indítottunk a további progresszió megakadályozása céljából. A szteroidterápia fokozatos csökkentése mellett nem volt javulás tapasztalható az effúzió mértékében, ezért műtéti ellátása történt, amely során az elülső csarnok rekonstrukciója mellett, a suprachorioideális térben levő folyadék lebocsátásra került és további hipotónia megelőző céllal az üvegtesti térbe C3F8 gáz injektálása történt. A beteg perzisztáló makulaödéma miatt egy alkalommal intravitreális bevacizumabkezelésben részesült. Az uveális effúziós szindróma sebészi ellátását tekintve Gass és munkatársai írták le a ma is leggyakrabban használt technikát, a részleges vagy teljes sclerectomiát egy sikertelen vortex véna dekompressziót követően (8). Ez egy 5×7 mm2-es nagyságú, a sclera vastagságának felét vagy 2/3-át elérő sclerectomia, 1-2 mm-rel az ekvátor előtt, amelyet egy 2 mm-es scleranyílás készítése követ. Ez a megoldás az esetek 83%-ában már egy és 96%-ban már két sclerotomia során csökkentette az effúziót uveális effúziós szindróma esetében (15). Ennek a technikának számos variánsát alkalmazzák a gyakorlatban. Uyama és munkatársai subscleralis sclerectomiát alkalmaztak, azonban a recidív vagy perzisztáló eseteikben további sclerectomiákra volt szükség (31). Mitomycin C (MMC) alkalmazását is előnyösnek találták a sclerectomia utáni fibrosis megelőzésében (29). Ghazi és munkatársai annyiban módosítottak a technikán, hogy a sclerotomia előtt, UH B-scan segítségével meghatározták hol a legvastagabb a sclera az effúzió területén és ott végezték az eljárást (9). Ez a módszer olyan esetekben is sikeresnek bizonyult, amelyeknél a konvencionális sebészi ellátás sikertelen volt. A legújabb ígéretesnek tűnő eljárás a Yepez és munkatársai által leírt Ex-Press sönt beültetése, amelynek hatására az effúzió a műtétet követő 48 órán belül megszűnt és nem alakult ki ismét a nyomonkövetés 1-2 éves periódusa alatt (35). A vitrectomia szerepe nem tisztázott idiopátiás effúziós szindróma esetén nanopthalmusos szemeknél. Claesy és munkatársai sikeresen kezeltek több uveális effúziós szindrómás esetet vitrectomiával, amely során superotemporalis sclerostomiát vagy sclerectomiát is végeztek a suprachorioideális folyadék lebocsátása céljából. Ezekre a műtétekre látást veszélyeztető, retinaleválással kísért chorioideális effúzió esetén került sor, amelyet követően az effúzió gyors javulása volt tapasztalható (4). Okhita és munkatársai esettanulmányai szerint a nem-nanopthalmusos esetekben előnyös lehet a vitrectomia elvégzése, azonban nanophthalmus esetén megelőző sclerostomia szükséges (21).
Következtetés
A chorioideális effúzió etiológiája sokrétű, azonban leggyakrabban filtrációs műtétek szövődményeként találkozhatunk vele. A legtöbb chorioideális effúzió konzervatív kezeléssel kezelhető, amely lokális cycloplegikum, és szteroid gyulladáscsökkentő, illetve szisztémás szteroid és acetazolamid-kezelést jelent. Különösen nagy vagy tartósan fennálló effúzió esetében, sebészeti beavatkozásra is szükség lehet a látás megőrzése céljából. A kórkép diagnosztizálása során számos szemészeti és szisztémás etiológiai ok vizsgálata szükséges. Ellátása személyre szabottan, a kiváltó ok figyelembevételével történik, szem előtt tartva a látásfunkció megmentésének időbeni korlátait.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Andrijević Derk B, Benčić G, Corluka V, Zorić Geber M, Vatavuk Z. Medical therapy for uveal effusion syndrome. Eye (Lond) 2014; 28: 1028–1031.
https://doi.org/10.1038/eye.2014.126
2. Banta JT, Hoffman K, Budenz DL, Ceballos E, Greenfield DS. Presumed topiramate-induced bilateral acute angle-closure glaucoma. Am J Ophthalmol 2001; 132: 112–114. https://doi.org/10.1016/s0002-9394(01)01013-3
3. Callahan C, Ayyala RS. Hypotony and choroidal effusion induced by topical timolol and dorzolamide in patients with previous glaucoma drainage device implantation. Ophthalmic Surg Lasers Imaging 2003; 34: 467–469. PMID: 14620750.
4. Claeys E, Stalmans P, Van Calster J, Casteels I, Stalmans I, Vandewalle E. A Retrospective Case Series of Uveal Effusion Syndrome. J Glaucoma 2020; 29: 995–998. https://doi.org/10.1097/IJG.0000000000001606
5. Forrester JV, Lee WR, Kerr PR, Dua HS. The uveal effusion syndrome and trans-scleral flow. Eye (Lond) 1990; 4: 354–365. https://doi.org/10.1038/eye.1990.48
6. Gao Y, Wu Q, Xu J, Tian Q, Xie X, Du X, Bi H. Management and follow-up of uveal effusion syndrome: a case report. BMC Ophthalmol 2023; 23: 355.
https://doi.org/10.1186/s12886-023-03078-x
7. Gass JDM, Jallow S. Idiopathic serous detachment of the choroid, ciliary body, and retina (uveal effusion syndrome). Ophthalmology 1982; 89: 1018–1032.
https://doi.org/10.1016/s0161-6420(82)34685-0
8. Gass JDM. Uveal effusion syndrome: a new hypothesis concerning pathogenesis and technique of surgical treatment. Retina 1983; 3: 159–163. PMID: 6635350.
9. Ghazi NG, Richards CP, Abazari A. A modified ultrasound-guided surgical technique for the management of the uveal effusion syndrome in patients with normal axial length and scleral thickness. Retina 2013; 33: 1211–1219. https://doi.org/10.1097/IAE.0b013e3182790eb8
10. Green RL, Byrne SF. Diagnostic ophthalmic ultrasound In: Ryan SJ, editor. Retina. St. Louis: Mosby; 1989.
11. Guo J, Cao X, Li X. Partial thickness sclerectomy and intravitreal anti-VEGF therapy for intractable uveal effusion syndrome. Int Ophthalmol 2019; 39: 1885–1890. https://doi.org/10.1007/s10792-018-0992-1
12. Haga A, Inatani M, Shobayashi K, Kojima S, Inoue T, Tanihara H. Risk factors for choroidal detachment after trabeculectomy with mitomycin C. Clin Ophthalmol 2013;7: 1417–1421. https://doi.org/10.2147/OPTH.S46375
13. Inomata H, Bill A, Smelser GK. Unconventional routes of aqueous humor outflow in Cynomolgus monkey (Macaca irus). Am J Ophthalmol 1972; 73: 893–907.
https://doi.org/10.1016/0002-9394(72)90459-x
14. Iwasaki K, Kakimoto H, Arimura S, Takamura Y, Inatani M. Prospective cohort study of risk factors for choroidal detachment after trabeculectomy. Int Ophthalmol 2020; 40: 1077–1083. https://doi.org/ 10.1007/s10792-019-01267-6
15. Johnson MW, Gass JDM. Surgical management of the idiopathic uveal effusion syndrome. Ophthalmology 1990; 97: 778–785.
https://doi.org/10.1016/s0161-6420(90)32511-3
16. Johnson MW. Uveal Effusion. In: Guyer DR, Yannuzzi LA, Chang S, et al, editors. Retina–vitreous–macula. Philadelphia: W.B. Saunders; 1999. p. 658–668.
17. Kanamoto T, Takamatsu M. Systemic steroid-pulse therapy in a patient with idiopathic choroidal detachment: a case report. Case Rep Ophthalmol 2012; 3: 65–70. https://doi.org/10.1159/000336566
18. Moses RA. Detachment of ciliary body-anatomical and physical considerations. Invest Ophthalmol 1965; 4: 935–41. PMID: 5831996.
19. Nilforushan N, Abolfathzadeh N, Najafzadeh F, Samimifar D. Subtenon triamcinolone injection to treat serous choroidal detachment after glaucoma surgery: A case series. Eur J Ophthalmol 2023; 33: 319–323.
https://doi.org/10.1177/11206721221108253
20. O'brien CS. Further Observations on Detachment of the Choroid After Cataract Extraction. Trans Am Ophthalmol Soc 1936; 34: 170–4. PMID: 16693087.
21. Ohkita T, Emi K, Toyoda E, Ueno C, Sawada K, Sawada K, Matsumura N, Morita S, Kashimoto D, Oyagi T, Ikeda T. [Efficacy of vitreous surgery for uveal effusion syndrome]. Nippon Ganka Gakkai Zasshi 2008; 112: 472–475. PMID: 18517008.
22. Peng X. Diagnosis and treatment of uveal effusion syndrome. Chin Ophthalmic Res 2005; 23(3): 327–329.
23. Sabti K, Lindley SK, Mansour M, Discepola M. Uveal effusion after cataract surgery: an echographic study. Ophthalmology 2001; 108: 100–103.
https://doi.org/10.1016/s0161-6420(00)00414-0
24. Sakai H, Sakima N, Nakamura Y, Nakamura Y, Hayakawa K, Sawaguchi S. Ciliochoroidal effusion induced by topical latanoprost in a patient with sturge-weber syndrome. Jpn J Ophthalmol 2002; 46: 553–555. https://doi.org/10.1016/s0021-5155(02)00542-7
25. Schepens CL, Brockhurst RJ. Uveal effusion. I. Clinical picture. Arch Ophthalmol 1963; 70: 189–201. https://doi.org/10.1001/archopht.1963.00960050191010
26. Shah RR. Flat anterior chamber and choroidal detachment in aphakia. Study of 500 cataract extractions. Br J Ophthalmol 1971; 55: 48–49.
https://doi.org/10.1136/bjo.55.1.48
27. Sharma R, Foot B, Jackson TL. A prospective, population-based, surveillance (BOSU) study of uveal effusion syndrome in the UK. Eur J Ophthalmol 2021; 31: 2451–2456. https://doi.org/10.1177/1120672120969369
28. Shields CL, Roelofs K, Di Nicola M, Sioufi K, Mashayekhi A, Shields JA. Uveal effusion syndrome in 104 eyes: Response to corticosteroids – The 2017 Axel C. Hansen lecture. Indian J Ophthalmol 2017; 65: 1093–1104. https://doi.org/10.4103/ijo.IJO_752_17
29. Suzuki Y, Nishina S, Azuma N. Scleral window surgery and topical mitomycin C for nanophthalmic uveal effusion complicated by renal failure: case report. Graefes Arch Clin Exp Ophthalmol 2007; 245: 755–757. https://doi.org/10.1007/s00417-006-0403-6
30. Toris CB, Pederson JE, Tsuboi S, Gregerson DS, Rice TJ. Extravascular albumin concentration of the uvea. Invest Ophthalmol Vis Sci. 1990; 31: 43–53. PMID: 2298542.
31. Uyama M, Takahashi K, Kozaki J, Tagami N, Takada Y, Ohkuma H, Matsunaga H, Kimoto T, Nishimura T. Uveal effusion syndrome: clinical features, surgical treatment, histologic examination of the sclera, and pathophysiology. Ophthalmology 2000; 107: 441–449. https://doi.org/10.1016/s0161-6420(99)00141-4
32. Weinreb RN. Enhancement of scleral macromolecular permeability with prostaglandins. Trans Am Ophthalmol Soc 2001; 99: 319–343. PMID: 11797317.
33. Williams KJ, Scholle T, Leung EH. Management of Serous and Hemorrhagic Choroidal Detachments and Complications. Int Ophthalmol Clin 2022; 62: 119–130. https://doi.org/10.1097/IIO.0000000000000436
34. Wu W, Dawson DG, Sugar A, Elner SG, Meyer KA, McKey JB, Moroi SE. Cataract surgery in patients with nanophthalmos: results and complications. J Cataract Refract Surg 2004; 30: 584–590. https://doi.org/10.1016/j.jcrs.2003.07.009
35. Yepez JB, Fernando AJ. Ex-PRESS shunt for choroidal fluid drainage in uveal effusion syndrome type 2: a potentially novel technique. JAMA Ophthalmol 2015; 133: 470–471. https://doi.org/10.1001/jamaophthalmol.2014.5913
36. Ying S and Panarelli JP. Management of Choroidal Effusions. touchREVIEWS in Ophthalmology 2024; 18: 14–17. https: //doi.org/10.17925/USOR.2024.18.1.4.
37. Ying S, Sidoti PA, Panarelli JF. Risk factors and management of choroidal effusions. Curr Opin Ophthalmol 2023; 34: 162–167.
https://doi.org/10.1097/ICU.0000000000000929
