Characteristics of diabetic macular oedema, modern treatment options and the state of care in Hungary
doi: 10.55342/szemhungarica.2023.160.4.168
Review
Summary
Diabetes mellitus (DM) has become one of the most significant public health challenges of our time. Diabetic macular oedema (DMO) is a common microvascular complication of the disease, causing drastic and often irreversible visual impairment, severely affecting the quality of life of a considerable proportion of patients. Worldwide, DMO is one of the most common causes of severe visual impairment in working-age adults (20-65 years). With the use of highly effective intravitreal vascular endothelial growth factor (VEGF) inhibitors, vision loss can be avoided and, in addition, vision improvement can be expected in a significant patient population. Based on international guidelines and clinical trials, high potency VEGF inhibitors are currently the first-line treatment for macular oedema causing central visual loss. In Hungary, access to the most effective, state-of-the-art treatments is limited in this therapeutic area. The aim of this article is to detail the main features of DMO disease, the current status and challenges of disease management in Hungary, highlighting the need for wider access to highly effective anti-VEGF therapies for DMO patients.
Összefoglaló
A diabetes mellitus (DM) korunk egyik legjelentősebb közegészségügyi kihívásává nőtte ki magát. A betegség egyik gyakori mikrovaszkuláris szövődménye a diabéteszes makulaödéma (DMO), amely drasztikus és gyakran visszafordíthatatlan látásromlást okoz, és a betegek jelentős részének életminőségét súlyosan befolyásolja. Világszerte a munkaképes (20–65 éves) felnőttek körében a DMO a súlyos látásromlás egyik leggyakoribb oka. A nagy hatékonyságú intravitreális vaszkuláris endotheliális növekedési faktor (VEGF)-gátlók alkalmazásával a látásvesztés elkerülhető, és ezen túlmenően látásjavulás is várható egy jelentős betegpopuláció esetében. A nemzetközi irányelvek és klinikai vizsgálatok alapján a centrális látásromlást okozó makulaödéma elsődleges kezelését jelenleg a nagy hatékonyságú VEGF-gátlók jelentik. Hazánkban ezen a terápiás területen a leghatékonyabb, korszerű kezelésekhez a hozzáférés korlátozott. Közleményünk célja, hogy részletezze a DMO-betegség fő jellemzőit, a betegség kezelésének jelenlegi helyzetét és kihívásait Magyarországon, kiemelve a DMO-betegek számára a nagy hatékonyságú anti-VEGF-terápiák szélesebb körű hozzáférésének szükségességét.Keywords
diabetic macular oedema, DMO, intravitreal anti-VEGF, Hungarian standard of care
Kulcsszavak
diabéteszes makulaödéma, DMO, intravitreális anti-VEGF, magyarországi ellátás
Bevezetés
A diabétesz okozta szemészeti szövődmények prevalenciája
Világszerte mintegy 537 millió embert érint a cukorbetegség (1), és ez a szám folyamatosan növekszik, 2035-re az előrejelzések szerint 600 millió embert érint majd a diabetes mellitus (2). Világszerte a cukorbetegek egyharmadának van valamilyen fokú diabéteszes retinopátiája (2–10), és a diabéteszes retinopátia felelős a vakság 1,0-4,8%-áért világszerte (11). Több mint 21 millió beteget érint a diabéteszes makulaödéma (7, 10, 11). Azoknál a betegeknél, akiknek a cukorbetegsége már több mint 20 éve tart, ötször nagyobb valószínűséggel alakul ki DME, mint azoknál, akiknek a cukorbetegsége <10 éve tart (11). A cukorbetegség okozta látásvesztés és vakság 90%-a megelőzhető lenne rendszeres szemészeti szűréssel (12) és időben történő szemészeti ellátással (1, 6, 7, 9, 13, 14).
A DMO kialakulásának kockázati tényezői közé tartozik a hosszabb ideje fennálló diabetes mellitus (DM), a nem megfelelő DM-kontroll, emelkedett hemoglobin-A1c (HbA1c) szintekkel, magas vérnyomás és hyperlipidaemia (emelkedett összkoleszterin- és trigliceridszint) (6, 7, 8, 11, 13–25). Egyéb másodlagos kockázati tényezők közé tartozik a diabéteszes nefropátia (károsodott vesefunkció), a tiazolidindionok alkalmazása, az elhízás, a vérszegénység, illetve különböző szisztémás gyulladás és endothel-diszfunkció markerek (6, 7, 8, 11, 13–25). Ezért, e szisztémás kockázati tényezők jó kontrollja a cukorbetegség okozta szemészeti szövődmények megelőzésének és kezelésének elsődleges módszere.
A diabétesz leggyakoribb szemészeti szövődményei és következményei
A diabétesz jelentős közegészségügyi kihívást jelent, különösen a szemészeti szövődmények kialakulásához járul hozzá (3, 9, 13, 14, 26, 27, 28, 29, 30). A leggyakoribb szemészeti eltérés a diabéteszes retinopátia (DR), egy mikrovaszkuláris szövődmény, amely két fő stádiumban jelentkezik: a nem-proliferatív, amelyet vérzés és vaszkuláris szivárgás jellemez, és a proliferatív, amelyet rendellenes neovaszkularizáció különböztet meg (10, 11, 13, 30, 31, 32). A retina érrendszerének ebből következő strukturális és funkcionális változásai hozzájárulnak a látásromláshoz (10, 11, 30).
A diabéteszes retinopátia kritikus és látást veszélyeztető szövődménye a diabéteszes makulaödéma (DMO) (10, 11, 13, 30, 31, 32). A DMO az extracelluláris folyadék felhalmozódását jelenti a makulában, ami a retina megvastagodását és funkcionális romlását idézi elő. Ennek következtében a DMO-ban szenvedő betegek gyakran torz vagy csökkent központi látást tapasztalnak, ami visszafordíthatatlan látásromláshoz és jogi értelemben vett vaksághoz is vezethet (1, 7, 10, 27, 30, 33). Ez a kór a diabéteszes populáció jelentős részét érinti, és világszerte a vakság vezető oka a munkaképes korú felnőttek (20–65 évesek) körében. A betegség incidenciájának növekedése jelentős aggodalomra ad okot, mivel egyre nagyobb közegészségügyi kihívást jelent (2, 7, 10, 11, 16, 17, 20, 22, 27, 33).
Diagnózis
A diabéteszes makulaödéma (DMO) a diabéteszes retinopátia egyik megnyilvánulása, amely a betegség különböző stádiumaiban fordulhat elő. Minél korábban diagnosztizáljuk, annál jobb esélyünk van a beteg kezelésére, és annál nagyobb az esélye, hogy megőrizze látását.
Képalkotó diagnosztika
A DMO kezdeti diagnosztikai lépése a tágított pupilla mellett végzett hátsó pólus réslámpás biomikroszkópos vizsgálata. A biomikroszkópos vizsgálat során makulavastagság, exsudátumok és cisztoid elváltozások azonosíthatók (7, 13, 33, 34, 35). A fundus fluoreszcein-angiográfia (FA, vagy FLAG) a retina kapilláris szivárgásának területeit mutathatja ki, az optikai koherenciatomográfia (OCT) pedig lehetővé teszi a retina metszeti képének megjelenítését. Az OCT jelentősen javította, és ma már nélkülözhetetlen a makula strukturális változásainak minőségi és mennyiségi értékelését (7, 13, 33, 34, 35, 36). Bár a DMO kiindulási diagnózisa továbbra is a réslámpás biomikroszkópia, az OCT döntő szerepet játszik a DMO részletes korai diagnózisában, kezelésében és folyamatos nyomon követésében (13, 35, 37). Az OCT kifejlesztése megváltoztatta a szemészet klinikai gyakorlatát, lehetővé téve egy új, noninvazív orvosi képalkotó vizsgálatot a retina betegségeinek diagnosztizálására. A DME klinikai kezelési stratégiája általában az OCT-képalkotás értelmezése alapján készül, és a terápia OCT-vezérelt, a retina szárazsága alapján (13, 38, 39, 40). Újabban, az OCT új kiterjesztéseként az optikai koherenciatomográfiás angiográfia (OCTA) fejlődött ki, amely nem invazív, mélységfelbontású képeket készít a retina mikrovaszkulatúrájáról (41, 42). Ez lehetővé teszi a DR és a DME különböző jellemzőinek kimutatását, beleértve a felszíni (SCP) és mély kapilláris plexusok (DCP) érsűrűségét (VD), a foveális avaszkuláris zóna (FAZ) méretét és a retina nonperfúziójának mértékét (43). Ez a technológia sok beteg esetében kiváltotta az invazív fluoreszcén-angiográfiát, és hozzájárult a különböző retinabetegségek pontosabb, nem invazív diagnózisához és monitorozásához is (41, 42, 43).
DMO osztályozása és klinikai értékelése
A makulaödéma súlyosságának értékelésére a „klinikailag jelentős makulaödéma” (CSME) kifejezést használják. Az Early Treatment Diabetic Retinopathy Study (ETDRS) (36) skála szerint diabéteszes makulaödéma akkor áll fenn, ha a hátsó pólusban retinális megvastagodás vagy kemény exudátum található. A CSME a következő feltételek mellett tekinthető jelenlévőnek:
- retinamegvastagodás a makula középpontjánál vagy annak 500 µm-es körzetében;
- vagy kemény exsudátum a makula középpontjánál vagy annak 500 μm-es körzetében, a szomszédos retina megvastagodásával együtt;
- vagy egy papilla területű vagy annál nagyobb retinamegvastagodási zónák, amelyek bármely része a makula középpontjától egy papillaátmérőn belül van, biomikroszkópiával megfigyelve (7, 33, 34, 35, 36).
Nemzetközi szakértők a betegség súlyosságára összpontosító egyszerűsített stádiumbeosztási rendszert javasoltak [International Clinical Diabetic Retinopathy Disease Severity Scale (34) és a SAVE (35) osztályozási protokoll], amely a DMO-t a retina érintettségének mértéke alapján enyhe, közepes és súlyos kategóriákba sorolja. A klinikai gyakorlatban azonban általában egy egyszerűsített, módosított terminológiát használnak, amely a fokális (körülírt) vagy diffúz (nem körülírt, elszórt vérzések) diabéteszes makulaödéma miatt kialakuló retinavastagság megkülönböztetésére összpontosít, amelyeket a fluoreszcein angiográfiában (FA) látható szivárgási mintázat határoz meg (5, 13, 35, 36, 44, 45, 46). Mindkét típusnál előfordulhat exsudátum, és a kettő megkülönböztetése gyakran nem egyértelmű, ezért a leghatékonyabb kezelési döntések meghozatala is összetett (13).
Jelenlegi terápiás megközelítések
A DMO kezelésének szisztémás megközelítése
A DMO kezelése a szisztémás betegség kezelésével kezdődik. A hyperglykaemia, a magas vérnyomás és a hyperlipidaemia szigorú szabályozása (7% alatti HbA1c, tartós 140 Hgmm alatti szisztolés vérnyomásérték) és kezelése késleltetheti a különböző mikrovaszkulopátiák, köztük a DR és a DMO kialakulását és progresszióját (7, 10, 11, 13, 14, 15, 16, 17, 18, 20, 21, 22, 30, 47, 48, 49).
Számos tanulmány [ACCORD (8), DCCT/EDIC (6), UKPDS (23), DIRECT-Protect (24), EURODIAB (25)] tanulmány alátámasztja azt a bizonyítékot, hogy ezek a kockázati tényezők a DMO kialakulásának kulcstényezői; mindazonáltal a normális glikémiás szintek megtartása nem garantálja, hogy a betegség nem fog előrehaladni (6–8, 10, 11, 13–18, 20, 22–25, 47, 48). Továbbra is kétséges a szisztémás biomarkerek ellenőrzésére gyakorolt ok-okozati hatás mértéke, és ezek prognosztikai markerként való tekintése a betegek jobb kimenetele érdekében mind a látási, mind az anatómiai mutatók esetében. (10, 14, 16, 47).
A DMO szemészeti kezelési lehetőségei
A DMO kezelési lehetőségei közé tartozik a fokális/grid lézeres fotokoaguláció, a kortikoszteroidok, a vitrectomia, az enzimatikus vitreolízis, a nem szteroid gyulladáscsökkentők (NSAID), triamcinolon, dexamethason, fluocinolon acetonid és az intravitreális vaszkuláris endothelnövekedési faktor (VEGF)- gátló terápiák, amelyek használatára a betegség súlyosságától és a beteg kiindulási látásélességétől (VA) függően kerül sor (7, 13, 27, 28, 33, 49, 50, 51, 52, 53). A DRCR.net tanulmányai [I. protokoll (54), T. protokoll (48), és U. protokoll (55)], és több nemzetközi irányelv [EURETINA (56), Asian Consensus Guideline (19), AAO (57), UK Consensus (58), ASRS (39) IDF (40)] alapján azonban a szemészek általánosságban az anti-VEGF intravitreális terápiát fogadják el elsővonalbeli kezelésként.
A DMO korszerű kezelése anti-VEGF-gátló szerekkel
Az aktuális terápiás megközelítések elsősorban a vaszkuláris endothelnövekedési faktor (VEGF) elleni szerek intravitreális injekcióit foglalják magukba, beleértve a ranibizumabot, az afliberceptet, a brolucizumabot, a faricimabot és off-label bevacizumabot is (1. táblázat) (28, 50, 52, 53, 59–82). Ezek a szerek a VEGF, az angiogenezis és az érrendszeri áteresztőképesség elősegítésében kulcsfontosságú fehérje gátlásával működnek, amely a DMO-ben szenvedő betegeknél emelkedett az egészséges szemekhez képest (13, 64). A szabályozatlan VEGF-aktivitás patológiás következményei, mint például a neovaszkularizáció és folyadékfelhalmozódás, hatékonyan kezelhetők ezen anti-VEGF-szerek célzott hatásával (64, 67, 71, 72, 73, 74, 75, 76, 77, 78, 79).
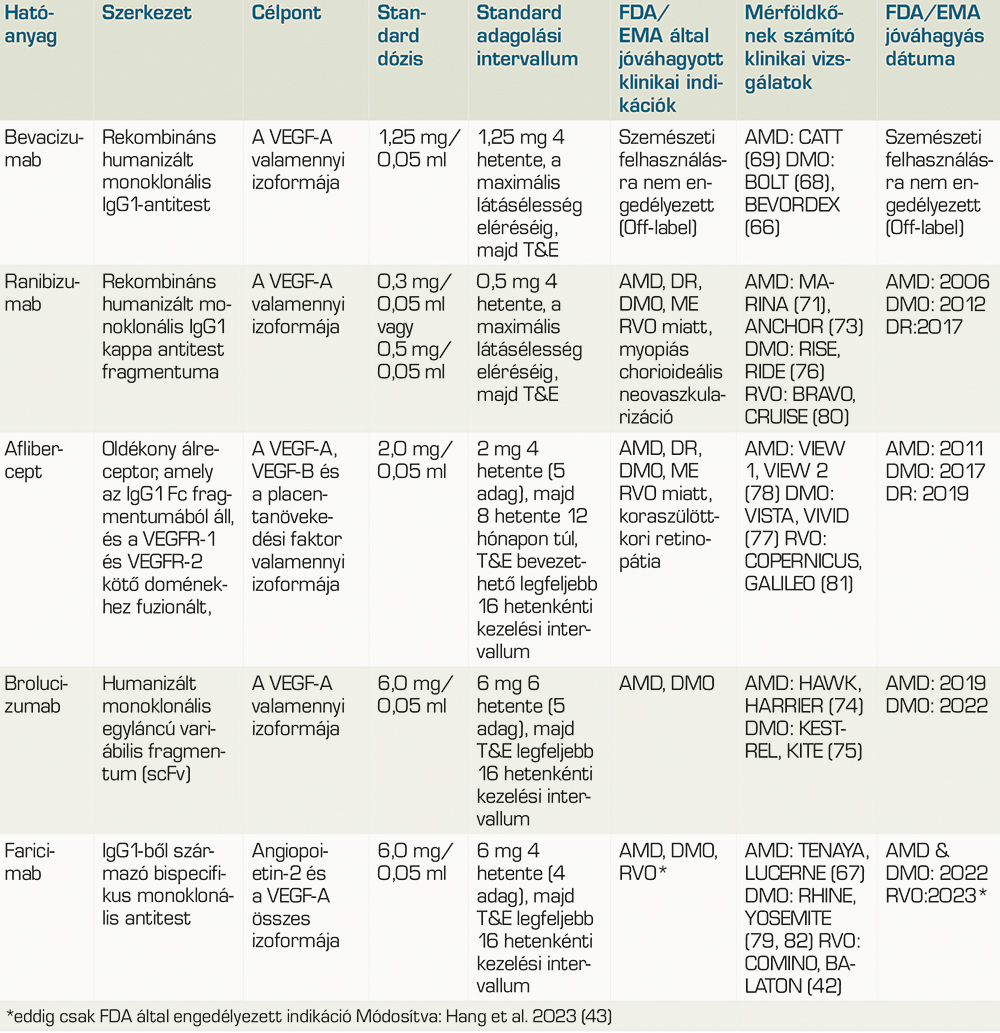
Bevacizumab (off-label/indikáción kívüli kezelési forma)
A bevacizumab egy humanizált rekombináns monoklonális antitest, ami a VEGF-A összes izomerjét gátolja (65, 66, 68–71, 73, 83, 84). A bevacizumabot 2004-ben engedélyeztek intravénás alkalmazásra vastagbélrák kezelésére, amelyet további szolid tumor indikációk követtek. A BOLT-tanulmány (Bevacizumab or Laser Therapy) (68) kimutatta, hogy 2 év alatt, 6 hetente alkalmazott (1,25 mg) intravitreális bevacizumabkezeléssel látásjavuláshoz vezetett az akkori goldstandard lézerkezeléssel szemben. A második év végére, a bevacizumabbal kezelt betekeg 8,6 EDTRS betűjavulást mutattak, míg a lézerrel kezelt betegeknél a látásélességük 0,5 betűvel romlott (68). A törzskönyvezett anti-VEGF szerekhez hasonlítva, a bevacizumab alacsonyabb költségű, off-label anti-VEGF-A molekula (48, 69, 72).
Ranibizumab
A ranibizumab egy humanizált monoklonális antitestfragmentum, amelyet Escherichia coli sejtekben rekombináns DNS-technológiával állítanak elő. Hatásmechanizmusa szelektíven gátolja a VEGF-A valamennyi aktív izoformáját (71, 73, 76, 80). A ranibizumab az első törzskönyvezett terápiás szer a DMO-indikációban, és hazánkban is engedélyezett. Klinikai hatékonyságát a RISE- és a RIDE-vizsgálat igazolta (76), amelyek összehasonlították a havi intravitreális ranibizumab (0,5 vagy 0,3 mg) vagy az álinjekciókat, külön betegcsoportokban. A ranibizumabbal kezelt betegek látásélessége a 3 éves vizsgálat végéig javult. A 36. hónapra a kiindulási értékhez képest ≥15 EDTRS-betűt javuló látásélességű betegek aránya az álkezelés/0,5 mg, 0,3 mg és 0,5 mg ranibizumabrecsoportban 19,2%, 36,8% és 40,2% volt a RIDE-ban, illetve 22,0%, 51,2% és 41,6% a RISE-ban (76).
2012-ig a lézeres kezelés volt a DMO kezelésének aranystandardja. A ranibizumab monoterápiával vagy lézeres fotokoagulációval kombinált, személyre szabott „szükség szerinti” terápia a Protocol I (85) szerinti vizsgálatban jobbnak bizonyult a lézeres monoterápiánál, ami forradalmasította a DMO kezelési protokollját (10, 13, 47, 85).
Aflibercept
Az aflibercept egy fúziós fehérje, amely a humán VEGF-receptor 1 és 2 extracelluláris domének humán IgG1 Fc részéhez fuzionált részeiből áll, és amelyet kínai hörcsög petefészek (CHO) K1-sejtekben állítanak elő rekombináns DNS-technológiával. Az aflibercept egy szolubilis álreceptor, amely nagy affinitással köti a VEGF-A-t, a VEGF-B-t és a placenta növekedési faktort (PIGF) (77, 78, 81, 86, 87). Az aflibercept Magyarországon is törzskönyvezett a diabéteszes makulaödéma kezelésére.
A DMO-ban végzett pivotális klinikai vizsgálatok, a VIVID és a VISTA (77) kimutatták az aflibercept hatékonyságát a DMO kezelésében. Az összehasonlított kezelési csoportok a 4 vagy 8 heti adagolási időközönként beadott 2,0 mg afliberceptet és a lézerterápiát foglalták magukban. Az átlagos BCVA-gyarapodás a kiindulási értéktől a 148. hétig a 4 hetente, 8 hetente adagolt aflibercept és a lézerkontroll esetén 10,4, 10,5 és 1,4 betű volt a VISTA-ban, illetve 10,3, 11,7 és 1,6 betű a VIVID-ben. A 148. héten a kiindulási értékhez képest ≥15 betűt nyert szemek aránya 42,9%, 35,8% és 13,6% volt a VISTA-ban, illetve 41,2%, 42,2% és 18,9% a VIVID-ben (77).
Brolucizumab
A brolucizumab egy humanizált monoklonális egyláncú Fv (scFv) antitestfragmentum, amelyet Escherichia coli sejtekben rekombináns DNS-technológiával állítanak elő, ahogy a ranibizumabot is (62, 74, 75). A brolucizumab a VEGF-A valamennyi izoformáját célozza, és az összes anti-VEGF közül a legkisebb molekula (26 kDa). A III. fázisú KESTREL- és KITE-eredmények azt mutatták, hogy a 6,0 mg brolucizumab kezelés DMO-s betegeknél nem rosszabb (non-inferior) a 8 hetenkénti 2,0 mg afliberceptkezelésnél a BCVA átlagos javulása tekintetében (+8,8 BCVA-betű a brolucizumab csoportban és +10,6 az afliberceptcsoportban a KESTREL-ben; +10,9 és +8,4 KITE-ban). Több betegnél volt a CST <280 μm perzisztens makulafolyadék nélkül, és a brolucizumabbal kezelt betegek 32,9%-a (KESTREL) és 47,5%-a (KITE) két év múlva is megőrizte látás- és anatómiai javulását a 12 hetenkénti és 12/16 hetenkénti adagolási intervallumon (75). A brolucizumab is törzskönyvezett a DMO kezelésére hazánkban.
Faricimab
A faricimab egy humanizált antitest, amelyet emlősök kínai hörcsög petefészek (CHO) sejtkultúrájában állítanak elő rekombináns DNS-technológiával, hasonlóan az aflibercepthez. Két különböző útvonal gátlásán keresztül hat, az angiopoietin-2 (Ang-2) és VEGF-A semlegesítésével (88–93). Ez a kettős útvonal-gátlás a vaszkuláris stabilitás elősegítésében és a gyulladás csökkentésében játszik szerepet a makulán belül (67, 79, 89, 91, 92, 94).
A III. fázisú YOSEMITE és RHINE non-inferiority vizsgálatokban a faricimabot aflibercept-tel hasonlították össze DMO-ben szenvedő betegeknél (79). A heti 8 és legfeljebb 16 heti személyre szabott kezelési időközönként (PTI) alkalmazott faricimabot (6,0 mg) a 8 hetente adagolt 2,0 mg aflibercepthez hasonlították. Az 1 év alatt elért látásjavulás a 2. évben is megmaradt; az átlagos BCVA-változás a kiindulási értékhez képest 2 év alatt a 8 hetente adott faricimabkezelés (+10,7 és +10,9 EDTRS-betű a YOSEMITE- és a RHINE-vizsgálatokban), illetve akár 16 hetente adott faricimab PTI esetén (+10,7 és +10,1 ETDRS-betű) összehasonlítható maradt a 8 hetente adagolt aflibercepthez képest (+11,4 és +9,4 ETDRS-betű). A faricimab PTI-karban a látás tartós javulása fennmaradt a hosszabb adagolási intervallumok mellett, a betegek >60%-a 16 hetenkénti, közel 80%-a betegeknek pedig ≥12 hetenkénti adagolási gyakorisággal a 96. héten (93). A faricimab Magyarországon is törzskönyvezett a diabéteszes makulaödéma kezelésére.
Terápiás döntéshozatali kritériumok – Anti-VEGF-terápiák összehasonlítása
Jelenleg nincsenek meghatározott kritériumok az anti-VEGF-szerek kiválasztására. A döntéseket a rendszeres és helyi szemészeti szövődmények kockázatainak, terápia refrakter (kezelésre rosszul reagáló) vagy nem ideális válasz kiértékelése, valamint a kezelések terheinek figyelembevételével kell meghozni (7, 13, 28, 31, 33, 47, 49, 51–53). A terápia választásakor kiemelkedően fontos a fovea érintettségének értékelése. A diabéteszes makulaödéma fennállási idejének (frissen kialakult/krónikus) figyelembevétele is lényeges lehet a terápiás döntéshozatal során (13, 37, 49, 84, 95, 96). Az anti-VEGF-terápiák kiválasztását illetően az olyan szempontok, mint a hatékonyság, a tartósság és a biztonságosság fontosak a kezelési lehetőségek összehasonlításához, vagy legalábbis azok közötti mérlegeléshez.
Hatékonyság és biztonságosság
A különböző anti-VEGF-gyógyszerek hatékonyságát és biztonságosságát vizsgáló Protokol T (48) vizsgálatban megfigyelték, hogy a kezdeti látásélesség csökkenést észlelő betegek (20/30-20/40-es kiindulási legjobban korrigált látásélességgel [BCVA] rendelkező szemek) esetében az aflibercept, a bevacizumab és a ranibizumab között nincs jelentős különbség a látási eredményekben (48, 72, 97). A közepes vagy súlyos látásvesztés (20/50 vagy annál rosszabb BCVA-val rendelkező szemek) esetében azonban az aflibercept a 2 éves követésig jobb látásélesség-eredményt mutat, mint a bevacizumab. A látásélesség átlagos változása +18,1 betűpont az afliberceptkezeléssel kezelt csoportban és +13,3 betűpont a bevacizumabbal kezelt csoportban (48, 72, 97). Mindhárom gyógyszer összehasonlítható szemészeti és szisztémás biztonsági profillal rendelkezett, minimális biztonsági kockázattal. Valamennyi sarkalatos vizsgálat (60, 61, 62, 67, 69, 71, 73–80, 85, 86, 95, 97, 98) részletesen bemutatta az intraokuláris gyulladás (IOI), a fertőzés, beleértve az endophthalmitist és az uveitist, valamint a súlyos mellékhatások, köztük a retinavéna elzáródása, a retina leválása vagy a retinavasculitis alacsony arányát. E szerek biztonságosságát a forgalomba hozatalt követő időszakban folyamatosan figyelemmel kísérik, és a súlyos mellékhatások eseteit általában klinikai esettanulmányokon keresztül vannak közzétéve (48, 95).
Ezt a tanulmányt 2016-ban publikálták, ezért a brolucizumab és a faricimab nem szerepelt az összehasonlításban. Mindkét gyógyszer az aflibercepthez képest előnyként számol be a hosszabb tartósságról (28, 52, 53, 75, 79), a pivotal vizsgálatok szerint az aflibercepthez képest jobb szárító hatással is rendelkeznek (75, 79). Mindkét gyógyszer jól tolerálható volt, és az összehasonlító aflibercepthez hasonló biztonsági profillal rendelkezett. A brolucizumab esetében a KESTREL és a KITE pivotális vizsgálatok enyhén emelkedett (intraokuláris gyulladásos arányok a brolucizumab esetében az aflibercepthez képest 4,2% vs. 1,1% [KESTREL] és 2,2% vs. 1,7% [KITE] volt, amelyből a retinavasculitis aránya 0,5% vs. 0% volt a KESTREL-ben, a KITE-ben nem volt eset). A retinális érelzáródások aránya 1,6% vs. 0,5% [KESTREL] és 0,6% volt mindkét kezelési ágban a KITE-ben) (75, 99). Mivel mindkét gyógyszer viszonylag új a klinikai alkalmazásban, további adatokra van szükség a valós klinikai alkalmazással és valós környezetben keletkezett adat (RWD) kísérletekkel az állított klinikai előnyök alátámasztásához, és biztonsági profiljuk alapos megismeréséhez.
Jelenleg több nagyszabású, független, vagy termékspecifikus, valós bizonyítékokkal alátámasztott (RWE) vizsgálat is létezik, amelyek a különböző anti-VEGF-terápiák hatékonyságát vizsgálják a DMO különböző betegcsoportjain belül, mint például a Fight Retinal Blindness! Registry (96, 100, 101). A RWE hatékonyságra, biztonságosságra és tartósságra vonatkozó adatok összegyűjtése holisztikusabb képet ad az előnyben részesített kezelés kiválasztásáról, és a hosszú távú biztonságosságról is.
Tartósság
A hatékonyság mellett a kezelés tartóssága, illetve a kezelési intervallumok meghosszabbítása is nagy jelentőséggel bír a betegek és a klinikák kezelési terheinek csökkentése szempontjából, de a kezelés költségei (az injekciók száma, a kezelés és az ellátás éves költségei, éves járulékos költségek) is csökkennek (13, 28, 47, 52, 53). Amint az 1. táblázatban látható, az injekciók éves száma az egyes gyógyszerek esetében, de a kezelés évenkénti bontásában is változik, mivel a kezelés első éve a feltöltő dózisokat is magába foglalja.
Az anti-VEGF kezelést általában 3-5 feltöltőadaggal kezdik, amit 4 hetente adnak be (brolucizumab esetén 6 hetente), majd PRN (pro re nata, szükség szerint) megközelítést, „treat and extend” (T&E) stratégiát, 12 vagy 16 hetenkénti kiterjesztéssel lehet alkalmazni (66, 75, 76, 77, 79, 84, 85, 87, 93, 96). Ami az éves injekciók számát illeti, ezek a számok betegenként változnak, de a betegek körülbelül 70%-ánál (49, 102, 103) a fent felsorolt gyógyszerek bármelyikét alkalmazhatjuk kiterjesztett kezelésre, a gyógyszerek alkalmazási előírása szerint (13, 35, 40, 56–58). Fontos megjegyezni, hogy a kezelési időközök meghosszabbítását mindig a OCT vezetésével kell végezni, és azt fokozatosan, az egyes gyógyszerekre vonatkozó specifikus irányelveknek megfelelően kell végrehajtani.
Nem ideálisan reagáló betegek/anti-VEGF-rezisztencia
Bár az anti-VEGF-injekciók forradalmasították a retina olyan állapotainak kezelését, mint a DMO, a gyakori kezelés és adagolás szükségessége miatt továbbra is kihívások merülnek fel (30). A diabéteszes retinopátiában és DMO-ban szenvedő betegek körülbelül 15-30%-a nem reagál megfelelően vagy teljesen az anti-VEGF-terápiára vagy az anti-VEGF-monoterápiára, és kezelésükhöz alternatív kezelési stratégiákra van szükség (54, 84, 96, 101, 102, 104). Az anti-VEGF-terápia nem optimális hatásának kialakulásának oka nem tisztázott, de a tachifilaxia (a gyógyszer ismételt beadása után csökkenő terápiás válasz) feltételezhetően a VEGF-ellenes antitestekre adott semlegesítő immunválasz miatt alakul ki (104). A VEGF-ellenes terápiák és a kortikoszteroidokkal kombinált terápia közötti váltás mérsékelt javulást mutatott e betegcsoport betegségének progresszióját illetően (37, 54, 103, 105, 106). A faricimab kettős útvonalú hatása, amely nemcsak a VEGF-A-t, hanem az Ang-2-t is célozza, egy új lehetőség lehet az ilyen betegek számára, amint azt az RWE-vizsgálatokból látjuk (107–109).
A DMO ellátása, kezelése és kihívásai Magyarországon
A diabétesz országos prevalenciája a felnőtt lakosság körében 2018-ban 9,9% volt, becslések szerint mintegy 798 300 beteg, és ez az incidencia egyre növekedik (3, 4, 26, 110). Az 50 év feletti felnőtt diabéteszes lakosság 20,1%-a (160 500 beteg) esetében fordult elő valamilyen formában diabéteszes retinopátia (DR) (3). A ≥50 éves DM-ben szenvedő személyek körében a diabéteszes retinopátia volt okolható a vakság 28%-áért és a súlyos látáskárosodás 50%-áért (4, 5, 26, 110). Ezen DR-betegek szegmensén belül a diabéteszes makulaödémában szenvedő betegek prevalenciája körülbelül 3,5% volt, ami mintegy 27 900 betegnek felel meg, és ez a betegség a 30-as és 40-es éveikben járó betegeket is érintheti (3, 5, 26, 111).
A DMO egyre nagyobb egészségügyi és társadalmi terhet jelent, tekintettel a megelőzhető vakság gazdasági hatására, az ellátórendszerekre nehezedő növekvő nyomásra, ami rávilágít a nagy hatékonyságú anti-VEGF-terápiák szükségességére, hogy a betegek számára tartósabb kezelést biztosítsanak a jobb hosszú távú eredmények érdekében.
Gazdasági és társadalmi hatások
Magyarországon évente ezer ember veszíti el a látását a cukorbetegség miatt (59). A DMO okozta látásvesztés súlyos következményekkel járhat a betegekre vonatkozóan, korlátozhatja a mindennapi tevékenységek végzésében, a társas kapcsolatok fenntartásában és a teljes életvitelben való részvételben (27, 110, 112). Betegségük miatt, a betegeknek újonnan kell alkalmazkodniuk környezetükhöz. A DMO a munkaképes (20–65 éves) felnőtteket is érinti, akiknél megelőzhető lenne a maradandó szemkárosodás. Ezek a betegek még inkább gondozásra szorulnak és betegségük további jövedelemcsökkenéshez, és lelki megpróbáltatásokhoz vezet (27, 112). A késői diagnózis és a kezelés hiánya vagy az alulkezelés az ilyen betegek esetében a munkaerő elvesztése és a súlyos látáskárosodás/vakság miatti további járulékos költségek miatt még nagyobb gazdasági terhet jelentenek, illetve ezek a faktorok negatívan befolyásolják az országok versenyképességét, beleértve Magyarországot is (3, 4, 22, 26, 27, 29, 31, 32, 110, 112).
Ellátási kihívások és terhelés
A diagnózis időben történő felállítása és a megfelelő időben elkezdett, szakszerű terápiák egyre nagyobb terhet rónak az ellátó centrumokra (3, 4, 46). Az emelkedő betegszám miatt a betegek megfelelő színvonalú ellátását egyre nehezebb biztosítani. A központok korábban soha nem tapasztalt mértékű terhelés mellet dolgoznak, és nincs meg bennük az összes beteg kiszolgálásához és ellátásához szükséges kapacitás (5, 110). Ennek következtében hosszú várakozási idők alakulnak ki, és a betegek nem mindig kapnak időben kezelést. A kapacitásproblémák miatt sok esetben a betegek túllépik az anti-VEGF-terápiás beavatkozás szakmailag ideális idejét és sok esetben már előrehaladott állapotban kezdik meg a terápiát, amikor a terápiák hatékonysága már mérsékeltebb (10, 30, 110, 112). A DME rendszeres monitorozást, szakértelmet igénylő kezelést és hosszú távú gondozást igényel. Ez terhelést jelent az egészségügyi rendszerre, ideértve a növekvő igényt a szemészeti szolgáltatásokra, a speciális diagnosztikai és terápiás felszerelésekre és az egészségügyi szakemberek időbeli igényére.
A DMO kezelése során számos más kihívással is szembesülünk. A betegségre jellemző elhúzódó krónikus és progresszív állapot tovább nehezíti a megfelelő terápiás kezelési terv felállítását, ami egyaránt terheket ró a betegekre és az ellátási rendszerre is (30).
Javasolt változtatások a jobb betegellátás érdekében a DMO-ban
Korszerű kezelések hozzáférése
Magyarországon, a DMO kezelésére a nagy hatékonyságú anti-VEGF-terápiák elérhetősége nagyon korlátozott. A DME esetében egyetlen törzskönyvezett anti-VEGF-terápiát sem finanszíroz a NEAK. Az innovatív, nagy hatékonyságú anti-VEGF-terápiák új lehetőséget kínálnak a DMO kezelésében, és potenciális választást jelenthetnek azon betegek esetében, akik nem reagáltak megfelelően a korábbi terápiára.
A multidiszciplináris ellátási megközelítés és a nemzeti szűrőprogramok szükségessége
A cukorbetegség által okozott látásproblémák és vakság 90%-ban megelőzhető lenne a rendszeres szemfenéki szűrések és időben elvégzett szemészeti kezelések segítségével (3, 5, 14, 44, 110). A diabéteszes makulaödéma kezelése átfogó multidiszciplináris megközelítést igényel (2, 13, 56) és előtérbe kell helyezni a prevenciót, a cukorbetegség összes rizikófaktorát kiemelve, és az összes szövődményeit célozva. Az új betegutak kialakítása megkönnyítheti a problémamentes átmenetet az alapellátás, a kardiológia, a diabetológia, az endokrinológia és a szemészet között. A kezelési irányelvek és a kezelési folyamatok kidolgozása kulcsfontosságú lenne az ellátás egységesítése szempontjából, és az egészségügyi szakemberek számára a bizonyítékokon alapuló gyakorlatok alkalmazását szolgálná.
Néhány éve publikált felmérés alapján Magyarországon, a cukorbetegek csak egyharmada vett részt puppillatágításban végzett szemfenék-vizsgálaton, és csak a betegek fele volt a javasolt éves szemészeti kontrollvizsgálaton (3). A korai felismerés és beavatkozás szempontjából kulcsfontosságú lenne a diabétesz és a szemészeti szövődmények nemzeti szűrőprogramjainak létrehozása, amelyek kifejezetten a retinát érintő betegségeket és a cukorbetegség szövődményeit céloznák meg (45, 46). A szemészeti szűrés kiterjedtségének és a szolgáltatásokhoz való hozzáférés javítása érdekében szükséges az alapellátás hatékonyságának növelése, valamint az országot lefedő szemfenéki szűrőállomások bevezetése. Ez különösen fontos vidéki és kisebb településeken (3, 44, 45, 46, 110, 113). Az újszerű digitális megoldások megjelenésével a telemedicinális szűrés integrálása értékes eszközt jelenthet a távértékeléshez, különösen az alulellátott területeken élő egyének számára amit már intézetünk munkatársai pilot vizsgálat formájában el is kezdtek kidolgozni (40, 106, 108). Nagy lehetőséget jelent a mesterséges intelligencia (AI) alkalmazása is a reading centerek segítésére.
Következtetések
A diabetes mellitus (DM) komoly közegészségügyi problémát jelent, különösen a diabéteszes makulaödéma (DMO) által okozott látásvesztés és vakság tekintetében. A DMO a munkaképes felnőttek körében a súlyos látásromlás vezető okai közé tartozik. A szisztémás kockázati tényezők korai felismerése és megfelelő kontrollja az elsődleges módszer a cukorbetegség okozta szemészeti szövődmények megelőzésére és kezelésére. A korai kezelés nagy hatékonyságú anti-VEGF-gátlók alkalmazásával segíthet elkerülni a látásvesztést és akár látásjavulást is eredményezhet ezen betegek számára. A fent említett gyógyszerek neovaszkuláris, időskori makuladegeneráció (nAMD) kezelésében már bizonyították költséghatékonyságukat és klinikai értéküket. Ez iránymutató lehet a magyarországi DMO-betegek finanszírozására is, és lehetőséget nyújthat a jövőben ezen terápiák szélesebb körű alkalmazására.
Magyarországon a DMO kezeléséhez való hozzáférés korlátozott. A gazdasági és társadalmi hatások jelentősek, évente több mint ezer ember veszíti el látását a cukorbetegség miatt. Az ellátórendszer terheltsége növekszik, a diagnózisok késedelme pedig tovább súlyosbítja a helyzetet.
A javulás érdekében a multidiszciplináris ellátási megközelítés és a nemzeti diabétesz szűrőprogramok bevezetése kulcsfontosságú lenne. Az innovatív anti-VEGF terápiák szélesebb körű hozzáférésének biztosítása, valamint az egységes irányelvek és folyamatok, és szűrőprogramok kialakítása mind hozzájárulhat a hatékonyabb ellátáshoz és a látáskárosodás csökkentéséhez.
Nyilatkozat
*A közlemény megírását a Roche Magyarország Kft. támogatta.
Irodalom
1. International Diabetes Foundation. IDF Diabetes Atlas Data Portal – Global Diabetes Data Report 2000-2045.
https://diabetesatlas.org/data/en/world/
2. Guariguata L, Whiting DR, Hambleton I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Res Clin Pract 2014; 103(2): 137–149.
https://doi.org/10.1016/j.diabres.2013.11.002
3. Tóth G, Nagy ZZ, Németh J. A cukorbetegség szemészeti szövődményeinek modellalapú költségterhe Magyarországon. Orv Hetil 2021; 162(8): 298–305.
https://doi.org/10.1556/650.2021.32031
4. Németh J, Tóth G, Resnikoff S, et al. Preventing blindness and visual impairment in Europe: What do we have to do? Eur J Ophthalmol 2019; 29(2): 129–132.
https://doi.org/10.1177/1120672118819397
5. Tóth G, Szabó D, Sándor GL, et al. Cukorbetegség és retinopathia diabetica regionális egyenlőtlenségei Magyarországon az 50 éves és idősebb korú lakosság körében. Orv Hetil 2017; 158(10): 362–367.
https://doi.org/10.1556/650.2017.30692
6. Nathan DM. The Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study at 30 Years: Overview. Diabetes Care 2014; 37(1): 9–16.
https://doi.org/10.2337/dc13–2112
7. Romero-Aroca P. Managing diabetic macular edema: The leading cause of diabetes blindness. World J Diabetes 2011; 2(6): 98.
https://doi.org/10.4239/wjd.v2.i6.98
8. Chew EY, Davis MD, Danis RP, et al. The Effects of Medical Management on the Progression of Diabetic Retinopathy in Persons with Type 2 Diabetes. Ophthalmology 2014; 121(12): 2443–2451.
https://doi.org/10.1016/j.ophtha.2014.07.019
9. International Diabetes Foundation. (2021). IDF Diabetes Atlas 10th edition – 2021. Diabetes Atlas Report –
https://diabetesatlas.org/idfawp/resource-files/2021/07/IDF_Atlas_10th_Edition_2021.pdf
10. Graue-Hernandez EO, Rivera-De-La-Parra D, Hernandez-Jimenez S, et al. Prevalence and associated risk factors of diabetic retinopathy and macular oedema in patients recently diagnosed with type 2 diabetes. BMJ Open Ophthalmol 2020; 5(1): e000304.
https://doi.org/10.1136/bmjophth-2019-000304
11. Yau JWY, Rogers SL, Kawasaki R, et al. Global Prevalence and Major Risk Factors of Diabetic Retinopathy. Diabetes Care 2012; 35(3): 556–564.
https://doi.org/10.2337/dc11-1909
12. Scanlon PH. The English National Screening Programme for diabetic retinopathy 2003–2016. Acta Diabetol 2017; 54(6): 515–525.
https://doi.org/10.1007/s00592-017-0974-1
13. Papp A. A diabéteszes makulaödéma korszerű kezelése. Szemészet 2016; 153(4): 160–174. Accessed November 21, 2023.
https: //szemorvostarsasag.hu/lapszamok/843.pdf
14. Lee R, Wong TY, Sabanayagam C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye and Vision 2015; 2(1): 17.
https://doi.org/10.1186/s40662-015-0026-2
15. Tapp RJ, Shaw JE, Harper CA, et al. The Prevalence of and Factors Associated With Diabetic Retinopathy in the Australian Population. Diabetes Care 2003; 26(6): 1731–1737.
https://doi.org/10.2337/diacare.26.6.1731
16. Ting DSW, Cheung GCM, Wong TY. Diabetic retinopathy: global prevalence, major risk factors, screening practices and public health challenges: a review. Clin Exp Ophthalmol 2016; 44(4): 260–277.
https://doi.org/10.1111/ceo.12696
17. Wong TY, Cheung N, Tay WT, et al. Prevalence and Risk Factors for Diabetic Retinopathy. Ophthalmology 2008; 115(11): 1869–1875.
https://doi.org/10.1016/j.ophtha.2008.05.014
18. Sasongko MB, Wong TY, Nguyen TT, et al. Serum Apolipoprotein AI and B Are Stronger Biomarkers of Diabetic Retinopathy Than Traditional Lipids. Diabetes Care 2011; 34(2): 474–479.
https://doi.org/10.2337/dc10-0793
19. Chhablani J, Wong K, Tan GS, et al. Diabetic Macular Edema Management in Asian Population: Expert Panel Consensus Guidelines. Asia-Pacific Journal of Ophthalmology 2020; 9(5): 426–434.
https://doi.org/10.1097/APO.0000000000000312
20. Magliah S, Bardisi W, Al Attah M, et al. The prevalence and risk factors of diabetic retinopathy in selected primary care centers during the 3-year screening intervals. J Family Med Prim Care 2018; 7(5): 975.
https://doi.org/10.4103/jfmpc.jfmpc_85_18
21. Matsuda S, Tam T, Singh RP, et al. The impact of metabolic parameters on clinical response to VEGF inhibitors for diabetic macular edema. J Diabetes Complications 2014; 28(2): 166–170.
https://doi.org/10.1016/j.jdiacomp.2013.11.009
22. Varma R, Bressler NM, Doan QV, et al. Prevalence of and Risk Factors for Diabetic Macular Edema in the United States. JAMA Ophthalmol 2014; 132(11): 1334.
https://doi.org/10.1001/jamaophthalmol.2014.2854
23. Genuth S. The UKPDS and its global impact. Diabetic Medicine 2008; 25(s2): 57–62.
https://doi.org/10.1111/j.1464–5491.2008.02504.x
24. Sjølie AK, Klein R, Porta M, et al. Effect of candesartan on progression and regression of retinopathy in type 2 diabetes (DIRECT-Protect 2): a randomised placebo-controlled trial. The Lancet 2008; 372(9647): 1385–1393. https://doi.org/10.1016/S0140-6736(08)61411-7
25. Schoenaker DAJM, Simon D, Chaturvedi N, et al. Glycemic Control and All-Cause Mortality Risk in Type 1 Diabetes Patients: The EURODIAB Prospective Complications Study. J Clin Endocrinol Metab 2014; 99(3): 800–807.
https://doi.org/10.1210/jc.2013–2824
26. Tóth G, Nagy ZZ, Németh J. Model-based economic burden of diabetic retinopathy in Hungary. Orv Hetil 2021; 162(8): 298–305.
https://doi.org/10.1556/650.2021.32031
27. Loewenstein A, Berger A, Daly A, et al. Save our Sight (SOS): a collective call-to-action for enhanced retinal care across health systems in high income countries. Eye 2023; 37(16): 3351–3359.
https://doi.org/10.1038/s41433-023-02540-w
28. Gonzalez-Cortes JH, Martinez-Pacheco VA, Gonzalez-Cantu JE, et al. Current Treatments and Innovations in Diabetic Retinopathy and Diabetic Macular Edema. Pharmaceutics 2022; 15(1): 122.
https://doi.org/10.3390/pharmaceutics15010122
29. Calabrò GE, Basile M, Varano M, et al. Economic Aspects in the Management of Diabetic Macular Edema in Italy. Front Public Health 2022; 10.
https://doi.org/10.3389/fpubh.2022.938987
30. Jaki Mekjavić P, Juratè Balčiunienè V, Ćeklić L, et al. The Burden of Macular Diseases in Central and Eastern Europe – Implications for Healthcare Systems. Value Health Reg Issues 2019; 19: 1–6.
https://doi.org/10.1016/j.vhri.2018.11.002
31. Liu E, Craig JE, Burdon K. Diabetic macular oedema: clinical risk factors and emerging genetic influences. Clin Exp Optom 2017; 100(6): 569–576.
https://doi.org/10.1111/cxo.12552
32. Park SJ, Ahn S, Woo SJ, Park KH. Extent of Exacerbation of Chronic Health Conditions by Visual Impairment in Terms of Health-Related Quality of Life. JAMA Ophthalmol 2015; 133(11): 1267.
https://doi.org/10.1001/jamaophthalmol.2015.3055
33. Musat O, Cernat C, Labib M, et al. DIABETIC MACULAR EDEMA. Rom J Ophthalmol 59: 133–136.
34. Wilkinson CP, Ferris FL, Klein RE, et al. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003; 110(9): 1677–1682.
https://doi.org/10.1016/S0161-6420(03)00475-5
35. Bolz M, Lammer J, Deak G, et al. SAVE: a grading protocol for clinically significant diabetic macular oedema based on optical coherence tomography and fluorescein angiography. British Journal of Ophthalmology 2014; 98(12): 1612–1617.
https://doi.org/10.1136/bjophthalmol-2013-304564
36. Early Treatment Diabetic Retinopathy Study Research Group. Grading Diabetic Retinopathy from Stereoscopic Color Fundus Photographs – An Extension of the Modified Airlie House Classification. Ophthalmology 1991; 98(5): 786–806.
https://doi.org/10.1016/S0161-6420(13)38012-9
37. Wallsh JO, Gallemore RP. Anti-VEGF-Resistant Retinal Diseases: A Review of the Latest Treatment Options. Cells 2021; 10(5): 1049.
https://doi.org/10.3390/cells10051049
38. de Barros Garcia JMB, Isaac DLC, Avila M. Diabetic retinopathy and OCT angiography: clinical findings and future perspectives. Int J Retina Vitreous 2017; 3(1): 14.
https://doi.org/10.1186/s40942-017-0062-2
39. Bakri SJ, Wolfe JD, Regillo CD, et al. Evidence-Based Guidelines for Management of Diabetic Macular Edema. J Vitreoretin Dis 2019; 3(3): 145–152.
https://doi.org/10.1177/2474126419834711
40. Tan G, Jia W, Diabetes Institute S, et al. Clinical Practice Recommendations for Managing Working Group; 2019.
41. Han R, Gong R, Liu W, et al. Optical coherence tomography angiography metrics in different stages of diabetic macular edema. Eye and Vision 2022; 9(1).
https://doi.org/10.1186/s40662-022-00286-2
42. Mirshahi R, Riazi-Esfahani H, Khalili Pour E, et al. Differentiating features of OCT angiography in diabetic macular edema. Sci Rep 2021; 11(1).
https://doi.org/10.1038/s41598-021-02859-y
43. Alam M, Zhang Y, Lim JI, Chan RVP, Yang M, Yao X. Quantitative OCT Angiography Features for Objective Classification and Staging of Diabetic Retinopathy HHS Public Access.
44. Gombos K, Bodrogi P. A szemészeti vizsgálatok jelentősége a cukorbeteg-gondozásban. Diabetologia Hungarica 2015; 24: 77–84.
45. Szabó D, Fiedler O, Somogyi A, et al. Telemedical diabetic retinopathy screening in Hungary: a pilot programme. J Telemed Telecare 2015; 21(3): 167–173.
https://doi.org/10.1177/1357633X15572712
46. Németh J, Maka E, Szabó D, et al. Működő telemedicinális szemészeti szűrőprogramok és lehetőségek hazánkban. IME – Interdiszciplináris Magyar Egészségügy 2019; 18(8): 46–51.
47. Chen YP, Wu AL, Chuang CC, et al. Factors influencing clinical outcomes in patients with diabetic macular edema treated with intravitreal ranibizumab: comparison between responder and non-responder cases. Sci Rep 2019; 9(1): 10952.
https://doi.org/10.1038/s41598-019-47241-1
48. Cai S, Bressler NM. Aflibercept, bevacizumab or ranibizumab for diabetic macular oedema. Curr Opin Ophthalmol 2017; 28(6): 636–643.
https://doi.org/10.1097/ICU.0000000000000424
49. Shah AR, Yonekawa Y, Todorich B, et al. Prediction of Anti-VEGF Response in Diabetic Macular Edema After 1 Injection. J Vitreoretin Dis 2017; 1(3): 169–174.
https://doi.org/10.1177/2474126416682569
50. Supuran CT. The management of glaucoma and macular degeneration. Expert Opin Ther Pat 2019; 29(10): 745–747.
https://doi.org/10.1080/13543776.2019.1674285
51. Stewart MW. The Expanding Role of Vascular Endothelial Growth Factor Inhibitors in Ophthalmology. Mayo Clin Proc 2012; 87(1): 77–88.
https://doi.org/10.1016/j.mayocp.2011.10.001
52. Muns SM, Villegas VM, Flynn HW, et al. Update on current pharmacologic therapies for diabetic retinopathy. Expert Opin Pharmacother 2023; 24(14): 1577–1593.
https://doi.org/10.1080/14656566.2023.2230139
53. Tatsumi T. Current Treatments for Diabetic Macular Edema. Int J Mol Sci 2023; 24(11): 9591.
https://doi.org/10.3390/ijms24119591
54. Bressler NM, Beaulieu WT, Maguire MG, et al. Early Response to Anti–Vascular Endothelial Growth Factor and Two-Year Outcomes Among Eyes With Diabetic Macular Edema in Protocol T. Am J Ophthalmol 2018; 195: 93–100. https://doi.org/10.1016/j.ajo.2018.07.030
55. Maturi RK, Glassman AR, Liu D, et al. Effect of Adding Dexamethasone to Continued Ranibizumab Treatment in Patients With Persistent Diabetic Macular Edema. JAMA Ophthalmol 2018; 136(1): 29.
https://doi.org/10.1001/jamaophthalmol.2017.4914
56. Schmidt-Erfurth U, Garcia-Arumi J, Bandello F, et al. Guidelines for the Management of Diabetic Macular Edema by the European Society of Retina Specialists (EURETINA). Ophthalmologica 2017; 237(4): 185–222.
https://doi.org/10.1159/000458539
57. Flaxel CJ, Adelman RA, Bailey ST, et al. Diabetic Retinopathy Preferred Practice Pattern®. Ophthalmology 2020; 127(1): P66–P145.
https://doi.org/10.1016/j.ophtha.2019.09.025
58. Downey L, Acharya N, Devonport H, et al. Treatment choices for diabetic macular oedema: a guideline for when to consider an intravitreal corticosteroid, including adaptations for the COVID-19 era. BMJ Open Ophthalmol 2021; 6(1): e000696.
https://doi.org/10.1136/bmjophth-2020-000696
59. Magyarország Kormánya. A Cukorbeteg-Szervezetek és a Kormány Együttműködésének Közös Eredményei Vannak. Kormany.hu, 14 Nov. 2023. Kormány.hu. Published online 2023. Accessed November 21, 2023.
https: //kormany.hu/hirek/a-cukorbeteg-szervezetek-es-a-kormany-egyuttmukodesenek-kozos-eredmenyei-vannak
60. Panos G, Triantafylla M, Massa HF, et al. Ranibizumab for the treatment of degenerative ocular conditions. Clinical Ophthalmology Published online June 2014: 1187.
https://doi.org/10.2147/OPTH.S40350
61. Anguita R, Tasiopoulou A, Shahid S, et al. A Review of Aflibercept Treatment for Macular Disease. Ophthalmol Ther 2021; 10(3): 413–428.
https://doi.org/10.1007/s40123-021-00354-1
62. Karasavvidou EM, Tranos P, Panos GD. Brolucizumab for the Treatment of Degenerative Macular Conditions: A Review of Clinical Studies. Drug Des Devel Ther 2022; 16: 2659–2680.
https://doi.org/10.2147/DDDT.S378450
63. Moon BH, Kim Y, Kim SY. Twenty Years of Anti-Vascular Endothelial Growth Factor Therapeutics in Neovascular Age-Related Macular Degeneration Treatment. Int J Mol Sci 2023; 24(16): 13004.
https://doi.org/10.3390/ijms241613004
64. Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9(6): 669–676.
https://doi.org/10.1038/nm0603-669
65. Ferrara N, Hillan KJ, Gerber HP, et al. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat Rev Drug Discov 2004; 3(5): 391–400.
https://doi.org/10.1038/nrd1381
66. Gillies MC, Lim LL, Campain A, et al. A Randomized Clinical Trial of Intravitreal Bevacizumab versus Intravitreal Dexamethasone for Diabetic Macular Edema. Ophthalmology 2014; 121(12): 2473–2481.
https://doi.org/10.1016/j.ophtha.2014.07.002
67. Heier JS, Khanani AM, Quezada Ruiz C, et al. Efficacy, durability, and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3, non-inferiority trials. The Lancet 2022; 399(10326): 729–740. https://doi.org/10.1016/S0140-6736(22)00010-1
68. Michaelides M, Kaines A, Hamilton RD, et al. A Prospective Randomized Trial of Intravitreal Bevacizumab or Laser Therapy in the Management of Diabetic Macular Edema (BOLT Study). Ophthalmology 2010; 117(6): 1078–1086.e2.
https://doi.org/10.1016/j.ophtha.2010.03.045
69. CATT Research Group MDF, MMG, YGS, GJE, FSL, & JGJ. Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration. New England Journal of Medicine 2011; 364(20): 1897–1908.
https://doi.org/10.1056/NEJMoa1102673
70. Michels S, Rosenfeld P, Puliafito C, et al. Systemic Bevacizumab (Avastin) Therapy for Neovascular Age-Related Macular DegenerationTwelve-Week Results of an Uncontrolled Open-Label Clinical Study. Ophthalmology 2005; 112(6): 1035–1047.e9.
https://doi.org/10.1016/j.ophtha.2005.02.007
71. Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for Neovascular Age-Related Macular Degeneration. New England Journal of Medicine 2006; 355(14): 1419–1431.
https://doi.org/10.1056/NEJMoa054481
72. Heier JS, Bressler NM, Avery RL, et al. Comparison of Aflibercept, Bevacizumab, and Ranibizumab for Treatment of Diabetic Macular Edema. JAMA Ophthalmol 2016; 134(1): 95.
https://doi.org/10.1001/jamaophthalmol.2015.4110
73. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus Verteporfin for Neovascular Age-Related Macular Degeneration. New England Journal of Medicine 2006; 355(14): 1432–1444.
https://doi.org/10.1056/NEJMoa062655
74. Dugel PU, Koh A, Ogura Y, et al. HAWK and HARRIER: Phase 3, Multicenter, Randomized, Double-Masked Trials of Brolucizumab for Neovascular Age-Related Macular Degeneration. Ophthalmology 2020; 127(1): 72–84.
https://doi.org/10.1016/j.ophtha.2019.04.017
75. Wykoff CC, Garweg JG, Regillo C, et al. KESTREL and KITE Phase 3 studies: 100-week results with brolucizumab in patients with diabetic macular edema. Am J Ophthalmol Published online July 2023.
https://doi.org/10.1016/j.ajo.2023.07.012
76. Brown DM, Nguyen QD, Marcus DM, et al. Long-term Outcomes of Ranibizumab Therapy for Diabetic Macular Edema: The 36-Month Results from Two Phase III Trials. Ophthalmology 2013; 120(10): 2013–2022.
https://doi.org/10.1016/j.ophtha.2013.02.034
77. Heier JS, Korobelnik JF, Brown DM, et al. Intravitreal Aflibercept for Diabetic Macular Edema. Ophthalmology 2016; 123(11): 2376–2385.
https://doi.org/10.1016/j.ophtha.2016.07.032
78. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal Aflibercept Injection for Neovascular Age-related Macular Degeneration. Ophthalmology 2014; 121(1): 193–201.
https://doi.org/10.1016/j.ophtha.2013.08.011
79. Wykoff CC, Abreu F, Adamis AP, et al. Efficacy, durability, and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with diabetic macular oedema (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. The Lancet 2022; 399(10326): 741–755.
https://doi.org/10.1016/S0140-6736(22)00018-6
80. Varma R, Bressler NM, Suñer I, et al. Improved Vision-Related Function after Ranibizumab for Macular Edema after Retinal Vein Occlusion. Ophthalmology 2012; 119(10): 2108–2118.
https://doi.org/10.1016/j.ophtha.2012.05.017
81. Pielen A, Clark WL, Boyer D, et al. Integrated results from the COPERNICUS and GALILEO studies. Clinical Ophthalmology 2017; 11: 1533–1540.
https://doi.org/10.2147/OPTH.S140665
82. Hattenbach LO, Abreu F, Arrisi P, et al. BALATON and COMINO: Phase III Randomized Clinical Trials of Faricimab for Retinal Vein Occlusion. Ophthalmology Science 2023; 3(3): 100302.
https://doi.org/10.1016/j.xops.2023.100302
83. Grisanti S, Ziemssen F. Bevacizumab: Off-label use in ophthalmology. Indian J Ophthalmol 2007; 55(6): 417.
https://doi.org/10.4103/0301-4738.36474
84. Ciulla TA, Hussain RM, Pollack JS, et al. Visual Acuity Outcomes and Anti–Vascular Endothelial Growth Factor Therapy Intensity in Neovascular Age-Related Macular Degeneration Patients. Ophthalmol Retina 2020; 4(1): 19–30. https://doi.org/10.1016/j.oret.2019.05.017
85. Bressler SB, Odia I, Glassman AR, et al. CHANGES IN DIABETIC RETINOPATHY SEVERITY WHEN TREATING DIABETIC MACULAR EDEMA WITH RANIBIZUMAB. Retina 2018; 38(10): 1896–1904.
https://doi.org/0.1097/IAE.0000000000002302
86. DeCroos FC, Reed D, Adam MK, et al. Treat-and-Extend Therapy Using Aflibercept for Neovascular Age-related Macular Degeneration: A Prospective Clinical Trial. Am J Ophthalmol 2017; 180: 142–150.
https://doi.org/10.1016/j.ajo.2017.06.002
87. Skelly, Bezlyak, Liew, et al. Treat and Extend Treatment Interval Patterns with Anti-VEGF Therapy in nAMD Patients. Vision 2019; 3(3): 41.
https://doi.org/10.3390/vision3030041
88. Augustin A. Treatment of neovascular age-related macular degeneration: Current therapies. Clinical Ophthalmology Published online January 2009: 175.
https://doi.org/10.2147/OPTH.S3926
89. Saharinen P, Eklund L, Alitalo K. Therapeutic targeting of the angiopoietin–TIE pathway. Nat Rev Drug Discov 2017; 16(9): 635–661.
https://doi.org/10.1038/nrd.2016.278
90. Heier JS, Singh RP, Wykoff CC, et al. The angiopoietin/tie pathway in retinal vascular DISEASES. Retina 2021; 41(1): 1–19.
https://doi.org/10.1097/IAE.0000000000003003
91. Regula JT, Lundh von Leithner P, Foxton R, et al. Targeting key angiogenic pathways with a bispecific Cross MA b optimized for neovascular eye diseases. EMBO Mol Med 2019; 11(5).
https://doi.org/10.15252/emmm.201910666
92. Joussen AM, Ricci F, Paris LP, Korn C, Quezada-Ruiz C, Zarbin M. Angiopoietin/Tie2 signalling and its role in retinal and choroidal vascular diseases: a review of preclinical data. Eye 2021; 35(5): 1305–1316.
https://doi.org/10.1038/s41433-020-01377-x
93. European Medicines Agency. EMA – Vabysmo, INN-Faricimab | Vabysmo 120 Mg/Ml Oldatos Injekció [Alkalmazási Előírás – Utolsó Frissítés Június 22, 2023.; 2023. Accessed November 21, 2023.
https: //www.ema.europa.eu/en/documents/product-information/vabysmo-epar-product-information_hu.pdf
94. Klaassen I, Van Noorden CJF, Schlingemann RO. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Prog Retin Eye Res 2013; 34: 19–48.
https://doi.org/10.1016/j.preteyeres.2013.02.001
95. Uludag G, Hassan M, Matsumiya W, et al. Efficacy and safety of intravitreal anti-VEGF therapy in diabetic retinopathy: what we have learned and what should we learn further? Expert Opin Biol Ther 2022; 22(10): 1275–1291.
https://doi.org/10.1080/14712598.2022.2100694
96. Ciulla TA, Pollack JS, Williams DF. Visual acuity outcomes and anti-VEGF therapy intensity in diabetic macular oedema: a real-world analysis of 28 658 patient eyes. British Journal of Ophthalmology 2021; 105(2): 216–221.
https://doi.org/10.1136/bjophthalmol-2020-315933
97. Cai S, Yang Q, Li X, Zhang Y. The efficacy and safety of aflibercept and conbercept in diabetic macular edema. Drug Des Devel Ther 2018; 12: 3471–3483.
https://doi.org/10.2147/DDDT.S177192
98. Rosas IO, Bräu N, Waters M, et al. Tocilizumab in patients hospitalised with COVID-19 pneumonia: Efficacy, safety, viral clearance, and antibody response from a randomised controlled trial (COVACTA). EClinicalMedicine 2022; 47: 101409.
https://doi.org/10.1016/j.eclinm.2022.101409
99. Holz FG, Iida T, Maruko I, Sadda SR. A consensus on risk mitigation for brolucizumab in neovascular age-related macular degeneration. Retina 2022; 42(9): 1629–1637.
https://doi.org/10.1097/IAE.0000000000003556
100. DMO Published Data Archives – Fight Retinal Blindness! Registry. Save Sights Registries. Published online 2023. Accessed November 21, 2023.
https://savesightregistries.org/publication_category/dme/
101. Daien V, Eldem BM, Talks JS, et al. Real-world data in retinal diseases treated with anti-vascular endothelial growth factor (anti-VEGF) therapy – a systematic approach to identify and characterize data sources. BMC Ophthalmol 2019; 19(1): 206.
https://doi.org/10.1186/s12886-019-1208-9
102. Sharma D, Zachary I, Jia H. Mechanisms of Acquired Resistance to Anti-VEGF Therapy for Neovascular Eye Diseases. Investigative Opthalmology & Visual Science 2023; 64(5): 28.
https://doi.org/10.1167/iovs.64.5.28
103. Gonzalez VH, Campbell J, Holekamp NM, et al. Early and Long–Term Responses to Anti–Vascular Endothelial Growth Factor Therapy in Diabetic Macular Edema: Analysis of Protocol I Data. Am J Ophthalmol 2016; 172: 72–79.
https://doi.org/10.1016/j.ajo.2016.09.012
104. Ratra D. Commentary: Switching of anti-vascular endothelial growth factor agents in refractory diabetic macular edema. Indian J Ophthalmol 2021; 69(2): 367.
https://doi.org/10.4103/ijo.IJO_2611_20
105. Madjedi K, Pereira A, Ballios BG, et al. Switching between anti-VEGF agents in the management of refractory diabetic macular edema: A systematic review. Surv Ophthalmol 2022; 67(5): 1364–1372.
https://doi.org/10.1016/j.survophthal.2022.04.001
106. Kuroiwa DAK, Malerbi FK, Regatieri CVS. New Insights in Resistant Diabetic Macular Edema. Ophthalmologica 2021; 244(6): 485–494.
https://doi.org/10.1159/000516614
107. Tabano D, Borkar DS, Garmo V, et al. FARETINA-DME- Early Treatment Patterns and Outcomes in Patients with Diabetic Macular Edema Treated with Faricimab: an IRIS RegistryTM Analysis. Invest Ophthalmol Vis Sci 2023; 64(8): 2699.
108. Kusuhara S, Kishimoto-Kishi M, Matsumiya W, et al. Short-Term Outcomes of Intravitreal Faricimab Injection for Diabetic Macular Edema. Medicina (B Aires) 2023; 59(4): 665.
https://doi.org/10.3390/medicina59040665
109. Rush RB, Rush SW. Faricimab for Treatment-Resistant Diabetic Macular Edema. Clinical Ophthalmology 2022; 16: 2797–2801.
https://doi.org/10.2147/OPTH.S381503
110. Tóth G, Németh J. A cukorbetegség és szemészeti szövődményeinek epidemiológiai vonatkozásai hazánkban. Lege Artis Medicinae 2020; 30(10): 441–447.
https://doi.org/10.33616/lam.30.038
111. Tóth G, Szabó D, Sándor GL, et al. Diabetes and blindness in people with diabetes in Hungary. Eur J Ophthalmol 2019; 29(2): 141–147.
https://doi.org/10.1177/1120672118811738
112. Garcia G, Khoshnevis M, Gale J, et al. Profound vision loss impairs psychological well-being in young and middle-aged individuals. Clinical Ophthalmology 2017; 11: 417–427.
https://doi.org/10.2147/OPTH.S113414
113. Tóth G, Szabó D, Sándor GL, et al. Rural–urban disparities in the prevalence of diabetes and diabetic eye complications in Hungary. Spektrum der Augenheilkunde 2021; 35(2): 54–60.
https://doi.org/10.1007/s00717-019-00433-6
