A case of severe vernal keratoconjunctivitis complicated by keratoconus
doi: 10.55342/szemhungarica.2024.161.3.125
Original scientific paper
Summary
Vernal keratoconjunctivitis is a severe form of childhood allergic conjunctivitis, which typically resolves spontaneously after adolescence. In some cases, it can lead to permanent vision impairment as a result of therapy side effects or inflammatory changes. The condition is often complicated by keratoconus, which is considered a consequence of eye itching and frequent eye rubbing. In our case report, we present an unusually severe and prolonged course of the disease, complicated by keratoconus.
Összefoglaló
A vernalis keratoconjunctivitis a gyermekkori allergiás kötőhártya-gyulladások egy súlyos formája, amely többségében a serdülőkort követően spontán megszűnik. Néhány esetben az alkalmazott terápia mellékhatásaként vagy a gyulladásos eltérések következményeként maradandó látásromláshoz vezethet. A megbetegedés gyakran szövődik keratoconussal, amelyet a szemviszketés és a következményes gyakori szemdörzsölés szövődményeként tartanak számon. Esetismertetésünkben egy szokatlanul súlyos és elhúzódó lefolyású, keratoconussal szövődött vernalis keratoconjunctivitisben szenvedő páciens kórtörténetét ismertetjük.Keywords
keratoconus, vernal keratoconjunctivitis, perforating keratoplasty
Kulcsszavak
keratoconus, vernalis keratoconjunctivitis, perforáló keratoplasztika
A vernalis keratoconjunctivitis (VKC) az allergiás kötőhártya-gyulladások egy súlyos, általában kétoldali, szezonális megjelenésű formája, amely főként atópiás hajlamú fiúgyermekeket érint. Típusos esetben a betegség 4–12 éves kor között zajlik és általában a pubertáskort követően megszűnik (1, 20). A tünetek – mint kifejezett viszketés, könnyezés és fényérzékenység – az esetek döntő többségében az allergiás eredetű kötőhártya-gyulladások kezelése során alkalmazott készítményekkel jól karbantarthatók főként, ha a lokális terápia részeként kortikoszteroid-, vagy ciklosporintartalmú készítményt is alkalmazunk (2). A súlyos formákban szuperficiális keratitis punctata, cornealis hámhiányok, ún. shield-fekélyek, hegesedés és neovaszkularizáció is megjelenhet (1, 3, 4). A megfelelően megválasztott és alkalmazott terápia a fenyegető cornealis szövődmények megelőzésének kulcsa, bár egyes esetekben a leghatékonyabb kezelés mellett is perzisztáló tünetek és szövődményes szaruhártya-érintettség alakul ki. Esetbemutatásunkban atípusos, terápiarezisztens VKC miatt kezelt fiatal férfi betegünk kórtörténetét ismertetjük és összefoglaljuk a vonatkozó friss szakirodalmat.
Esetismertetés
Páciensünket első alkalommal 13 éves korában vizsgáltuk kétoldali esotropia, nagyfokú myopia és egyre fokozódó homályos látás miatt. Anamnéziséből kiemelendők az atópiás hajlam talaján halmozódó különböző megbetegedések, úgy mint csecsemőkorban jelentkező ekcéma, asztma, IgA-hiány, inhalatív irányú poliallergia (pl. pollen, házipor, állati szőr, penészgombák stb.), valamint a többszörös kórházi kezelést igénylő atópiás dermatitis. Legjobb korrigált látóélessége az első vizsgálat alkalmával a jobb szemen –12,0 D szférikus alappal és 2,5 D cilinderrel 40°-ban 0,3, valamint ugyanezen korrekció mellett a bal szemen 0,4 volt. A fokozódó látásromlás hátterében ekkor kétoldali juvenilis keratoconus igazolódott (1. ábra), szaruhártya vastagsága a legvékonyabb ponton ekkor a jobb szemen 433 μm, a bal szemen 405 μm volt. A keratoconus progressziójának megállítása céljából rövid időn belül a jobb szemen cross-linking (CXL) kezelést végezünk. A bal szaruhártya kifejezett elvékonyodása miatt a CXL-kezelést ezen a szemen nem végeztük el. A látóélesség javítása céljából mindkét oldalra kemény kontaktlencse viselését javasoltuk.
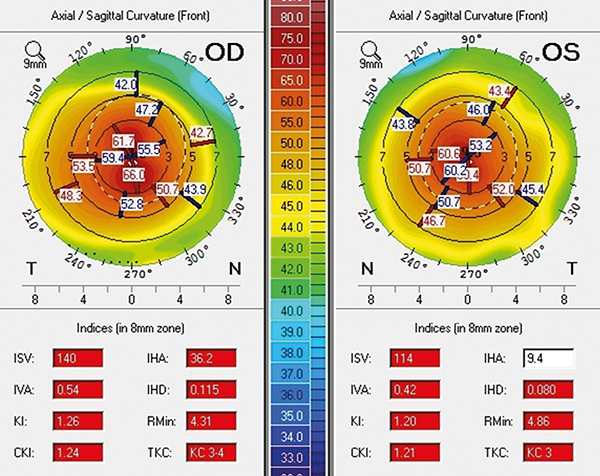
Néhány hónap múlva jobb oldali túlsúllyal mindkét szemen váladékozás, fényérzékenység és viszketés, valamint a jobb oldalon pszeudoptózis jelentkezett. A felső tarzális kötőhártyán ekkor kifejezetten érágas, váladékkal fedett óriáspapillák, a limbusban Trantas-csomók voltak megfigyelhetők. A szaruhártya felszínén diffúz, pontszerű festődés jelentkezett. Az eltérés hátterében kétoldali, kevert formájú VKC-t diagnosztizáltunk.
A tünetek fellángolásakor gyakori, tartósítószer-mentes műkönny, potens kortikoszteroid (dexamethason), hízósejtmembrán-stabilizátor (olopatadin), valamint cornealis érintettség esetén antibiotikum- (tobramycin) tartalmú lokális szemcseppkezelést javasoltunk. A betegség kezdeti szakaszában az akut fázisok kezelése után a dexamethason-tartalmú szemcseppet gyengébb, de a mellékhatásprofil szempontjából kedvezőbb kortikoszteroid-tartalmú (fluorometholon) kezelésre cseréltük, azonban a tünetek egyre gyakoribb fellángolása ezt csupán rövid időszakokra tette lehetővé. Páciensünk a súlyos, leginkább perennialis jellegű tünetek miatt a kemény kontaktlencsét nem tudta viselni. Az előrehaladott keratoconus, illetve az óriáspapillák (2. ábra) miatt ismétlődően kialakuló felszínes cornealis hámhiányok, illetve shield-fekélyek talaján kialakult centrális cornealis hegesedés (3. ábra) miatt látóélessége fokozatosan romlott, három évvel az első megjelenést követően a legjobb korrigált látóélesség a jobb szemen 0,1, a bal szemen 0,25 volt.
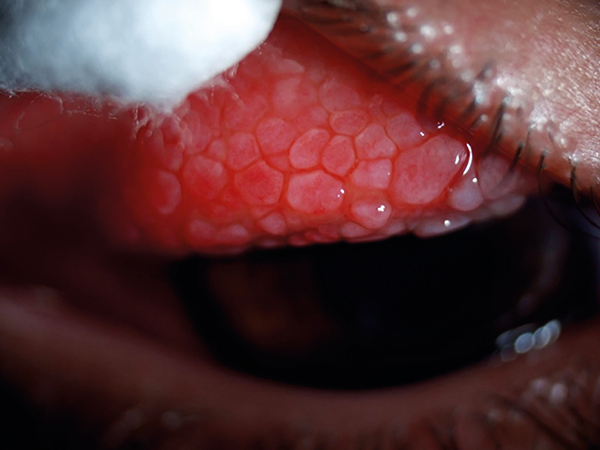

Az ismétlődő cornealis érintettség miatt elvégeztük az óriáspapillák fagyasztásos kezelését, valamint több alkalommal adtunk kortikoszteroid-tartalmú subconjunctivalis injekciót a tarzális conjunctiva alá. Ennek következtében a folyamatosan fennálló hámhiány a szaruhártyán megszűnt, azonban a súlyos viszketés, könnyezés és fényérzékenység továbbra is fennállt. A későbbiekben lokális ciklosporin-tartalmú szemcseppkezelést indítottunk a kortikoszteroid-igény csökkentése és a tünetek mérséklése céljából, azonban a dexamethason-tartalmú szemcsepp leállítását követően a tünetek újra és újra elviselhetetlenné váltak a beteg számára még az immunmoduláns kezelés mellett is. A hosszú távon alkalmazott lokális kortikoszteroid-kezelés mellékhatásaként hátsó kérgi katarakta alakult ki mindkét szemen. A szemnyomás mindvégig normáltartományban volt. A több éven keresztül elhúzódó súlyos VKC, a társuló keratoconus, illetve a kialakult hátsó kérgi katarakta miatt páciensünk látóélessége tovább romlott, 18 éves korára fehér bot segítségével közlekedett. A látóélesség javítása céljából szürkehályog-ellenes műtéttel kombinált perforáló keratoplasztika (PKP) elvégzését terveztük mindkét szemen, azonban ezt a perzisztáló szemfelszíni gyulladás miatt nem tudtuk végrehajtani. További két év elteltével, 20. életévének betöltése után szemfelszíni panaszai mérséklődni kezdtek, majd néhány hónap alatt teljesen elmúltak. Ezt követően került sor először a jobb, majd a bal szemen PKP, illetve szürkehályog-ellenes műtét és műlencse-beültetés elvégzésére. Látóélessége a jobb szemen 2 évvel a műtétet követően korrekció nélkül 0,8, míg a bal szemen fél évvel a műtét után –6,0 D cilinder 90° mellett 0,1, amely jelentős életminőségbeli javulást jelent számára.
Megbeszélés
A VKC pontos etiológiája nem tisztázott és feltehetőleg genetikai, környezeti és immunológiai tényezők együttes kóroki szerepe áll a háttérben. A VKC előfordulási gyakorisága jellegzetes földrajzi eltérést mutat: főként a szubtrópusi éghajlati övezetben fekvő országokban gyakori, ahol a tünetek perenniális jellege sem ritka (1, 5). Prevalenciája a nyugat-európai országokban alacsony, 1,16–10,55/10 000 fő között változik (5). A prevalenciában kimutatható regionális eltérések felvetik az e régiókban élők genetikai prediszpozíciójának lehetőségét. Korábban egyes szerzők az 5q kromoszómán található ún. citokin gén cluster túlzott expressziójának szerepét valószínűsítették, amely az eozinofilsejtek, különböző citokinek és a CD4+ sejtek túlsúlyához vezet (6). A VKC patogenezisében szerepet játszanak IgE- és nem-IgE-mediált, valamint egyéb nem-specifikus túlérzékenységi reakciók is. Az IgE-mediált túlérzékenységi reakció szerepét a VKC-vel diagnosztizált betegeknél kimutatható, IgE-rendszerre jellemző magasabb szintű eozinofil kationos fehérje, az emelkedett össz-IgE és eozinofilsejtszám, valamint a kötőhártyában lévő emelkedett számú hízósejt támasztja alá. A VKC-s esetek közel felében áll fenn atópiás eredetű szisztémás betegség, pl. az asztma, ekcéma vagy szénanátha (7), amelyekben közös pont az I-es típusú hiperszenzitivitású reakció szerepe.
A VKC kezelésében a kezelés alapját az egyéb allergiás kötőhártyagyulladások kezelésében is használt készítmények jelentik, úgy mint hideg borogatás, tartósítószer-mentes műkönny, illetve hízósejtmembrán-stabilizáló szerek. Ebben a betegségben az akut fázisok erélyes kezelése kiemelt fontosságú, hiszen a nem kellőképpen hatékony terápia mellett könnyen kialakulhatnak szaruhártya-szövődmények. Ennek következtében az akut fellángolások alkalmával többnyire potens kortikoszteroid-tartalmú lokális cseppterápiára van szükség. A kortikoszteroidok elhúzódó használata azonban jól ismert szövődményekhez, szürkehályog-képződéshez és szekunder glaukómához vezethet, ezért adásuk csak a legszükségesebb ideig javasolt. Az esetek döntő többségében kiválóan alkalmazható ún. „szteroidspóroló” szer a ciklosporintartalmú szemcsepp, amivel a tünetek jól karbantarthatók (2, 8, 9, 20).
Habár a VKC elsősorban fiatal gyermekeket érint és a serdülőkor után spontán megszűnik, a friss szakirodalmi adatok új entitásként említik az ún. felnőttkori VKC-t. Két formája ismert: a korai megjelenésű forma, amely gyermekkorban kezdődik, de a pubertáskort követően is hosszan fennmarad, illetve a késői típus, amely felnőttkorban de novo jelentkezik. A betegség patogenezisében fontos szerepe van az androgénhormonok különböző eltéréseinek, illetve ezzel összefüggésben az androgén útvonal lokális immunitásra gyakorolt hatásának. A felnőttkori formában a tünetek sokkal súlyosabb formában zajlanak, ami potenciálisan látásvesztéshez vezet a következményes szövődmények miatt. Ebben a formában a cornealis szövődményeken túl cikatrizáló szemfelszíni eltérések, illetve limbális őssejt-elégtelenség is előfordulhatnak (10, 11).
A keratoconus a szaruhártya nem gyulladásos, általában kétoldali megjelenésű degeneratív megbetegedése. A betegség oka nem ismert, de gyakran atópiás hajlamú pácienseknél jelenik meg (12). A keratoconus myop astigmiához vezet, a látóélességet lassan, progresszíven rontja (13). A progresszió megállításában az egyetlen ismert kezelés a szaruhártya CXL kezelése, amely a cornea kollagénrostjai közötti keresztkötések megerősítése által fokozza annak rigiditását (14). A CXL-kezelés 400 μm-es szaruhártya-vastagság alatt káros hatású lehet az endothelsejtekre. Egyes szerzők ilyen esetben a szaruhártya hipoozmoláris riboflavinnal való CXL-kezelését javasolják (15). A keratoconus a VKC gyakori szövődménye, amelyet a kifejezett viszketés és az ezzel járó gyakori szemdörzsölés következményeként tartanak számon. A keratoconus a VKC-ben szenvedő betegek esetében általában súlyosabb és gyorsabb progressziójú, amely kifejezett látásromláshoz vezet, ezért ezeknél a betegeknél a keratoconus korai felismerése kiemelt jelentőségű. Habár a CXL-kezelés eredményessége VKC esetén is kifejezetten jó, a keratoconus sok esetben későn kerül felismerésre, ami gyakran teszi szükségessé a keratoplasztika elvégzését (16). A műtét időpontjátnak megválasztása kulcsfontosságú a graft túlélése érdekében. A PKP hosszú utókezelése és a graft vulnerabilitása miatt a perenniális jellegű, vagy kifejezetten súlyos fellángolásokkal járó VKC esetén célszerűbb a műtétet a betegség spontán oldódását követően elvégezni. Több tanulmány kimutatta, hogy a VKC-hez társuló keratoconus miatt végzett PKP-k eredményessége a graft túlélése, a posztoperatív szövődmények aránya, illetve a posztoperatív látóélesség tekintetében nem különbözik a VKC-ben nem szenvedő keratoconusos pácienseknél elvégzett PKP-k eredményeihez képest (17, 18, 19).
Következtetés
A fentiekben egy keratoconussal szövődött, ún. felnőttkori VKC-ben szenvedő páciens kórtörténetét ismertettük. Ez az elhúzódó, általában súlyos epizódokkal járó lefolyás potenciálisan hatással van a látóélességre a szemfelszíni szövődmények miatt. A keratoconus nem minden esetben a VKC szövődménye, esetenként már annak kialakulása előtt elkezdődik, amelyre a két betegség közös pontjaként fennálló atópiás hajlam lehet a magyarázat. A permanens szemfelszíni gyulladás miatt a látóélesség javítása céljából tervezett keratoplasztika időpontja sokáig tolódhat, amely a betegek életminőségét hosszú ideig jelentősen ronthatja. A VKC oldódása után a keratoplasztika jó végeredménnyel kivitelezhető.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Bonini S, Sacchetti M, Mantelli F, et al. Clinical grading of vernal keratoconjunctivitis. Curr Opin Allergy Clin Immunol 2007; 7(5): 436–41.
https://doi.org/10.1097/ACI.0b013e3282efb726
2. Leonardi A. Management of vernal keratoconjunctivitis. Ophthalmol Ther 2013; 2(2): 73–88.
https://doi.org/10.1007/s40123-013-0019-y
3. Vichyanond P, Pacharn P, Pleyer U, et al. Vernal keratoconjunctivitis: a severe allergic eye disease with remodeling changes. Pediatr Allergy Immunol 2014; 25(4): 314–22.
https://doi.org/10.1111/pai.12197. Epub 2014 Jan 20.
4. Al-Akily SA, Bamashmus MA. Ocular complications of severe vernal keratoconjunctivitis (VKC) in Yemen. Saudi J Ophthalmol 2011; 25(3): 291–4.
https://doi.org/10.1016/j.sjopt.2011.02.001
5. Bremond-Gignac D, Donadieu J, Leonardi A, et al. Prevalence of vernal keratoconjunctivitis: a rare disease? Br J Ophthalmol 2008; 92(8): 1097–102.
https://doi.org/10.1136/bjo.2007.117812
6. Bonini S, Bonini S, Lambiase A, et al. Vernal keratoconjunctivitis: a model of 5q cytokine gene cluster disease. Int Arch Allergy Immunol 1995; 107(1–3): 95–8.
https://doi.org/10.1159/000236942
7. Bonini S, Bonini S, Lambiase A, et al. Vernal keratoconjunctivitis revisited: a case series of 195 patients with long-term followup. Ophthalmology 2000; 107(6): 1157–63.
https://doi.org/10.1016/s0161-6420(00)00092-0
8. Erdinest N, Solomon A. Topical immunomodulators in the management of allergic eye diseases. Curr Opin Allergy Clin Immunol 2014; 14(5): 457–63.
https://doi.org/10.1097/ACI.0000000000000089
9. Chigbu DI, Labib BA. Immunopharmacology in Vernal Keratoconjunctivitis: Current and Future Perspectives. Pharmaceuticals (Basel) 2021; 14(7): 658.
https://doi.org/10.3390/ph14070658
10. Di Zazzo A, Micera A, De Piano M, et al. Adult Vernal Keratoconjunctivitis: Clinical and biochemical profile of a rare disease. Ocul Surf 2019; 17(4): 737–42. Epub 2019 Jul 2.
https://doi.org/10.1016/j.jtos.2019.07.004
11. Di Zazzo A, Bonini S, Fernandes M. Adult vernal keratoconjunctivitis. Curr Opin Allergy Clin Immunol 2020; 20(5): 501–6.
https://doi.org/10.1097/ACI.0000000000000672
12. Hashemi H, Heydarian S, Hooshmand E, et al. The Prevalence and Risk Factors for Keratoconus: A Systematic Review and Meta-Analysis. Cornea 2020; 39(2): 263–70.
https://doi.org/10.1097/ICO.0000000000002150
13. Mas Tur V, MacGregor C, Jayaswal R, et al. A review of keratoconus: Diagnosis, pathophysiology, and genetics. Surv Ophthalmol 2017; 62(6): 770–83. Epub 2017 Jul 6.
https://doi.org/10.1016/j.survophthal.2017.06.009
14. Singh T, Taneja M, Murthy S, et al. Evaluation of safety and efficacy of different protocols of collagen cross linking for keratoconus. Rom J Ophthalmol 2020; 64(2): 158–67. PMCID: PMC7339692
15. Gu S, Fan Z, Wang L, et al. Corneal collagen cross-linking with hypoosmolar riboflavin solution in keratoconic corneas. Biomed Res Int 2014; 2014: 754182.
https://doi.org/10.1155/2014/754182
16. Wajnsztajn D, Solomon A. Vernal keratoconjunctivitis and keratoconus. Curr Opin Allergy Clin Immunol 2021; 21(5): 507–14.
https://doi.org/10.1097/ACI.0000000000000765
17. Egrilmez S, Sahin S, Yagci A. The effect of vernal keratoconjunctivitis on clinical outcomes of penetrating keratoplasty for keratoconus. Can J Ophthalmol 2004; 39(7): 772–7.
https://doi.org/10.1016/s0008-4182(04)80072-3
18. Wagoner MD, Ba-Abbad R, King Khaled. Eye Specialist Hospital Cornea Transplant Study G. Penetrating keratoplasty for keratoconus with or without vernal keratoconjunctivitis. Cornea 2009; 28(1): 14–8.
19. Thomas JK, Guel DA, Thomas TS, et al. The role of atopy in corneal graft survival in keratoconus. Cornea 2011; 30(10): 1088–97.
https://doi.org/10.1097/ICO.0b013e31818225dd
20. Szentmáry N, Módis L, Nagy Zoltán Zs. A szaruhártya immunológiai betegségei Szemészet 2022; 159(4): 140–145.
https://doi.org/1055342/SZEM-HUNGARICA 2022.159.4.140
