The role of biological therapy in the treatment of non-infectious uveitis – The results of the patients treated with adalimumab in the southern Great Plain
doi: 10.55342/szemhungarica.2024.161.2.76
Original scientific paper
Summary
Introduction: Since 2016, only adalimumab has gotten approval among the tumour necrosis factor inhibitors for treating non-infectious, non-anterior uveitis. Adalimumab is the only biologic agent that can be given for the indication of uveitis. We introduce our experiences with adalimumab in the therapy of non-infectious non-anterior uveitis in adulthood in the southern Great Plain. Patients and methods: Retrospective investigation in the Department of Ophthalmology, University of Szeged, between 2017 and 2021. Results: We examined 18 (12 females and 6 males) patients. Their average age was 51 years old at the beginning of the therapy. Seven (39%) patients had intermedier, 3 (17%) patients had posterior, 8 (44%) patients had panuveitis. The causes of uveitis were systemic autoimmune disease in 4 cases, 1 patient had serpiginous chorioretinopathy, and 13 patients had idiopathic uveitis. During adalimumab therapy, the rate of additional local and systemic therapy decreased. The activity of the inflammation, the rate of cystoid macular edema, and glaucoma decreased. There was no progression or worsening in visual acuity. Conclusion: When DMARD therapy doesn’t work, biologic therapy can provide a resolution. Among our patients, the demographic data, the localization of the inflammation, the cause of the inflammation, the effect of adalimumab, and the complications of adalimumab therapy meet the data from the literature.
Összefoglaló
Bevezetés: A tumornekrózis-faktor-inhibitorok közül az adalimumab rendelkezik Magyarországon 2016 óta törzskönyvvel a felnőttkori nem infekciózus eredetű, nem anterior uveitis kezelésére. Kiemelt jelentőségét az adja, hogy ez az első és napjainkig az egyetlen biológiai terápiás készítmény, amely uveitis indikációjával adható. Célunk, hogy bemutassuk a Szegedi Szemészeti Klinikán szerzett tapasztalatokat a nem fertőzéses eredetű uveitisek adalimumabterápiájával kapcsolatban felnőtt betegeink esetén. Betegek és módszerek: Az SZTE Szemészeti Klinikán retrospektív módon vizsgáltuk a 2017 és 2021 között adalimumabbal kezelt felnőtt betegek adatait. Eredmények: Vizsgálatunkba tizennyolc (tizenkét nő, hat férfi) beteget vontunk be. A résztvevők átlagéletkora az adalimumabkezelés indításakor ötvenegy év volt. Az uveitis anatómiai lokalizációját tekintve hét (39%) betegnél intermedier, három (17%) betegnél posterior, nyolc (44%) betegnél panuveitis állt fenn. Az uveitist négy betegnél szisztémás autoimmun betegség, egy betegnél serpinginosus chorioretinopathia okozta, tizenhárom betegnél az uveitis idiopathiás volt. Az adalimumabkezelés eredményeként a szisztémás és lokális kiegészítő kezelések aránya csökkent. Az uveitisek aktivitása és az uveitis szövődményeként kialakuló cisztoid makulaödéma és glaukóma aránya is csökkent adalimumabterápia hatására a vizsgálati idő kezdetéhez viszonyítva. Az uveitises epizódok fellángolása minden esetben minimálisra csökkent, illetve megszűnt. Látásélességükben jelentős javulás nem következett be. Következtetés: A bázisterápiára nem reagáló uveitises betegek esetében a gyógyulási lehetőséget a biológiai terápia nyújthatja. A vizsgálatunkban résztvevők demográfiai adatai, az uveitisek lokalizációja, a gyulladást kiváltó okok, az adalimumab hatása a gyulladás aktivitására és a szövődményekre megegyeznek a szakirodalomban leírtaknak.Keywords
uveitis, biological therapy, adalimumab
Kulcsszavak
uveitis, biológiai terápia, adalimumab
Bevezetés
Az uveitis a gyulladásos betegségek egyik gyakori és látást veszélyeztető csoportja, ami az uveát, a retinát és a retinaereket érinti. Különböző megközelítések szerint lehet osztályozni: az anatómiai elhelyezkedés, a kiváltó okok, a klinikai és patológiai megjelenés és a betegség lefolyása alapján (7, 10, 12).
A Standardization of Uveitis Nomenclature (SUN) munkacsoport 2005-ben publikálta az uveitisek felosztásáról szóló alapelveket. A klasszifikáció alapjául a gyulladás anatómiai lokalizációja szolgál, ez alapján beszélünk anterior, intermedier és posterior uveitisről. Panuveitis esetén nincs predilekciós helye a gyulladásnak (4).
Etiológia szerint megkülönböztetünk fertőzéses és nem fertőzéses eredetű uveitist. Fertőzéses uveitist okozhatnak vírusok, baktériumok, gombák és paraziták. A nem fertőzéses eredetű uveitis hátterében gyakran szisztémás autoimmun alapbetegség, neurológiai kórkép vagy egyéb, szemészeti szindróma áll. Az esetek közel egyharmadában ismeretlen marad a kiváltó ok, ez az ún. idiopathiás forma (10, 11).
Az uveitis kezelésének célja csökkenteni, illetve megelőzni a látást fenyegető szövődmények kialakulását, mérsékelni a betegség tüneteit és a beteg panaszait; illetve az uveitist okozó háttérbetegség gyógyítása (2).
A kortikoszteroidok a szem nem fertőzéses eredetű gyulladásos megbetegedéseinek a fő terápiás alappillérei. Szemészetben a kortikoszteroidokat alkalmazhatjuk csepp, periokuláris, intravitrealis vagy szisztémás formában (orálisan vagy intravénásan) is (2, 9, 10).
Intermedier és posterior noninfekciózus uveitis (NIU) esetében, ha a betegség kortikoszteroidra rezisztensnek bizonyul, vagy súlyos mellékhatások lépnek fel, akkor immunmoduláció révén ható, Disease-Modifying Antirheumatic Drugs (DMARD) gyógyszercsoportba tartozó szerek alkalmazása jöhet szóba. Ezek az antimetabolitok (metotrexát, azatioprin), kalcineurin-gátlók (ciklosporin, tacrolimus) és alkilálószerek (ciklofoszfamid). Ezen szerek adása társszakmák bevonásával történik. Használatuk mellett fontos a máj- és vesefunkció szoros kontrollja, sok esetben ezeknek az értékeknek a romlása indokolja a terápiamódosítást (1–3).
Amennyiben az immunmoduláns szerek sem érik el a kívánt hatást, vagy mellékhatásokat okoznak, biológiai terápia jöhet szóba. Uveitis indikációjával felnőtteknek adható TNF-alfa-gátlók csoportjába tartozó biológiai terápiás készítmény az adalimumab. Felépítését tekintve humán IgG1 monoklonális antitest, előállítása rekombináns DNS-technológiával történik. Elsőként a rheumatoid arthritis, majd számos egyéb autoimmun betegség kezelésére engedélyezték használatát (5).
Az adalimumab 2016 óta engedélyezett Magyarországon nem fertőzéses eredetű, intermedier-, posterior- és panuveitisben. Kiemelt jelentőségét az adja, hogy ez az első és napjainkig az egyetlen biológiai terápiás készítmény, amely uveitis indikációjával adható. NIU-ben adalimumabterápia jön szóba a szisztémás kortikoszteroid- és az immunszuppressziós terápia hatástalansága esetén, illetve, ha használatuk egyéb okok miatt kontraindikált (1, 3).
Az adalimumab alkalmazása subcutan módon történik. Kezdő telítő dózisa 80 mg, majd ezt követően a fenntartó terápia kéthetente 40 mg. Az adalimumab használata során felléphetnek mellékhatások, leggyakrabban az injekció beadásának helyén alakul ki lokális reakció (fájdalom, duzzanat, erythema). Fertőzéses kórképek közül gyakran fordulnak elő felső légúti infekciók, opportunista fertőzések, továbbá sok esetben megfigyelték látens tbc és HBV reaktiválódását. Előidézheti autoimmun betegség kialakulását, mint például psoriasis vagy ritkán Guillan–Barré-szindróma és sclerosis multiplex. Mellékhatásként fellépő leggyakoribb malignus betegség a nem melanoma természetű bőrrák, lymphoma és leukémia (8).
Az adalimumab TNF-alfa-gátlás révén megváltoztatja az immunrendszer működését, így a szervezet fogékonyabbá válhat fertőzéses és daganatos betegségekre. Az immunfunkciók megváltozása egyes autoimmun és demyelinizációs kórképek progresszióját is kiválthatja. A kezelés megkezdése előtt szűrővizsgálatokat kell végezni olyan betegségek kizárására, amelyek adalimumabterápia mellett a betegség súlyosbodásához vezetnének. Ezek kizárásában segítségünkre lehetnek a részletes anamnézis, laborvizsgálatok és képalkotó diagnosztikai eszközök (pl.: mellkasröntgen, szívultrahang-vizsgálat) (1, 3, 5, 8).
Vizsgálatunk célja volt, hogy bemutassuk a Szegedi Szemészeti Klinikán 2017. januártól 2021. decemberig szerzett tapasztalatokat a NIU adalimumabterápiájával kapcsolatban felnőtt betegeink esetén.
Tanulmányunk további célkitűzése volt az adalimumabbal kezelt NIU-betegeink eredményeinek összehasonlítása az irodalmi adatokkal.
Betegek és módszerek
Tanulmányunkban retrospektív módon vizsgáltuk a Szegedi Szemészeti Klinika uveitis ambulanciáján 2017. január és 2021. december között nem fertőzéses eredetű uveitis miatt adalimumabbal kezelt felnőtt betegeket. A MedSol rendszer segítségével jutottunk a vizsgálatunkhoz szükséges adatokhoz és információkhoz.
Tanulmányunkba azokat a betegeket választottuk be, akik az adalimumabot uveitis indikációjával kapták és legalább 3 hónapig tartott a kezelés.
A vizsgálatunk 2 fő részből állt:
- Az általános adatok feljegyzése és kiértékelése (nem, életkor, az uveitis anatómiai lokalizációja és oldalisága, az NIU etiológiája, a terápia megkezdése előtt alkalmazott egyéb kezelések, az adalimumabterápia folytonossága, az adalimumabterápia időtartama, a kezelés során fellépő mellékhatások).
- Az adalimumabterápia indításakor feljegyzett adatok és eredmények összehasonlítása a terápia elhagyásakor/a követési idő végén feljegyzett adatokkal és eredményekkel.
Etikai engedély száma: 5053
Eredmények
A kritériumainknak 18 beteg (12 nő, 6 férfi) felelt meg, így ezen betegek adatait és eredményeit dolgoztuk fel. A legfiatalabb beteg 20 éves, a legidősebb beteg 80 éves volt az adalimumabterápia kezdetekor. A betegek átlagéletkora az adalimumab indításakor 51 év volt.
Hét (39%) betegnél intermedier-, három (17%) betegnél posterior-, nyolc (44%) betegnél panuveitis állt fenn. Hat (33%) betegnél az uveitis egyoldali (2 esetben jobb oldali; 4 esetben bal oldali), tizenkettő (67%) betegnél pedig kétoldali volt, ezt mutatja az 1. ábra.
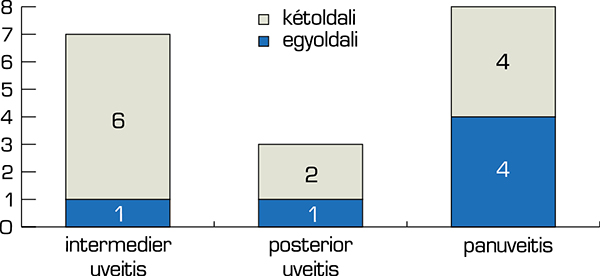
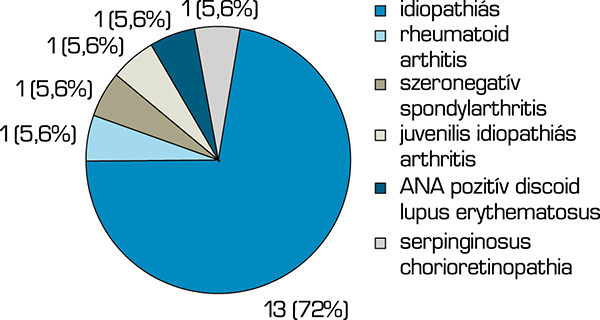
A vizsgálatunkba bevont betegeknél a fertőzéses eredetet minden esetben kizártuk. Az anamnézis, laborvizsgálatok és képalkotók segítségével, továbbá a társszakmák bevonásával öt (28%) esetben tudtuk megállapítani a gyulladás eredetét. Az uveitis hátterében egy esetben rheumatoid arthritis, egy esetben szeronegatív spondylarthritis, egy esetben juvenilis idiopathiás arthritis (JIA), egy esetben ANA-pozitív discoid lupus erythematosus, egy esetben pedig serpinginosus chorioretinopathia igazolódott. A fennmaradó 13 (72%) betegnél ismeretlen maradt a kiváltó ok. A 2. ábra ismerteti az uveitisek etiológia szerinti megoszlását a vizsgálatban résztvevők között.
Az adalimumabkezelés előtt 14 (77%) beteg kapott szisztémásan kortikoszteroidot, ami hat esetben okozott mellékhatást: 4 betegnél a per os kortikoszteroid-terápia mellett vérnyomás-ingadozás és cukorháztartás-zavar alakult ki, 2 betegnél intraokuláris nyomásemelkedés jelentkezett. Szisztémás immunszuppresszív kezelésben hat (33%) beteg részesült az adalimumabterápia előtt. A leggyakrabban ciklosporint és metotrexátot alkalmaztunk. Az egyik páciensnél az immunszuppresszív szerek mellékhatásokat okoztak, az azatioprin mellett láz és végtagfájdalmai jelentkeztek, a ciklosporin vesefunkció-romlást idézett elő.
A vizsgálatainkba bevont betegek közül 13 (72%) beteg kapta folyamatosan az adalimumabot, közülük két (11%) páciens esetében került felfüggesztésre. Az egyik betegnél családtervezés miatt 1 évig szüneteltettük a terápiát, majd ezt követően a recidiváló uveitise miatt újraindítottuk. A másik betegnél adalimumab mellett paradox psoriasis jelenkezett mellékhatásként, de a bőrtünetek szanálódása után újrakezdtük az adalimumabkezelést.
A terápiát három (17%) esetben állítottuk le véglegesen, két betegnél az adalimumab mellett jelentkező mellékhatások miatt, a harmadik betegnél terápiarezisztencia miatt került leállításra.
A vizsgált betegek között a legrövidebb adalimumabbal történő kezelési idő 3 hónap volt, amikor a páciensnél paradox psoriasis alakult ki, ezért a terápiát leállítottuk. A leghosszabb adalimumab alkalmazási idő 57 hónap, az átlag terápiás idő 26 hónapig volt.
A követési idő alatt öt (28%) betegnél jelentkezett mellékhatás. Két beteg esetében paradox psoriasis alakult ki az adalimumab alkalmazása mellett, emiatt az egyik betegnél a terápiát felfüggesztettük, majd a bőrtünetek szanálódása miatt az uveitis kiújulásával a terápiát újraindítottuk. A másik betegnél is leállítottuk az adalimumabot a bőrtünetek miatt, de a követési idő végéig nem indítottuk újra. Egy betegnél a terápia során több alkalommal láz jelentkezett, valószínű az adalimumabterápia mellékhatásaként, ezért a terápiát leállítottuk. Az egyik vizsgált személynél a kezelés során egy alkalommal testszerte, de főleg a felső testfélen vörös, nem viszkető foltok jelentek meg, amelyek égető érzéssel társultak. A bőrtünet pontos etiológiája ismeretlen maradt, az adalimumab elhagyása nélkül, bőrgyógyászati terápia mellett a tünetek szanálódtak.
Egy beteg a subcutan injekció beadási helyén kialakuló lokális erythemáról számolt be. A bőrpír és duzzanat a beadást követően 4-5 nap alatt elmúlt. A páciensnél kialakuló bőrtünetek nem indokolták az adalimumab elhagyását.
Az adalimumabterápia kezdetekor 12 (66%) jobb és 15 (83%) bal szemen detektáltunk aktív uveitist. A vizsgálati idő végén egy esetben, jobb szemen volt aktív a gyulladásos folyamat, a bal szemeknél nem találtunk aktív uveitist. Adalimumab használata mellett az aktív uveitisek aránya jelentősen lecsökkent.
Az adalimumab indításakor összesen 15 (42%) (6 jobb, 7 bal) szembe adtunk alkalmanként valamilyen lokális szteroidinjekciót. A vizsgálat befejeztével összesen hat (16%) (3 jobb, 3 bal) szembe injekcióztunk szteroidot szükség esetén, és ezen felül egy páciens mindkét szemén anti-VEGF-injekcióval egészítettük ki az adalimumabterápiát. Az átlagosan egy főre jutó napi per os szteroidmennyiség a követési idő kezdetén 6,3 mg volt, ami a követési idő végére 2,2 mg-ra csökkent. Az adalimumab indításakor négy beteg, az adalimumab elhagyásakor kettő beteg részesült szisztémás immunszuppresszív kezelésben.
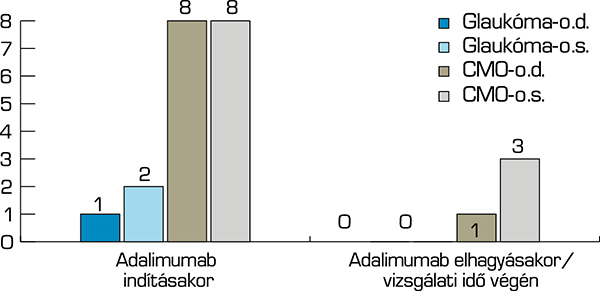
Összevetettük az uveitis leggyakoribb szövődményeinek, a glaukómának és a cisztoid makulaödéma (CMO) az előfordulását a vizsgálat kezdetén és végén. Vizsgálatunk elején összesen 16 (8 jobb, 8 bal) szemen észleltünk CMO-t és 3 szemen (1 jobb, 2 bal) glaukómát. A követési idő végén 4 szemet (1 jobb, 3 bal) érintett CMO, glaukóma pedig egyik páciensnél sem állt fenn, ezt mutatja a 3. ábra.
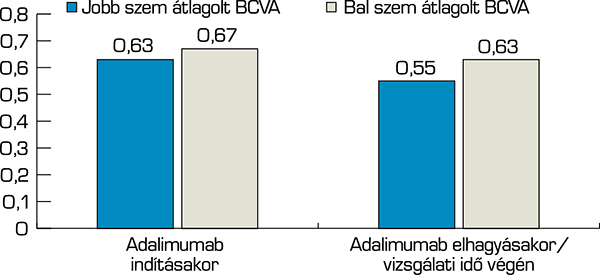
A 4. ábra demonstrálja az átlagolt legjobb korrigált látásélességet (best corrected visual acuity – BCVA), a vizsgálat kezdetén a jobb szemen 0,63, a bal szemen 0,67 volt. A követési idő végén mért BCVA mindkét szemen kevesebb lett, a jobb szemen 0,55, a bal szemen 0,63. A vizsgálati idő kezdetéhez viszonyított látásélesség romlásáért három szem esetében band keratopathia, négy szem esetében szürkehályog, kettő szem esetében makulát érintő károsodás volt felelős.
Megbeszélés
Az NIU a fiatal és középkorú populációt érintő betegség, amely nőknél gyakrabban fordul elő (7, 11, 12). A vizsgálatunkban résztvevő 18 betegből 12 nő, 6 férfi beteg volt, a férfi-nő arány 1:2. Az adalimumabterápia kezdetén a betegek átlagéletkora 51 év volt. A vizsgált betegek demográfiai jellemzői megegyeznek a szakirodalomban leírtakkal (7, 11, 12).
Az uveitis anatómiai lokalizációja alapján hét (39%) betegnél intermedier-, három (17%) betegnél posterior-, nyolc (44%) betegnél panuveitist találtunk. A betegek 67%-ánál (12 beteg) volt kétoldali az uveitis. A terápiában részesülők között tehát nagyobb százalékban fordult elő intermedier vagy panuveitis, és gyakrabban mutatkozott kétoldali lokalizációban.
Az NIU hátterében leggyakrabban szisztémás autoimmun betegség vagy szemészeti szindróma áll, de sok esetben az etiológia ismeretlen marad (7, 9, 10). Vizsgálatunkban az uveitist négy betegnél szisztémás autoimmun betegség, egy betegnél serpinginosus chorioretinopathia okozta, 13 betegnél az uveitis idiopathiás volt.
Az endogén uveitisek kezelése egy meglehetősen összetett folyamat, amely során társszakmák bevonása is szükséges lehet. A terápia megválasztásában a lépcsőzetesség elvét kell szem előtt tartani. NIU esetén a nem anterior uveitisek első terápiája a kortikoszteroid-kezelés, leginkább szisztémásan. A kortikoszteroidot azonban sok betegnél a kialakuló mellékhatások, vagy terápiarezisztencia miatt el kell hagyni, ilyen esetekben az úgynevezett szteroidspóroló immunszuppresszív szerek jöhetnek szóba. DMARD-terápia hatástalanság, vagy mellékhatás esetén harmadik lépcsőként biológiai terápia bevezetése lehetséges (1– 3, 8).
Vizsgálatunkban az adalimumab bevezetése előtt mindegyik beteg kapott lokálisan és szisztémásan kortikoszteroidot (2). Az adalimumabot harmadik terápiás lépcsőként alkalmaztuk.
A szakirodalomban adalimumab használata esetén az uveitis aktivitását illetően jelentős javulásról számolnak be (1, 2, 3, 8). Az adalimumabterápia indításakor összesen 27 (75%) szemen volt aktív az uveitis, a vizsgálati idő végére egy (0,03%) szem kivételével az összes aktív uveitis remisszióba került. Eredményeink azt mutatják, hogy az adalimumab a gyulladás aktivitását kedvezően befolyásolja.
Adalimumab használatával a betegeknél mind a lokális, mind a szisztémás kiegészítő terápiák mértékét csökkenteni lehetett, sok esetben elhagyásra kerültek.
A TNF-alfa-gátlók CMO-ra kifejtett kedvező hatását számos vizsgálatban leírták (1, 3, 6). Ezzel jól korrelál, hogy vizsgálatunkban az uveitis szövődményeként fellépő CMO sok esetben jól reagált az adalimumabra. Kezdetben összesen tizenhat, tanulmányunk végén négy szemen észleltünk CMO-t. Adalimumab használata mellett a három glaukómás szemen is sikerült az intraokuláris nyomás egyensúlyi állapotát visszaállítani.
Az adalimumabterápia sikerét mérhetjük a BCVA változásával is. A szakirodalomban adalimumabterápia használata mellett látásélességjavulásról számolnak be (1, 2, 3, 8). Tanulmányunkban a követési idő végére a jobb és bal szemen is kevesebb lett az átlag BCVA a vizsgálati idő kezdetéhez viszonyítva. A BCVA-ban a jobb szemen 0,08-os; a bal szemen 0,03-os csökkenés volt megfigyelhető. A romló látásélességet az egyes betegeknél a korábbi terápia mellékhatása, illetve a korábbi uveitisek következményeként kialakult makulaatrófia, katarakta vagy band keratopathia magyarázhatja.
Következtetések
Összefoglalásul elmondhatjuk, hogy a vizsgálatunkban résztvevők demográfiai adatai, az uveitisek lokalizációja, a gyulladást kiváltó okok, az adalimumab hatása a gyulladás aktivitására és a szövődményekre megegyeznek a szakirodalomban leírtakkal. A szakirodalmi eredmények alapján várt BCVA-javulás nem következett be egyéb, a látóélességet befolyásoló szemészeti betegségek miatt.
A TNF-alfa-gátlók lehetővé teszik az endogén uveitisek célzott terápiás kezelését. Az adalimumab biztonságos és legtöbb esetben hatásos kezelésnek bizonyult, az eddigi szisztémásan ható szerekhez (kortikoszteroidok, DMARD) képest hatalmas előrelépés az endogén uveitisek kezelésében. Jelenleg is tesztelés alatt állnak és a közeljövőben szemészeti terápiában bevezetésre kerülhetnek olyan biologikumok, amelyek még célzottabban és akár sikeresebben tudják eliminálni az uveitises gyulladást kiváltó és fenntartó citokineket, interleukineket (6).
Nyilatkozat
A szerzők kijelentik, hogy eredeti közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Fodor M. Terápiás újdonságok az uveitis kezelésében. Szemészet 2021;158: 171–191.
2. Foster CS, Kothari S, Anesi SD, et al. The Ocular Immunology and Uveitis Foundation preferred practice patterns of uveitis management. Surv Ophthalmol 2016; 61: 1–17.
https://doi.org/10.1016/j.survophthal.2015.07.001
3. Géhl Zs, Szepessy Zs, Nagy ZZs. A TNFa-gátló szemészeti alkalmazása: adalimumab kezelés uveitisben. Orv Hetil 2021; 162: 1370–1375.
https://doi.org/10.1556/650.2021.32188
4. Jabs DA, McCluskey P, Palestine AG, et al. The standardisation of uveitis nomenclature (SUN) project. Clin Experiment Ophthalmol 2022; 50: 991–1000.
https://doi.org/10.1111/ceo.14175
5. Jang D-I, Lee A-H, Shin H-Y, et al. The Role of Tumor Necrosis Factor Alpha (TNF-a) in Autoimmune Disease and Current TNF-a Inhibitors in Therapeutics. Int J Mol Sci 2021; 22: 2719.
https://doi.org/10.3390/ijms22052719
6. Pleyer U, Neri P, Deuter C. New pharmacotherapy options for noninfectious posterior uveitis. Int Ophthalmol 2021; 41: 2265–2281.
https://doi.org/10.1007/s10792-021-01763-8
7. Sen HD, Albini TA, Burkholder BM et al. Uveitis and Ocular Inflammation. In: Basic and Clinical Science Course. China, American Academy of Ophthalmology, 2020; 68-83. ISBN: 1681043653, 9781681043654
8. Smeller L, Sümegi V, Tóth-Molnár E, Sohár N. A biológiai terápia helye a gyermekkori uveitis ellátásában. Orv Hetil 2022; 163: 1402–1408.
https://doi.org/10.1556/650.2022.32578
9. Sohár N. Gyermekkori uveitisek. Szemészet 2017; 154: 191–198.
10. Süveges I, Csákány B, Dohán J, Erdei A, Fodor M, Géhl Zs, Módis L, Resch M, Sohár N, Szekanecz Z, Szepessy Zs. Uveitis. Medicina könyvkiadó Zrt.; 2023. pp. 29–36, 53–59, 118–122. ISBN: 978 963 226 869 9.
11. Tsirouki T, Dastiridou A, Symeonidis C, et al. A Focus on the Epidemiology of Uveitis. Ocul Immunol Inflamm 2018; 26: 2–16.
https://doi.org/10.1080/09273948.2016.1196713
12. Yang P. Classification of uveitis. In Atlas of uveitis. China, Springer Nature Singapore Pte Ltd. and Peopole’s Medical Publishing House; 2021. pp. 7–9.
ISBN-10: 9811537283 ISBN-13: 978-9811537288
