Massive submacular haemorrhage and suprachoroidal haemorrhage after the administration of an intravitreal anti-VEGF injection
doi: 10.55342/szemhungarica.2023.160.4.198
Case report
Summary
Submacular haemorrhage arising secondary to neovascular age-related macular degeneration has a poor prognosis and currently no “gold standard” treatment. Intravitreal injections of anti-vascular endothelial growth factor (VEGF) agents are widely used, their safety profile is well-known, but at the same time, they can be associated with devastating ocular complications for patients on systemic antithrombotic therapy. We report a case of massive submacular, suprachoroidal, and vitreous haemorrhage after an intravitreal anti-VEGF injection in a patient with exudative age-related macular degeneration.
Összefoglaló
Nedves típusú időskori makuladegeneráció talaján kialakult submacularis vérzés egy rossz prognózisú kórkép, amelynek kezelésére jelenleg nincs „goldstandardnak” számító terápiás eszköz. A széles körben alkalmazott intravitreális VEGF-gátló-kezelés biztonságprofilja ismert, ugyanakkor szisztémás antitrombotikus terápia mellett, szokatlan mellékhatások is jelentkezhetnek. Ritka szövődményként ismertetünk egy masszív submacularis vérzés, chorioidea-ablatio és üvegtesti vérzés képében jelentkező komplex esetet, amely nedves típusú időskori makuladegeneráció miatt indított intravitreális VEGF-gátló-kezelés után alakult ki.Keywords
submacular, suprachoroidal haemorrhage, macular degeneration
Kulcsszavak
submacularis vérzés, chorioidea-ablatio, makuladegenereáció
Bevezetés
Submacularis vérzés során a vér a makula területére lokalizálódva, a neuroszenzoros retina és az RPE (retinal pigment epithelium) rétegei között jelenik meg, míg sub-RPE esetében a retinalis pigmentepithel alatt; leggyakrabban nedves típusú AMD (age-related macular degeneration) szövődményeként. A vér önmagában gátat jelent a retina és a chorioidea közötti tápanyag és oxigéntranszportnak, ugyanakkor a bomlástermékeiként megjelenő vas és hemosziderin a retina sejtjeit direkt károsítják (15), az általuk kiváltott toxikus hatás már 24 órával a vérzés megjelenése után megmutatkozik (6). A fibrinháló kialakulásával és zsugorodásával a külső retina sejtjei tovább károsodnak (18). A kórfolyamat természetes lefolyása során kialakuló hegesedés végül súlyos látásromlást eredményez, a vér spontán felszívódásával a látásélesség általában nem javul, ezért az azonnali terápiás beavatkozás alapvető. A kezelési lehetőségek között szerepel intravitreális expanzív gáz injektálása (SF6: kén-hexafluorid, C3F8: oktafluor-propán) a vérzés elmozdítására, akár szöveti plazminogén-aktivátor (tPA: tissue plasminogen activator) intravitreális alkalmazásával kombinálva, fotodinámiás terápia, anti-VEGF- (vascular endothelial growth factor) kezelés vagy pars plana vitrectomiával kombinált intravitreális vagy subretinalis tPA-kezelés. A szöveti plazminogén-aktivátor egy szerin-proteáz, amely a fibrinolízis során a plazminogén plazminná való alakulását katalizálja. A komplikációk és a prognózis a terápiás modalitások, a subretinalis vérzés kiterjedése szerint változnak, így jelenleg nem létezik „goldstandard” kezelés. Shin és munkatársai-nak a kutatása alapján a 450 mikron feletti centrális retinalis vastagságot okozó submacularis vérzésnél a kombinációs kezelésekkel jobb visuskimenetelt lehetett elérni, míg ennél kisebb CRT (central retinal thickness) esetén az anti-VEGF-kezelés önmagában hatásosnak bizonyult (16). A VEGF-monoterápia előnye, hogy elérhető, kevésbé invazív, mint a PPV (pars plana vitrectomia), a beavatkozás után a beteget nem kell pozícionálni, ugyanakkor nem semlegesíti a hemolitikus termékek retinotoxikus hatását.
Vérzéses chorioidea-leválás során, a ciliaris artériák ruptúrájának következtében a chorioidea és sclera közötti tér – azaz a suprachorioidealis tér – vérrel telítődik. Ritka, de potenciálisan súlyos szövődmény, amelyet szemmegnyitó műtétek és traumás események egyaránt kiválthatnak. A szemet érő tompa vagy penetráló sérülés következtében kialakuló suprachorioidealis vérzés kórlefolyása eltér az intra- vagy posztoperatívan jelentkező vérzésétől, ennek megfelelően külön entitásként kezelendő (4). Intraocularis műtétek esetében, ezt a szövődményt leggyakrabban a szem hipotóniája idézi elő, amelyet ciliochorioidealis effúzió, majd ciliáris artéria megfeszülése, végül érruptúra követ (19). A kórkép kialakulásának rizikótényezőjeként számba vehető az előrehaladott kor, a generalizált arterioszklerózis, a hipertónia és a diabetes mellitus, amelyek az ér strukturális gyengüléséhez vezetnek. A veleszületett és szerzett coagulopathiák is kockázati faktornak tekinthetők. Szemészeti rizikót a glaukóma, a magas szemnyomás, az aphakia, a tengelymyopia és az intraocularis gyulladások jelentenek. Ezek a faktorok szintén a ciliáris artériák integritását gyengítik (4). A különböző okokból elindított Valsalva-manőverek, azaz a zárt glottis mellett történő forszírozott kilégzések is fokozott érfali stresszt eredményeznek, az episcleralis vénás nyomás növelésével, valamint a vénás visszaáramlás csökkentésével (5).
Esetbemutatás
Egy 84 éves nőbeteg esetét ismertetjük, akinek a szemészeti anamnéziséből kiemelhető a bal szem gyermekkorban lezajlott chorioretinitises gyulladása. A beteg a jobb szemén hirtelen kialakult látásélesség-csökkenés és centrális scotoma panaszaival jelentkezett. Az elvégzett vizsgálatok alapján a jobb szem legjobb korrigált látásélessége 0,15, a bal szemé 0,06, ami 2017-ben, egy korábbi ambulánslap szerint még 1,0 és 0,09 volt. Az intraocularis nyomás applanációs tonométerrel 18/18 Hgmm-nek adódott, réslámpás vizsgálattal mindkét oldalon phacosclerosis, egyebekben ép elülső szegmentum mutatkozott. Pupillatágításban végzett biomikroszkópos szemtükrözés során a funduson ép papillák, szklerotikus erek, a jobb oldalon elődomborodó makula, a centrumban sárgásszürke membrán, körülötte subretinalis vérzés, makulaszerte drusenek és pigmentegyenetlenség, míg bal oldalon, a papillomacularis köteg és a makula területén inveterált chorioretinitises góc volt látható. Makuláris OCT- (optikai koherencia tomográfia) vizsgálat során a jobb oldalon jelentős centrális retinalis vastagságfokozódás (448 mikron), kiterjedt, multilobulált, inhomogén denzitású pigmentepithelium leválás, amely környezetében subretinalis folyadék ábrázolódott (1. ábra).
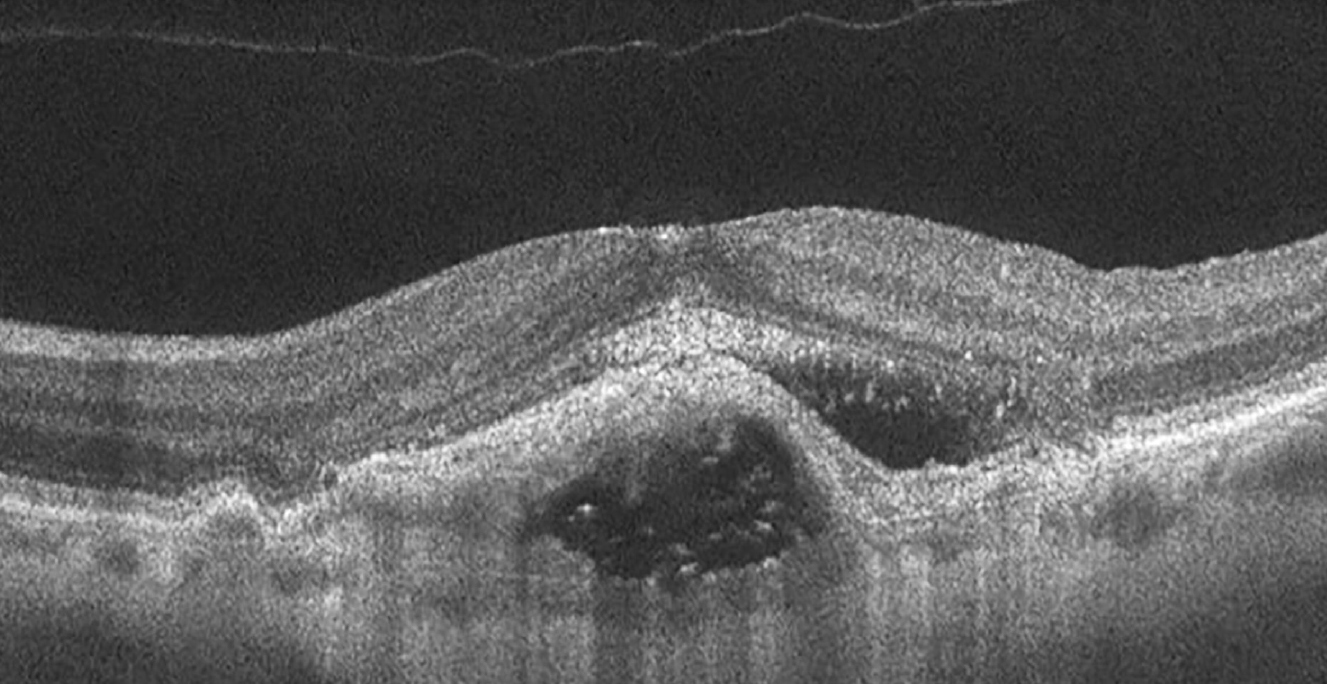
Bal oldalon makulaszerte kiterjedt RPE-egyenetlenség: pigmentepithel-sorvadás és hipertrófia jeleivel, valamint fotoreceptorréteg-atrófia mutatkozott.
A beteg jelentősebb általános megbetegedései között hipertónia, angina pectoris szindróma, nagyízületek degeneratív elváltozásai és a 2021 júliusában core biopsziával igazolt jobb oldali rosszindulatú emlődaganat szerepelt, utóbbit szövettan vizsgálat eredménye is alátámasztott, mint carcinoma lobulare mammae. További onkológiai kivizsgálások és a 2022 októberében készült mellkasi és hasi CT alapján többek között tumor ventriculi – lokoregionális limfatikus disszemináció lehetőségével –, ascites és generalizált arterioszklerózis került leírásra. A beteg az onkológiai kezeléstől elzárkózott, egyedül hormonterápia – Arilla (anasztrozol) – szedését vállalta. Ezenfelül thrombocytagátló, vérnyomáscsökkentő és protonpumpagátló-kezelésben is részesült.
A jobb szemet érintő, fent részletezett elváltozást exsudatív AMD-nek véleményeztük, a centrális makuláris vastagságot figyelembe véve intravitrális anti-VEGF-kezelést indítottunk. Két nappal az ambuláns megjelenést követően, betegünk a pars planán keresztül, az intravitreális Avastin (0,05 ml bevacizumab) injekciót szövődménymentesen megkapta, a kezelés után a szemnyomás kompenzált volt, a chorioretinalis réteg körben feküdt, a beteg jó általános állapotban távozott.
A beavatkozást követő héten a beteg súlyosbodó látásromlás panaszával érkezett ambulanciánkra, az elvégzett vizsgálatok alapján a jobb szem látásélessége kézmozgás látásra csökkent, a funduson a centrumot is érintő, attól temporál és lefelé húzódó, nagy kiterjedésű (2 papillányi területet meghaladó) subretinalis vérzés ábrázolódott. Ellátásként C-vitamin és Dicynon (etamsylát) tartós alkalmazását javasoltuk.
Egy hónappal az intravitreális injekció beadása után, a kontrollvizsgálatokon a jobb szem látásélessége fényérzésre csökkent, a szem fájdalmatlan volt, az üvegtestben masszív gomolygó sanguis jelent meg, a fundust érdemben nem lehetett megvizsgálni. Ultrahang B-képen üvegtesti vérzésnek és a hátsó pólusra lokalizálódó, vérzéses chorioidea-ablationak megfelelő elváltozás ábrázolódott; azaz az üvegtesti gélben tömeges, mobilis, pontszerű, inhomogén eloszlású echoforrások, valamint dóm alakú, a suprachorioidealis térben magas, inhomogén echogenitású képlet látszott (2. ábra).
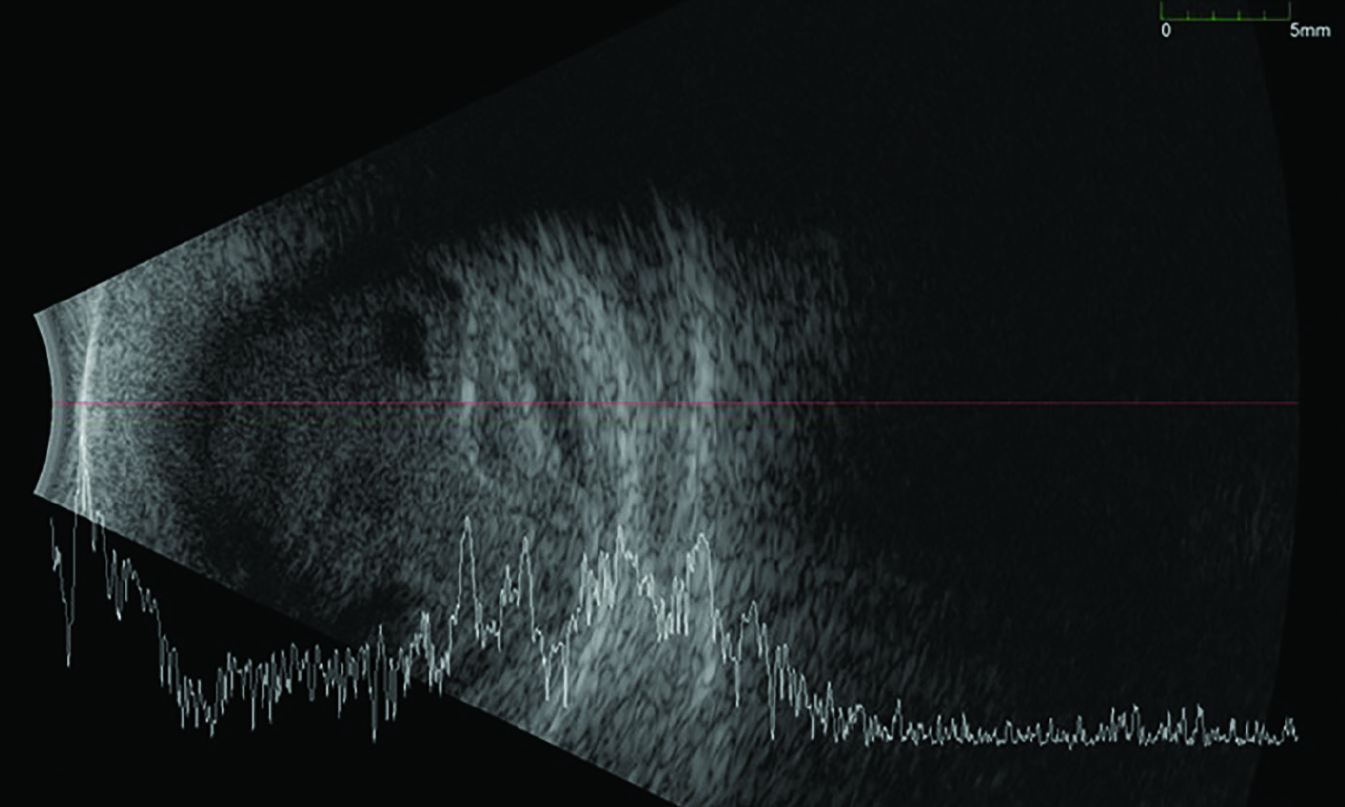
Tekintettel a beteg monoculus statusára, kezelésként jobb oldali phacoemulsificatióval kombinált pars plana vitrectomia elvégzése mellett döntöttünk. Felvételkor az intraocularis nyomás 14 Hgmm, a műtét során, a hátsó póluson lapos chorioidea-ablatio és diffúzan szétterülő subretinalis vérzés képe vált egyértelművé. Zavartalan posztoperatív szak után, a távozási visus kézmozgáslátás, a szemnyomás mindvégig céltartományon belüli volt. A műtét utáni kontrollvizsgálaton a látásélesség érdemben nem változott, a chorioidea-leválás mértéke ugyan csökkent, azonban a subretinalis vérzés csaknem a teljes hátsó pólust magába foglalta (3. ábra).
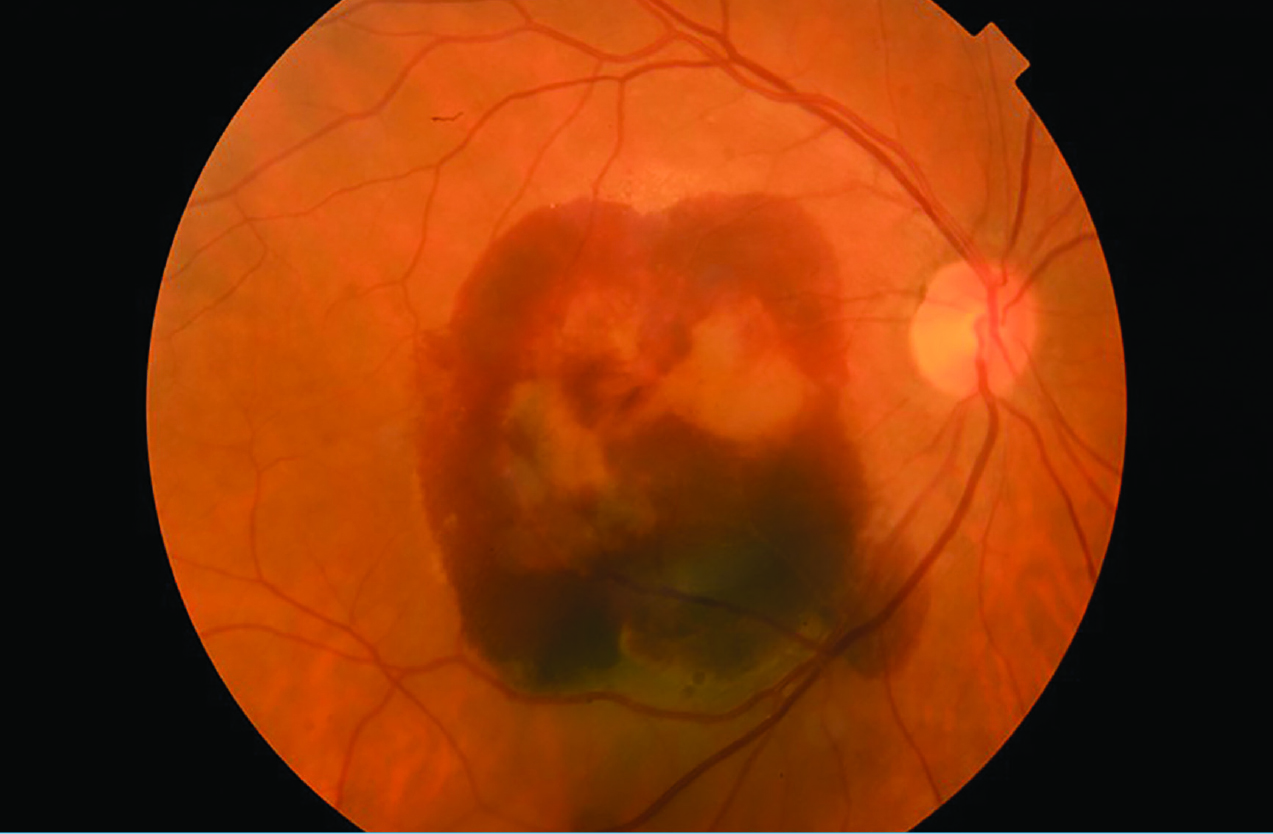
A későbbi kontrollvizsgálatokat a beteg alapbetegségéből adódó állapotrosszabbodás miatt nem tudtunk elvégezni.
Megbeszélés
A retinalis neovaszkularizációval járó megbetegedések kezelésének elterjedt módja az intravitreális injekció formájában alkalmazott VEGF-gátló-kezelés. A beavatkozás szövődményének spektruma az ártalmatlan subconjunctivális vérzéstől a retinaleválásig és az endophthalmitisig terjedhet.
Az anti-VEGF-kezelést követő submacularis vérzés kialakulása, fokozódása ismert jelenség, azonban a nedves típusú AMD természetes kórlefolyása miatt, kifejezetten nehéz direkt összefüggést találni az intravitreális injekció és a vérzés megjelenése között, hiszen a vaszkularizációs membrán önmagában bármikor subretinalis vérzéshez vezethet. Ugyanakkor nagy, okkult membránok esetében (≥ 15 mm2) szignifikánsan nagyobb számban jelentkezett ez a szövődmény (7), amely kapcsolatba hozható az antiangiogenetikus faktorok membránra gyakorolt fokozott kontrakciós hatásával (7, 13), ami egy strukturálisan gyenge érhálózat esetében még kifejezettebb lehet. Egy másik lehetséges mechanizmus a bevacizumab beadását követő rövid ideig tartó, de hirtelen jelentkező szisztolés vérnyomás-emelkedés, ami vérzéses szövődményeket eredményezhet (9). Akut RPE-szakadáshoz társulva is megjelenhet submacularis vérzés, azonban esetünkben ilyen klinikai jel nem mutatkozott.
A vérzéses chorioidea-ablatio, mint intravitreális injekciót követő szövődmény, csak elvétve szerepel az irodalomban. Brouzas és munkatársai 10 nappal az intravitreális Avastin injekció beadását követő akut látásvesztés, magas szemnyomás (55 Hgmm) és kifejezett fájdalommal kísért masszív chorioidea-ablatio esetét jelentették, amelyet 4 hónap után a másik szem szimpátiás ophtalmiája követett (1). Jones és munkatársai egy retinaleválás miatt korábban már vitrectomizált, intravitreális VEGF-gátló injekciót követően kialakult 360o-os, masszív chorioideális vérzés esetét ismertették, és a szövődményt a beavatkozás során hirtelen kialakult intraocularis nyomáscsökkenésnek tulajdonították (10). Betegünknél mindvégig normáltartományon belüli szemnyomásértékeket mértünk, az injekció beadása során üvegtesti veszteség és direkt trauma nem keletkezett, így a chorioidea-ablatio kialakulását a gyors IOP-csökkenésből adódó mechanizmus nem magyarázza.
A posztinjekciós üvegtesti vérzés előfordulása ritka, ami leggyakrabban az intravitreális alkalmazásmód következménye, kialakulhat az injekció helyén, a tűszúrás okozta sérülés következményeként, szövődhet retinaszakadással és leválással, szintén a tű penetrációja során kialakult direkt sérülés okán, vagy szekunder módon, a szúrcsatornán keresztüli üvegtesti prolapsus generálta trakciós erő hatására, de PVD (posterior vitreous detachment) indukálásával is (3). Esetünkben az üvegtesti vérzés jóval az injekció beadását követően jelentkezett, traumás esemény hiányában, így a feltételezhető mechanizmus sokkal inkább a chorioideális neovaszkularizációs membránból fakadó üvegtesti vérzés irányába mutat, ami a retina mikrosérülésein keresztüli, úgynevezett áttöréses vérzés képében jelentkezett, és nem független eseményként. Submacularis vérzés jelenlétében az intravitreális kezelést követő áttöréses üvegtesti vérzés kialakulásának kockázati tényezője: a nagy kiterjedésű (2 PD-nél nagyobb területű) submacularis vérzés, PCV- (polypoidealis chorioidealis vasculopathia) altípus, azonban az antikoaguláns terápia, mint független rizikófaktor kifejezetten ellentmondásos tényezőként szerepel a szakirodalomban (17, 8).
Következtetés
Bár a betegünk thrombocytagátló kezelésben részesült az ANCHOR (2) és a MARINA (14) majd a későbbi tanulmányok (11, 12) sem erősítették meg, hogy az antitrombotikus kezelés nagyobb kockázatot jelent a VEGF-gátló-kezelés következtében jelentkező intraocularis vérzések kialakulásában. Ennek alapján nem merült fel a kezelés idején a thrombocytagátló terápia felfüggesztése, amelyet az alapbetegségből származó kockázat–haszon mérlegelése sem indokolt. Ugyanakkor szisztémás hajlamosító tényezőként a magasvérnyomás-betegség, az előrehaladott életkor és a generalizált arterioszklerózis betegünknél halmozottan fennálltak, amelyek az érfal strukturális gyengülésén keresztül fokozott kockázatot jelenthettek, mind a submacularis mind a chorioidea-ablatio vonatkozásában.
Esetünk jól mutatja, hogy az első vonalban alkalmazott terápiás eszköz megválasztásánál a fennálló szisztémás rizikófaktorokat ugyanolyan körültekintően kell értékelni, mint az ocularis tényezőket – akárcsak a centrális makuláris vastagságot. Az események sorozata rámutat, hogy egy alapvetően biztonságos terápiás eszköz esetén, a halmozott vaszkuláris kockázati tényezők szokatlan és súlyos intraocularis vérzéses szövődményekhez vezethetnek, amit eddig az irodalomban nem, vagy csak elvétve jeleztek. Az azonnali intravitreális VEGF-gátló-kezelés elindításával, vérzéscsillapító gyógyszerekkel, majd a sürgősséggel elvégzett pars plana vitrectomiával széles spektrumon, általánosan elfogadott terápiás módszereket alkalmaztunk. Sajnálatos körülmény, hogy betegünk további kontrollvizsgálatokon nem jelent meg, így a beavatkozások eredményeit átfogóan nem tudjuk értékelni. Ettől függetlenül esetünk didaktikus, elemzésre és a gondolatmenet továbbvitelére érdemes.
Nyilatkozat
A szerzők kijelentik, hogy esetismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Brouzas D, Koutsandrea C, Moschos M, Papadimitriou S, Ladas I. Apostolopoulos M. Massive choroidal hemorrhage after intravitreal administration of bevacizumab (Avastin) for AMD followed by controlateral sympathetic ophthalmia. Clin Ophthalmol 2009; 3: 457–9.
https://doi.org/10.2147/opth.s4641.
Epub 2009 Aug 20
2. Brown DM, Michels M, Kaiser PK, Heier JS, Sy JP, Ianchulev T; ANCHOR Study Group. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study. Ophthalmology 2009 Jan; 116(1): 57–65.e5.
https://doi.org/10.1016/j.ophtha.2008.10.018
3. Brown KR, Yannuzzi NA, Smiddy WE, Gregori NZ, Berrocal AM, Haddock LJ, Schwartz SG, Lee WH, Sridhar J, Wu DM, Flynn HW Jr, Townsend JH. Rhegmatogenous Retinal Detachment after Intravitreal Injection. Ophthalmol Retina 2021 Feb; 5(2): 178–183. Epub 2020 Jul 14.
https://doi.org/10.1016/j.oret.2020.07.007
4. Chu TG, Green RL. Suprachoroidal hemorrhage. Surv Ophthalmol 1999 May–Jun; 43(6): 471–86.
https://doi.org/10.1016/s0039-6257(99)00037-5
5. Foo R, Tsai A, Lim L. Management of suprachoroidal hemorrhage. American Academy of Ophthalmology Web site.
https://www.aao.org/eyenet/article/management-of-suprachoroidal-hemorrhage.
6. Glatt H, Machemer R. Experimental subretinal hemorrhage in rabbits. Am J Ophthalmol 1982 Dec; 94(6): 762–73.
https://doi.org/10.1016/0002-9394(82)90301-4
7. Goverdhan SV, Lochhead J. Submacular haemorrhages after intravitreal bevacizumab for large occult choroidal neovascularisation in age-related macular degeneration. Br J Ophthalmol 2008 Feb; 92(2): 210–2.
https://doi.org/10.1136/bjo.2007.127902
8. Hasegawa T, Otani A, Sasahara M, Gotoh N, Ooto S, Tamura H, Yamashiro K, Tsujikawa A, Yoshimura N. Prognostic factors of vitreous hemorrhage secondary to exudative age-related macular degeneration. Am J Ophthalmol 2010 Feb; 149(2): 322–329.e1. PMID: 20103057.
https://doi.org/10.1016/j.ajo.2009.09.012.
9. Iguchi Y, Ito Y, Kikuchi M, Ishikawa K, Oshima H, Yatsuya H, Terasaki H. Seasonal variations of acute massive submacular haemorrhage associated with age-related macular degeneration. Br J Ophthalmol 2006 Oct; 90(10): 1256–8.
https://doi.org/10.1136/bjo.2006.099259
10. Jones RK, Khan IJ, Habal S. Suprachoroidal haemorrhage following intravitreal injection. Postgrad Med J 2017 Jan; 93(1095): 56.
Epub 2016 Jul 25.
https://doi.org/10.1136/postgradmedj-2016-134144.
11. Loukopoulos V, Meier C, Gerding H. Hemorrhagic complications after intravitreal injections of ranibizumab in patients under coumarin-type anticoagulation. Klin Monbl Augenheilkd 2010 Apr; 227(4): 289–91.
Epub 2010 Apr 20.
https://doi.org/10.1055/s-0029-1245225
12. Mason JO 3rd, Frederick PA, Neimkin MG, White MF Jr, Feist RM, Thomley ML, Albert MA Jr. Incidence of hemorrhagic complications after intravitreal bevacizumab (avastin) or ranibizumab (lucentis) injections on systemically anticoagulated patients. Retina 2010 Oct; 30(9): 1386–9.
https://doi.org/10.1097/IAE.0b013e3181e09739
13. Modarres M, Naseripour M, Falavarjani KG, Nikeghbali A, Hashemi M, Parvaresh MM. Intravitreal injection of 2.5 mg versus 1.25 mg bevacizumab (Avastin) for treatment of CNV associated with AMD. Retina 2009 Mar; 29(3): 319–24.
https://doi.org/ 10.1097/IAE.0b013e318198148e
14. Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, Kim RY; MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006 Oct 5; 355(14): 1419–31.
https://doi.org/ 10.1056/NEJMoa054481
15. Sanders D, Peyman GA, Fishman G, Vlchek J, Korey M. The toxicity of intravitreal whole blood and hemoglobin. Albrecht Von Graefes Arch Klin Exp Ophthalmol 1975 Dec 4; 197(3): 255–67.
https://doi.org/10.1007/BF00410870
16. Shin JY, Lee JM, Byeon SH. Anti-vascular endothelial growth factor with or without pneumatic displacement for submacular hemorrhage. Am J Ophthalmol 2015 May; 159(5): 904–14.e1. Epub 2015 Jan 28.
https://doi.org/10.1016/j.ajo.2015.01.024.
17. Shin YI, Sung JY, Sagong M, Lee YH, Jo YJ, Kim JY. Risk factors for breakthrough vitreous hemorrhage after intravitreal anti-VEGF injection in age-related macular degeneration with submacular hemorrhage. Sci Rep 2018 Jul 12; 8(1): 10560.
https://doi.org/10.1038/s41598-018-28938-1
18. Toth CA, Morse LS, Hjelmeland LM, Landers MB 3rd. Fibrin directs early retinal damage after experimental subretinal hemorrhage. Arch Ophthalmol 1991 May; 109(5): 723–9.
https://doi.org/10.1001/archopht.1991.01080050139046
19. Wolter JR, Garfinkel RA. Ciliochoroidal effusion as precursor of suprachoroidal hemorrhage: a pathologic study. Ophthalmic Surg 1988 May; 19(5): 344–9.
