New insights into geographic atrophy
doi: 10.55342/szemhungarica.2024.161.2.62
Original scientific paper
Summary
Geographic atrophy (GA) is one of the dry forms of age-related macular degeneration that causes severe visual impairment, which increases social challenges, but is also the subject of intensive research. The purpose of this continuing education review is to present up-to-date results of the state of science in relation to GA. With the development and wider access to multimodal imaging, both early diagnosis and progression monitoring have become possible. Certain microstructural abnormalities of the retina serve as biomarkers in establishing a prognosis. In addition to the traditional visual examination methods, other visual functional tests are also justified in the case of GA to accurately follow the patient's complaints. Effective drugs have already appeared in the therapeutic arsenal of GA, which was untreatable previously, and their continuous expansion is expected.
Összefoglaló
A geografikus atrófia (GA) az időskori makuladegeneráció száraz típusú és nagyfokú látásromlást okozó formája, amely társadalmilag egyre nagyobb kihívásokat okoz, ugyanakkor intenzív kutatás témáját is képezi. Jelen továbbképző közlemény célja a tudomány állásának naprakész eredményeit bemutatni a GA-val kapcsolatban. A multimodális képalkotás fejlődésével és egyre szélesebb körű elterjedésével mind a korai diagnózis, mind a progresszió követése lehetővé vált. A retina bizonyos mikrostrukturális eltérései biomarkerként szolgálnak a kórjóslat felállításában. A hagyományos visusvizsgáló módszerek mellett egyéb látás funkcionális vizsgálatok is indokoltak GA esetében a beteg panaszainak pontos követésében. A korábban egyáltalán nem kezelhető GA terápiás tárházában napjainkra már megjelentek hatékony gyógyszerek, amelyek folyamatos bővülése várható.Keywords
geographic atrophy, age-related macular degeneration, multimodal imaging, optical coherence tomography, blindness
Kulcsszavak
geografikus atrófia, időskori makuladegeneráció, multimodális képalkotás, optikai koherencia tomográfia, vakság
Bevezetés
Az időskori makuladegeneráció (Age-related macular degeneration – AMD) a felnőttkori szerzett látásromlás vezető oka az iparilag fejlett országokban és hazánkban is (1), jelentősége kiemelten fontos az 50 év feletti populációban. A szemfenéki kép alapján típusát tekintve száraz (nonexsudatív) és nedves (exsudatív) formáit különböztetjük meg (2). Stádium tekintetében kezdődő, intermedier és előrehaladott kategóriába sorolható (3). A típus és a stádium meghatározza a látáskárosodás mértékét (4). Mind a száraz, mind a nedves típus okozhat nagyfokú látásromlást, jelen közlemény témája az előrehaladott száraz típusú makuladegeneráció ún. geografikus atrófia (GA). A folyamatok megértéséhez azonban nélkülözhetetlen a betegség kórfolyamatainak megértése, amely a korábbi stádiumok rövid összefoglalását is jelenti. A GA kezelése kiemelt figyelmet kap a gyógyszerfejlesztések területén, az Egyesült Államokban 2023-ban két hatóanyagot is törzskönyveztek a betegség kezelésére. Az összefoglaló közleményben a jelenleg is folyó intenzív kutatómunka során körvonalazódó új kezelési módszereket is ismertetjük.
Epidemiológia
Az AMD a 2020. évi becslések alapján mintegy 196 millió embert érint világszerte, közel 20 millióra volt tehető az USA-ban AMD-vel élők száma 2019-ben, akik közül mintegy 1,5 millió betegnek előrehaladott állapotú stádium miatt romlott meg a látása (5). Az előrejelzések szerint az átlagéletkor növekedésével 2040-re akár a 288 milliót is elérheti világszerte az AMD-ben érintettek száma (6–8). Az összesített prevalencia 8,69% a 45–85 éves korosztályban, amely terén etnikai különbségek figyelhetők meg: 12,33% az európai származásúak körében, 10,43% a latinok körében, 7,53 az afrikai és 7,38% az ázsiai eredetűek körében (8). Az előrehaladott AMD éves incidenciája az USA-ban 0,35% fő az 50 évesnél idősebbek körében (9), amely Fisher 8 évig tartó prospektív vizsgálata alapján a kaukázusiak körében a legmagasabb, mintegy 4,1%-ra tehető (10). A GA az AMD száraz típusú előrehaladott formáját jelenti, amely a világon több mint 5 millió embert érint, a prevalenciája 0,81% főre tehető az USA-ban, és gyakorisága jóval magasabb a 80 évnél idősebbek körében (6,89%), míg a GA kockázatát magába foglaló 125 µm-nél nagyobb drusen prevalenciája 6,12%-ra tehető (11).
Klinikai jellemzők és kóroki tényezők
A GA kialakulásának pontos folyamata nem ismert, a patogenezisben elsődlegesen a retinalis pigmentepithelium (RPE) progresszív degenerációja zajlik, amellyel egyidejűleg a környezetében lévő szövetek is sorvadnak, mint a choriocapillaris és a fotoreceptorok rétegei is, amelyek együttesen vezetnek látásfunkció csökkenéséhez (11). A GA az esetek többségében csak később okoz látóélesség-csökkenést, mindaddig, amíg a fovea területe nem érintett, a hagyományos visusvizsgálatok nem fedik fel a látásfunkció csökkenését, azok nem korrelálnak a beteg panaszaival (12). Chakravarthy szerint a GA diagnózisának időpontjában a betegek 7,1%-ában már a látásromlás igazolódott kétoldali GA esetében az Egyesült Királyságban 16% jogi vakság alakult ki 6,2 év alatt (13). A mentális egészség hanyatlása és az életminőség romlása is észlelhető a GA progressziója esetén (14, 15).
Tünetek
A GA esetében a legalapvetőbb funkcionális vizsgálat az ETDRS- táblán mért legjobb korrigált látóélesség (BCVA – best corrected visual acuity). A fovea megtartottsága esetén még előrehaladottabb esetekben is sokszor teljes, vagy csaknem teljes visus mérhető. A betegek mégis rossz látásról számolnak be főleg a parafoveális területek érintettsége miatt, elsődlegesen olvasás (keresztrejtvényfejtés), illetve romló kontraszt és színlátás mellett. A funkcionális zavarok nagyban rontják az életminőséget, az önellátás képességét és kockázati tényezőt is jelentenek, pl. balesetek tekintetében. A hagyományos visusvizsgálat mellett az alacsony megvilágítású visusvizsgálat (low-luminance VA – LLVA) és olvasási sebesség mérése végezhető. Előbbi az LLVA egy 2,0 log neutrális (szürke) szűrő előtétlencsével végzett ETDRS BCVA-vizsgálatnak felel meg. Az olvasási sebesség a hagyományos ETDRS-táblán, vagy a Radner-táblákkal vizsgálható.
A Radner-táblák komplexebb, standardizált nyelvtani szerkezetű, azonos számú betűből és azonos hosszúságú szavakból felépülő, azonos nehézségű mondatokat tartalmaznak, a hagyományos olvasótáblán ismert egyre csökkenő méretben. Az olvasási sebességet logaritmikus formában adjuk meg (logarithm of the reading acuity determination – logRAD), amelyen azt értjük, hogy melyik az a legkisebb betűvel szedett mondat, amelyet még 30 másodpercen belül el tud olvasni a beteg. A maximális olvasási sebességet a percenként elolvasott szavak száma is jellemzi (words per minute – wpm) (16). Hasonlóan használható (de minden adott nyelvre validálni kell) a Minnesota Low-vision Reading Test-tábla (MNREAD) (17). A vizsgálatok eredményét jelentősen befolyásolja, hogy monokuláris vagy binokuláris módon végezzük. A GA-léziók elhelyezkedése nagyban meghatározza a fenti funkciókat, elsődlegesen a parafoveális felső és jobb oldali ETDRS-mezőkre lokalizált léziók rontják az olvasási képességet, amelyet a mikroperimetriás vizsgálatok is megerősítettek.
Diagnosztika és képalkotás
A GA diagnosztikája a hagyományos szemfenék-vizsgálaton túl a multimodális képalkotáson alapszik. A képalkotás hozzájárul a korai diagnózis, a progresszió követése és a prevenció, illetve a napjainkra megjelenő új kezelési módszerek hatásainak felméréséhez. A multimodális képalkotás jelenti az optikai koherencia tomográfia (OCT), a színes fundusfotó (CFP), a vörösmentes fotó, az infravörös (IR), a fundus autofluoreszcencia (FAF) és a fluoreszcein-angiográfia (FA) felvételek együttes értékelését (18). A GA leírásában sokféle kifejezés terjedt el (19). A különböző képmodalitások komplex értelmezésében segít a Classification of Atrophy Meeting (CAM) munkacsoport, amely közleményeiben foglalja össze a GA képalkotásának értelmezési lehetőségeit (20, 21).
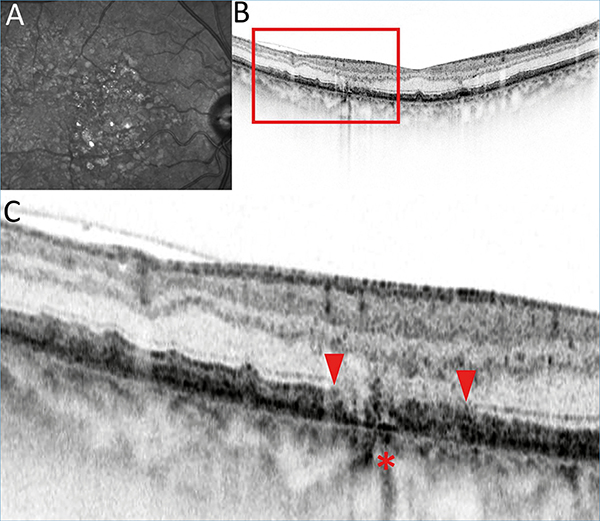
A hagyományos CFP és vörösmentes fundusfotó hagyományosnak számít a szemfenéki kórképek rögzítésében, amely alkalmas a GA követésére (1. ábra), de egyéb modalitások több információt nyújtanak (22).
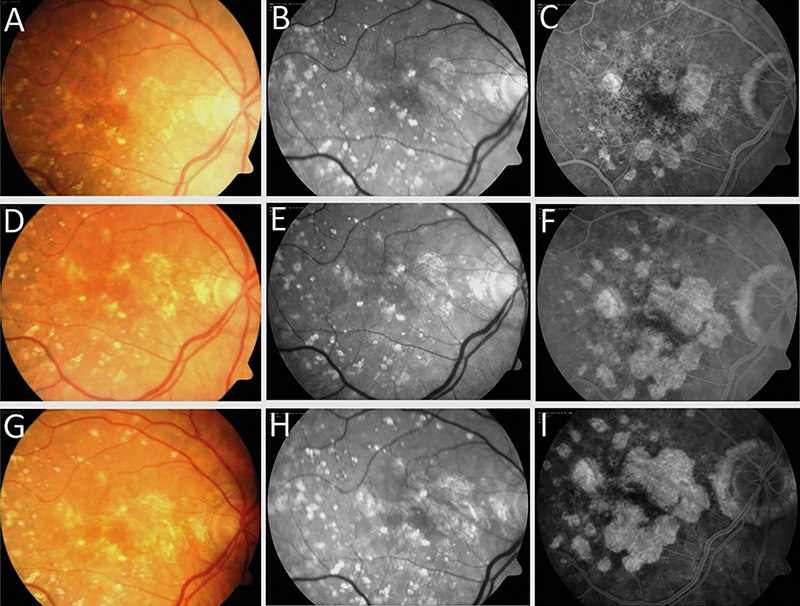
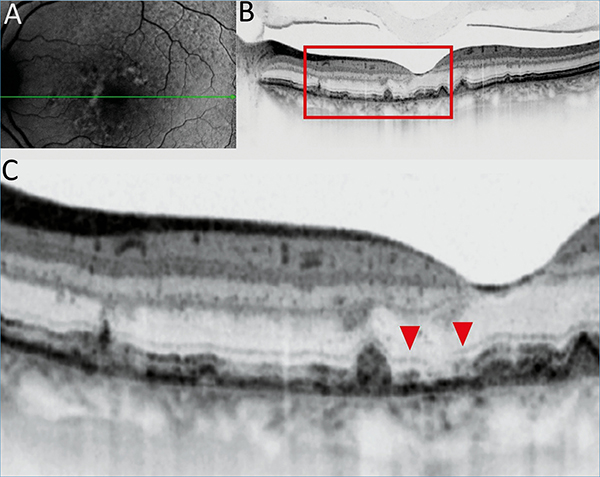
A FAF a hipofluoreszcens területek pontos kimutatásában segít, meghatározva az RPE-sorvadás méretét és elhelyezkedését. Az RPE-sejtek fluorofórjainak függvényében autofluoreszkál, amely jelentősen csökken sorvadás esetén. A fovea fiziológiásan is alacsony autofluoreszcens terület, így a GA fovea érintettségének felmérését ez nehezítheti, ebben segít az OCT és az NIR (infravörös közeli – near-infrared reflectance.) A hipoautofluoreszcenciájú területeket szabálytalanul hiperautofluoreszcens szövetek veszik körül általában (23), amely jellemzi a sorvadás fokozódását. A FAF alkalmas a progresszió követésére a legkönnyebben (2. ábra).
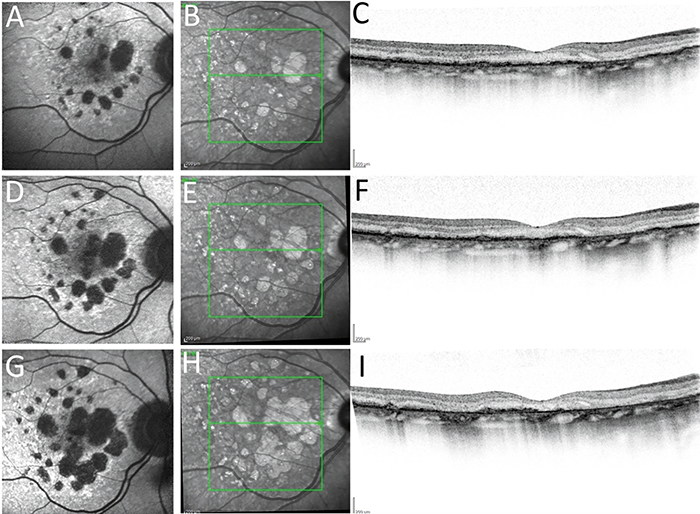
Az éles kontraszt miatt az automatikus képelemző szoftverek algoritmusai is könnyen felismerik a határait (24). Az alkalmazott excitáló fény hullámhosszának megfelelően különböző FAF-fajtákat különböztetünk meg: zöld, azaz green-light fundus autofluoreszcencia (GAF; excitáció = 518 nm) versus kombinált kék, azaz blue-light fundus autofluorescence (BAF; excitáció = 488 nm) és megemlítendő az infravörös közeli (NIR; 820 nm) (19). Ezek bármelyike alkalmazható a gyakorlatban, a legtöbb készülékben leginkább a BAF az elterjedt modalitás.
Az AMD diagnosztikájában alapvető FA, elsődlegesen az exsudatív formában. GA esetében a FA-felvételen a GA-lézió éles határú korai hiperfluoreszcens területként ábrázolódik, amelyet RPE-ablakdefektusnak is nevezünk, hiszen az RPE-hiányon keresztül a chorioideakeringés láthatóvá válik, amelyet az ép RPE normálesetben elfedne (1. ábra). Tekintettel az invazív vizsgálati módszerre, a rendszeres követésre való alkalmazása háttérbe szorult.
Osztályozás
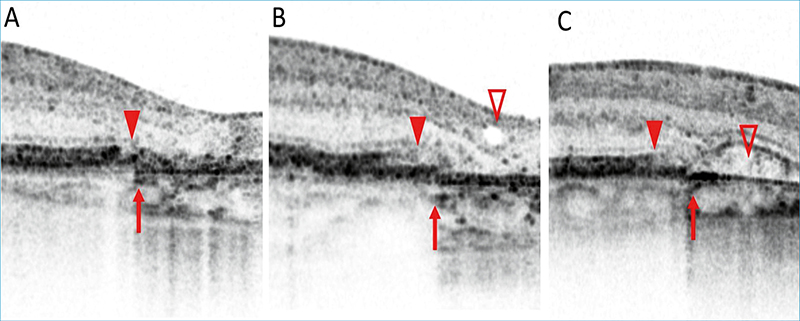
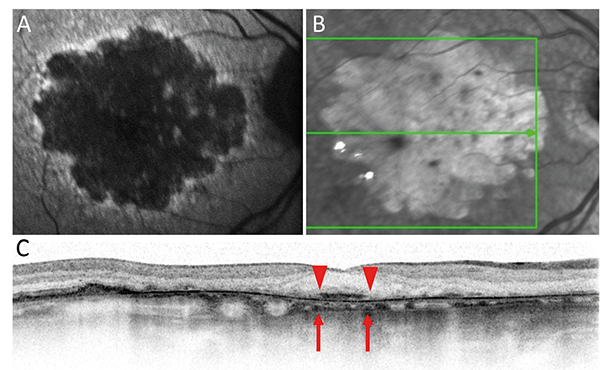
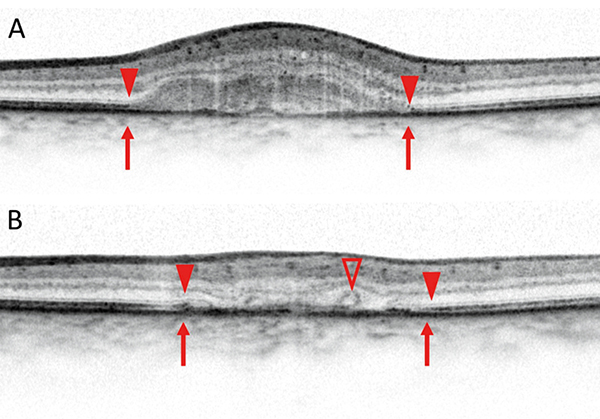
A CAM-klasszifikáció elsősorban az OCT-vel észlelhető sorvadásos eltérések elemzésén alapul, ezért ezt részletesebben ismertetjük az alábbiakban. Az OCT-felvételeken az RPE, a külső retina- és a chorioidea-atrófia részletesen elemezhető. Jellegzetesen elvékonyodik, illetve felszívódik az RPE és a fotoreceptor-réteg. A sorvadt RPE-n keresztül áttűnik, azaz magasabb reflektivitással ábrázolódik a chorioidea (choroidal signal hypertransmission). A készülékek felbontó képességének növekedésével a CAM-klasszifikáció szerint megkülönböztethető részleges és teljes RPE és külső retinaatrófia a progresszió függvényében (1. táblázat, 3–6. ábra).

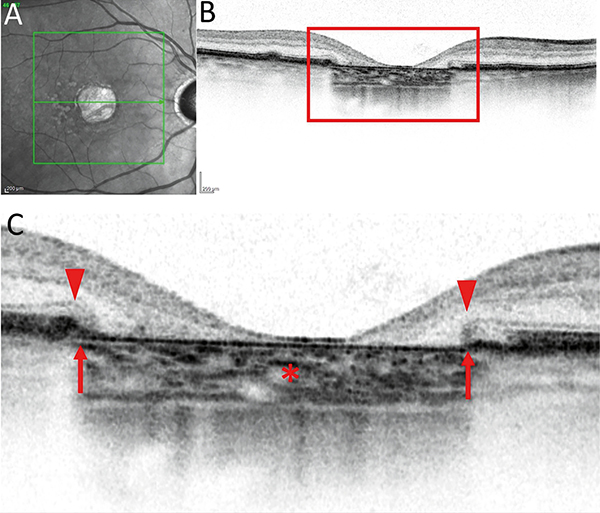
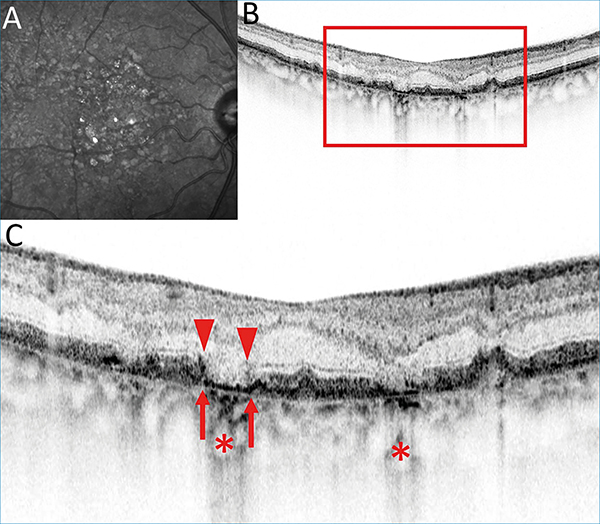
A részleges RPE és külső retinaatrófia (Incomplete RPE and outer retinal atrophy – iRORA) jellegzetessége, hogy a drusen mellett megjelenik a chorioidea fokozott reflektivitása (hipertranszmisszió), ugyanitt az RPE és a felette lévő fotoreceptor-réteg is degenerálódik. Az iRORA jelei kockázati tényezőt jelentenek a teljes RPE és fotoreceptor-sorvadásra (complete RPE and outer retinal atrophy – cRORA). A cRORA definíciója legalább 250 μm átmérőjű teljes RPE- és fotoreceptor-sorvadás. Fontos kitétel, hogy az RPE-ruptura mellett kialakuló hasonló kép nem cRORA-nak felel meg. Amennyiben az RPE még nem sorvadt, akkor is kialakulhat a külső retina sorvadása. A külső retinasorvadás lehet teljes (complete outer retinal atrophy – cORA) és részleges (incomplete out retinal atrophy – iORA). Az ellipszoid zóna (EZ) és a membrana limitans externa (ELM) folytonossága megszakad ezen esetekben és elvékonyodik a külső retina és az interdigitációs zóna (IZ), de az RPE folytonossága követhető.
Progresszió és kockázatok
A Szemészet hasábjain Seres összefoglaló közleményében kitér a GA kockázatait jellemző biomarkerekre is (29, 30). Az AREDS és az AREDS 2-tanulmányok hosszú távú követései alapján bizonyos biomarkerek a GA gyorsabb növekedésének kockázatát jelentik. Annál nagyobb kifejezettebb a progresszió, minél több a GA-folt, minél nagyobb a folt mérete, minél kevésbé centrális és minél inkább van hiperautofluoreszcens szegélye. Kétoldali GA esetén a prognózis rosszabb (31, 32).
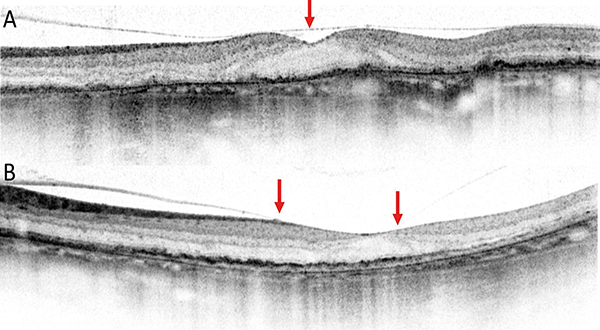
OCT-alapú biomarkerként említhető, hogy Fleckenstein és Moussa leírása szerint az RPE-fotoreceptor komplex a GA határán különböző formátumban jelenhet meg, amely prognosztikai jelentőséggel bír (24, 33). Az RPE–Bruch-membrán felépítése alapján lehet szabályos, szabálytalan és hasadt formájú (7. ábra).
A makula területében GA esetén jellemzően az érhártya is elvékonyodik. A chorioidea-vastagság, mint OCT-biomarker oly módon értelmezhető, hogy megtartott vastagsághoz képest a vékony chorioidea kedvezőtlen jel a progresszió szempontjából (8. ábra).
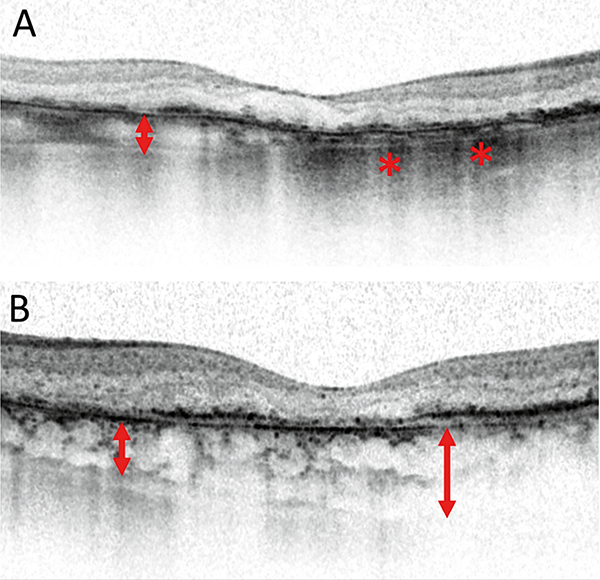
Kedvezőtlenül befolyásolja a makula sorvadását, amennyiben vitreomakuláris trakció, vagy ERM társul hozzá (9. ábra).
Az FAF-biomarker jellegzetességei az atrófia perifériás szegélyének fokozott autofluoreszcenciáját jelenti, amely az aktivitásra utal (10. ábra).
A visusfelvételkor a fovea funkcióját mérjük. Az ETDRS-tábla előnye a soronkénti 5 betű megjelenítés, amely már az olvasáshoz hasonló funkcionális teszt is egyben. Az olvasási képesség szempontjából a subfoveális terjedésű GA a legfontosabb akadály, de a juxta-, vagy extrafoveális foltok okozta apró szkotomáknak megfelelően kifejezett olvasási nehézséget okoznak a betegeknek. Az olvasási sebesség mérése ezáltal jellemzi a GA funkcionális károsító hatását. A GA-sorvadásos foltok az esetek 70%-ában nem centrálisan indulnak, de az első észleléstől számított átlagosan 2,5 év alatt válnak subfoveális terjedésűvé (34). Ötéves távlatban a betegek csaknem kétharmadánál eléri a foveát a sorvadás (31). A GA növekedése sajnos nem zárja ki az exsudatív AMD kialakulását, GA talaján az esetek kb. harmadában alakul ki érújdonképződés 4 éven belül.
Érújdonképződéssel járó nedves típusú AMD kezelése kapcsán is észlelhető GA kialakulása. A Seven-Up-tanulmányban azt találták, hogy 7 évvel az antiVEGF-kezelés megkezdése után az esetek 98,2%-ában alakult ki FAF alapján GA, és 89,7%-ban ez a fovea területét is érintette (35). A sikeres anti-VEGF-kezelések mellett tehát még több GA megjelenésére kell számítanunk, mint az anti-VEGF-korszak előtti időszakban (36). Jó esetben a makulában a heg kisebb méretű lesz, vagy egyáltalán nem alakul ki, de a sorvadás nem kerülhető el a legtöbb esetben (11. ábra).
A fotoreceptor-réteg pusztulására utal a külső tubuláció (outer retinal tubulation – ORT). Az RPE repedése pigmenthám elemelkedések kezelése kapcsán kialakulhat, amely GA-ra emlékeztető képet alakít ki, a repedés mellett teljes RPE-fotoreceptor-sorvadás alakul ki, amely leginkább a cRORA-ra emlékeztet, de eltérő patomechanizmus mellett jön létre (12. ábra).
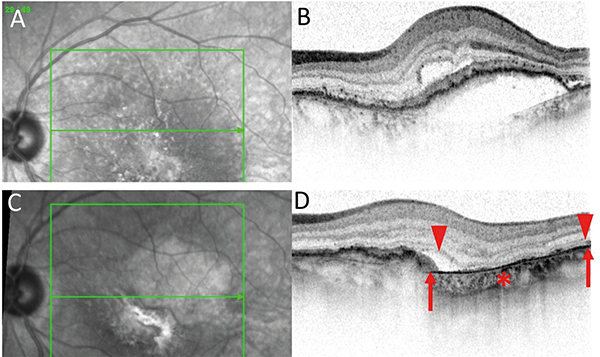
A: IR-képen a PED-del járó exsudatív AMD, B: OCT. C: IR-felvétel az RPE-ruptura után, D: OCT- felvételen a hiányzó RPE. Nyíl: az RPE határa. Nyílhegy: A fotoreceptorok határa. *fokozott chorioidea-transzmisszió. Rövidítés lásd a szövegben
A GA-betegek követése jellemzően 6-12 havonta javasolt, amennyiben nincs panasza a betegnek. A mesterséges intelligencia már szolgáltat eredményeket a betegség lefolyásával kapcsolatban (37, 38, 39), amely tovább árnyalja majd a kórjóslattal kapcsolatos ismereteinket. A közeljövőben elérhetővé váló kezelések tükrében az ellenőrzés ütemezése azonban várhatóan változni fog.
Terápiás lehetőségek
Az AMD-s betegek számára előnyös lehet a nagy dózisú antioxidáns vitaminokból (C, E és béta-karotin) és cinkből álló étrend-kiegészítők alkalmazása, amelyekről megállapították, hogy csökkentik az előrehaladott AMD kialakulásának kockázatát (40).
Több tanulmány utal arra, hogy a komplementrendszer, a veleszületett immunrendszer egyik összetevője fontos szerepet játszik a GA kialakulásában.
A genetikai vizsgálatok kimutatták, hogy az AMD-vel összefüggésbe hozható genetikai polimorfizmusok a komplementfehérjéket kódoló génekben vagy azok közelében lokalizálódtak (41).
A genetikai vizsgálatokon kívül szövettani vizsgálatok komplementfehérjéket találtak a drusenben, valamint a komplementfehérjék emelkedett szintjét a postmortem AMD-s szemek külső retinaszövetében (42, 43). Továbbá, GA-ban szenvedő egyéneknél a plazmában az aktivált komplementtermékek emelkedett szintjét találták (44). Ezen eredmények alapján több, a komplementrendszert célzó gyógyszer vizsgálata indult a GA kezelésére (45, 46) és 2023-ban az Egyesült Államokban már két GA kezelését célzó intravitrealisan alkalmazott gyógyszer törzskönyvezése is megtörtént.
Pegcetacoplan
A pegcetacoplan (Syfovre; Apellis Pharmaceuticals Waltham, Massachusetts, USA) C3 komplement gátló, amelynek hatékonyságát a III. fázisú multicentrikus, randomizált, kettősen maszkolt, álinjekcióval kontrollált OAKS- és a DERBY-vizsgálatok igazolták, amelyekben összesen 637, illetve 621, 60 éves vagy idősebb GA-ban szenvedő beteg vett részt (47). Az elsődleges végpont a GA-elváltozások FAF-fal mért teljes területének változása volt 12 hónap alatt.
Mind a Syfovre havi, mind a kéthavonta történő beadása a GA-elváltozás növekedési ütemének szignifikáns csökkenését mutatta az álinjekcióhoz képest. Az OAKS-vizsgálatban a havi adagolás 22%-os csökkenést eredményezett (p <0,0001), míg a kéthavi adagolás 18%-os csökkenést (p = 0,0002) mutatott a GA-elváltozás növekedésében 24 hónap alatt (47). A DERBY-vizsgálatban a havi adagolás 19%-os csökkenést (p = 0,0004), a kéthavonta végzett adagolása pedig 16%-os csökkenést (p = 0,003) eredményezett a GA-elváltozás növekedésében ugyanezen időtartam alatt (47).
A DERBY és az OAKS együttes 18 hónapos eredményei azt mutatták, hogy a pegcetacoplan 23%-kal, illetve 18%-kal csökkentette a GA-elváltozás növekedésének mértékét az álinjekcióval kezelt csoporthoz képest. Ezek az adatok vezettek ahhoz, hogy az FDA 2023 februárjában törzskönyvezte a pegcetacoplant, mint a GA első kezelési lehetőségét (46).
Bár a látóélességben a kezelt csoportban nem tapasztaltak javulást, a III. fázisú vizsgálat új adatai azt mutatták, hogy a havonta és a kéthavonta pegcetacoplant kapó betegeknél a mikroperimetriával mért retinaérzékenység csökkenése kisebb volt, és kevesebb új szkotómát tapasztaltak az álinjekcióval kezelt csoporthoz képest (48).
Egy másik fontosnak tűnő pont a fotoreceptorok állapotának megőrzése. A poszt hoc elemzés mind a havi, mind a kéthavonta alkalmazott kezeléseknél a kontrollcsoporthoz viszonyítva a külső magvas réteg (ONL) kifejezetten vastagabb volt, valamint a 12. hónapra a pegcetacoplan-kezelt szemekben a fotoreceptorok belső szegmentumának vastagabbnak bizonyult a kontrollcsoporthoz képest (49).
A klinikai vizsgálatokban a pegcetacoplan adása során a kezelt csoportban ugyanakkor szignifikánsan több subretinalis chorioideális érújdonképződés kialakulását figyelték meg. Két év alatt a havi adagolású csoportban a neovaszkuláris AMD előfordulása 12% volt, a kéthavonta adagolt csoportban 7%, szemben a kontrollcsoport 3%-ához képest (47). Ezek az eredmények kiemelik a Syfovre-t kapó betegek szoros nyomonkövetésének fontosságát a neovaszkuláris AMD esetleges kialakulása és az anti-VEGF-terápiák időben történő beadása szempontjából. Intraocularis gyulladás előfordulását (vitritis, üvegtesti sejtek, uveitis, csarnokvízben sejtek, iritis) a havonta Syfovre-t kapó betegek 4%-ánál és a kéthavonta kezelést kapó betegek 2%-ánál jelentették. Ezzel szemben intraocularis gyulladást az álinjekcióval kezelt betegek kevesebb, mint 1%-ánál figyeltek meg. Iszkémiás opticus neuropathiát a havonta SYFOVRE-t kapó betegek 1,7%-ánál, a kéthavonta kezelt betegek 0,2%-ánál, ezzel szemben a kontrollcsoportban egyetlen betegnél sem észleltek (47).
Az OAKS- és a DERBY-vizsgálatok során nem számoltak be retinitis vagy okkluzív/nonokkluzív vasculitis előfordulásairól. A SYFOVRE 2023. februári bevezetése óta azonban számos okkluzív és nem okkluzív vasculitises esetet jelentettek az FDA-nak (50).
Emellett a III. fázisú vizsgálat kiterjesztését is megkezdték, GALE (NCT04770545) néven. Ez a kiterjesztés az OAKS- és DERBY-vizsgálatokat befejező résztvevők 80%-át foglalja magában.
A nemrégiben közzétett 6 hónapos GALE-vizsgálat eredményei (azaz a 24 és 30 hónapos követési idő között összesen) 39%-kal, illetve 32%-kal csökkent GA-elváltozás növekedést mutattak ki a havi és a kéthavonta alkalmazott kezeléssel, az álinjekcióval kezelt kontrollcsoporthoz képest. Konkrétan a kezelés 45%-kal, illetve 33%-kal csökkentette a nem szubfoveális GA-lézió növekedését a havi és a kéthavonta alkalmazott kezeléssel, az álinjekcióval kezelt kontrollcsoporthoz képest (51).
Avacincaptad pegol
2023 augusztusában az amerikai Élelmiszer- és Gyógyszerügyi Hivatal (FDA) egy másik gyógyszer, az Izervay (avacincaptad pegol intravitreális oldat, Iveric Bio/Astellas, Cranbury, NJ) GA-ra történő alkalmazását is engedélyezte. A pegcetacoplanhoz hasonló módon az avacincaptad pegol is a komplementrendszerre hat azáltal, hogy a C5 komponenst célozza és gátolja (52). A gyógyszer regisztrációjához a III. fázisú GATHER1 és GATHER2 klinikai vizsgálatok szolgáltak alapul. A GATHER2-vizsgálatban a 2. évben a betegeknél a havi injekciókkal 14%-kal, a kéthavonta adott injekciókkal 19%-kal csökkent a GA növekedésének átlagos mértéke (46, 53). A pegcetacoplanhoz hasonlóan úgy tűnik, hogy a kezelés hatása a folyamatos alkalmazással növekszik, a kezelés hatása (a GA növekedésének átlagos mértéke a kiindulási értékhez képest) több mint kétszeresére nő 2 év alatt az 1 éves kezelés hatásához képest (46, 53).
Kiemelendő, hogy az avacincaptad pegollal kezelt betegeknél a kontrollcsoporttal összehasonlítva 56%-os csökkenést mutattak az egy év alatt bekövetkező tartós látásvesztés (15 betűvesztés) kockázatában (54).
Az avacincaptad pegollal történő kezelésnek a pegcetacoplanhoz hasonló kockázatai vannak, beleértve az endophthalmitis kockázatát, mint minden intravitreális injekció esetében, és a neovaszkuláris AMD kockázatát, amelynek aránya 11,6%, szemben a 9%-os álinjekcióval kezelt betegek esetében. A GATHER2-vizsgálatban csak egy nem súlyos intraocularis gyulladásról számoltak be (46, 53), így az avancicaptad pegol esetében a gyulladás kockázata kisebb lehet, mint a pegcetacoplan esetében. Az avancicaptad pegolról eddig kevesebb valós adat áll rendelkezésre, mivel nem olyan régóta van kereskedelmi forgalomban.
Jövőbeni lehetőségek
Számos klinikai vizsgálat van folyamatban a GA kezelésére, a szájon át szedhető gyógyszerektől a sejtterápiáig. Az alábbiakban két konkrét GA-tanulmányt mutatunk be, de természetesen elismerjük, hogy még sok más is fejlesztés alatt áll, és a jövőben kezelési lehetőséget jelenthet.
Génterápia
Jelenleg több génterápiás vizsgálat van folyamatban különböző stratégiák vizsgálatára, beleértve a komplement kaszkád gátlását és a szabályozó fehérjék fokozását. A génterápiában rejlő lehetőség, hogy mindössze egyetlen beavatkozással kezelje a betegséget, szemben a havonta, kéthavonta alkalmazott intravitrealis injekciós kezelésekkel.
Az egyik ilyen intravitrealisan alkalmazott génterápia a Janssen pharmaceuticals (Beerse, Belgium) által szponzorált JNJ-81201887 (46). Ebben a 2. b fázisú vizsgálatban 2024 tavaszától kezdődött meg a betegbeválogatás. A vizsgált készítmény, a JNJ8121201887 egy génterápia, amely egy anti-CD59-fehérjét kódol. A CD59 a komplementkaszkád utolsó komponense, és a CD59 aktivitásának gátlása csökkentheti a membrántámadási komplex kialakulását és az azt követő sejthalált.
Sejtterápia
A GA-ra alkalmazott sejtterápiák többsége elsősorban az RPE-sejtek transzplantációjára fókuszál. Egy I/II.a fázisú vizsgálatban (NCT02590692) a CPCB-RPE1 elnevezésű kompozit implantátummal 16 betegnél vizsgálták a humán embrionális őssejtekből (hESC) származó monolayer RPE-sejtek bejuttatásának megvalósíthatóságát (55, 57). Az implantátumot kapott 5 szem interim analízise az OCT-felvételek alapján a fotoreceptorok integrálódását jelezte a recipiensekben (56, 57). Figyelemre méltó, hogy az implantátumot kapott betegek egyikénél sem tapasztalták a látáscsökkenés (ETDRS-betűkben mérve) további progresszióját, és egy betegnél a beültetést követő 60. napon 17 betűs javulást tapasztaltak, amely a 120. napon is fennmaradt. Kiemelendő, hogy az RPE-transzplantáción átesett betegek egyikénél sem észleltek klinikailag releváns mellékhatásokat (56).
Következtetések
A geografikus atrófia az időskori makuladegeneráció száraz típusú és nagyfokú látásromlást okozó, korábban gyógyíthatatlannak és visszafordíthatatlannak tekintett formája, ma már ígéretes az Egyesült Államokban törzskönyvezett terápiával rendelkezik. A jelenleg még csak a tengerentúlon elérhető kezelési lehetőségek képesek – a komplement útvonal gátlásán keresztül – a betegséget jellemző látásromlás kialakulásának késleltetésre.
Sajnos, mint a legtöbb kezelésnek, ennek a beavatkozásnak is vannak lehetséges mellékhatásai, úgy, mint az érújdonképződés kialakulásának fokozott kockázata, vagy egy esetleges intraocularis gyulladás lehetősége.
A multimodális képalkotás adta lehetőségek tovább pontosíthatják ismereteinket nemcsak a betegség kórlefolyásáról, hanem arról is, hogy melyek azok a betegek, akik különösen sokat nyerhetnek az új kezelésekkel.
Különösen fontos a betegeknek a betegségük megértésére vonatkozó oktatása, az önellenőrzés fontosságának hangsúlyozása, a változások korai észlelése és a szemészorvos időben történő értesítése.
Várhatóan az új terápiás lehetőségek, a közeljövőben, Európában és hazánkban is megjelennek, és egyben új kihívást jelentenek nemcsak az ellátórendszernek, hanem a finanszírozónak is.
Nyilatkozat
A szerzőknek a közleményben szereplő készülékek, készítmények terén anyagi érdekeltsége nem áll fenn, a közlemény megírása anyagi támogatásban nem részesült. PA konzultáns: Apobiologix/Apotex, Akceso Advisors, Bayer, Formycon, Novartis, Roche.
Irodalom
1. Flaxman SR, Bourne RRA, Resnikoff S, Ackland P, Braithwaite T, Cicinelli MV, Das A, Jonas JB, Keeffe J, Kempen JH, Leasher J, Limburg H, Naidoo K, Pesudovs K, Silvester A, Stevens GA, Tahhan N, Wong TY, Taylor HR; Vision Loss Expert Group of the Global Burden of Disease Study. Global causes of blindness and distance vision impairment 1990–2020: a systematic review and meta-analysis. Lancet Glob Health 2017; 5: e1221–e1234.
https://doi.org/10.1016/S2214-109X(17)30393-5
2. Pámer Zs. Amit ma tudunk az időskori macula degenerációról – Irodalmi áttekintés. Szemészet 2013; 150: 1–16.
3. Ferris FL 3rd, Wilkinson CP, Bird A, Chakravarthy U, Chew E, Csaky K, et al. Clinical classification of age-related macular degeneration. Ophthalmology 2013; 120: 844–51.
https://doi.org/10.1016/j.ophtha.201
4. Fleckenstein M, Schmitz-Valckenberg S, Chakravarthy U. Age-Related Macular Degeneration: A Review. JAMA 2024; 331: 147–157.
https://doi.org/10.1001/jama.2023.26074
5. Fleckenstein M, Thiele S, Pfau M, Schmitz-Valckenberg S, Holz FG. Trockene altersabhängige Makuladegeneration – Epidemiologie und Klassifikation [Dry Age-Related Macular Degeneration – Epidemiology and Classification]. Klin Monbl Augenheilkd 2019; 236: 1068–1075. German.
https://doi.org/10.1055/a-0958-9621
6. Jonas JB, Cheung CMG, Panda-Jonas S. Updates on the epidemiology of age-related macular degeneration. Asia Pac J Ophthalmol (Phila) 2017; 6 (6): 493–497.
https://doi.org/10.22608/APO.2017251
7. Rein DB, Wittenborn JS, Burke-Conte Z, et al. Prevalence of age-related macular degeneration in the US in 2019. JAMA Ophthalmol 2022; 140: 1202–1208.
https://doi.org/10.1001/jamaophthalmol.2022.4401
8. Wong WL, Su X, Li X, Cheung CM, Klein R, Cheng CY, Wong TY. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014; 2: e106–16.
https://doi.org/10.1016/S2214-109X(13)70145-1
9. Rudnicka AR, Kapetanakis VV, Jarrar Z, et al. Incidence of late-stage age-related macular degeneration in American Whites: systematic review and meta-analysis. Am J Ophthalmol 2015; 160: 85–93.e3.
https://doi.org/10.1016/j.ajo.2015.04.003
10. Fisher DE, Klein BE, Wong TY, et al. Incidence of age-related macular degeneration in a multi-ethnic United States population: the Multi-Ethnic Study of Atherosclerosis. Ophthalmology 2016; 123: 1297–1308.
https://doi.org/ 10.1016/j.ophtha.2015.12.026
11. Clevenger, Leanne; Rachitskaya, Aleksandra. Identifying geographic atrophy. Current Opinion in Ophthalmology 2023; 34: 195–202.
https://doi.org/10.1097/ICU.0000000000000952
12. Bagheri S, Lains I, Silverman RF, et al. Percentage of foveal vs total macular geographic atrophy as a predictor of visual acuity in age-related macular degeneration. J Vitreoretin Dis 2019; 3: 278–282.
https://doi.org/10.1177/2474126419859454
13. Chakravarthy U, Bailey CC, Johnston RL, et al. Characterizing disease burden and progression of geographic atrophy secondary to age-related macular degeneration. Ophthalmology 2018; 125: 842–849.
https://doi.org/10.1016/j.ophtha.2017.11.036
14. Fonteh CN, Mathias MT, Mandava N, Manoharan N, Lynch AM, Navo R, Patnaik JL; University of Colorado Retina Research Group. Mental health and visual acuity in patients with age-related macular degeneration. BMC Ophthalmol 2022; 22: 391.
https://doi.org/10.1186/s12886-022-02602-9.
15. Péntek M, Brodszky V, Biró Z, Kölkedi Z, Dunai Á, Németh J, Baji P, Rencz F, Gulácsi L, Resch MD. Subjective health expectations of patients with age-related macular degeneration treated with antiVEGF drugs. BMC Geriatr 2017; 17: 233.
https://doi.org/10.1186/s12877-017-0619-9
16. Künzel SH, Lindner M, Sassen J, Möller PT, Goerdt L, Schmid M, Schmitz-Valckenberg S, Holz FG, Fleckenstein M, Pfau M. Association of Reading Performance in Geographic Atrophy Secondary to Age-Related Macular Degeneration With Visual Function and Structural Biomarkers. JAMA Ophthalmol 2021; 139: 1191–1199.
https://doi.org/10.1001/jamaophthalmol.2021.3826
17. Calabrèse A, Cheong AM, Cheung SH, He Y, Kwon M, Mansfield JS, et al. Baseline MNREAD measures for normally sighted subjects from childhood to old age. Invest Ophthalmol Vis Sci 2016; 57: 3836–3843.
https://doi.org/10.1167/iovs.16-19580
18. Farinha C, Cachulo ML, Coimbra R, et al. Age-related macular degeneration staging by color fundus photography vs. multimodal imaging-epidemiological implications (the Coimbra Eye Study-Report 6). J Clin Med 2020; 9: 1329
https://doi.org/10.3390/jcm9051329 PMID: 32370299
19. Pfau M, Goerdt L, Schmitz-Valckenberg S, Mauschitz MM, Mishra DK, Holz FG, Lindner M, Fleckenstein M. Green-Light Autofluorescence Versus Combined Blue-Light Autofluorescence and Near-Infrared Reflectance Imaging in Geographic Atrophy Secondary to Age-Related Macular Degeneration. Invest Ophthalmol Vis Sci 2017; 58: BIO121–BIO130.
https://doi.org/10.1167/iovs.17-21764
20. Schmitz-Valckenberg, Steffen MD, FEBO; Sadda, Srinivas MD; Staurenghi, Giovanni MD; Chew, Emily Y. MD; Fleckenstein, Monika MD; Holz, Frank G. MD, FEBO for the CAM (Classification of Atrophy Meeting)-Group. GEOGRAPHIC ATROPHY: Semantic Considerations and Literature Review. Retina 2016; 36: 2250–2264.
https://doi.org/10.1097/IAE.0000000000001258
21. Guymer RH, Rosenfeld PJ, Curcio CA, Holz FG, Staurenghi G, Freund KB, Schmitz-Valckenberg S, Sparrow J, Spaide RF, Tufail A, Chakravarthy U, Jaffe GJ, Csaky K, Sarraf D, Monés JM, Tadayoni R, Grunwald J, Bottoni F, Liakopoulos S, Pauleikhoff D, Pagliarini S, Chew EY, Viola F, Fleckenstein M, Blodi BA, Lim TH, Chong V, Lutty J, Bird AC, Sadda SR. Incomplete Retinal Pigment Epithelial and Outer Retinal Atrophy in Age-Related Macular Degeneration: Classification of Atrophy Meeting Report 4. Ophthalmology 2020; 127: 394–409.
https://doi.org/10.1016/j.ophtha.2019.09.035
22. Papp A. Az OCT szerepe az időskori macula degeneratio diagnosztikájában. In: Optikai koherencia tomográfia a szemészetben.. Szerk: Nagy Zoltán Zsolt. Budapest: Semmelweis Kiadó; 2018. p. 94–106.
ISBN 978-963-331-437-1
23. Holz FG, Bindewald-Wittich A, Fleckenstein M, Dreyhaupt J, Scholl HP, Schmitz-Valckenberg S; FAM-Study Group. Progression of geographic atrophy and impact of fundus autofluorescence patterns in age-related macular degeneration. Am J Ophthalmol 2007; 143: 463–472.
https://doi.org/10.1016/j.ajo.2006
24. Fleckenstein M, Schmitz-Valckenberg S, Martens C, Kosanetzky S, Brinkmann CK, Hageman GS, Holz FG. Fundus autofluorescence and spectral-domain optical coherence tomography characteristics in a rapidly progressing form of geographic atrophy. Invest Ophthalmol Vis Sci 2011; 52: 3761–3766.
https://doi.org/10.1167/iovs.10-7021
25. Sadda SR, Guymer R, Holz FG, Schmitz-Valckenberg S, Curcio CA, Bird AC, Blodi BA, Bottoni F, Chakravarthy U, Chew EY, Csaky K, Danis RP, Fleckenstein M, Freund KB, Grunwald J, Hoyng CB, Jaffe GJ, Liakopoulos S, Monés JM, Pauleikhoff D, Rosenfeld PJ, Sarraf D, Spaide RF, Tadayoni R, Tufail A, Wolf S, Staurenghi G. Consensus Definition for Atrophy Associated with Age-Related Macular Degeneration on OCT: Classification of Atrophy Report 3. Ophthalmology 2018; 125: 537–548.
https://doi.org/10.1016/j.ophtha.2017.09.028
26. Resch M, Németh C, Barcsay G, Ecsedy M, Borbándy Á, Géhl Z, Balogh A, Szabó A, Nagy ZZ, Papp A. Szemfenéki érfestés festék nélkül: Az optikai koherencia tomográfia alapú angiográfia exsudativ típusú időskori maculadegenerációban [Angiography of the ocular fundus without dye: Optical coherence tomography based angiography in exsudative age-related macular degeneration]. Orv Hetil 2016; 157: 1683–1690. Hungarian.
https://doi.org/10.1556/650.2016.30548
27. Resch MD, Balogh A, Deák GG, Nagy ZZ, Papp A. Vascular density in age-related macular degeneration after one year of antiVEGF treatment with treat-and-extend and fixed regimens. PLoS One 2020; 15: e0229388. https://doi.org/10.1371/journal.pone.0229388
28. Resch MD, Balogh A, Kurth T, Nagy ZZ, DeBuc DC, Papp A. Atrophy of retinal vessels28.in neovascular age-related macular degeneration following long-term treatment with 20 intravitreal anti-VEGF injections. BMC Ophthalmol 2022; 22: 469.
https://doi.org/10.1186/s12886-022-02700-8
29. Seres A. Drusenek és subretinalis drusenoid depozit: kockázatok időskori makuladegenerációban. Szemészet 2018; 155: 159–171.
30. Fleckenstein M, Mitchell P, Freund KB, et al. The progression of geographic atrophy secondary to age-related macular degeneration. Ophthalmology 2018; 125: 369–390.
https://doi.org/10.1016/j.ophtha.2017.08.038
31. Keenan TD, Agrón E, Domalpally A, Clemons TE, van Asten F, Wong WT, Danis RG, Sadda S, Rosenfeld PJ, Klein ML, Ratnapriya R, Swaroop A, Ferris FL 3rd, Chew EY; AREDS2 Research Group. Progression of Geographic Atrophy in Age-related Macular Degeneration: AREDS2 Report Number 16. Ophthalmology 2018; 125: 1913–1928.
https://doi.org/10.1016/j.ophtha.2018.05.028
32. Phillips MR, Chaudhary V. Measuring atrophy in age-related macular degeneration: why does reliability matter? Eye 022; 36: 1527–1528.
https://doi.org/10.1038/s41433-022-02010-9
33. Moussa K, Lee JY, Stinnett SS, Jaffe GJ. Spectral domain optical coherence tomography-determined morphologic predictors of age-related macular degeneration-associated geographic atrophy progression. Retina 2013 Sep; 33(8): 1590–9.
https://doi.org/10.1097/IAE.0b013e31828d6052
34. Lindblad AS, Lloyd PC, Clemons TE, Gensler GR, Ferris FL 3rd, Klein ML, Armstrong JR; Age-Related Eye Disease Study Research Group. Change in area of geographic atrophy in the Age-Related Eye Disease Study: AREDS report number 26. Arch Ophthalmol 2009; 127: 1168–1174
https://doi.org/10.1001/archophthalmol.2009.198
35. Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K; SEVEN-UP Study Group. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multicenter cohort study (SEVEN-UP). Ophthalmology. 2013; 120: 2292–2299.
https://doi.org/10.1016/j.ophtha.2013.03.046
36. Lukács R, Resch M, Papp A, Szabó A, Borbándy Á, Menkens H, Kiss H, Németh J. Hosszú távú intravitrealis ranibizumabkezelés exsudativ időskori maculadegenerációban [Long-term treatment with intravitreal ranibizumab for exudative age-related macular degeneration]. Orv Hetil 2013; 154: 1790–1797. Hungarian.
https://doi.org/10.1556/OH.2013.29729.
37. Pfau M, Künzel SH, Pfau K, Schmitz-Valckenberg S, Fleckenstein M, Holz FG. Multimodal imaging and deep learning in geographic atrophy secondary to age-related macular degeneration. Acta Ophthalmol 2023; 101: 881–890.
https://doi.org/10.1111/aos.15796
38. Anegondi N, Gao SS, Steffen V, Spaide RF, Sadda SR, Holz FG, Rabe C, Honigberg L, Newton EM, Cluceru J, Kawczynski MG, Bengtsson T, Ferrara D, Yang Q. Deep Learning to Predict Geographic Atrophy Area and Growth Rate from Multimodal Imaging. Ophthalmol Retina 2023; 7: 243–252.
https://doi.org/10.1016/j.oret.2022.08.018
39. Behning C, Fleckenstein M, Pfau M, Adrion C, Goerdt L, Lindner M, Schmitz-Valckenberg S, Holz FG, Schmid M. Modeling of atrophy size trajectories: variable transformation, prediction and age-of-onset estimation. BMC Med Res Methodol 2021; 21: 170.
https://doi.org/10.1186/s12874-021-01356-0
40. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001; 119: 1417–1436.
https://doi.org/10.1001/archopht.119.10.1417
41. Gehrs KM, Jackson JR, Brown EN, Allikmets R, Hageman GS. Complement, age-related macular degeneration and a vision of the future. Arch Ophthalmol 2010; 128: 349–358.
https://doi.org/10.1001/archophthalmol.2010.18
42. Johnson LV, Ozaki S, Staples MK, Erickson PA, Anderson DH. A potential role for immune complex pathogenesis in drusen formation. Exp Eye Res 2000; 70: 441–449.
https://doi.org/10.1006/exer.1999.0798
43. Loyet KM, Deforge LE, Katschke KJ Jr, Diehl L, Graham RR, Pao L, Sturgeon L, Lewin-Koh SC, Hollyfield JG, van Lookeren Campagne M. Activation of the alternative complement pathway in vitreous is controlled by genetics in age-related macular degeneration. Invest Ophthalmol Vis Sci 2012; 53: 6628–6637.
https://doi.org/10.1167/iovs.12-9587
44. Reynolds R, Hartnett ME, Atkinson JP, Giclas PC, Rosner B, Seddon JM. Plasma complement components and activation fragments: associations with age-related macular degeneration genotypes and phenotypes. Invest Ophthalmol Vis Sci 2009; 50: 5818–5827.
https://doi.org/10.1167/iovs.09-3928
45. Loewenstein A, Trivizki O. Future perspectives for treating patients with geographic atrophy. Graefes Arch Clin Exp Ophthalmol 2023; 261: 1525–1531.
https://doi.org/10.1007/s00417-022-05931-z
46. Vakharia P, Eichenbaum D. Geographic atrophy: current and future therapeutic agents and practical considerations for retinal specialists. Curr Opin Ophthalmol 2024; 35: 165–169. Epub 2024 Feb 28.
https://doi.org/10.1097/ICU.0000000000001046
47. Heier JS, Lad EM, Holz FG, Rosenfeld PJ, Guymer RH, Boyer D, Grossi F, Baumal CR, Korobelnik JF, Slakter JS, Waheed NK, Metlapally R, Pearce I, Steinle N, Francone AA, Hu A, Lally DR, Deschatelets P, Francois C, Bliss C, Staurenghi G, Monés J, Singh RP, Ribeiro R, Wykoff CC; OAKS and DERBY study investigators. Pegcetacoplan for the treatment of geographic atrophy secondary to age-related macular degeneration (OAKS and DERBY): two multicentre, randomised, double-masked, sham-controlled, phase 3 trials. Lancet 2023; 402: 1434–1448.
https://doi.org/10.1016/S0140-6736(23)01520-9
48. Apellis Announces 24-Month Phase 3 Post Hoc Results Showing Treatment with Pegcetacoplan Led to Preservation of Function in High-Risk Areas of the Retina in Patients with Geographic Atrophy (GA) at AAO Annual Meeting 2022
https: //investors.apellis.com/news-releases/news-release-details/apellis-announces-24-month-phase-3-post-hoc-results-showing. Utolsó elérés: 2024.04.24.
49. Pfau M, Schmitz-Valckenberg S, Ribeiro R, Safaei R, McKeown A, Fleckenstein M, Holz FG. Association of complement C3 inhibitor pegcetacoplan with reduced photoreceptor degeneration beyond areas of geographic atrophy. Sci Rep 2022; 12: 17870.
https://doi.org/10.1038/s41598-022-22404-9
50. Witkin AJ, Jaffe GJ, Srivastava SK, Davis JL, Kim JE. Retinal Vasculitis After Intravitreal Pegcetacoplan: Report From the ASRS Research and Safety in Therapeutics (ReST) Committee. J Vitreoretin Dis 2023; 8: 9–20. https://doi.org/10.1177/24741264231220224
51. Patel SB, Heier JS, Chaudhary V, Wykoff CC. Treatment of geographic atrophy: an update on data related to pegcetacoplan. Curr Opin Ophthalmol 2024; 35: 64–72.
https://doi.org/10.1097/ICU.0000000000000845
52. Jaffe GJ, Westby K, Csaky KG, Monés J, Pearlman JA, Patel SS, Joondeph BC, Randolph J, Masonson H, Rezaei KA. C5 Inhibitor Avacincaptad Pegol for Geographic Atrophy Due to Age-Related Macular Degeneration: A Randomized Pvotal Phase 2/3 Trial. Ophthalmology 2021; 128: 576–586.
https://doi.org/10.1016/j.ophtha.2020.08.027
53. Khanani AM, Patel SS, Staurenghi G, Tadayoni R, Danzig CJ, Eichenbaum DA, Hsu J, Wykoff CC, Heier JS, Lally DR, Monés J, Nielsen JS, Sheth VS, Kaiser PK, Clark J, Zhu L, Patel H, Tang J, Desai D, Jaffe GJ; GATHER2 trial investigators. Efficacy and safety of avacincaptad pegol in patients with geographic atrophy (GATHER2): 12-month results from a randomised, double-masked, phase 3 trial. Lancet 2023; 402: 1449–1458.
https://doi.org/10.1016/S0140-6736(23)01583-0
54. Patel SS, Lally DR, Hsu J, Wykoff CC, Eichenbaum D, Heier JS, Jaffe GJ, Westby K, Desai D, Zhu L, Khanani AM. Avacincaptad pegol for geographic atrophy secondary to age-related macular degeneration: 18-month findings from the GATHER1 trial. Eye (Lond) 2023; 37: 3551–3557.
https://doi.org/10.1038/s41433-023-02497-w
55. Study of Subretinal Implantation of Human Embryonic Stem Cell‐Derived RPE Cells in Advanced Dry AMD: ClinicalTrials.gov; 2020
https: //clinicaltr ials.gov/ct2/show/NCT02590692 Utolsó elérés 2024.04.24.
56. Kashani AH, Lebkowski JS, Rahhal FM, Avery RL, Salehi-Had H, Dang W, Lin CM, Mitra D, Zhu D, Thomas BB, Hikita ST, Pennington BO, Johnson LV, Clegg DO, Hinton DR, Humayun MS. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Sci Transl Med 2018; 10: 4097.
https://doi.org/10.1126/scitranslmed.aao4097
57. Antonio-Aguirre B, Arevalo JF. Treating patients with geographic atrophy: are we there yet? Int J Retina Vitreous 2023; 9: 72.
https://doi.org/10.1186/s40942-023-00493-6
