Mycoplasma pneumoniae infection related with intraocular inflammation (case report and review of
doi: 10.55342/szemhungarica.2024.161.2.88
Case report
Summary
Aims To raise the possible causative role of Mycoplasma pneumoniae (MP) in intraocular inflammation through describing cases.
Case report: A 38-year-old female patient experienced visual impairment in one eye after having upper respiratory infection a month ago. Examinations described vitritis, uveitis with serous retinal detachment (SRD), vasculitis.
Serological tests were made which lead us to the suspicion of having recently developed MP infection. After the patient was treated with doxycyclin and metilprednisolon, the vitreous body cleared up, SRD disappeared, but the external retina remianed its disorganised state.
In the second case, a 32-year-old man was diagnosed with unilateral papillitis associated sudden visual impairment after a week having upper respiratory complaints. The examination revealed serological result of Mycoplasma pneumonia infection. After patient was treated with 1 mg/kg oral metilprednisolone, he symptoms and visual acuity was markedly improved.
In our report we give an overview of the pathogenetics, pathomechanisms, diagnostic and therapeutic aspects of MP associated ocular manifestations.
Conclusion:Our two cases confirm that MP is a possible and notable condition that should be included in the differential diagnostic scale for uveitis and papillitis, especially in young, healthy patients developing ophthalmic symptoms after lower or upper respitartory tract infection.
Összefoglaló
Célkitűzés: Mycoplasma pneumoniae (MP) lehetséges kóroki szerepének felvetése az intraocularis gyulladásokban két eset ismertetése kapcsán.Esetismertetés: A 38 éves nőbeteg egyik szemén, egy hónapja észlelt látásromlását felső légúti hurut előzte meg. A vizsgálatok vitritist, szerózus retinaleválással (SRD serous retinal detachment) járó uveitist, vasculitist jeleztek. A kórfolyamatot szerológiai vizsgálatok alapján feltételezhető, közelmúltban lezajlott MP-fertőzéssel hoztuk összefüggésbe. Doxycyclin- és metilprednisolon-terápia mellett az üvegtest tisztult, az SRD megszűnt, a dezorganizált külső retina nem reorganizálódott. Második esetben egy 32 éves férfinél felső légúti panaszok után egy héttel hirtelen látásromlás hátterében egyoldali papillitist diagnosztizáltunk. A kivizsgálás Mycoplamsa pneumoniae infekcióra utaló szerológiai eredményt detektált. Per os metilprednisolon-kezelés mellett a folyamat regrediált, a visusa teljessé vált. Beszámolónkban áttekintést adunk az MP-asszociált ocularis manifesztációk patogenetikájának, patomechanizmusának, diagnosztikus és terápiás vonatkozásainak problematikájáról.
Következtetés: Két esetünk megerősíti azt, hogy az MP-t érdemes felvenni az uveitisek és papillitisek differenciáldiagnosztikai skálájába, különösen, ha egyébként egészséges, fiatal felnőttnél alsó vagy felső légúti hurutot követően alakul ki a szemészeti kórkép.
Keywords
Mycoplasma pneumoniae, uveitis, papillitis
Kulcsszavak
Mycoplasma pneumoniae, uveitis, papillitis
Bevezetés
2023 őszén egészségügyi hírportálok gyermekeket és fiatal felnőtteket érintő, elsősorban Mycoplasma pseumoniae (MP) okozta atípusos pneumóniaincidencia-emelkedésről számoltak be. Az első jelzések Kínából származtak (23), aztán megjelentek a hírek az MP-fertőzések incidenciájának Európában – Dániában (14), Hollandiában (3) – észlelt fokozódásáról is. Bár ez a kórokozó elsősorban alsó és felső légúti infekciót okoz, a fertőzések kb. 25%-a extrapulmonalisan is manifesztálódik és akár szemészeti vonatkozású kórfolyamatokat is okozhat. Ez utóbbiak között viszonylag gyakori a conjunctivitis, de jelentek meg beszámolók elülső uveitis, vitritis, panuveitis, retinitis, neuritis esetekről is (17, 18). Ezért tartjuk indokoltnak, hogy az utóbbi időben, intézetünkben kezelt két, MP-fertőzéssel összefüggésbe hozható esetünket ismertessük.
Esetismertetések
Első eset
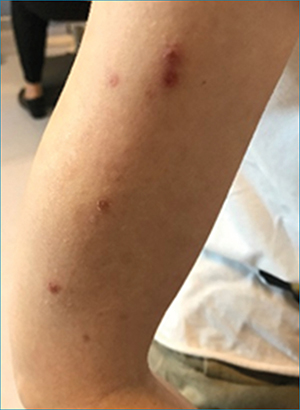
A harmincnyolc éves nőbeteg a jobb szemén egy hónapja észlelt látásromlás miatt került intézetünkbe. Általános betegségről nem tudott. Rákérdezésre elmondta, hogy a látásromlást megelőző hetekben hosszasan köhögött, de mivel láza nem volt, orvoshoz nem fordult. Ezzel egy időben testszerte viszkető kiütéseket is észlelt.
A beteg feltűnően sovány testalkatú volt. Karján és arcán papulosus bőrelváltozásokat láttunk, további vizsgálat a törzsén és az alsó végtagjain is hasonló elváltozásokat tárt fel.
A jobb szemén a korrigált visus 4 m.o.u., a bal szemén 1,0 volt. A jobb szemen békés elülső szegmentumot láttunk. Üvegtestben sűrűn pigmentgranulumokat is tartalmazó, nagy sejtkonglomerátumok voltak láthatóak. A szemfenéken IV-X óra között a makulát is érintő retinaleválást, a makulában a mélyben elhelyezkedő inhomogén sárgás-szürke anyagfelhalmozódást az elemelkedett retinában (1. ábra), VII óra irányában cisztát, körülötte exsudátumot, és a ciszta szélénél és a periférián alul helyenként intraretinalis vérzéseket észleltünk.
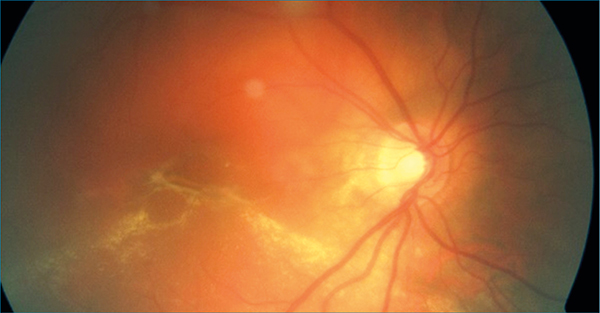
Retinaszakadást nem találtunk. Optikai koherencia tomográfia (OCT) az üvegtesti térben kb. 50 µm átmérőjű hiperreflektív pontokat mutatott. A fovealis impresszió megtartott volt, subfovealisan cisztoid űrök ábrázolódtak. A külső retinarétegek dezintegráltak voltak. Ugyancsak subfovealisan, a subretinalis térben egyenetlen vastagságú, homogén reflektivitású, hiperreflektív anyag-felhalmozódás látszott (2. ábra).
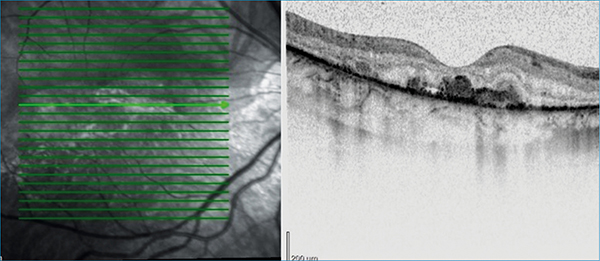
A makula alsó szélétől a periféria felé, a szerózus retinaleválásnak (SRD) megfelelően az elemelkedett retina külső rétegeiben 30-50 µm átmérőjű hiperreflektív pontokat észleltünk, amelyek helyenként konfluáltak (3. ábra).
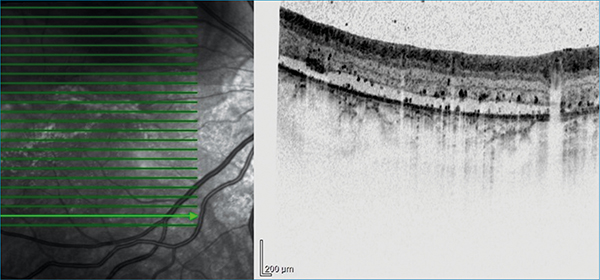
Ugyanilyen hiperreflektív pontok az SRD területében, a subretinalis térben, a retinalis pigmentepithelium (RPE) felszínén, valamint a chorioideában is megfigyelhetők voltak. Ezeknek a mérete és reflektivitása megegyezett azokéval, amelyek az üvegtestben is ábrázolódtak. Fluoreszcein-angiográfia a makula és az elemelkedett retinának megfelelő területen már a korai fázisokban megjelenő, később fokozódó, jelentős, foltos hiperfluoreszcenciát (4. ábra), a késői fázisokban ezen területeken kívül, a fekvő retinának megfelelően is, fundusszerte foltos hiperfluoreszcenciát mutatott (5. ábra).
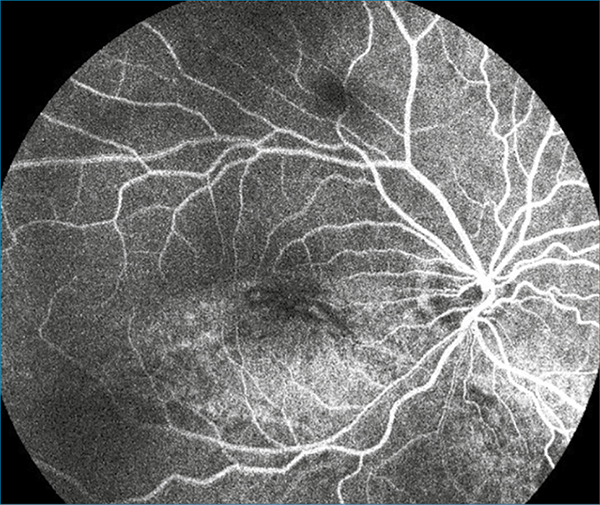
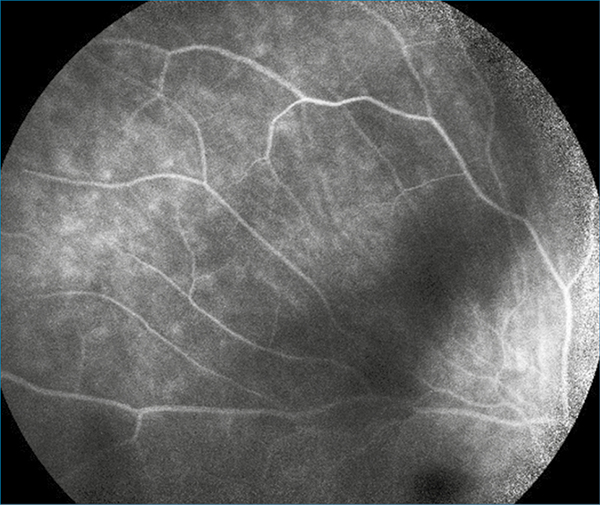
A panaszmentes bal szemen nem mutatkozott kóros eltérés sem biomikroszkópos, sem kiegészítő vizsgálatokkal. A vizsgálatok alapján, a jobb szemen uveitist, vasculitist diagnosztizáltunk, és ezek hátterének feltárására további vizsgálatokat indikáltunk.
Rutin laboratóriumi vizsgálata nem mutatott kóros értékeket. A klinikai kép alapján felvetődött Behcet-kórt, polyarteritis nodosát és szifiliszt a bőrgyógyászati vizsgálat, szerológiai és immunológiai (TPA, RPR, CRP, ANCA) vizsgálatok nem támasztották alá. Egyéb immunológiai (Immunfixációs elfo, Protein elektroforézis) vizsgálatok is negatívok voltak. Tumoros/paraneoplasiás hátteret feltételezve tumormarker, mellkasröntgen, hasi UH, mellkas- és hasi CT-vizsgálatok történtek, ezek negatív eredményt adtak. Infekciószerológiai leletek friss, illetve a közelmúltban zajlott Mycoplasma pneumoniae fertőzés gyanúját vetették fel (1. vizsgálat IgA: pozitív, IgM: negatív, IgG: erősen pozitív; két héttel később, 2. vizsgálat IgA: negatív, IgM: negatív, IgG erősen pozitív). Egyéb szerológiai vizsgálatok más egyéb friss vagy közelmúltban lezajlott fertőzést nem detektáltak (HSV1, HSV2: aspecifikus reakció, HIV, VZV, CMV, EBV, HBV, HCV, Toxoplasma, Bartonella henselae, Bartonella quintana, Borrelia burgdorferi, Toxocara, Echinococcus, Leishmania, Treponema pallidum, Chlamydia pneumoniae, Brucella, Francisella tularensis, Leptospira, Yersinia: negatív). Az intraocularis térből mintavétel nem történt, a páciens azt nem vállalta.
A beteg kezdetben bevezetett per os metilprednisolon-kezelését (1 mg/testsúlykilogramm kezdő dózis) 14 napon át adott, napi 100 mg doxycyclinkezeléssel egészítettük ki. Négy hét alatt a bőrtünetek regrediálni kezdtek, az üvegtest tisztább lett, a szerózus retinaleválás megszűnt. A periférián látott retinaciszta nem változott, az exsudátumok érdemi változást nem mutattak. A külső retina a 4 hónappal későbbi OCT-képek szerint nem regenerálódott, dezintegrált maradt – ezzel összhangban a látóélessége mérsékelt javulást mutatott (BCVA: 0,4). Kontroll fluoreszcein-angiográfiát a beteg vegetatív labilitása, az első alkalommal kollapszusig fajult rosszulléte miatt nem végeztünk.
Második eset
A harminckét éves férfi jobb oldali, hirtelen bekövetkezett, nagyfokú látáscsökkenés miatt került intézetünkbe.
Vizsgálatakor a jobb szem látóélessége 0,1, a bal szemén 1,0 volt. A jobb szemen ép elülső szegmentumot és tiszta törőközegeket találtunk, a papilla azonban elmosott szélű, hyperaemiás, duzzadt volt, egy apró csíkolt vérzéssel. Egyéb eltérés nem mutatkozott. A bal szemet épnek találtuk. A jobb, illetve bal szem kritikus fúziós frekvenciaértéke 22, illetve 42 Hz volt. Látótérvizsgálat (HAAG-STREIT, OCTOPUS 900) a jobb szemen centrális érzékenységcsökkenést, a bal oldalon ép viszonyokat mutatott. A klinikai kép alapján jobb oldali papillitist állapítottunk meg. A beteg általános anamnézisét ennek megfelelően egészítettük ki. Kiderült, hogy a szemészeti tünetet megelőzően egy héttel torokfájással, hidegrázással zajló, akut felső légúti betegsége volt, egyébként egészségesnek tudta magát. Állattal nem volt kapcsolata, egzotikus vidéken nem járt. Oltást a közeli időszakban nem kapott, toxikus tényezők nem voltak feltárhatók. Családi anamnézisből testvérének sclerosis multiplex (SM) betegségére derült fény.
Általános kivizsgálást kezdtünk a papillitis etiológiájának felderítésére. A beteg rutin laboratóriumi vizsgálata nem mutatott eltérést, mint ahogy a neurológiai vizsgálata sem. SM-protokoll szerint végzett koponya mágnesesrezonancia-vizsgálat kórosat nem detektált. 80 mg kezdő dózisú per os szteroidkezelést kezdtünk és infekciós szerológiai vizsgálatokat kezdeményeztünk.
A szerológiai leletek a közelmúltban zajlott Mycoplasma pneumoniae infekció gyanúját vetették fel (erősen pozitív IgA és IgG, negatív IgM). Egyéb szerológiai vizsgálatok más egyéb friss, vagy közelmúltban lezajlott fertőzést nem detektáltak (HIV, HSV2, EBV, Chlamydia psittaci, Toxoplasma, RPR, TPPA, Bartonella henselae, Borrelia burgdorferi negatív. Chlamydia pneumoniae, HSV1, Yersinia: IgG-pozitivitás IgM és IgA negativitása mellett. Hepatitis B immunizáltság.
Tekintettel a megkezdett kezelés mellett észlelt határozott javulásra, nem jött szóba mintavétel az intraocularis térből. Ugyanezen okból a beteg a felmerülő MP-fertőzés miatt javasolt antibiotikumkezelést nem vállalta. Egy hónap alatt a visusa teljessé vált, a centrális scotoma megszűnt, a papilla képe normalizálódott.
Megbeszélés
Az MP az atípusos pneumónia és más alsó és felső légúti fertőzések ismert kórokozója, főleg gyermekek és fiatal felnőttek körében. A kórokozó inkubációs periódusa 1-4 hét, néha csak néhány nap (10). Az MP infekciós rátáját 2–35% közöttire becsülik, az alacsonyabb értéket az endémiás időszakokra, a magasabbat az epidémiás időszakokra vonatkoztatva. Epidémiás időszakok 4-7 évente jelentkeznek (5). A kórokozó tünetmentesen is jelen lehet, vagy a fertőzést követően akár hónapokon át is perzisztálhat a szervezetben. Mivel a primer fertőzés kapcsán kialakuló immunválasz nem nyújt tartós védettséget, az MP-fertőzésre jellemző a reinfekció (10). Az esetek többségében a tünetek enyhék és spontán gyógyulás következik be, de ritkán akár fulmináns fertőzés is felléphet, leginkább immunszupprimált szervezetekben. A felső és alsó légutak betegsége mellett az MP-fertőzés következtében vagy azzal összefüggésben számos egyéb kórkép is létrejöhet, akár légúti tünetek nélkül is: neurológiai, renális, dermatológiai, musculosceletális, hematológiai, kardiovaszkuláris és gasztrointesztinális megjelenési formák ismertek (17, 13). Szemészeti érintettségről is történtek közlések. Az MP leggyakrabban conjunctivitist okozhat, de az infekcióval összefüggésben ritkábban elülső uveitist, még ritkábban vitritist, uveitist, papillitist, papillaödémát, retinalis vérzéseket, exsudátumokat is leírtak (1, 11, 16, 17, 18, 20, 22). Kérdéses, hogy ezekért az extrapulmonalis kórfolyamatokért mi a felelős: maga az MP-fertőzés vagy az infekcióhoz társuló immunfolyamat és gyulladás.
Az MP-fertőzés bizonyítása a napi rutinban infekciós szerológiai módszerekkel és molekuláris vizsgálattal, a legmegbízhatóbban a kettővel együtt lehetséges (2, 18). Önmagában egyetlen szerológiai vizsgálat eredménye nem elégséges, néhány hét különbséggel levett két minta eredményének összehasonlítása, az IgG jelentős titeremelkedése utalhat megbízhatóan aktív/aktuális fertőzés meglétére. Ugyanakkor még a szerológiai és a PCR-vizsgálat kombinálása esetén is minden eset egyedi elbírálása szükséges, a tesztekben rejlő némi bizonytalanságon túl különösen azért, mert a tünetmentes MP-hordozók előfordulása sem ritka (10), mint ahogy az is lehetséges, hogy MP-fertőzöttség mellett, azzal esetleg közvetlen kapcsolatban nem álló, egyéb eredetű kórfolyamat is fennállhat. Géhl Zs. és munkatársai bizonyítottan Varicella zoster vírus okozta akut retinanekrózis (ARN) egy esetében friss bakteriális infekcióra utaló MP szerológiai teszt eredményt is észleltek, ami miatt annak megfelelő kezelést is adtak a betegnek, de az ARN-t nem hozták vele összefüggésbe (7).
Az MP-fertőzés patogenezise komplex; direkt károsító mechanizmusokat – adhéziós, membránfúziós, táplálék-megvonásos, invazív és toxikus károsodást – és immunkárosodást, gyulladásos károsodást is egyidejűleg magába foglal (9). A fertőzés extrapulmonalis manifesztációinak hátterében is direkt bakteriális invázión kívül a kórokozó által kiváltott immunfolyamatoknak tulajdonítanak fontos szerepet (9). MP okozta pneumónia esetében immunkomplexek jelenlétét mutatták ki vérben (20) – ez az erek falába lerakódva III. típusú túlérzékenységi reakciót, gyulladást, vasculitist okozhat, akár intraocularisan is. Egyes szerzők bizonyos extrapulmonalis megjelenési formáknál a vaszkuláris okklúzió szerepét is elkülönítve említik (13), ennek hátterében a baktériumnak ugyancsak a direkt vagy indirekt hatása állhat.
A fent bemutatott mindkét esetben szimptomatikus felső légúti hurutos kórkép előzte meg az intraocularis gyulladásos tünetek megjelenését. Fiatal felnőttekről van szó, tehát abba a korosztályba tartozókról, akiket az MP legúti infekció gyakran érint. Az első esetünkben a két, egymást követő szerológiai vizsgálat közelmúltban zajlott MP-fertőzés valószínűségét alátámasztja, mint ahogy ennek fényében az sem zárható ki, hogy a nála észlelt dermális és ocularis kórfolyamat is az MP-fertőzéssel hozható összefüggésbe. A második esetünkben csak egy szerológiai vizsgálat történt, az ugyancsak a közelmúltban zajlott MP-fertőzésre utalt.
Az általunk észlelt kórfolyamatok nem ismeretlenek az MP-fertőzéssel összefüggésbe hozott extrapulmonalis manifesztációk között (17, 20). Rocha-Cabrera és munkatársai papillitis és szerózus retinaleválás két esetét közölték és tartották MP-fertőzéssel összefüggőnek (16). Liu és munkatársai továbbá Milla és munkatársai bilaterális papillitises esetüket (11, 12), Bai és munkatársai kétoldali, vitritis-szel, exsudatív retinaleválással, vasculitissel és papilladuzzanattal járó panuveitises, esetüket tartották MP eredetűnek (1). A bőrtünetek – amelyek első esetünkben jelen voltak – ugyancsak ismertek MP-vel összefüggésbe hozott extrapulmonalis megjelenésként, sőt közöttük viszonylag gyakoriak (18).
Ugyanakkor se a közölt, se a saját eseteinkben nincs közvetlen bizonyíték az MP-fertőzés és a szemészeti kórfolyamatok összefüggésére, mert az intraocularis térből nem történt mintavétel sem MP-antitest, sem PCR-vizsgálatra. Mi ezt az első esetünkben a kórfolyamat súlyossága és a szerteágazó etiológiai lehetőségek miatt erősen szorgalmaztuk, de a beteg merev ellenállásába ütköztünk, a második esetben az egyértelmű gyógyulási tendencia miatt nem is szorgalmaztuk. Ugyanakkor így – bár számos szóbajöhető kórokot kizártunk mindkét esetben a vizsgálatainkkal –, mindkét esetben maradt az MP-n kívül alternatív etiológiai lehetőség. Az első esetben az intraocularis térből vett minta esetleges MP-fertőzésre utaló pozitivitása többek között a Behcet-kórtól való elkülönítést segíthette volna, amit még mindig nyitott lehetőségnek tartunk. Bár orális vagy genitális nyálkahártya-érintettség nem jelentkezett, és pathergiás bőrreakciót sem észleltünk a betegnél, ezek hiánya nem zárja ki a Behcet-kór lehetőségét, mert annak első manifesztációja akár uveitis és a szem ereinek vasculitise is lehet, és a fiatal életkor, az acneiform papulózus bőrelváltozások beleillenének a képbe.
Ráadásul ismert, hogy a Behcet-kór manifesztációjában komoly szerepük van az infekcióknak, sőt, a lehetséges infektív ágensek között egy Mycoplasma-fajtának a szerepét is valószínűsítették (21). A második esetünkben se lehetünk egészen biztosak az MP etiológiai szerepében. A fiatalember családjában előfordult SM-betegség. Bár a családi prevalenciaadatok tekintetében a magyarországi adatok (2%) a nemzetközi adatoktól (12,6%) eltérően alacsonyabb értéket mutatnak (8), a pozitív családi anamnézis a gyanút fokozza. Az a tény, hogy esetleges SM-et az elvégzett neurológiai és képalkotó vizsgálatok nem erősítették meg, annak lehetőségét nem zárja ki. Ráadásul az SM-betegség manifesztálódásának hátterében ugyancsak számos infekció fordulhat elő triggerfolyamatként (4). Így ebben az esetben a látásromlást megelőzően egy héttel jelentkező felső légúti betegség kórokozója által indított gyulladásos kaszkád akár SM elindítója is lehet.
Első esetünk fontos információjának tartjuk az SRD területének megfelelően nyert OCT-s képek tartalmát. Az OCT-s képalkotás során ábrázolt hiperreflektív pontok jelenléte a chorioidea, a retinalis pigmentepithelium és a külső retina szintjében, valamint a subretinalis térben nagy valószínűséggel az ott megnyilvánuló aktív, gyulladásos reakció jele, mint ahogy a retinához közel eső üvegtesti térben ábrázolt hasonló hiperreflektív pontokat az üvegtest gyulladásos infiltrációjának jeleként értékeljük. Feltételezhetően ezek lokalizációjával van összefüggésben az is, hogy pont az a réteg, ahol a legnagyobb mennyiségben észlelhettük őket – tehát a külső retina –, dezintegrált a OCT-felvételeken, ami a gyenge funkcióval, rossz látóélességgel összhangban van. Hogy annak okául, hogy a követés során a külső retina esetleges regenerációjának morfológiai jelei – a külső retina reorganizációja – nem mutatkoztak, és ezzel párhuzamban a funkció is csak mérsékelt javulást mutatott a szerózus leválás elmúlta után, azt hozhatjuk-e fel, hogy a beteg a látásromlás észlelését követően még egy hónapig nem fordult orvoshoz, és így a kezelés késett, nem tudhatjuk, bár feltételezhető, hogy a hosszú ideig fennálló gyulladásos folyamat nagyobb valószínűséggel vezethet irreverzibilis károsodáshoz, mint egy esetleg rövidebb ideig fennálló gyulladás. Bár a szemfenéki biomikroszkópos megjelenés az esetünkben alapvetően különbözött a szifiliszes hátsó placoid chorioretinitistől, a OCT-s kép azzal kísértetiesen egyező. Pichi és munkatársai (15) a szifiliszes placoid chorioretinitisben a chorioidea, az RPE és a külső retina szintjében észlelt hiperreflektív pontokat gyulladásos fókuszokként interpretálták és – ezeknek a rétegeknek a gyulladás következtében létrejött károsodása miatt bekövetkezett – külső vér-retina barrier diszfunkcióval magyarázták a subretinalis folyadékgyülemet. Bár esetünkben szerológiai vizsgálatok kizárták a szifilisz lehetőségét, az nem zárható ki, hogy az OCT-s kép – ugyan más kórokozó által elindított folyamatot, de – hasonló patomechanizmust tükröz az esetünkben is.
Míg az MP okozta pneumónia antibiotikumkezeléséről egyértelmű a szakmai álláspont, az MP-vel összefüggésbe hozható extrapulmonalis megjelenési formák – így az ocularis formák – esetében sok az ellentmondás és tisztázatlan kérdés, hiszen hiányos a tudásunk a folyamat patogenezisével kapcsolatban. Egyes esetekben nagy valószínűséggel felvethető a kórokozó fizikai jelenléte és direkt szöveti károsító hatása, más esetekben posztinfekciós gyulladásos és immunfolyamatok feltételezhetők a háttérben. Az előbbi esetben nyilván észszerű az antibiotikummal való kezelés, az utóbbiak esetében viszont kérdéses az antibiotikumok esetleges szerepe. A kérdést bonyolítja, hogy a két folyamat – a direkt és az immunológiai károsító mechanizmus – egyidejűleg, szinergizmusban működhet (9). Nemcsak a kifejezetten ritka ocularis megnyilvánulási formák, de még a viszonylag gyakori központi idegrendszeri manifesztációk kezelésére vonatkozólag sem találtunk prospektív, randomizált vizsgálatot. Általában immunmodulációs (szteroid, súlyos esetekben immunglobulin) és antibiotikumkezelést egyedi meggondolások alapján alkalmaznak, vaszkuláris okklúziós kórképeknél antikoagulációt is javasolnak. Antibiotikumként a makrolidek, a tetracyclin és a fluorokinolonok jöhetnek számításba – gyermekeknél az utóbbi kettő csak makrolid-rezisztencia esetén. Vannak vélemények, miszerint az extrapulmonalis formákban mindenképpen indokolt immunmoduláns szteroidkezelés mellett antibiotikum adása az antigénstimulus csökkentésére (13). Saját eseteinkben szteroidkezelést szinte azonnal kezdtünk, a tetracyclinnel történő terápiakiegészítést csak a pozitív MP szerológiai vizsgálat megszületése után mérlegeltük, első esetünkben azt be is vezettük. Második esetünkben az addigra észlelt jelentős javulás miatt a beteg az antibiotikumkezelést visszautasította, a gyógyulás anélkül is teljessé vált.
Következtetések
A fentiekben fiatal felnőtteken, MP-fertőzéssel összefüggésbe hozható két szemészeti, gyulladásos kórlefolyást ismertettünk. Mindegyikben felső légúti megbetegedés előzte meg a szemészeti panaszokat, a szerológiai tesztek a közelmúltban zajlott MP-fertőzésre utaltak. A kórképek egybevágtak az MP ritka, de ismert extrapulmonalis, ocularis formáival. Két esetünk megerősíti azt, hogy az MP-t érdemes felvenni az uveitisek és papillitisek differenciáldiagnosztikai skálájába, különösen, ha egyébként egészséges, fiatal felnőttnél alsó vagy felső légúti hurutot követően alakul ki a szemészeti kórkép.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetéseik megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Bai X, Chen Y, Hua R. Multimodal imaging findings in a patient with bilateral panuveitis secondary to Mycoplasma pneumoniae infection. Quant Imaging Med Surg 2023; 13(2): 1232–1234.
https://doi.org/10.21037/qims-22-455
2. Beeton M L, Zhang X-S, Balla E. Mycoplasma pneumoniae infections, 11 countries in Europe and Israel, 2011 to 2016. Euro Surveill 2020; 25(2): pii=1900112.
https://doi.org/10.2807/1560-7917
3. Bolluyt DC, Euser SM, Souverein D, et al. Increased incidence of Mycoplasma pneumoniae infections and hospital admissions in the Netherlands, November to December 2023.Euro Surveill 2024 Jan; 29(4).
https://doi.org/10.2807/1560-7917.ES.2024
4. Dunalska A, Kamila Saramak K, Szejko N. The Role of Gut Microbiome in the Pathogenesis of Multiple Sclerosis and Related Disorders. Cells 2023; 12(13): 1760.
https://doi.org/10.3390/cells12131760
5. Foy H M, Kenny G E, Cooney M K, et al. Long-Term Epidemiology of Infections with Mycoplasma pneumoniae. Journal of Infectious Diseases 1979; 139(6): 681–687.
https://doi.org/10.1093/infdis/139.6.681
6. Galeone M, Colucci R, Massimiliano D' Erme A, et al. Potential Infectious Etiology of Behçet's Disease. Patholog Res Int 2012; 2012: 595380.
https://doi.org/10.1155/2012/595380
7. Géhl Zs, Resch M. Akut retina nekrózis – Esetismertetés és irodalmi áttekintés. Szemészet 2012; 3: 221–224.
8. Harichian M H, Farzad F, Payam S, et al. Worldwide prevalence of familial multiple sclerosis: A systematic review and meta-analysis. Multiple Sclerosis and Related Disorders 20. 2018; 43–47.
https://doi.org/10.1016/j.msard.2017.12.015
9. Jun H, Mihua L, Zhufeng Y. Insights into the pathogenesis of Mycoplasma pneumoniae. Molecular Medicine Reports November 2016; 14(5): 4030–4036.
https://doi.org/10.3892/mmr.2016.5765
10. Balla E, Petrovay F, Boross K. Mycoplasma pneumoniae és Chlamydia pneumoniae fertőzések szerodiagnosztikája Mikrobiológiai körlevél „Johan Béla” Országos Epidemiológiai Központ Bakteriológiai, Mikológiai, Parazitológiai és Tipizálási Főosztály; 2004. 4(1): 19–23.
https://www.nnk.gov.hu/attachments/article/1078/Mikrobiologiai_korlevel_2004.pdf
11. Liu EM, Janigian RH. Mycoplasma pneumoniae: the other masquerader. JAMA Ophthalmology 131(2): 251–53.
https://doi.org/10.1001/jamaophthalmol.2013.5
12. Milla E, Zografos L, Piguet B. Bilateral Optic Papillitis Following Mycoplasma pneumoniae Pneumonia. Ophthalmologica 1995; 212(5): 344–346.
https://doi.org/10.1159/000027322
13. Mitsuo N. Classification of Extrapulmonary Manifestations Due to Mycoplasma pneumoniae Infection on the Basis of Possible Pathogenesis. Frontiers in Microbiology January 2016|; 7(23): 1–9.
https://doi.org/10.3389/fmicb.2016.00023
14. Nordholm A C, Søborg B, Jokelainen P, et al. Mycoplasma Pneumoniae Epidemic in Denmark, October to December, 2023. Euro Surveill 2024; 29(2): pii=2300707.
https://doi.org/10.2807/1560-7917. ES.2024.29.2.2300707
15. Pichi F, Curi A LL, Vascocelons-Santos DV, et al. Optical Coherence Tomography Findings in Infectious Posterior Uveitis. Ocular Immunology and Inflammation 30(3): 1–12.
https://doi.org/10.1080/09273948.2022.2032197
16. Rocha-Cabrera P, Cordovés-Dorta L, Lopez VL et al. Uveitis by Mycoplasma pneumoniae in Tenerife, Canary Islands: Report of Two Cases. J Clin Exp Ophthalmol 2015; 6: 508.
https://doi.org/10.4172/2155-9570.1000508
17. Salzman MB, Sood SK, Slavin ML, et al. Ocular Manifestations of Mycoplasma Pneumoniae Infections. Clinical Infectious Diseases 1992; 14: 1137–9.
18.Sanchez-Vargas FM, Gomez-Duarte OG. Mycoplasma pneumonia – an emerging extra-pulmonary pathogen. Clin Microbiol Infect 2008; 14: 105–115.
19. Tagliabue C, Salvatore C M, Techasaensiri C. The Impact of Steroids Given with Macrolide Therapy in Experimental Mycoplasma pneumonia Respiratory Infection. J Infect Dis 2008 Oct 15; 198(8): 1180–1188. https://doi.org/10.1086/591915
20. Yashar S, Yashar B, Epstein E, et al. Uveitis associated with Mycoplasma pneumoniae meningitis. Acta Ophthalmol Scand 2001; 79: 100–101. ISSN 1395-3907
https://doi.org/10.1034/j.1600-0420.2001.079001100.x.
21. Zouboulis CC, Turnbull JR, Mühlradt PF. Association of Mycoplasma fermentans with Adamantiades-Behçet’s disease. New York: Kluwer Academic/Plenum Publishers; 2003. p. 191–194.
22. Weinstein O, Shneck M, Levy J, et al. Bilateral acute anterior uveitis as a presenting symptom of Mycoplasma pneumoniae infection. Can J Ophthalmol 2006; 41: 594–5.
23. World Health Organization (2023 Nov. 23). Disease Outbreak News; Upsurge of respiratory illnesses among children in northern China.
https://www.who.int/emergencies/disease-outbreak-news/item/2023-DON494
