The differential diagnosis of primary intraocular lymphoma as uveitis masquerade syndrome in relation to a case
doi: 10.55342/szemhungarica.2023.160.3.128
Original scientific paper
Summary
Introduction: The uveitis masquerade syndrome includes inflammation-like systemic and ophthalmic pathologies appearing as infiltration of the eyeball but not based on infections or immune processes, secondarily. Two main groups are distinguished: neoplastic and non-neoplastic.
Objective and methods: To demonstrate the differential diagnosis of uveitis masquerade syndrome and the difficulties of therapy selection by reporting a primary intraocular lymphoma case.
Case report: A 65-year-old female patient presented in June 2019 with “floating blurs” in front of her amblyopic left eye, which were diagnosed as vitreous haemorrhage. The fundus could not be examined at that time; BCVA was 0.9/hm. Following the absorption of the vitreous haemorrhage, a chorioretinitis lesion became visible in the macula. Systemic investigation was started to clarify the aetiology of the uveitis, which ended with negative results. A vitreous sample was taken, from which no pathogen could be detected. As a result of the systemic antibiotic and steroid therapy, the process regressed. In January 2020, right eye panuveitis was diagnosed, and methotrexate treatment was initiated. Due to the progression in the left eye, repeated vitreous sampling was performed, and mature B-cell non-Hodgkin lymphoma was diagnosed by flow cytometry. The haematological examination was completed without any other abnormal results. In January 2021, a brain lesion was found, which proved to be DLBCL histologically and necessitated chemotherapy. She reached complete remission and became ophthalmologically asymptomatic by September 2021, with a BCVA of 1.0/nlp.
Conclusions: The diagnosis of uveitis masquerade syndromes is difficult. It can take longer than a year from the initial symptoms to determine the exact aetiology due to the chance of confusion with inflammatory pathologies. We emphasise that a uveitis masquerade syndrome should be considered when an inflammatory disease is refractory to therapy.
Összefoglaló
Bevezetés: Az uveitis masquerade-szindrómák közé olyan szisztémás és szemészeti gyulladást utánzó kórképek sorolandóak, amelyek a szemgolyó infiltrációjaként jelentkeznek és nem másodlagos módon fertőzések, immunfolyamatok által alakulnak ki. Két fő csoportja különböztethető meg: neoplasztikus és nonneoplasztikus.Célkitűzés és módszerek: Az uveitis masquerade-szindróma differenciáldiagnosztikájának, és a megfelelő terápiaválasztás nehézségeinek bemutatása egy primer intraocularis lymphoma esetének ismertetése kapcsán.
Esetismertetés: 65 éves nőbeteg 2019 júniusában jelentkezett, amblyop bal szeme előtt jelentkező „úszkáló homályok” miatt, amelyet üvegtesti vérzésnek diagnosztizáltak. A fundus ekkor nem volt vizsgálható az érintett oldalon, BCVA 0,9/kml. A vérzés feltisztulását követően, egy makulát érintő, chorioretinitises góc vált láthatóvá. Lokális kezelés mellett, a beteg szisztémás kivizsgálása indult, az uveitis etiológiájának tisztázása céljából, amely negatív eredménnyel zárult. Diagnosztikus vitrectomia során üvegtesti mintavétel történt, amelyből kórokozó nem volt kimutatható. Az elindított empirikus szisztémás antibiotikum- és szteroidterápia hatására, az idiopátiás uveitisnek tartott folyamat regrediált, a páciens látása javult. 2020 januárjában jobb oldali szemen is panuveitis alakult ki, amely miatt methotrexatkezelés kezdődött. A bal szem progressziója miatt 2020 szeptemberében ismételt üvegtesti mintavétel történt, amelynek áramláscitometriai vizsgálata érett B-sejtes non-Hodgkin-lymphomát igazolt. Hematológiai kivizsgálás történt, amely szisztémás érintettséget nem bizonyított, így primer intraocularis lymphomának véleményezték. 2021 januárjában tüneteket okozó agyi térfoglalás igazolódott, amely a kemo-, majd sugárterápia indításához szükséges szövettani eredményt biztosította. Szemészetileg és hematológiailag 2021 szeptemberére komplett remisszióba került és tünetmentessé vált, BCVA 1,0/fén.
Következtetések: Az uveitis masquerade-szindrómák diagnosztikája nehéz, a kezdeti tünetektől számítva egy évig is elhúzódhat a pontos etiológia meghatározása, a gyulladásos kórképekkel való összetéveszthetősége miatt. Kiemelendő, hogy terápiarefrakter gyulladásos kórképekben gondoljunk rá.
Keywords
uveitis masquerade syndrome, primary intraocular lymphoma, uveitis
Kulcsszavak
masquerade-szindróma, intraocularis lymphoma, uveitis
Bevezetés
Az Uveitis Masquerade Szindrómához (UMS) tartoznak azon kórképek, amelyeknél a betegek tünetei uveitis képét utánozzák, viszont ezen kórképek hátterében nem gyulladásos betegségek állnak, illetve nem tartoznak a hagyományos értelemben vett uveitisek közé (14). Ezek a tünetek nem, vagy csak átmeneti javulást mutatnak szteroidterápiára. Feloszthatjuk neoplasztikus és non-neoplasztikus típusokra. Az 1. táblázatban a felnőttkori uveitis masquerade-szindrómákat foglaltuk össze. Gyermekkorban a retinoblastoma, Coats-betegség, juvenilis xanthogranuloma, és a medulloepithelioma jönnek szóba, mint uveitist utánzó kórképek (5).

Az UMS-ek epidemiológiai adatait és klinikai megjelenésüket nehéz meghatározni tekintettel arra, hogy ritkán fordulnak elő és gyakran félrediagnosztizálják őket, valamint kevés nagy betegszámú vizsgálat zajlott velük kapcsolatban. 2001-ben Rothova és munkatársai, egy uveitises betegcsoport klinikai anyagát feldolgozva a betegek 5%-ánál találtak UMS-t (40/828 beteg) és ebből 19 eset a malignus UMS-csoportba tartozott, amelynek 75%-a primer intraocularis lymphoma volt. A 21 nem malignus UMS-ból tíz esetben szemészeti érrendszert érintő megbetegedést (diabéteszes retinopathia, ocularis iszkémiás szindróma, hipertenzív retinopathia stb.), öt esetben öröklődő retinabetegséget (pl. retinitis pigmentosa) diagnosztizáltak és az esetek nagy részében a kiinduló diagnózis vasculitis, atípusos uveitis volt (11). Hasonló adatok találhatók Grange vizsgálatában, ahol 853 betegből 21-et (2,5%) diagnosztizáltak malignus UMS-sel (6, 15). Habár ritka kórképek, mégis fontos a megfelelő időben történő diagnosztizálásuk a látás megőrzése és az élet megtartása céljából. Tekintettel arra, hogy a malignus uveitis masquerade-szindrómák 75%-át a primer intraocularis lymphoma képezi, és diagnosztikája, ahogy esetünk is reprezentálja, kihívásokkal jár mind a szemészek, mind a társszakmák számára, ezért részletezésére különös figyelmet szenteltünk.
Az intraocularis lymphoma (IOL) megnevezése, magába foglalja a primer intraocularis lymphomát (PIOL), amely főként a központi idegrendszerből (CNS) és a másodlagos intraocularis lymphomát (SIOL), amely a központi idegrendszeren kívülről ered. Becslések szerint az IOL incidenciája a szem rosszindulatú daganatainak 1,86%-át teszi ki. Az elsődleges agydaganatok 4-6%-áért és az extranodális lymphomák 1-2%-áért felelősek. A betegek körében a központi idegrendszert is érintő esetek százalékos aránya 60-80%. A primer központi idegrendszeri lymphomában (PCNSL) szenvedő betegek 15–25%-ánál alakul ki a lymphoma szemészeti megnyilvánulása (4). A PIOL leggyakoribb formája a retinalis eredetű primer vitreoretinalis lymphoma (PVRL), amely szövettanilag leggyakrabban (95%) diffúz nagy B-sejtes lymphoma (DLBCL). Az úgynevezett pan-B-sejtmarkerek (azaz CD20, CD79a és PAX5) mellett a PVRL MUM1/IRF4-et, nagyon gyakran BCL-2-t és -6-ot expresszál (12).
Mivel a PIOL egy „Masquerade Szindróma” a differenciáldiagnosztikája számos infekciózus és noninfekciózus kórképet felvethet. A nemzetközi és magyar szakirodalmi összefoglalókat, esettanulmányokat áttekintve az alábbi, 2. táblázatban feltüntetett kórképek vizsgálata, kizárása volt szükséges a megfelelő diagnózis eléréséhez. Mindezen kórképek vizsgálata a diagnózisalkotást az intraocularis lymphomák esetén, a panaszok jelentkezésétől kezdve 4-40 hónapra is elnyújthatja, amely közben rapid progresszió alakulhat ki (2).

Esetbemutatás
65 éves nőbeteg 2019 júniusában jelentkezett amblyop bal szeme előtt „úszkáló homályok” miatt, amelyet üvegtesti vérzésnek diagnosztizáltak. A fundus ekkor nem volt vizsgálható az érintett oldalon, BCVA 0,9/kml. A vérzés feltisztulását követően egy makulát érintő sárgás-fehér, vérzésekkel tarkított chorioretinitises góc vált láthatóvá, amely miatt lokális kezelés mellett, szisztémás kivizsgálása indult az uveitis etiológiájának tisztázása céljából. Az általános labor-, szerológiai vizsgálat, valamint góckutatás (mellkasröntgen, fogászati, fül-orr-gégészeti, nőgyógyászati, reumatológiai, immunológiai, belgyógyászati vizsgálat) negatív eredménnyel zárult. 2019 júliusában diagnosztikus vitrectomia során üvegtesti mintavétel történt, amelyet bakteriológiai tenyésztésre és herpeszvírusok okozta fertőzés kizárása céljából PCR-vizsgálatra továbbítottunk, amelyek negatív eredményt hoztak. Az 1. ábrán a 2019 augusztusában készült makula OCT-felvétele látható a bal szem szemfenéki elváltozásáról.

A felmerülő Toxoplasma-fertőzés okozta panuveitis és chorioretinitis miatt elindított empirikus szisztémás antibiotikumos (2×2 tabletta Sumetrolim) és szteroidterápia (1 mg/ttskg-os dózisról csökkentve 16 mg-os fenntartó dózisig) hatására, a folyamat regrediált, a bal szem látása javult. 2020 januárjában a jobb oldali szemen is panuveitist diagnosztizáltunk, amely miatt szteroidkímélő methotrexátkezelés kezdődött. A kétoldali továbbra is aktív panuveitis miatt felmerült biológiai terápia indítása, amelyhez a szükséges kivizsgálást megkezdtük (kardiológiai vizsgálat, mellkasröntgen, koponya-MR-vizsgálat negatív). A bal szemből, 2020 szeptemberében a szisztémás terápia mellett kialakuló további progresszió (panuveitis mellett hypopyon megjelenése) miatt ismételt üvegtesti mintavétel történt, amelynek áramláscitometriai vizsgálata érett B-sejtes non-Hodgkin-lymphomát igazolt (2. ábra), de citológiai vizsgálattal kóros nem mutatkozott.
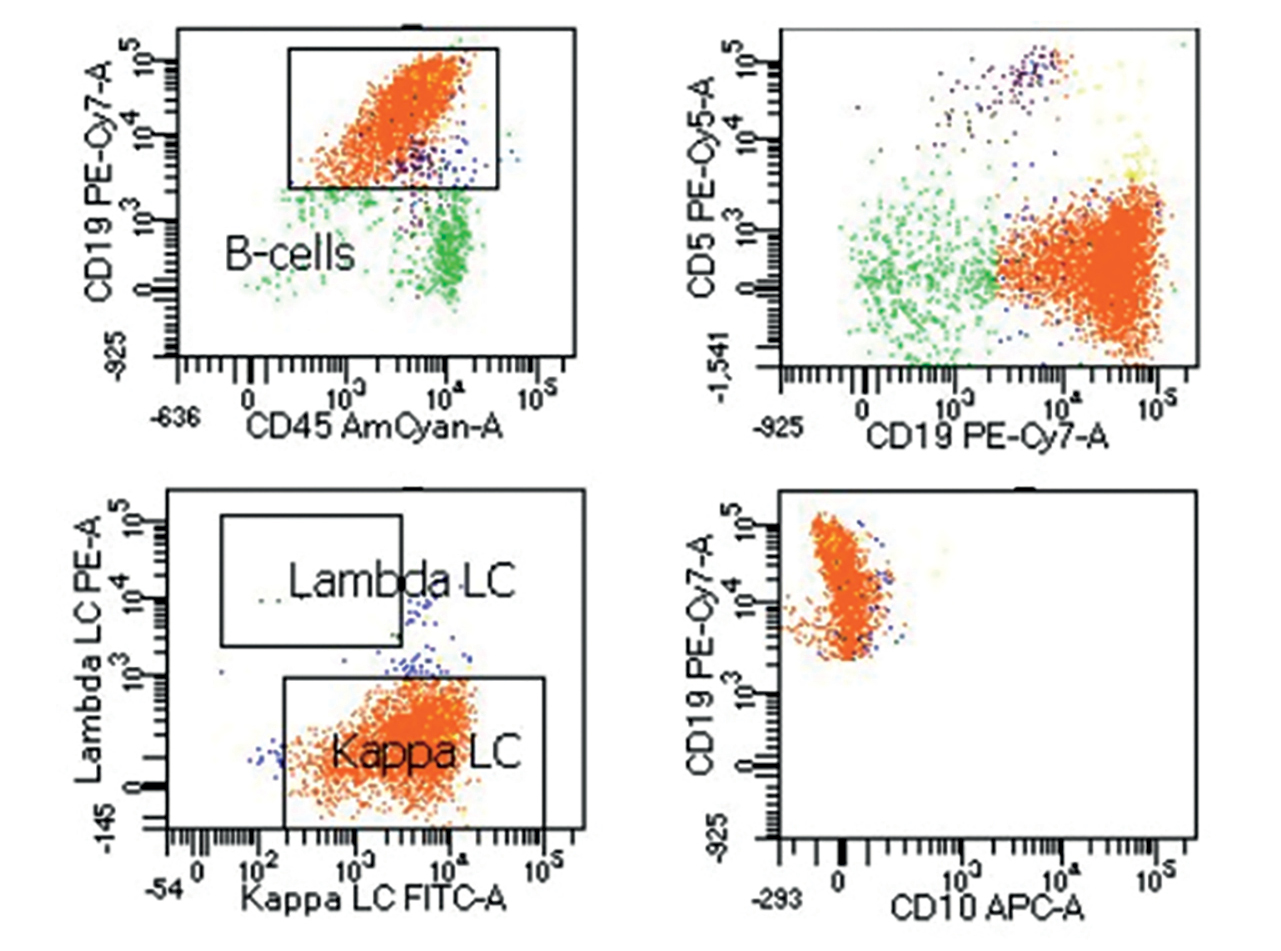
Hematológiai vizsgálat történt (lumbálpunkció, koponya-MRI, hasi-mellkasi CT, cristabiopszia és csontvelő aspirációs citológia), amelyek negatív eredménnyel zárultak. 2020 októberében jobb szemből ismételt üvegtesti mintavétel történt a lymphoma hematológiai terápiájához szükséges pontosabb identifikálás céljából, de az erről az oldalról vett minta kiegészítő információt nem adott. A műtéttel egy időben bal szemen kialakult goniorubeosis okozta szekunder glaukóma miatt, anti-VEGF injekciós kezelésben részesült. 2021 januárjában járászavar miatt, koponya-CT és -MRI (3. ábra) történt, amelyen, jobb oldalon parietálisan az ellenoldalra is terjedő nagyméretű térfoglalás igazolódott, amelynek biopsziája a kemo-, majd sugárterápia indításához szükséges szövettani eredményt biztosította (CD20, CD79a pozitív, CD10 negatív, BCL-6, MUM1, BCL-2 pozitivitást mutató non-centrum germinatívum kiindulású diffúz nagy B-sejtes lymphoma).
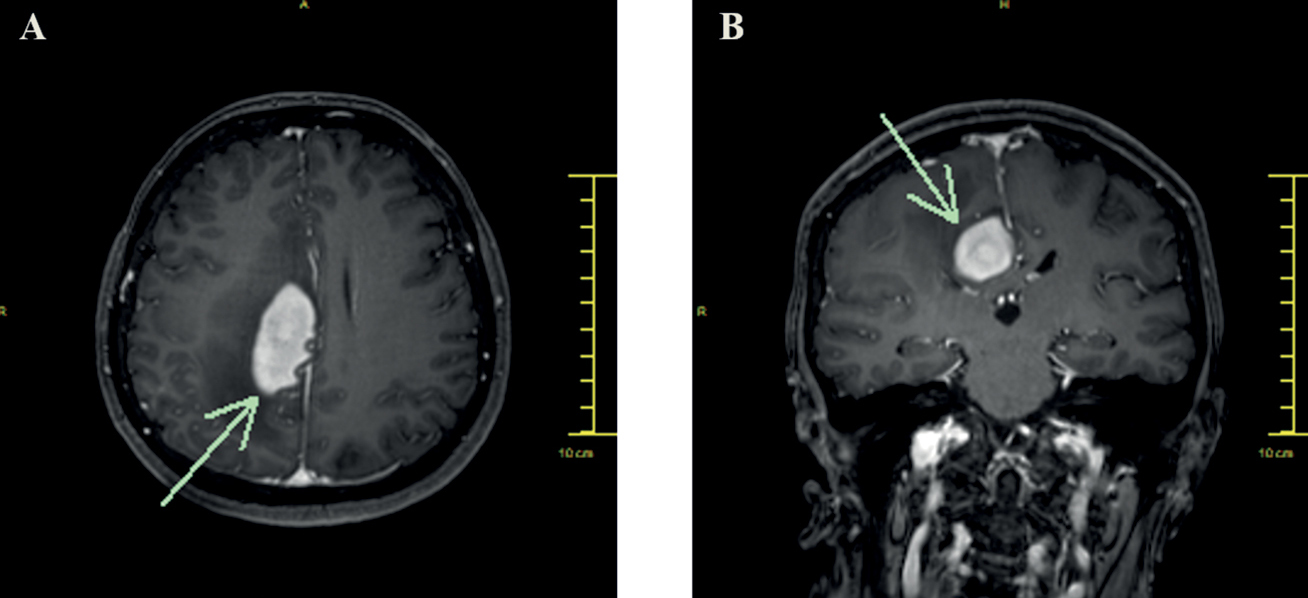
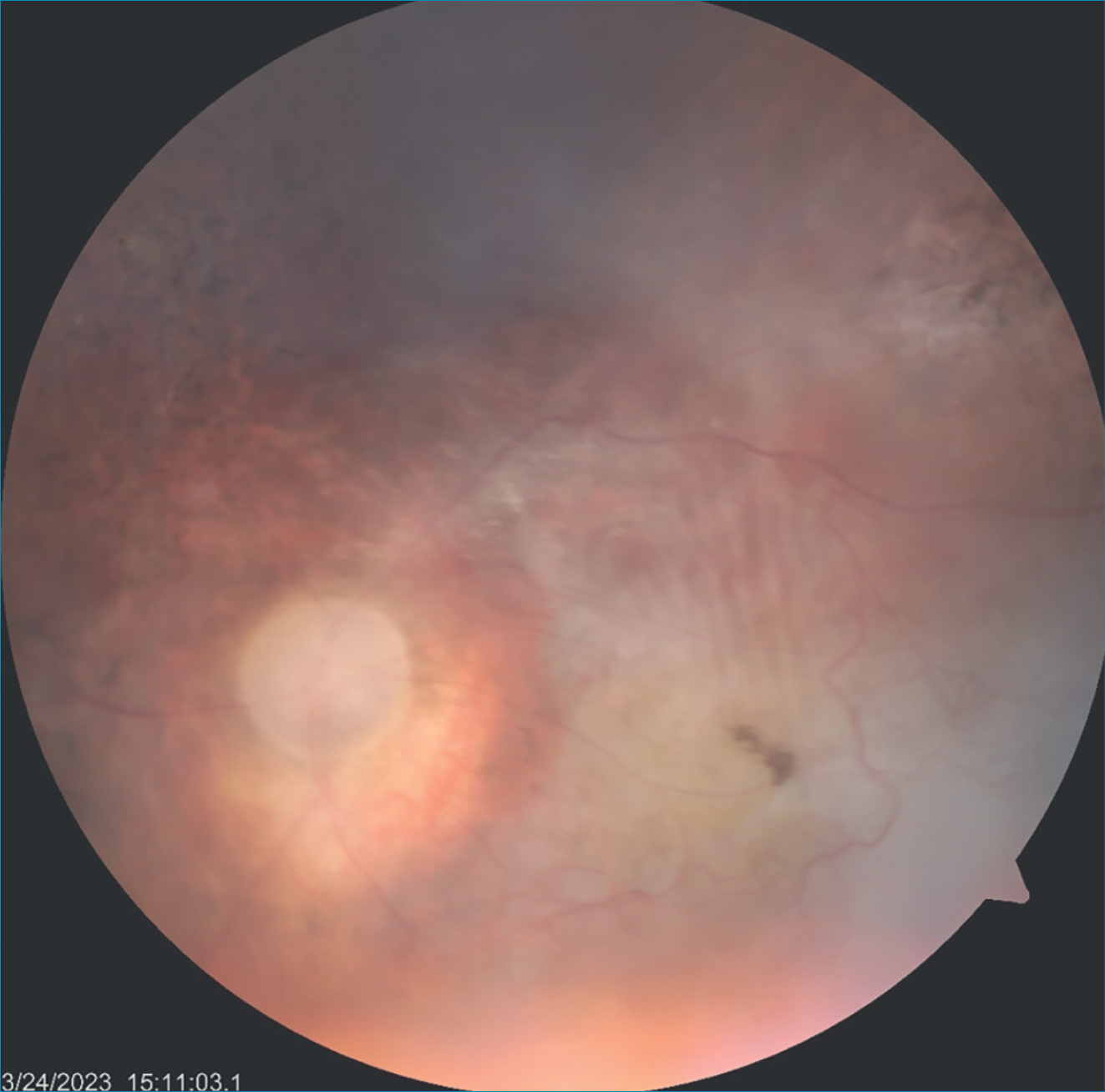
Ennek ismeretében a Hematológiai osztály R-MPV (rituximab, methotrexát, prokarbazin, vincristin) protokollt kezdett, amelynek hatására az áprilisban készült koponya-MRI-vizsgálat radiológiai regressziót mutatott. Az autológ őssejt-transzplantáció (SCT) elégtelen őssejt-mobilizálás miatt nem volt lehetséges. Ekkor intraocularisan tumor- és gyulladásmentessé vált. Júniusban konszolidációs kezelésként R+HD-Ara-C (Rituximab plusz nagy dózisú Citarabin) kemoterápiát kapott. A júliusban végzett kontroll koponya MRI-vizsgálata a jobb frontoparietalis régióban még aktív gócot igazolt, amely miatt az érintett agyi területre, illetve a bal szemre, mérsékelt recidív infiltráció miatt, sugárkezelést indikáltak 24 Gy dózisban, illetve boost 9 Gy dózisban. Hematológiailag komplett remisszióba került, neurológiai kórjele nem maradt. Szemészetileg 2021 szeptemberére tünetmentessé vált, BCVA 1,0/fén. Obszervációját azóta is rendszerességgel végezzük, szemészeti státusza változatlan. A 4. ábrán a bal szem szemfenéki képe látható, az utolsó kontroll alkalmával, mint a betegség végstádiuma.
Megbeszélés
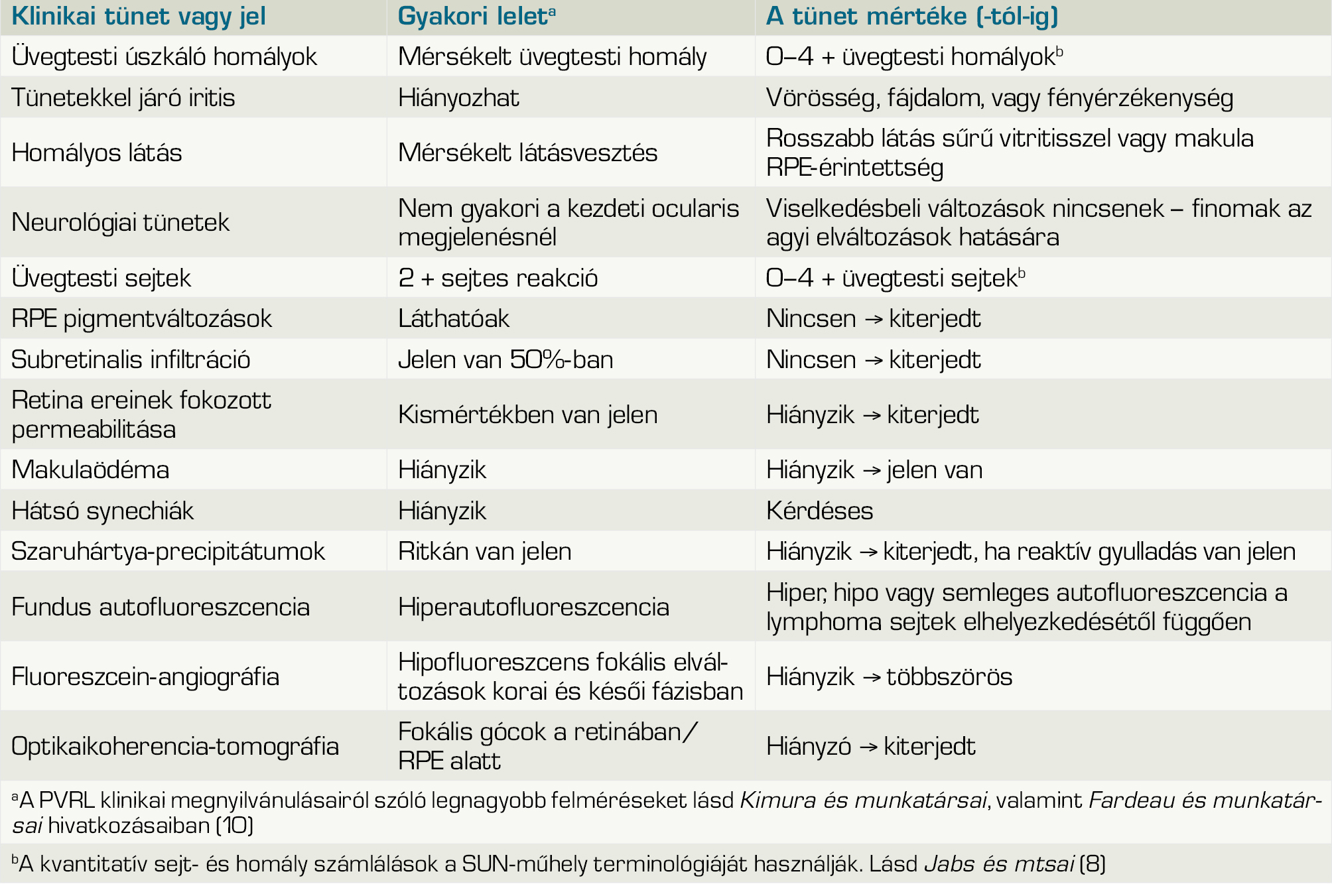
Az uveitises masquerade-szindrómák (UMS) valójában nem gyulladásos kórképek. Ezeknél a betegeknél az intraocularis gyulladás másodlagosan alakul ki, egy másik kezdeti rendellenesség miatt, vagy gyulladásosnak tűnő intraocularis sejtek és opacitások jelennek meg, mint például pigment, vér vagy rosszindulatú sejtek. Esetükben a helytelen diagnózis nagyon súlyos következményekkel járhat, akár a beteg életére nézve is, ezért a masquerade-szindróma helyes diagnózisa és kezelése rendkívül fontos (11). A malignus masquerade-szindrómák leggyakoribb formája az intraocularis lymphoma a látott klinikai kép alapján nagyon sokrétű, amely miatt a Nemzetközi Uveitis Tanulmányi Csoport (IUSG) által összehívott szakértői testület a PVRL-betegség felismerésének és diagnosztizálásának javítása érdekében konszenzust hozott létre. A betegek többsége 50 év feletti, fájdalommentes látásromlást és úszkáló homályokat tapasztal, szemvörösség vagy fényérzékenység nélkül (13). A nők gyakrabban érintettek, mint a férfiak, 2:1 arányban. A betegség az esetek 80%-ánál kétoldali, de jelentkezésekor aszimmetrikus (12). A szakirodalomban ismertetett, szemészeti vizsgálatok során látható elváltozásokat és a kialakuló tünetek mértékét a 3. táblázatban tüntettük fel (13).
Az elülső szegmenstünetek közé tartoznak az elülső csarnokban megjelenő fehérje és alakos elemek, a szaruhártya hátlapján precipitátumok, az írisz vérbősége, elmosódott rajzolata, amelyet ritkán pseudohypopyon kísér. A hátsó szegmentum eltérései utánozhatják a chorioretinitist vagy a vasculitist, és magukba foglalhatják a vitritist, amely kezdetben érzékeny a helyi és orális szteroidokra (7). Az üvegtesti térben a lypmhomás sejtek lapjai és klaszterei figyelhetők meg. A daganatsejtek nagyobbak, mint a gyulladásos sejtek, és nem keverednek a reaktív gyulladásos sejtekkel, ami egy olyan klinikai jellemző kialakulásához vezet, amelyet „aurora borealis” vagy „gyöngysor” megjelenésként írnak le, az üvegtest rostjai mentén lerakódó sejtek miatt (12, 7). Alkalmanként előfordulhat hátsó üvegtesti leválás és vérzés is. A szemfenéken jellemzőek a krémszerű narancssárga léziók a retinában vagy a retina pigmentepitheliuma alatt, amelyek lehetnek aprók, több gócúak vagy akár konfluálhatnak is. A szakirodalom ezt a jellegzetes mintázatot „leopárd bőr” mintázatnak nevezi. Előfordulhat izolált subretinalis lézió, társuló exudatív retinaleválás, vagy látóideg-infiltráció is. Néha a PIOL kétoldali granulomatosus panuveitisnek tűnik (9). A makula közelében kialakuló PVRL diszciform hegként is megjelenhet (12). A cisztoid makulaödéma gyakran hiányzik, ellentétben a hasonló sejtkiszórással járó uveitises esetekkel, és a látás a vitritis mértéke alapján a vártnál jobb. A kialakuló érelzáródások retinainfarktusokat és vérzéseket okozhatnak, amelyek utánozzák az akut retinanekrózist vagy retinitist (2). Fájdalmas, vörös szem, másodlagos glaukóma és hyphaema is kialakulhat az írisz neovaszkularizációja következtében. Ezeket a tüneteket tévesen az uveitisnek tulajdoníthatják, ami a diagnosztikát bonyolítja (12). Az orbitalis, extrascleralis és sclerochoroidális érintettség ritka, de megfigyelhető. Az általunk leírt esetben üvegtesti vérzésnek imponáló képet láttunk, amelyet a láthatóvá váló chorioretinitises góc, akut retinanekrózis képe az infekciózus uveitis diagnózisa felé vitt, amely az üvegtesti mintavétel során nem igazolódott. A szisztémás szteroidkezelés mellett kezdetben javuló, majd szteroidkímélő immunszuppresszív kezelés megkezdését indokló progresszió felvetette az ismételt üvegtesti mintavétel szükségességét, a megfelelő terápiarestrikció (legalább 2 hét) mellett. A szemgolyóból történő mintavétel technikái közé tartozik az üvegtest vékony tű aspirációja pars plana seben keresztül (21 G-25 G), pars plana vitrectomia, transscleralis biopszia subretinalis léziók esetén, az elülső csarnokból történő mintavétel és az enukleáció. Az idiopátiás szteroidrezisztens krónikus uveitisben szenvedő betegeknél a gyorsan szállított, nem fixált, pars plana vitrectomia során vett üvegtesti minták vizsgálata számít az arany standardnak, az intraocularis lymphoma kizárására. A 4. táblázatban az intraocularis lymphoma diagnosztikáját szolgáló, üvegtesti mintából végezhető vizsgálatokat tüntettük fel.

lymphoma esetén (7)
A vitrectomia alkalmával történő mintavétel során szükséges a nagy furatú vitrectomok használata és az alacsony vágási sebesség a sejtek sérülésének csökkentése érdekében, valamint az infúzió leállítása után, hígítatlan friss üvegtesti folyadék összegyűjtése. A mintát mihamarabb a feldolgozó laboratóriumba érdemes szállítani, mivel a lymphomás sejtek morfológiai degradáción mehetnek keresztül. A minta HOPE (HEPES-glutaminsav puffer-közvetített szerves oldószervédelem) oldatban történő szállítása tovább növelheti a pozitív eredmények valószínűségét (7). A malignus sejtek közvetlen, citológiai vizsgálattal történő megjelenítése továbbra is a diagnózis jelenlegi arany standardja (3).
A citológiai laboratóriumi diagnózist nagyban segíti az immuncitokémiai-, az áramlási citometriai vizsgálatok. A citokinanalízisen belül az interleukinszintek biokémiai kimutatása (IL10:IL6 arány >1) lehet segítségünkre, amely hazánkban elsősorban kutatási célokat szolgál (2). A legtöbb IOL-eset monoklonális B-sejtes lymphoma, amely pozitívan festődik a B-sejtes markerekre, köztük a CD19-re, CD20-ra, CD22-re és CD79a-ra (2). A citokinelemzés hasznos segédeszközzé vált az IOL és a gyulladásos állapotok, például az uveitis megkülönböztetésében. A B-sejtek nagy mennyiségű interleukin-10-et (IL-10) választanak ki, amely egy immunszuppresszív citokin, amely elősegíti a B-sejtes lymphomás sejtproliferációját. Ezzel szemben az interleukin-6 (IL-6) egy proinflammatorikus citokin, amelyet általában a makrofágok és a T-sejtek választanak ki az üvegtestbe gyulladásos körülmények között, beleértve az uveitist is. A citokinanalízis enzimhez kötött immunszorbens vizsgálatokat (ELISA) vagy citokin multiplex vizsgálatokat használ az üvegtest IL-10 és IL-6 szintjének mérésére és az IL-10:IL-6 arány kiszámítására. Az 1,0-nél nagyobb IL-10:IL-6 arány IOL-ra utal. A citokinprofil alkalmazása azonban több okból is ellentmondásos. A citokinszintek különösen érzékenyek a kortikoszteroid és az immunszuppresszáns terápiára, ami potenciálisan félrevezető arányokhoz vezethet (3). Az IOL molekuláris tesztelését nagyrészt a polimeráz láncreakció (PCR) megjelenése tette lehetővé. IOL-biomarkerek, mint például a B- és T-sejt-receptor klonalitása, a B-sejtes lymphoma 2 (BCL2) transzlokációja és a myeloid differenciálódás elsődleges válasza 88 (MYD88) L265P-mutáció (3). A molekuláris genetikai vizsgálatok kiegészítő diagnosztikus szempontként szolgálhatnak. Esetünkben az üvegtesti mintából készült citológiai vizsgálat negatív eredményt adott, ami feltétele a szisztémás kemoterápia megkezdéséhez. Ilyen esetekben a következő diagnosztikus lépés a hematológiai kivizsgálás (cristabiopszia, liquor mintavétel, agyi térfoglalás esetén biopszia). A PIOL jelentkezésekor 16-34%-ban van központi idegrendszeri érintettség. Gyakori fokális neurológiai lelet a hemiparesis 51%-ban, és a cerebelláris jelek, beleértve az ataxiát is, 23%-ban fordulnak elő. A PCNSL- ben szenvedő betegek 13-25%-ánál vannak szemészeti tünetek a diagnózis során. Ezzel szemben a becslések szerint a PIOL-esetek 42%-a és 92%-a között intracraniális lymphoma alakul ki átlagosan 8-29 hónapon belül (2). Az MRI-leleten azonosítható elváltozásokkal rendelkező betegek 25%-ának lesz pozitív CSF citológiája. A PCNSL diagnózisa az agyi térfoglalás szövettani vizsgálatával állítható fel, és ha egyidejűleg a szem érintettsége is fennáll, akkor a szemszövet-biopszia nem szükséges.
Kezelés
Az IOL kezelési módjai közé tartozik az intravitrealis kemoterápia, a szisztémás kemoterápia és a sugárterápia, amelyet önmagában vagy megfelelő kombinációban alkalmaznak. A terápiák a betegség mértékétől, a központi idegrendszer érintettségének meglététől vagy hiányától, valamint a betegek általános állapotától függően változnak. Az IOL központi idegrendszeri vagy szisztémás érintettség nélküli kezelésére vonatkozó jelenlegi ajánlást, a lokális kezelésre kell korlátozni, beleértve az intraocularis methotrexátot és/vagy a szem besugárzását a szisztémás toxicitás minimalizálása érdekében (9). Azonban a PCNSL gyakori progressziója miatt a szisztémás kezelés is meggondolandó.
A szisztémás kemoterápiához hasonlóan az intravitrealis kemoterápia alappillére a methotrexát (9). Az intravitrealis 0,4 mg/0,1 ml methotrexáttal helyi tumorkontroll érhető el relapszusos PIOL-ban, a PCNSL ocularis relapszusában is elsődleges a kezelés szisztémás kemoterápiával, az intratekális kemoterápiával vagy sub-Tenon szteroid injekciókkal kombinálva. Az intravitrealis injekciókat az első 4 hétben hetente kétszer, majd hetente egyszer 8 héten keresztül, és havonta ismételve 9 hónapon keresztül kapja a beteg, ami összesen 25 injekciót jelent. Remisszió átlagosan 6,4 injekció után érhető el; az esetek 95%-ának pedig 13 vagy kevesebb injekcióra van szüksége hozzá. Ismételt alkalmazása esetén gyógyszer-rezisztencia léphet fel (2). A nagy dózisú methotrexát a legaktívabb gyógyszer, önmagában alkalmazva akár 72%-os válaszarányt, kombinációban pedig akár 94%-100%-ot is eredményez (9). A rituximab egy anti-CD20 monoklonális antitest, amelyet alkalmaznak intravitrealis formában a methotrexát injekciók gyakoriságának csökkentésére vagy a methotrexát-rezisztens IOL eseteiben (9). Általában négyhetes időközönként adják. Az elsődleges válasz általában jó, de a későbbi relapszusok intravitrealis methotrexátot és besugárzást igényelhetnek (7).
A szisztémás kemoterápia fő akadálya, a kemoterápiás szer vér–agy gáton és a vér–retina gáton keresztül történő átjutása. A nagy dózisú methotrexát áthatol a vér–agy gáton, 50-80%-os válaszaránnyal, ezért általában minden kemoterápiás protokollban szerepel. A citozin-arabinozid szintén jó penetranciájú, amely miatt az MTX-kezelés kiegészítéseként alkalmazzák. Valluri és munkatársai MTX és Ara-C kombinációját alkalmazták szem- és központi idegrendszeri betegségben szenvedő pácienseknél. Mind a szem, mind a központi idegrendszer betegségei legalább 24 hónapos remisszióval megszűntek (16). Mindkét szer esetén jelentkezhetnek szemészeti mellékhatások, mint a szemhéjödéma, könnyezés, szemhéj és kötőhártya-gyulladás, keratitis, fotofóbia. Az intravénás rituximabot általában methotrexáttal együtt adják a PVRL kiújulása esetén. Az autológ őssejt-transzplantációt lehetőség szerint első remisszióban végezzük PCNSL esetén intenzív kemoterápia után. A folyamatban lévő vizsgálatok alatt álló gyógyszerek a Pomalidomid, az Ibrutinib és a Lenalidomid és Rituximab kombinációja ígéretes eredményekkel kecsegtetnek (7).
Külső, lokális sugárkezelés lehetősége felmerül PIOL-ban szenvedő betegek esetén központi idegrendszeri érintettség nélkül (30-35 Gy 15 frakcióban). A profilaktikus központi idegrendszeri kezeléssel kiegészített szembesugárzást a PIOL kezelésére, a látás megőrzésére és a központi idegrendszer érintettségének megelőzésére is használják. A teljes agy sugárkezelését a szem sugárkezelésével egészítik ki olyan esetekben, amikor központi idegrendszeri disszemináció van jelen és a beteg autológ őssejt-transzplantációra nem alkalmas, és azoknál, akik nem reagálnak a szisztémás kemoterápiára, vagy nem tolerálják az agresszív terápiákat (7).
Következtetés
Ez az eset rávilágít az intraocularis lymphoma diagnosztizálásával és kezelésével kapcsolatos folyamatos kihívásokra. Míg a klinikai és szemészeti képalkotó leletek gyakran utalnak a diagnózisra, a további vizsgálatok általában központi idegrendszeri-MR, mellkas-has-kismedence-CT, illetve egész test-PET/CT-képalkotást foglalnak magukban, hogy felfedjék az extraocularis érintettséget olyan betegeknél, akiknél PVRL vagy uvealis lymphoma gyanúja merül fel. A diagnózis szövet-, üvegtest- vagy liquor mintavételt igényel, amelyet speciális citológiai, immunológiai és/vagy genetikai analízis követ. A kezelés leggyakrabban multidiszciplináris és betegspecifikus; helyi és szisztémás kemoterápiát is tartalmazhat, regionális sugárkezeléssel vagy anélkül (13).
Nyilatkozat
A szerzők kijelentik, hogy a speciális esetet ismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Aronow ME, Shen D, Hochman J, Chan CC. Intraocular Lymphoma Models. Ocul Oncol Pathol 2015; 1: 214–222.
https://doi.org/10.1159/000370158
2. Cunningham ET, Miserocchi E, Smith JR, Gonzales JA, Zierhut M. Intraocular Lymphoma. Ocul Immunol Inflamm. 2021; 29: 425–429.
https://doi.org/10.1080/09273948.2021.1941684
3. Davis JL. Intraocular lymphoma: a clinical perspective. Eye (Lond) 2013; 27: 153–162.
https://doi.org/10.1038/eye.2012.250
4. Fardeau C, Lee CP, Merle-Béral H, Cassoux N, Bodaghi B, Davi F, Lehoang P. Retinal fluorescein, indocyanine green angiography, and optic coherence tomography in non-Hodgkin primary intraocular lymphoma. Am J Ophthalmol 2009; 147: 886–894.
https://doi.org/10.1016/j.ajo.2008.12.025
5. Géhl Zs. Masquerad-szindrómák. In: Süveges I. (szerk.) Uveitis. Budapest: Medicina Könyvkiadó Zrt.; 2023. p. 151–155. ISBN szám: 978 963 226 869 9
6. Grange LK, Kouchouk A, Dalal MD, Vitale S, Nussenblatt RB, Chan CC, Sen HN. Neoplastic masquerade syndromes in patients with uveitis. Am J Ophthalmol 2014; 157: 526–531.
https://doi.org/10.1016/j.ajo.2013.11.002
7. Heiferman MJ, Yu MD, Mruthyunjaya P. Update in Molecular Testing for Intraocular Lymphoma. Cancers (Basel) 2022; 14: 4546.
https://doi.org/10.3390/cancers14194546
8. Jabs DA, Nussenblatt RB, Rosenbaum JT. Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol 2005; 140: 509–516.
https://doi.org/10.1016/j.ajo.2005.03.057
9. Kalogeropoulos D, Vartholomatos G, Mitra A, Elaraoud I, Ch'ng SW, Zikou A, Papoudou-Bai A, Moschos MM, Kanavaros P, Kalogeropoulos C. Primary vitreoretinal lymphoma. Saudi J Ophthalmol 2019; 33: 66–80.
https://doi.org/10.1016/j.sjopt.2018.12.008
10. Kimura K, Usui Y, Goto H. The Japanese Intraocular Lymphoma Study Group. Clinical features and diagnostic significance of the intraocular fluid of 217 patients with intraocular lymphoma. Jpn J Ophthalmol 2012; 56: 383–389.
https://doi.org/10.1007/s10384-012-0150-7
11. Rothova A, Ooijman F, Kerkhoff F, Van Der Lelij A, Lokhorst HM. Uveitis masquerade syndromes. Ophthalmology 2001; 108: 386–399.
https://doi.org/10.1016/s0161-6420(00)00499-1
12. Sagoo MS, Mehta H, Swampillai AJ, Cohen VM, Amin SZ, Plowman PN, Lightman S. Primary intraocular lymphoma. Surv Ophthalmol 2014; 59: 503–516.
https://doi.org/10.1016/j.survophthal.2013.12.001
13. Simakurthy S, Jena S, Tripathy K. Primary Intraocular Lymphoma. 2023 Feb 22. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. p. 1–29. PMID: 35015415
14. Tan AH, Chee SP. Malignant uveitis masquerade syndrome. Am J Respir Crit Care Med 2014; 190: 24–25. PMID: 18655462
15. Tang LJ, Gu CL, Zhang P. Intraocular lymphoma. Int J Ophthalmol 2017; 10: 1301–1307.
https://doi.org/10.18240/ijo.2017.08.19
16. Valluri S, Moorthy RS, Khan A, Rao NA. Combination treatment of intraocular lymphoma. Retina 1995; 15: 125–129.
https://doi.org/10.1097/00006982-199515020-00006
