A guide to preventing or delaying myopia onset and slowing its progression
doi: 10.55342/szemhungarica.2023.160.3.90
Review
Summary
The purpose of this summary is to support professional work in Hungary in order to prevent the further spread of myopia and provide actionable guidelines for experts. It is important to discuss myopia and share knowledge about it because the number of myopic individuals has significantly increased in childhood, both globally and in Hungary. This increase raises concerns as myopia can become the leading cause of blindness, but there are now effective procedures available that can help prevent or at least delay the onset of myopia, as well as slow down its progression in those who have already developed it. Due to the urgency of the situation, the International Myopia Institute (IMI) and the European Society of Ophthalmology (SOE) have developed and published the latest knowledge and recommended treatment guidelines for myopia management. This Hungarian-language summary is based on these guidelines and numerous studies with proven results. The guidelines summarize the current international definition and classification of myopia, present the pathomechanism of nearsightedness, discuss epidemiological findings, identify risk factors, and highlight current procedures that can prevent or delay the onset of myopia and slow down its progression.
Összefoglaló
Összefoglaló közleményünk célja, hogy elősegítsük a hazai szakmai munkát a rövidlátóság további terjedésének megállítására, és hogy ehhez követhető útmutatót adjunk a szakemberek kezébe. A rövidlátóságról azért kell beszélni és az ismereteket megosztani, mert világviszonylatban és hazánkban is gyermekkorban nagymértékben megnövekedett a rövidlátók száma, amely miatt a myopia a leggyakoribb vaksági okká válhat, és ugyanakkor viszont rendelkezésre állnak ma már olyan hatékony eljárások, amelyek bevezetésével és alkalmazásával a rövidlátóság kialakulása elkerülhető vagy legalább késleltethető, illetve a már kialakult rövidlátóság esetén, annak progressziója lassítható. A helyzet sürgőssége miatt az International Myopia Institute (IMI) és az European Society of Ophthalmology (SOE) kidolgozta és közzétette a myopia ellátásának legfrissebb tudásanyagát és javasolt kezelési útmutatóját. Ezen útmutatók és számos közleményben bizonyított erejű vizsgálatok alapján született meg ez a magyar nyelvű referáló közlemény. Az útmutató összegezi a myopia jelenlegi nemzetközi definícióját, klasszifikációját, bemutatja a rövidlátás patomehanizmusát, az epidemiológiai eredményeket, a rizikófaktorokat és a jelenlegi eljárásokat, amelyekkel megelőzhető, illetve késleltethető a myopia kialakulása és lassítható a progressziója.Keywords
myopia, prevention, interventions in myopia control, outdoor activity, atropine, orthokeratology
Kulcsszavak
myopia, prevenció, myopiaprogressziót lassító intervenciók, szabadtéri tevékenység, atropin, orthokeratológia
1. Bevezetés
A rövidlátás ma már jelentős globális közegészségügyi problémaként ismert, amely a következő évtizedekben emberek milliárdjait fogja érinteni, különösen Ázsiában (1). A kóros rövidlátás már most is a látáskárosodás egyik fő oka mind az ázsiai, mind a nyugati népesség körében (1, 2), és növelheti egyéb társszembetegségek, úgy, mint a katarakta, glaukóma, retinaleválás vagy a maculopathia rizikóját (3, 4). Mivel a rövidlátás és a kóros rövidlátás előfordulása világszerte növekszik, egyre nagyobb szükség van kialakulásának és progressziójának aktív megelőzésére.
Az International Myopia Institute 2019-ben tette közzé 17 ország 88 szakértője által összeállított tanulmányát a rövidlátásról (5), amelyet 2021-ben és 2023-ban is frissített és megjelentetett (6, 7). Az European Society of Ophthalmology 2021-ben, e nemzetközi tanulmány alapján 12 európai ország 26 témában járatos szakértője segítségével megalkotta az Európára vonatkozó ajánlásokat (8). Ezek az összefoglaló tanulmányok, valamint korábbi szerkesztőségi cikkünk ajánlásai (9) adják e cikk vezérfonalát.
A kéziratunk célja, hogy naprakész információkkal szolgáljon a myopiával kapcsolatos jelenlegi ismeretekről, felhívja a figyelmet e refrakciós hiba fontosságára és ajánlást fogalmazzon meg a magyar szemészorvosok számára a gyermek- és serdülőkori rövidlátás kialakulásának megelőzésére és progressziójának lassítására.
2. Definíció, klasszifikáció
A nemzetközi standardhoz igazodva és a világban egységesítve, a rövidlátás definíciója és osztályozása az International Myopia Institute által leírtakat követi (10).
A kvalitatív fogalom szerint a myopia olyan fénytörési hiba, amelynél a szembe érkező fénysugarak relaxált akkomodációs állapotban az optikai tengellyel párhuzamosan a retina előtt fókuszálódnak.
Tengely (axiális) myopia esetén a myopiás refraktív hiba a normálisnál hosszabb szemtengelyhosszból ered, míg refraktív myopia esetén a szaruhártya túlságosan domború, vagy a szemlencse a szokásosnál nagyobb optikai erősségű.
Szekunder myopiáról akkor beszélünk, ha e fénytörési hiba egyetlen, specifikus okra (pl. gyógyszer, szaruhártya-betegség vagy szisztémás klinikai szindróma) vezethető vissza, és nem a rövidlátás kialakulásának elismert populációs kockázati tényezői okozzák.
Patológiás a myopia, ha a rövidlátással járó túlzott tengelyhossz a szem hátsó szegmensében szerkezeti elváltozásokhoz vezet (beleértve a hátsó staphylomát, a myopiás maculopathiát és a nagyfokú rövidlátással összefüggő opticus neuropathiát), és a legjobb korrigált látóélesség csökkenését, elvesztését okozhatja.
A kvantitatív fogalom szerint a rövidlátás olyan állapot, ahol a refrakciós hiba szférikus ekvivalense kisebb, vagy egyenlő –0,5 dioptriánál (D), relaxált akkomodációs állapotban.
Megkülönböztetünk kisfokú rövidlátást, ha a refrakciós hiba szférikus ekvivalense ≤–0,50 és >–6,00 D relaxált akkomodációs állapotban, és nagyfokú rövidlátást, ahol a refrakciós hiba szférikus ekvivalense ≤–6,00 D relaxált akkomodációs állapotban.
Új fogalomként premyopiáról akkor beszélünk, ha a refrakciós hiba szférikus ekvivalense ≤+0,75 D és >–0,50 D relaxált akkomodációs állapotban azon gyermekeknél, ahol a kort, és egyéb rizikófaktorokat figyelembe véve valószínűsíthető, hogy a jövőben rövidlátás fog kialakulni, és ez megelőző beavatkozást tesz szükségessé.
3. Patomechanizmus
A rövidlátás kialakulása nem csupán genetikai eredettel bír (lásd még részletesebben az 5. alfejezetben). Kísérleti modellek bizonyították, hogy a myopia a látási körülményekhez való alkalmazkodásként alakulhat ki, az emmetropizációban működő mechanizmusokhoz hasonlóan. Így a rövidlátás kialakulása és progressziója a szem növekedését befolyásoló vizuális/környezeti körülmények és genetikai tényezők összetett kölcsönhatásának eredménye (11, 12).
A legújabban megjelent cikkek többsége a szemgolyó túlzott növekedéséért a perifériás retinán jelentkező defókuszt tartja felelősnek (13). Amikor a tárgyról jövő fénysugarak képe a retina előtt jelenik meg, myopiás, amikor mögötte, hypermetropiás defókuszról beszélünk (14–20). A retinalis defókusz olyan kaszkádot indít el, amely számos celluláris és biokémiai változáshoz vezet a retinában és a retina pigmentepitheliumban (RPE). Ezek a kémiai jelek a chorioideán keresztül továbbítódnak. A chorioidea olyan növekedési faktorokat szabadít fel, amelyek képesek szabályozni a scleralis extracelluláris mátrix (ECM) átrendeződését, és a szem növekedéséhez és rövidlátó fénytörési állapothoz vezetnek (21–23) (1. ábra).
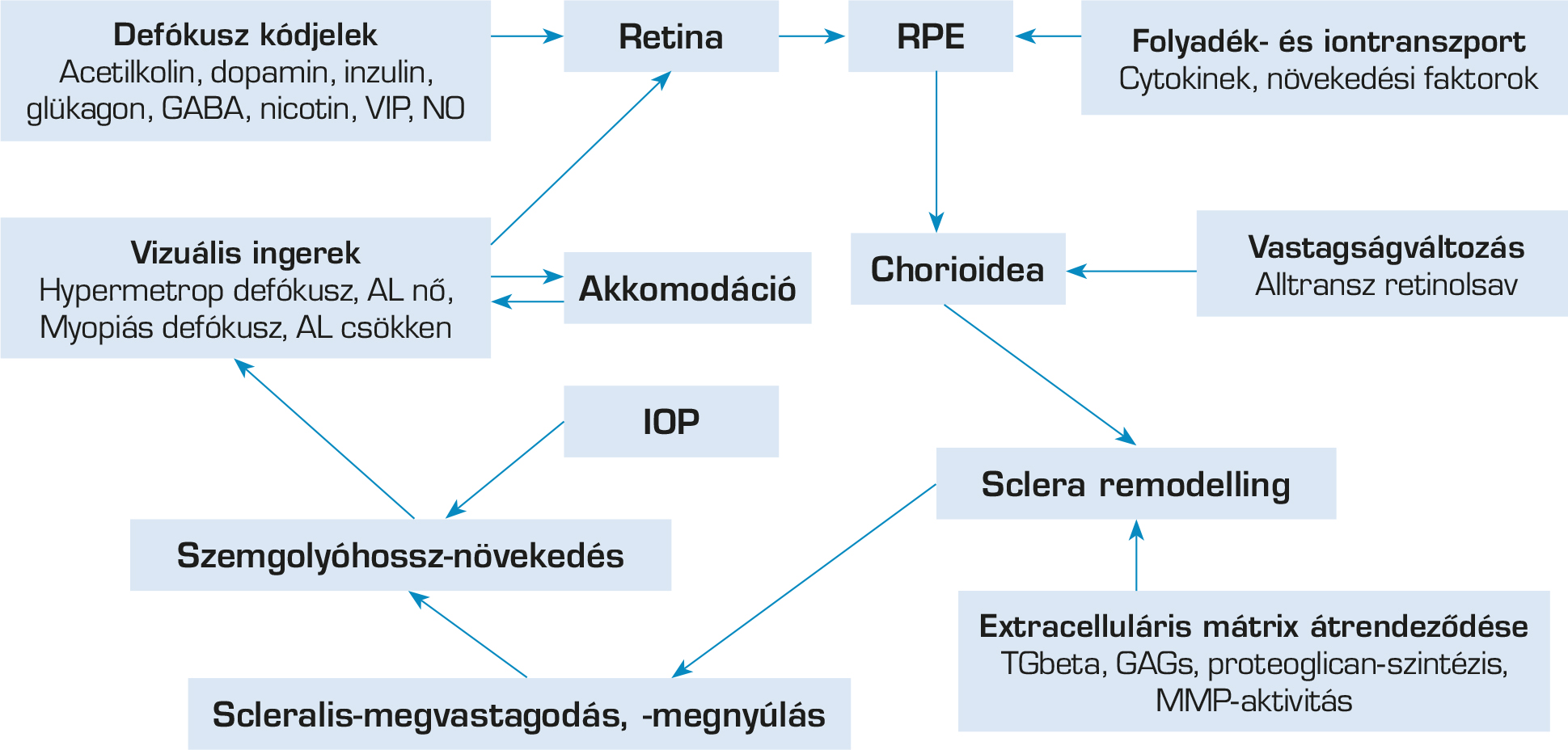
A retinalis képminőséget és így a szem hosszát szemészeti és környezeti tényezők is befolyásolhatják, úgymint a magasabb rendű aberrációk (24–26), a cirkadián ritmus (27–29), a fényintenzitás és annak spektrális összetétele (30–32).
A chorioideára egyre nagyobb figyelem összpontosul a rövidlátás kapcsán. Hypermetropiás defókusz hatása pár órán belül a chorioidea elvékonyodását okozza, míg myopiás defókusz a megvastagodásához vezet. Ez utóbbi által jobban ellenáll a szem megnyúlásának. Ezek alapján a chorioidea válasza értékes mutatója lehet már pár óra alkalmazás után is az optikai intervenciók hatékonyságának (33).
4. Epidemiológia
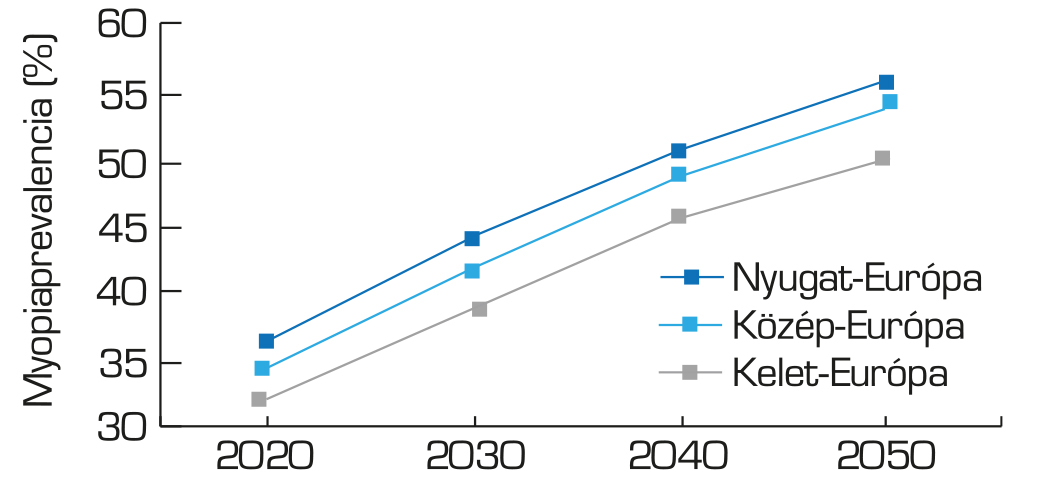
A rövidlátás prevalenciája 2050-re az előrejelzések szerint 65%-ra növekszik Ázsiában, 56%-ra Nyugat-Európában, 54%-ra Közép-Európában és 50%-ra Kelet-Európában, ha addig nem vezetnek be preventív intervenciókat (1) (2. ábra).
Egy 2015-ös metaanalízis alapján, Nyugat- és Észak-Európában az elmúlt 20-30 évben egyértelműen a rövidlátás gyakoriságának növekedése volt megfigyelhető (34–36). Ezzel szemben, míg a jelentések szerint a rövidlátók száma világszerte emelkedett, Délkelet-Norvégiában úgy tűnik, hogy hasonló tendencia nem tapasztalható (37). Ugyanígy Dániában sem, ahol a közel 140 éves követési idő alatt sem történt meggyőző változás a rövidlátás prevalenciájában (38). Mivel Ázsiában két-három generációval ezelőtt a rövidlátás gyakorisága sokkal alacsonyabb volt (39), arra következtethetünk, hogy a modern populációkban a környezeti és társadalmi tényezőknek jelentős szerepe van a myopia kialakulásában.
Jelenleg az iskoláskorú gyermekek körében a rövidlátás előfordulása Kelet-Ázsiában 73%, Észak-Amerikában 42%, és Európában is jelentős ez a százalék (34,5%) (1, 40). Az afrikai és dél-amerikai gyermekeknél viszont alacsonyabb, 10% alatti prevalenciát mértek (41). Egy Európára vonatkozó metaanalízis szerint, a legmagasabb prevalenciával a 25–29 éves korcsoport rendelkezik (47,2%) (42). Az európai, amerikai és óceániai fehér népesség körében az elmúlt évtizedekben végzett vizsgálatok nem mutattak ki egyértelmű különbségeket (43).
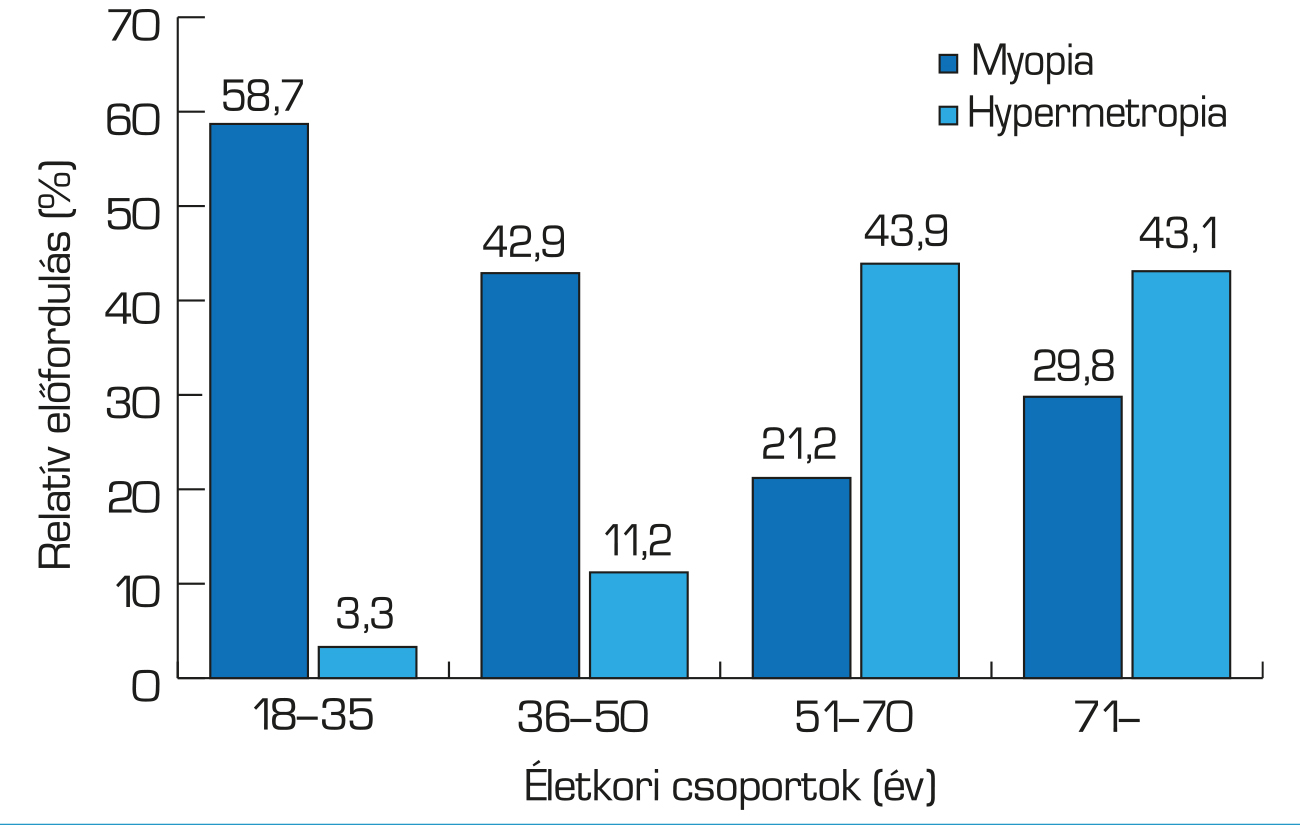
Magyarországon az elmúlt évtizedben a myopia előfordulása a 18–35 éves korcsoportban elérte az 58,7%-ot, míg korábban (1934-ben, illetve 1960-ban) nem haladta meg a 7%-ot (44, 45) (3. ábra).
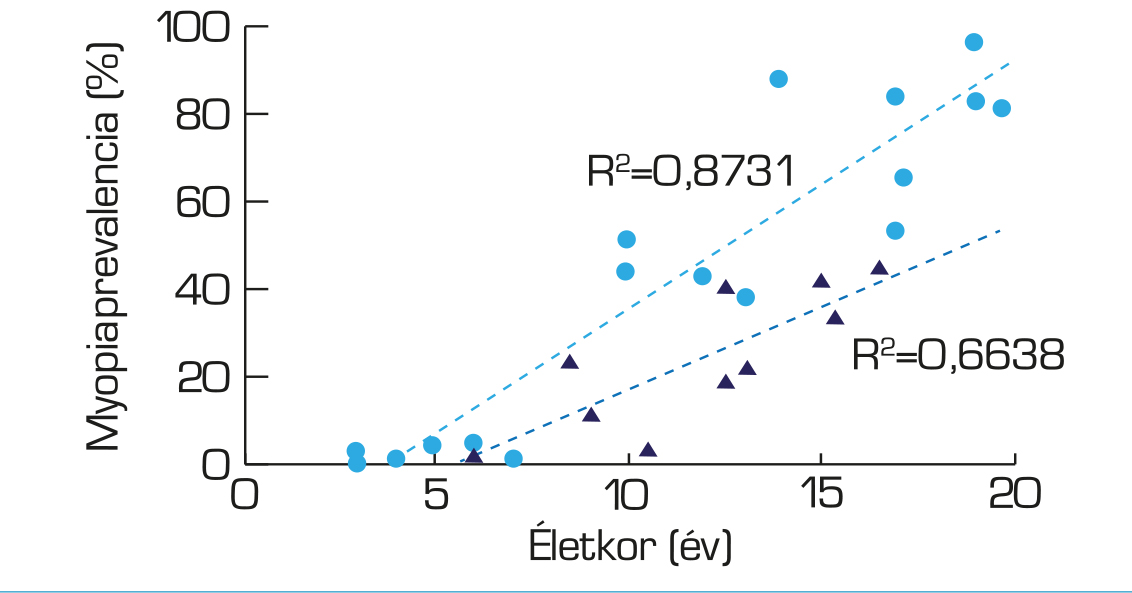
A nagyfokú myopia legerősebb rizikófaktora mind az ázsiai, mind a kaukázusi rassz esetén a fiatalkori kezdet (46–49). Hatéves kor alatt a rövidlátás prevalenciája alacsony, még az ázsiai gyermekek esetében is. Hatéves kortól azonban jelentősen kezd emelkedni az előfordulás gyakorisága. Kialakulásának legmagasabb aránya jelenleg a 7–10 éves korosztályban a legjelentősebb (50, 51) (4. ábra).
Európai, 6–16 éves fehérbőrű gyermekek átlagos éves progressziója refrakcióban –0,41 D és a szemgolyó megnyúlásában 0,3 mm, míg a 12–22 éves korosztályban ez –0,16 D és 0,15 mm (39).
A myopiaprogresszió leállása, vagyis a myopia stabilizációja 15 éves korig a gyermekek csaknem felében, 48%-ában figyelhető meg, 18 éves korra az esetek 78%-a, 21 éves korra az esetek 90%-a stabilizálódik. A nagyfokban rövidlátók kivételével a teljes stabilizálódás 24 éves korra tehető (52–54). Azonban vannak irodalmi adatok arra vonatkozólag, hogy a 20–30 éves korosztályban is folytatódhat a rövidlátás romlása, amely részben genetikai, részben környezeti tényezők együttes hatásának köszönhető (55).
A rövidlátás prevalenciájában bimodális mintázat is megfigyelhető. Az afroamerikai etnikumú és a szingapúri lakosság mellett Franciaországra és Magyarországra is jellemző, hogy a myopia prevalenciájának csúcspontjai a húszas, valamint a hetvenes-nyolcvanas éveikben járó személyeknél van (44, 56) (3. ábra). A bimodális eloszlás valószínűleg az axiális myopiának köszönhető a fiatalabbak körében, míg a nukleáris szürkehályog miatti másodlagos refraktív myopizációnak az idősebb egyénekben, illetve a műtött szürkehályogosokban az általában enyhe myopiára tervezett műlencse törőerőnek (44, 57).
A myopia progressziója és az etnikum tekintetében az ázsiai és európai gyermekek rövidlátásának progressziója ellentmondásos. Egy metaanalízis az ázsiai gyermekeknél gyorsabb progressziót mutatott ki (0,27 D-val), mint az európai gyermekeknél az 1 éves követési időszak alatt (58). Egy ausztrál vizsgálat azonban hasonló progressziós arányt talált az Ausztráliában élő fehér európai és kelet-ázsiai gyermekek között, ami arra utal, hogy a környezeti tényezők inkább befolyásolhatják a rövidlátás progresszióját (59). Érdekes azonban, hogy finn és szingapúri gyermekek azonos korcsoportját összehasonlítva, a finn gyermekeknél gyorsabb volt a rövidlátás romlása 3 év alatt (60).
5. Genetika
A rövidlátást a genetikai és a környezeti tényezők együttes hatása okozza (8, 61). A rövidlátás gyakoriságának közelmúltbeli globális növekedése valószínűleg nem kizárólag genetikai tényezőkre vezethető vissza. A PubMed adatbázisban 1966–2001 között végzett kutatás egyértelműen arra utal, hogy a környezeti hatások erőteljesen befolyásolják a rövidlátás kialakulását és progresszióját (61). Szingapúrban az elmúlt időszakban a környezeti tényezők olyan nagymértékben változtak, hogy a nem rövidlátó szülőkkel rendelkező gyermekek nagy része is ma már rövidlátó, és a kisfokban rövidlátó szülők esetében pedig nagyfokú rövidlátó (62). A környezeti hatások a szülői fénytörési hibától függetlenül növelik a rövidlátás kockázatát az egész populációban (63–65), bár a szülők rövidlátása magasabb kockázatot jelent a fiatalkorban kialakult (early-onset) rövidlátásban (46, 66). Az oligogén és poligénes kockázati tényezők azt mutatják, hogy a magas genetikai kockázatú személyeknél akár 40-szer nagyobb a rövidlátás kockázata, mint az alacsony genetikai kockázatú személyeknél (61).
A mai napig több mint 600 genetikai lókuszt azonosítottak a fénytöréssel és a rövidlátással kapcsolatban. A másodlagos, szindrómákhoz társult rövidlátás számos génje átfedésben van a közönséges rövidlátás génjeivel, amely utóbbiak többnyire alacsony kockázatot jelentenek, de az általános populációban igen elterjedtek (61, 67).
A nagyfokú rövidlátás szindrómás formái, mint például a Marfan- szindróma, a congenitalis stacioner éjszakai vakság, a Stickler-szindróma és a Donnai–Barrow-szindróma, túlnyomórészt Mendel-féle módon öröklődik (68). A rövidlátás ezen formái ritkák. Néhány retinadisztrófia is rendelkezik myopia-fenotípussal. Ezért is fontos, hogy a szemorvosok tisztában legyenek a myopizáló szindrómák jellemzőivel, és fiatalon jelentkező myopia vagy klinikai gyanú esetén kiterjedt szemészeti vizsgálatokat végezzenek ezek feltárására.
6. Rizikófaktorok
A myopiakutatásban számos olyan nem-genetikai kockázati tényezőt azonosítottak, amelyek befolyásolják a rövidlátás gyakoriságát és progresszióját. A környezeti tényezők, leginkább a szabadban töltött idő és az oktatás, valamint a személyes jellemzők játszanak fontos szerepet a rövidlátás kialakulásában és progressziójában, de az ép binokuláris látás fontosságáról is érdemes szót ejteni (69).
6.1. Környezeti tényezők
Mint láttuk, a genetika önmagában nem magyarázza az elmúlt ötven év drámai változását a myopia prevalenciájában. A környezeti kockázati tényezők változásának kulcsszerepe van a rövidlátás kialakulásában és progressziójában (69–71).
6.1.1. Szabadtéri tevékenység hiánya
A mai napig az egyik legfontosabb környezeti tényező, ami a rövidlátás kialakulásában szerepet játszhat a szabadban eltöltött idő hiánya. Különböző elméletek léteznek arra vonatkozóan, hogy a szabadban töltött idő kedvező hatása a fényexpozíció erejének (72, 73), a rövid hullámhosszúságú (360-400 nm) és/vagy az ultraibolyafény-expozíció megnövekedett értékének (74, 75), vagy más mechanizmusnak köszönhető.
A minél több szabadban eltöltött idő bizonyítottan hatékony a rövidlátás kialakulásának megelőzésében, azonban a progresszió gátlásában már nem ennyire egyértelmű a szerepe (76, 77).
6.1.2. Közeli munka
A közeli munkavégzés, vagy tanulás időtartama szoros összefüggésben van a kevesebb szabadtéri tevékenységgel (78), így a rövidlátás gyorsabb progressziójával (79) és prevalencájával is (80–82). Ha hetente egy órával növeljük a szem közelre alkalmazkodását (1 dioptria-óra), 2%-kal nőhet a rövidlátás rizikója (83).
Kelet-Ázsiához képest Európában a rövidlátás prevalenciája jelentősen alacsonyabb, valószínűleg amiatt, hogy Ázsiában korábbi életkortól kezdődik az oktatás, mint Európában, ahol intenzitásában is elmarad az ázsiaitól (71, 84).
A Consortium for Refractive Error and Myopia (CREAM) study különböző korosztályokból származó európai és ázsiai résztvevők adatait felhasználva megállapította, hogy a rövidlátás általános kockázatát jelentősen befolyásolja az iskolai végzettség. A közeli munkával töltött idő és az iskolai végzettség évei sokkal nagyobb kockázatot jelentettek a rövidlátás szempontjából, mint a genetikai tényezők önmagukban (85–87).
A tanulás és a rövidlátás közötti kapcsolat mechanizmusa nem teljesen tisztázott. Az egyik elmélet szerint a retinában (14, 88, 89) jelentkező defókusz és az akkomodáció tartós késleltetésével magyarázható (18, 83, 90–92), mivel mindkettő elősegíti a szemgolyó tengelyének megnyúlását. Egy nemrégen felállított alternatív hipotézis szerint a probléma összefügghet a fehér alapon fekete szöveg használatával, amely erősen túlstimulálja a retina OFF-pályáit (93). A fekete papíron lévő fehér szöveg ellenkező helyzetet eredményez, a retina ON-pályáinak túlstimulálásával. Fiatal egyéneknél a chorioidea mindössze egy óra alatt elvékonyodott, amikor a kísérleti személyek fehér háttéren fekete szöveget olvastak, de megvastagodott, amikor fekete háttéren fehér szöveget olvastak (93). Korábbi vizsgálatok már kimutatták, hogy a vékonyabb chorioidea összefügg a rövidlátás kialakulásával, a vastagabb chorioidea pedig a rövidlátás kialakulásának gátlásával (21, 22, 94), ezért a fehér szöveg fekete képernyőről vagy tabletről történő olvasása gátolhatja a rövidlátást, míg a hagyományos fekete szöveg fehér háttéren stimulálhatja azt (93).
6.1.3. Számítógép- és okostelefon-használat
A közeli munkavégzés jelentős részét manapság a digitális eszközök használata jelenti, és így összefüggésbe hozhatók a myopiával. Néhány közelmúltbeli tanulmány jelentős kapcsolatot dokumentált a rövidlátás és a digitális képernyő előtt töltött idő között (42, 83, 95–99). Más összefoglaló tanulmány azonban vegyes eredményekről számolt be ezzel kapcsolatban (100). Az okostelefonon vagy táblagépen (tableten) végzett otthoni munka a COVID-19-zárlat alatt jelentősebb myopia progressziót jelentett a 7–12 éves gyermekeknél, szemben a televízió vagy projektor használóknál (101).
Mindenképpen figyelembe kell vennünk, hogy a digitális eszközök kedvezhetnek a beltéri életmódnak, azonban a rövidlátás prevalenciájának hirtelen emelkedéséről már azelőtt beszámoltak, hogy ezek az eszközök elterjedtek volna gyermekkorban. A fiatal gyermekek körében a digitális képernyők fokozott elérhetősége és oktatás, szabadidős, vagy rekreációs célú használata elősegítheti a rövidlátás kialakulását és progresszióját (8).
A COVID-19-világjárvány idején az otthoni bezártság súlyosbította a rövidlátás világméretű terhét (102–106), még az alacsony dózisú atropinterápiában részesülő gyermekeknél is (107). A myopia fokozott progressziójának legfőbb kockázati tényezői e statisztikák szerint a digitális eszközök előtt töltött megnövekedett időtartam, és a szabadtéri tevékenység csökkent ideje (101–103, 105–109).
6.1.4. Lakóhely
A rövidlátás gyakoriságára hatással lehet a városi és vidéki életmód különbsége (69). A városi környezetben élő gyermekeknek nagyobb az esélye a rövidlátás kialakulására, mint a vidéki környezetben élőknek (43,110). A népsűrűségnek is szerepe lehet ebben a differenciában (111–113). A szem tengelyhossza szignifikánsan hosszabbnak bizonyult a nagyobb népsűrűségű területeken és kisebb lakásban élőknél, mint az alacsony népsűrűségű és nagyobb méretű lakásban élőknél (114).
A rövidlátás előfordulásának regionális eltéréseit még városokon belül is megfigyelték. A Sydney Myopia Study szerint a rövidlátás aránya a belvárosi területeken volt a legmagasabb (112).
6.1.5. Fizikai aktivitás
Számos tanulmány igazolta a kapcsolatot a rövidlátás kockázatának csökkenése és a fokozott fizikai aktivitás között (82, 115, 116). Ezt az összefüggést megzavarhatja az a tény, hogy a fokozott fizikai aktivitás gyakran a szabadban történik, és inkább a kültéri tevékenységnek köszönhető a jótékony hatása (73, 117). Egy 16–17 évesek körében végzett vizsgálat kimutatta, hogy a kevesebb mozgás és a fokozott képernyő használat hozzájárult a rövidlátás 25%-os előfordulási gyakoriságához, és megduplázódott a rövidlátás kockázata azoknál, akik hetente kevesebb, mint 3 órát mozogtak, vagy naponta több mint 6 órát töltöttek a képernyő előtt. Így elmondható, hogy a fizikai aktivitás védőfaktor, a közeli munka pedig a rövidlátás kockázati tényezője serdülőkorban (118).
6.1.6. Társadalmi-gazdasági státusz
A társadalmi-gazdasági státusz (havi jövedelem, szülői végzettség) összefüggésbe hozható a rövidlátás valószínűségével (119, 120), azonban elég ellentmondásos. Egyes publikációk szerint a myop gyermekek szülei magasabb végzettséggel rendelkeznek (57, 119), míg más cikk szerint a szülői jövedelem és a foglalkozás gyengébb összefüggést mutatott a gyermekkori rövidlátással (121, 122).
6.1.7. Táplálkozási tényezők
Napjainkban számos egészségügyi probléma összefüggésbe hozható a táplálkozási szokásokkal, ezért a szülők érdeklődhetnek, hogy a táplálkozási szokások megváltoztatásával csökkenthető-e a myopia progressziója.
Kínai iskolásoknál a magasabb telített zsír- és koleszterinbevitel összefüggésbe hozható volt a hosszabb szemtengellyel (123), míg francia gyermekeknél a szénhidrátokban gazdag étrend esetén nagyobb fokú volt a rövidlátás (124).
A nem kiegyensúlyozott étrend és/vagy az elhízás inzulinrezisztenciával járhat együtt, amely megzavarhatja a szemlencse alkalmazkodási képességét, ezáltal myopiához vezethet (125).
Mindezek ellenére, jelenleg nincs arra evidencia, hogy a rövidlátás kontrolljában szerepe lenne a táplálkozási szokásoknak (126).
6.1.8. Cirkadián ritmus
Hosszú évek óta feltételezik, hogy a cirkadián ritmus és az emmetropizáció összefügg (127). A szabadban jellemző, nagy intenzitású fény aktiválja az önmagában fényérzékeny retinalis ganglionsejteket (ipRGC), amelyek kommunikálnak a dopaminerg amakrin sejtekkel (128). Ez napközben dopaminfelszabadulást eredményez, ami bizonyítottan csökkenti a rövidlátásra való hajlamot (129, 130).
Egy nagy esetszámú kínai tanulmány kimutatta, hogy a késői alvás a városi általános iskolás gyermekek körében a rövidlátás előfordulásának és progressziójának kockázati tényezője (131).
6.2. Személyes jellemzők
6.2.1. Etnicitás
A különböző etnikai csoportok a myopia prevalenciájában jelentős különbséget mutatnak: magasabb a rövidlátás gyakorisága Kelet- és Délkelet-Ázsiában. Mivel a rövidlátással kapcsolatos genetikai eltérésekben a kelet-ázsiai és az európai etnikai csoportok között nincs jelentős differencia (69), a különbséget valószínűleg az eltérő környezeti tényezőkben kell keresnünk (122, 39, 80).
6.2.2. Nemi differencia
Alapvető különbség nincs a rövidlátásban a nemek között, bár az újabb tanulmányok a lányoknál gyakoribb előfordulásról számoltak be (69). A progressziót nézve ellentmondást találunk, egyes vizsgálatokban a lányok gyorsabban a progrediálnak, mint a fiúk (58, 130–134), míg más tanulmányok ezt nem igazolták (135–137). A nemi különbség a lányok hátrányára körülbelül 9 éves kortól mutatkozik, egyes szerzők szerint a késői serdülőkorban a fehér nők a fehér férfiakhoz képest kétszer nagyobb valószínűséggel voltak rövidlátók (43).
6.2.3. Szülők myopiája
Az, hogy a szülők rövidlátók, jól dokumentált kockázati tényezője a rövidlátásnak (69). Különböző etnikai csoportokban végzett vizsgálatok kimutatták, hogy egy vagy két rövidlátó szülő növeli az utódok rövidlátás kockázatát, és szignifikáns összefüggés van a családi anamnézis és a rövidlátás előfordulása között (66, 69, 81, 121, 138, 139). Úgy tűnik azonban, hogy a rövidlátó szülők száma kisebb prediktív értékkel (140, 141), míg a családban lévő myopok száma erősebb prediktív értékkel bír (60, 61).
A szülők rövidlátása nem tekinthető bizonyítéknak a rövidlátás örökletességére, mivel az összefüggés a közös életmód (96) és a magasabb iskolai végzettség eredménye is lehet (60). Valójában a rövidlátó szülők általában képzettebbek, és kétségkívül azt szeretnék, ha gyermekeik ugyanolyan, ha nem magasabb szintű képzést kapnának, mint ők. A genetikai kockázat mellett tehát ott van a magasabb iskolázottság bizonyított kockázati tényezője is (143).
6.2.4. Fizikai tulajdonságok
A fizikai tulajdonságok és a rövidlátás közötti kapcsolat nem egyértelmű. Jung és munkatársai megállapították, hogy a 19 éves szöuli férfiak testalkata (magasság, súly) nem állt szignifikáns kapcsolatban a rövidlátással (144), míg Japánban 8-9 éves általános iskolás gyermekeknél a testsúly és a testtömegindex (BMI) szignifikáns és pozitív összefüggést mutatott a szemtengely hosszával (145). Más, európai vizsgálat szerint finn férfiaknál a BMI körülbelül 5%-kal kisebb, a zsírtartalom pedig alacsonyabb volt a rövidlátó férfiaknál, mint nem rövidlátóknál (146).
Általánosságban úgy tűnik, hogy a magasság és a tengelyhossz között szoros biológiai kapcsolat van, azonban ez a refrakciót már nem érinti (69). A táplálkozási, az oktatási és a társadalmi tényezők közbeszólhatnak. A magas myopiaprevalenciájú országokat összehasonlítva más, kevésbé myopterületekkel, inkább az edukációban való differencia a jelentősebb, mint a magasságbeli eltérések (69, 84).
6.2.5. Születési körülmények
A születési hónapokat vizsgálva kimutatták, hogy a nyári vagy őszi hónapokban született személyeknél a téli hónapokhoz képest magasabb volt a rövidlátás előfordulása (147, 148). Ennek pontos mechanizmusa nem ismert, de összefüggést mutathat a természetes fénynek korai perinatális időszakban történő expozíciójával (147). Felmerül az az elmélet is, hogy a nyáron született gyermekek általában akár egy évvel korábban kezdik meg iskolai tanulmányaikat, és ez a korábbi iskolakezdés lehet felelős a rövidlátás kialakulásában tapasztalt különbségekért (69, 143).
Több vizsgálat is beszámolt a rövidlátás és a születési sorrend közötti összefüggésről. Az elsőként született gyermekek általában nagyobb fokban rövidlátók (149, 150). Ez a tendencia összhangban van az oktatást vizsgáló tanulmányok eredményeivel, amelyekben az elsőszülött gyermekek jellemzően magasabb szintű oktatásban részesülnek, ami a rövidlátás ismert kockázati tényezője (151).
A ROP-hoz társuló nagyfokú rövidlátás patofiziológiailag különbözik az időre születettek nagyfokú rövidlátásától. A ROP-os gyermekeknél a megváltozott elülső szegmentum fejlődési mechanizmusa (megnövekedett lencsevastagság, sekélyebb elülsőcsarnok mélység) vezet a nagyfokú rövidlátáshoz (152, 153). Németh János vizsgálta a különböző súlyosságú ROP-os gyermekek szemtengelyhosszát, és megállapította, hogy enyhe ROP stádiumaiban az életkori átlagnak megfelelő, vagy hosszabb, míg a súlyos ROP esetén az átlagosnál rövidebb a szemtengelyhossz (153).
6.2.6. Intelligencia
A magasabb intelligencia (IQ) általában összefügg a rövidlátással (97, 154–156). Nem világos azonban, hogy az intelligenciának van-e független hatása a rövidlátásra, az iskolázottság és a kevesebb szabadban töltött idő hatásán túl. A környezeti tényezők mind az intelligenciát, mind a rövidlátást módosíthatják (157–160). Kelet- és Délkelet-Ázsiában a népesség IQ-szintjének növekedése kevésbé drámai (159, 160), összehasonlítva a rövidlátás gyakoriságának növekedésével (69). Az ázsiai vizsgálatok független összefüggéseket mutattak ki a rövidlátás és a tanulmányi osztályzatok, az IQ-értékek és az iskolai évek között (155, 161). Az iskolai végzettséggel való összefüggés általában jelentősebb (154).
6.3. Binokuláris látás/Akkomodáció
A binokuláris látás és akkomodáció szerepe a myopia kialakulásában és progressziójában ellentmondásos. Egyes szerzők szerint a magasabb akkomodáció-konvergencia/akkomodáció (AC/A) hányados nemcsak a rövidlátás kialakulása előtt jelenthet rizikótényezőt, hanem a rövidlátás megjelenése utáni progresszióban is szerepet játszhat (162, 163). Más szerzők szerint is a rövidlátóvá váló egyének AC/A hányadosa már hozzávetőlegesen 4 évvel a rövidlátás diagnózisának felállítása előtt emelkedett értékű volt, és a diagnózis felállításáig tovább növekedett, viszont a progresszió mértékét már nem befolyásolta (164).
Ellentmondásosak a késleltetett akkomodációs válasz tekintetében megjelent referenciák is. Egyesek szerint az ennek következményeképpen jelentkező hyperopiás retinalis defókusz a közeli látási tevékenységek során serkentőleg hathat a szemgolyó megnyúlására (162, 164–166), míg mások szerint nem befolyásolja a myopiát (167–169).
Bár az abnormális binokularitás esetén a rövidlátás kialakulásának és progressziójának kockázata megnő, a vizsgálatok alapján mégsem jelent további rizikótényezőt a genetika, vagy a környezeti hatásokhoz képest (78, 170). Ennek ellenére, miután a távoli homályos látás fontos vizuális ingere a szemgolyó megnyúlásának, és a binokularitás szerepet játszik a szem egészséges fejlődésében, a fiatalkori binokuláris látás ellenőrzése szükséges lépés a myopiakontrollban (170).
A különböző rizikófaktorok myopiával való kapcsolatának erősségét az 1. táblázat tartalmazza.

7. Myopiakontroll-eljárások és gyakorlati alkalmazásuk
A myopiakontroll-eljárások ismerete és használata azért fontos, mert a myopia okozta látáskárosodás vagy vakság kumulatív kockázata a 24,0 mm-nél kisebb szemekben csak 6,9%, amely rizikó a 26,0 mm-nél 25%-ra emelkedik, és több mint 90% lesz a 30,0 mm-t meghaladó szemgolyók esetében (171). Az is ismert, hogy a myopia egy dioptriával való lassítása 40%-kal csökkenti annak valószínűségét, hogy egy páciensnél myopiás maculopathia alakuljon ki (172). Azonban, fontos megjegyezni, hogy még az alacsony és közepes rövidlátás is jelentős kockázatot hordoz a látásromlás szempontjából (172, 173).
Mint láttuk, a rövidlátás szemészeti szövődményei szoros összefüggésben vannak a szemtengelyhossz növekedésével, ezért a tengelyhossz változásának nyomon követése a rövidlátás kezelésének elsődleges eszköze kell, hogy legyen. Ma már rendelkezésre állnak a szemgolyó hosszának mérésére biometriai eszközök (pld. IOL Master, Lenstar), amelyek használatával a rövidlátásra hajlamos, vagy rövidlátó gyerekek könnyen kiszűrhetőek, vagy nyomon követhetőek (174–176).
A szemtengelyhossz nem mutat lineáris növekedési ütemet sem az életkorral, sem a nemmel, vagy etnicitással. Léteznek szemtengelyhossz-növekedési görbék, amelyek információt adnak, hogy felnőttkorra mennyi a kockázata a rövidlátás, vagy akár a nagyfokú rövidlátás kialakulásának (174, 176). Ezen görbék segítséget nyújtanak a kezelés indításának időpontjában, vagy a kezelés hatékonyságának követésében (174, 176) (5. ábra).
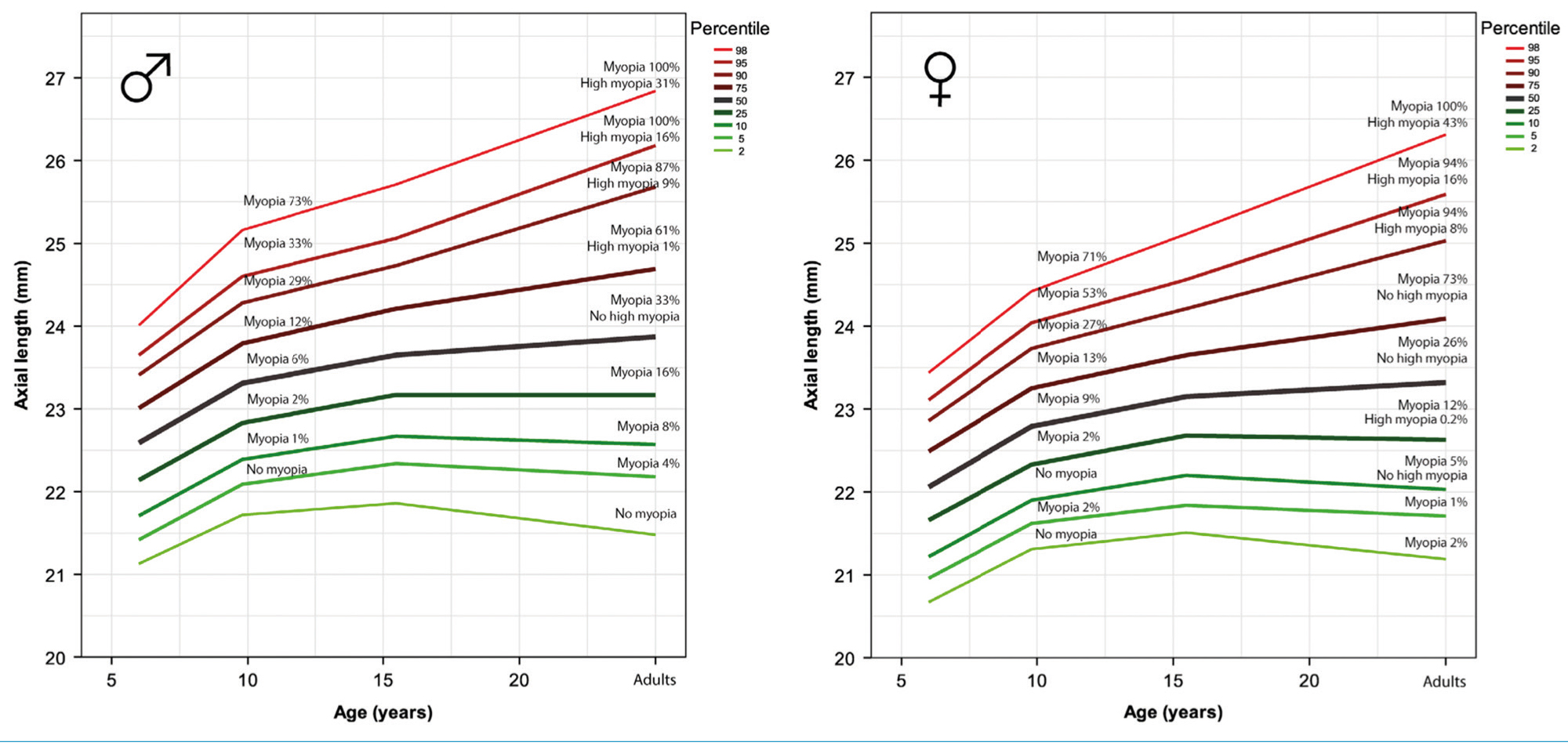
A rövidlátás kialakulásának megelőzésére és a rövidlátás progressziójának csökkentésére a következő eljárások ismeretesek:
- Életmódbeli változtatások – a környezeti hatások optimalizálása.
- Farmakológiai megközelítés, az atropin szemcsepp helyi alkalmazása.
- Optikai eszközök használata, beleértve a szemüveget, a speciális kialakítású lágy kontaktlencsét és az éjszaka viselésű orthokeratológiai gázáteresztő kemény kontaktlencsét. Evidenciák bizonyítják, hogy valamennyi módszer lassítja a rövidlátás kialakulását vagy progresszióját, bár a különböző beavatkozások hatékonysága eltérő (177).
7. 1. Környezeti tényezők optimalizálása
7.1.1. Szabadtéri tevékenység
Számos tanulmány kiemeli a szabadban töltött idő növelésének védő szerepét a rövidlátás megelőzésében (82, 178–184). Egy metaanalízis szerint, minden további heti egy óra szabadban töltött idő a rövidlátás kockázatának 2%-os csökkenéséhez vezethet (185). A rövidlátás kialakulásának esélye körülbelül egyharmadával kisebb, ha a szabadban töltött idő heti 0-5 óra helyett heti 14, vagy több óra (180).
A szabadtéri tevékenység és a myopia progressziójának lassítása közti kapcsolat oka nem teljesen tisztázott. Az erre vonatkozó cikkek alapján, a szabadban töltött idő önmaga, és nem a szabadban végzett fizikai tevékenység az, ami a védelmet adja (73, 186). Protektív faktor lehet a környezet háromdimenziós struktúrái által a retinán megjelenő defókusz mintázat (88), illetve a fény által előidézett hátsó pólusi dopaminfelszabadulás, amely ismerten gátolja a szemgolyó megnyúlását (187). Az ultraibolya (UV) fény hiánya is axiális rövidlátást idézhet elő (188). Flitcroft és munkatársai szerint, a természetes környezet tulajdonságaihoz képest az ember alkotta városi és beltéri környezet hasonló térbeli tulajdonságokat idéz elő, mint az állatmodellekben alkalmazott, rövidlátást előidéző diffúz szűrők (110). Ha a környezetünk építkezésében ezt figyelembe vennénk, segíthetne a rövidlátás előfordulásának csökkentésében (8).
Már említettük, hogy a szabadban töltött idő szerepe a myopia kialakulásában erősebben bizonyított, mint a már kialakult myopia progressziójának gátlásában betöltött szerepe (189).
Wu és munkatársai kimutatták, hogy az iskolai szünetekben a szabadban töltött idő (10-20 perc délelőtt és délután egyaránt) szignifikáns jó hatással van a rövidlátás kialakulására, viszont nem befolyásolta a rövidlátó gyermekek myopiájának progresszióját (182). Az utóbbi összefüggést másik vizsgálat is megerősítette, a myopia progressziójára nem volt hatása sem a közeli munkának, sem a szabadban eltöltött időnek a már myopiás gyermekeknél (181). Ezzel ellentmondásosnak tűnhet, hogy a már myopiás gyermekek progressziója szezonális: a sötét téli hónapokban gyorsabban, mint a világosabb nyári hónapokban lassabban progrediál (190, 191).
7.1.2. D-vitamin
Több tanulmány igazolta, hogy myopokban alacsonyabb a D-vitamin-szint a nem rövidlátókhoz lépest (192–195). Ennek ellenére a D-vitaminhoz kapcsolódó cikkek megosztóak.
Kisgyerekekben az alacsonyabb szérum 25-hidroxi-vitamin D-koncentráció összefüggésbe volt hozható a hosszabb bulbussal és a rövidlátás nagyobb kockázatával, függetlenül a kültéri expozíció idejétől, és a rassztól (192). Más cikkekben a teljes D-vitamin és a D3-vitamin szérumszintek a szabadban töltött idő biomarkerei voltak, azonban nem volt bizonyíték arra, hogy ezek függetlenül kapcsolatban állnának a későbbi rövidlátással (196).
A CREAM-konzorcium vizsgálatában a Mendel-féle randomizációs elemzés nem támasztotta alá a D-vitamin közvetlen kapcsolatát a rövidlátás fennállásával, mivel az alacsonyabb 25(OH)D-szintre genetikailag hajlamos egyének nem voltak rövidlátóbbak (75).
7.1.3. Beltéri megvilágítás
Kínai iskolákban végeztek kísérletet: az osztálytermekben a beltéri megvilágítást 100 luxról 500 luxra emelték, amely szignifikáns jó hatással volt a rövidlátás kialakulására, a fénytörésre és a szemtengely megnyúlására (72). A 3000 luxnál nagyobb fényintenzitásnak a rövidlátással szemben védőhatása van (197).
Ideális lehetne a kültéri környezethez hasonló fényintenzitás elérése beltérben, mert ezáltal csökkenthetnénk a rövidlátás előfordulását és progresszióját (110, 198). A rövid hullámhosszú ibolyántúli (360–400 nm hullámhosszú) fény hiányzik a beltéri környezetben, pedig szerepet játszik a rövidlátás progressziójának gátlásában (74).
Az elmúlt néhány évben a hagyományos fényforrások helyett a light-emitting-diode (LED) megvilágítás terjedt el, mint új generációs lokális fényforrás. Egy Kínában végzett keresztmetszeti vizsgálat alapján a LED-lámpák használata fokozza a rövidlátó refrakciós hibát és a szemgolyó tengelymegnyúlását (199). A francia Élelmiszer-, Környezetvédelmi és Munkahelyi Egészségvédelmi és Biztonsági Ügynökség (ANSES) ajánlata, hogy a gyermekek által gyakran használt helyeken kerüljék az erős kék komponensű, hideg-fehér fényt kibocsátó LED-es fényforrások használatát, mivel még nem ismerjük a hosszú távú fotokémiai hatását. Az ANSES javasolja a LED-ek háztartási használatra történő értékesítésének korlátozását (200).
Mindenesetre törekedjünk arra, hogy a LED-fény használatánál a hagyományos LED-fényhez képest a melegebb LED, vagy a meleg és hideg LED-fény kombinációját válasszuk, így potenciálisan csökkenthetve a rövidlátás kockázatát a gyermekeknél (201).
7.1.4. A környezeti tényezők változtatásának összefoglalása, életmódbeli tanácsok
Szabadtéri tevékenység: A rövidlátás kialakulásának esélye csökkenthető a naponta több, mint kétórányi szabadban eltöltött idővel, még azoknál a gyerekeknél is, akik sokat dolgoznak közelre (82, 202).
Ajánlott a lehető legtöbb időt természetes fényben tölteni (megfelelő védelemmel az ultraibolya sugárzástól), életkortól függetlenül (8, 43, 69, 78, 203). A WHO ajánlása szerint az 5–17 éves korosztályban heti 3 napon, naponta legalább 60 perc közepes, és erős intenzitású mozgás javasolt, korlátozva a monitor előtt eltöltött időt (204).
Közeli munka: A több szabadtéri tevékenységgel párhuzamosan fontos, hogy csökkentsük az olvasással vagy más közeli munkával töltött időt.
Minden közeli tevékenység esetén a távolságot legalább 30 cm-re kell növelni (205, 206). Az iskolán kívül, az olvasással vagy más közeli tevékenységgel folyamatosan töltött időt legfeljebb 30-45 percre kell csökkenteni (205, 206), amely után 5-10 perces ideális szünetek javasoltak (207, 208).
A közeli tevékenység mellett a fej döntése, vagy írás közben a ceruzahegy-közeli kéztartás (amely szintén a fej döntésével jár) összefüggésbe hozható a rövidlátás progressziójának nagyobb esélyével (197, 206, 209, 210), tehát kerülendő.
Beltéri megvilágítás: A beltéri világítás maximalizálása érdekében inkább használjunk hagyományos izzókat (3000 Lux fölött), mint LED-es megvilágítást (199–201). A LED-es megvilágítás esetén, ha lehet, csak melegfehér (2700 K) LED-izzókat válasszunk (201).
Képernyőhasználat: A holland Erasmus Myopia Research Group és a WHO a kétévesnél fiatalabb gyermekek esetében a közeli képernyőhasználatot teljesen betiltaná; 2–5 éves kor között napi egy, és az 5–12 év közötti gyermekek esetében pedig a napi két órára korlátozná (175, 211). Az online tanuláshoz használt tablet, mobiltelefon vagy számítógép képernyője helyett inkább javasolt a tévéképernyő, vagy projektor használata (101). A monitoron javasolt inkább a fekete alapon fehér szöveg beállítása (93).
Cirkadián ritmus: Különösen a serdülők esetében erősen ajánlott, hogy legalább 1 órával alvás előtt hagyják abba a telefonok és képernyők használatát, mivel megzavarhatja az alvási ciklust (213), és mint a fentebb említett tanulmány kimutatta, a késői lefekvés összefüggésbe hozható a rövidlátás gyorsabb ütemű progressziójával (131).
7.2. Optikai beavatkozások
7.2.1. Szemüvegviselés
A rövidlátás korrekciójának legegyszerűbb és mellékhatásoktól mentes módszere a szemüveg viselése.
7.2.1.1. Alulkorrekció
Gyakran találkozni még ma is olyan esettel, ahol a gyermek mindkét szemén direkt alul van korrigálva. Azt gondolhatnánk, hogy ezzel lassítható a rövidlátás romlása, hiszen segítjük az akkomodációt. A tudomány jelenlegi állása szerint azonban a kétszemes alulkorrekció nemhogy nem hatékony, hanem ártalmas a myopiaprogresszió szempontjából (8, 214, 215).
A Gyermekszemészeti és Strabológiai Világtársaság (World Society of Paediatric Ophthalmology & Strabismus, WSOPS) 2023-as myopiára vonatkozó ajánlása szerint a prospektív klinikai vizsgálatokból származó adatok alapján a rövidlátás alulkorrekciója vagy növeli, vagy nincs hatással a progresszióra. Az alulkorrekció nem lassítja a myopia progresszióját, és a továbbiakban nem javasolt az alkalmazása (203).
Az alulkorrekció mivel nem biztosítja a távoli jó látóélességet, így viselkedésbeli változásokhoz is vezethet. Ezek a gyermekek a szabadtéri tevékenység hátrányára inkább a beltéri életmódot választják, amely, mint tudjuk a myopia kialakulásának és progressziójának rizikófaktora (216).
7.2.1.2. Bifokális és progresszív (PAL) szemüveglencsék
A bifokális és progresszív szemüvegek lehetővé teszik, hogy viselőjük távolra élesen lásson, és akkomodáció nélkül, vagy annak segítésével közelre is. A myopia progressziójának késleltetésére már korábban is használták ezt a szemüvegtípust, mivel csökkentik az akkomodációs szükségletet és a késleltetett akkomodációt a közeli munkavégzés során (217).
Ennek ellenére a progresszív szemüveglencsékkel végzett vizsgálatok csak kismértékű, klinikailag elhanyagolható hatást mutattak a rövidlátás progressziójának lassításában (218–221), és európai vizsgálatok sem igazolták, hogy a bifokális szemüvegek megakadályoznák a rövidlátás progresszióját (222, 223).
7.2.1.3. Myopiakontroll-szemüveglencsék
Az új szemüveglencse kialakítások egyre fejlődő területet jelentenek a rövidlátás-szabályozás tekintetében. Lam és munkatársai egy kétéves randomizált vizsgálatban speciálisan tervezett, úgynevezett Defocus Incorporated Multiple Segments (DIMS) szemüveglencsét használtak a myopiaprogresszió lassítására (224). Ez a lencsekialakítás egy központi optikai zónával rendelkezik a fénytörési hiba korrekciójára, és e zónát több, myopiás defókuszt előidéző (+3,50 D) szegmens veszi körül. Így a lencse egyszerre biztosítja az éles látást távolra, és a myopiás defókuszt egyidőben távolra és közelre nézéskor is. A klinikai vizsgálat 2 éves eredményei azt mutatták, hogy a DIMS-lencsét viselő kelet-ázsiai etnikumú gyermekeknél 52%-kal kisebb volt a rövidlátás progressziója (átlagosan –0,41±0,06 D) a DIMS-csoportban, szemben az egyfókuszú távoli szemüveglencsét viselő csoportéval (–0,85 ± 0,08 D) és 62%-kal kisebb a bulbus megnyúlása (átlagos különbség 0,34±0,04 mm) az egyfokuszú szemüveglencsékhez képest. A kétéves vizsgálati időszak alatt a DIMS-lencsét viselők mintegy 21,5%-ánál nem volt kimutatható a rövidlátás progressziója, míg a kontrolloknál ez csak 6%-ban fordult elő (224). A DIMS-vizsgálatban a résztvevők napi több mint 15 órán keresztül folyamatosan viselték a szemüveget. Ezt követően a rövidlátás-szabályozó hatás a harmadik évben is fennmaradt mindazoknál, akik az előző 2 évben DIMS-szemüveglencsét használtak, mind pedig azoknál, akik az egyfókuszú szemüvegről etikai okok miatt a DIMS-technológiára váltottak (225). A temporális és nazális tekintési irányokban a látóélesség és a kontrasztérzékenység is csökkent a DIMS-lencsével az egyfókuszú lencséhez képest (226, 227). A fő látási panasz e lencsékkel a naponta 1-2-szer jelentkező, középperifériás homályos látás volt (228). A DIMS-technológiájú szemüveg hazánkban is elérhető, az egyéves eredményekről a Szemészet folyóirat korábbi számában olvashattunk (229).
A másik ígéretes technológia a myopiakontrollban a Highly Aspherical Lenslet (HAL) szemüveglencse. A kétéves, randomizált tanulmány eredménye azt mutatta, hogy a magasan aszférikus lencse 0,80 D-val (55%) lassította a rövidlátás progresszióját és 0,35 mm-rel (51%) a tengelyhossz növekedését az egyfókuszú szemüveghez képest. A viselési idő hatással volt az eredményekre, a legalább napi 12 órát viselők esetében a rövidlátás-szabályozás hatékonysága 0,99 D-ra (67%) és 0,41 mm-re (60%) nőtt (230). A HAL-típusú szemüveg már elérhető Magyarországon is.
A hároméves study első éves adatai már rendelkezésre állnak egy harmadik, diffúziós optikai technológiát (diffusion dot technology, DOT) alkalmazó szemüveglencse vizsgálatából, amelynek célja a térbeli kontraszt csökkentése (a lencsének csak egy kis, ~ 5 mm-es központi területe mentes a diffúziós elemektől). A 6–10 éves korosztályban végzett eredmények biztató adatokkal szolgálnak, a refrakció/bulbushossz átlagos változása –0,14 D/0,15 mm és –0,22 D/0,20 mm volt a teszt 1 és teszt 2 lencsékkel, szemben az egyfókuszú lencsével mért –0,54 D/0,30 mm-es változással (231).
7.2.1.4. A szemüveglencsék összefoglalása
A rövidlátás alulkorrekciója nem ajánlott, mivel még akár fokozhatja is a rövidlátás progresszióját (214). A bifokális, vagy progresszív szemüvegek az egyfókuszú szemüveglencsékkel szemben csak kis mértékben lassították a rövidlátás progresszióját (214). A különböző myopiakontroll-szemüveglencsék esetében a DIMS, a HAL és a DOT technológiájú szemüveglencsék eredményei ígéretesnek bizonyulnak.
7.2.2. Kontaktlencsék
7.2.2.1. Lágy kontaktlencse (SCL)
A szakirodalomban nincs bizonyíték arra, hogy a hagyományos lágy kontaktlencse viselése befolyásolná a rövidlátás progresszióját a szemüveg viselésével szemben (216, 232, 233).
7.2.2.2. Kemény, gázpermeábilis kontaktlencse (RGP)
Egyes tanulmányok szerint a kemény, gázáteresztő lencsék lassítják a rövidlátás progresszióját gyermekeknél (234, 235), azonban újabb tanulmányok kimutatták, hogy e lencsék használata nem befolyásolja a szemgolyó tengelyirányú megnyúlását, és a rövidlátásra gyakorolt hatását inkább a szemfelszín, lencse okozta időszakos ellapulása okozza (236, 237).
7.2.2.3. Konvencionális lágy multifokális kontaktlencsék
A bifokális/multifokális kontaktlencsék közül, a centrumban távoli korrekcióval rendelkező típus alkalmazható a myopiakontrollban. Ezekben a struktúrákban a lencse perifériás régiója viszonylag nagyobb pozitív dioptriával rendelkezik, amely a periféria felé fokozatosan növekszik (progresszív kialakítás), vagy különálló zónákban jelenik meg (koncentrikus gyűrűs kialakítás). A nagyobb pozitív törőerejű rész pozitív szférikus aberrációt képez, és ezáltal lassítja a rövidlátás romlását (143). A koncentrikus gyűrű kialakítások, tehát a bifokális változat jobban kontrollálja az axiális szemgolyó megnyúlást, mint a progresszív kialakítás (44,4% vs. 31,6%), míg a refrakcióra gyakorolt hatásuk hasonló (36,3% vs. 36,4%) (216). Ezek a bifokális lágy kontaktlencsék a tanulmányok szerint (238–240) a rövidlátás progresszióját a refrakcióban 30-38%-kal, az axiális megnyúlást pedig 31-51%-kal lassították a 24 hónapos követési idő alatt (241).
7.2.2.4. Myopiakontroll lágy kontaktlencsék
A Magyarországon is elérhető és egyre több helyen illesztett a napi eldobható hidrogél dual-fókusz kontaktlencse, amely randomizált, kontrollált vizsgálatban 3 éves időszak alatt a 8–12 éves gyermekeknél a refrakcióban –0,51 D vs. –1,24 D (59%) változást, míg a tengelyhosszban 0,30 mm vs. 0,62 mm (52%) változást eredményezett az egyfókuszú kontaktlencsékkel összehasonlítva (242, 243). E lencsének a 6 éves követési idejű tanulmánya is publikálásra került, mely szerint a további évek alatt sem veszített a redukciós hatásából (244). A kontaktlencse hatékonysága még szembe tűnőbb, ha növeljük a viselési időt (245).
A közelmúltbeli, 3 éves multicentrikus, randomizált klinikai BLINK (Bifocal Lenses in Nearsighted Kids) vizsgálatban a dual-fókusz kontaktlencsék effektivitását vizsgálták az addíciós zóna dioptriájától függően (+1,5 D vs. +2,5 D). Az egyfókuszú távoli kontaktlencsékkel összehasonlítva, a nagyobb addícióval rendelkező kontaktlencsék 0,45 D-val lassították a rövidlátás progresszióját és 0,23 mm-rel a szem növekedését, míg a kisebb addícióval rendelkezők 0,29 D-val a refrakciót és 0,16 mm-rel a szem növekedését (246).
Ezeknél a lágy kontaktlencse-típusoknál meg kell találni az egyensúlyt, hogy a lehető legnagyobb addícióval rendelkező lencsét illesszük annak érdekében, hogy maximalizálni lehessen a myopiaprogresszió-lassító hatását a retina perifériáján, de ugyanakkor ne legyen homályos a távoli látás, ami viszont vizuális ingere lehet a szemgolyó megnyúlásának.
Az egyik legújabb fejlesztés az Extended Depth of Focus (EDOF) technológiájú kontaktlencse. Több vizsgálat is igazolta hatékonyságát (247, 248). Az EDOF technológiájú kontaktlencsék optikailag hasonlóak az aszférikus lencsékhez. A szférikus aberrációk módosítását használják a multifokalitás létrehozásához, de magasabb rendű optikai aberrációkat is előidéznek. Csökkentik az akkomodációs igényt, és így hozzájárulnak a szem megnyúlásának lassításához (143).
7.2.2.5. Orthokeratológia (ortho-K)
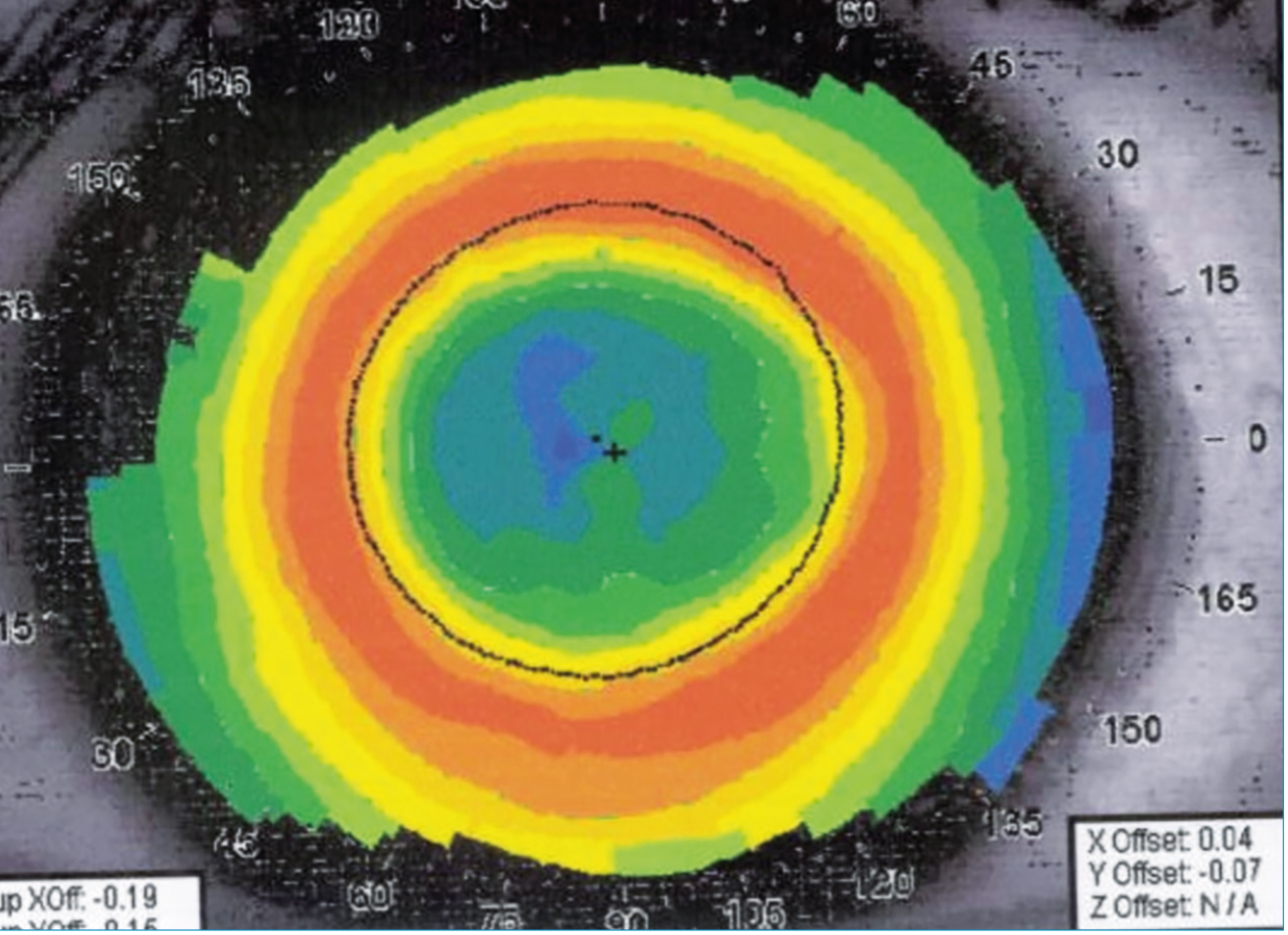
Az orthokeratológia egy olyan technika, amely során speciálisan tervezett, fordított geometriájú, gázáteresztő kemény kontaktlencse kerül éjszakára a szemfelszínre. A cornea középső részének ellapítása és az epithel vékonyodása, míg a középperifériás rész kiemelése és epithel vastagodása révén átformálja a szaruhártya felszínét (249–251) (6. ábra). Mivel a szaruhártya felszíne általában legalább a következő napig megtartja a formáját, az ortho-K korrigálja a rövidlátó refraktív hibát anélkül, hogy napközben szemüveget vagy kontaktlencsét kellene viselni. Orthokeratológiával általában a rövidlátás korrekciója –6,0 D szférikus és 3,0 D astigmatizmusig lehetséges (lencsetípus-függő), nagyobb fokú rövidlátás esetén a szemüveges felülkorrekció jön szóba (252).
Számos klinikai vizsgálat bizonyította az orthokeratológia myopiakontrollban betöltött szerepét (249, 253–260). Az axiálistengely-megnyúlás lassításának hatása 30% és 63% között mozog. A kezelés általános hatása 50% körüli. Az ortho-K a retinalis perifériás defókusz myopiás eltolódása révén fejti ki jótékony hatását (261), bár a megváltozott magasabb rendű aberrációk szerepe (262, 263), és a chorioidea vastagságának fokozása sem zárható ki, mint patomechanizmus (264).
Az orthokeratológia az anisometrópiában is igazoltan alkalmazható. Az éjszakai lencse viselése mellett a szemgolyó megnyúlása jobban lelassul a myopiásabb szemekben, hatékonyan csökkentve a két szem közti dioptriakülönbséget (265–269).
Az orthokeratológiai kontaktlencse effektivitása dózis- és lokalizációfüggő.
A dózisfüggő hatékonyság azt jelenti, hogy az általa centrálisan lenyomott dioptriának megfelelő mennyiségű pozitív szférikus aberrációt okoz a cornea középperifériás részén (270) (6. ábra), amely mennyiség megegyezik az általa okozott retinalis myopiás shifttel, és adja a kezelés hatékonyságát (271–273).
A lokalizációfüggő hatékonyságot az adja, hogy a pozitív szférikus aberrációs, körkörös zónának mindenképp a pupilla területébe kell esni, ami vagy elég tág pupillát (275–278), vagy a kontaktlencse kisebb optikai zóna átmérőjét igényli (276, 278–280).
Néhány tanulmány szerint az ortho-K-kezelés elhagyása a gyermekeknél a bulbushossz nagyobb mértékű növekedéséhez vezethet (rebound hatás), ezért nem javasolják 14 éves kor alatt a kezelés elhagyását (281, 282). Egyes tanulmányok azt is feltételezik, hogy a kezelés relatív hatékonysága idővel csökkenhet (256, 283, 284).
Az 1980 és 2015 közötti klinikai tanulmányokat elemző, összesen 170 publikációt tartalmazó szisztematikus áttekintés az ortho-K-kezelés leggyakoribb szövődményének, a szaruhártya epitheliopathiáját találta. Egyéb klinikailag jelentős mellékhatások közé tartozott a hámban megjelenő reverzibilis vaslerakódás, a kiemelkedő fibrilláris vonalak és a szaruhártya biomechanikai tulajdonságainak átmeneti változása. A cikk összegzéseként, az orthokeratológia biztonságos lehetőség a rövidlátás progressziójának lassítására, és alkalmazásakor a mikrobás keratitis kockázata hasonló, mint más, éjszakai viselésű lencsék esetében (284, 285).
7.2.2.6. Kontaktlencsék összefoglalása
A rigid gázáteresztő kontaktlencséknek és az egyfókuszú lágy kontaktlencséknek nincs bizonyított hatása a myopia progressziójára (214).
A bulbushossz-megnyúlás kisebb mértékű a bifokális lágy kontaktlencsét viselők esetében, mint az egyfókuszú lágy kontaktlencsét viselők esetében (214, 286).
Bizonyított a myopia kontrollja speciális myopiakontroll lágy lencsekialakításokkal és az orthokeratológiai kezeléssel (214, 286).
7.2.3. Optikai intervenciók összefoglalása, a myopia progresszió lassítása optikai módszerekkel
Szemüveges korrekció:
A szemüveg viselése nem invazív, egyszerű eszköze a fénytörési hibák, így a rövidlátás optikai korrekciójának. A gyermekeket arra kell ösztönözni, hogy a myopiás korrekciót teljes időben viseljék, mivel egyes tanulmányok szerint a myopia alulkorrekciója fokozza a rövidlátás progresszióját (287–289).
Ne korrigáljuk alul a gyermekeket (8, 203, 215)! A kék fényt blokkoló szemüvegnek nincs hatása (290), a bifokális vagy progresszív szemüvegnek pedig csekély hatása van a rövidlátás kontrolljára (203, 216).
A rövidlátás progressziójának lassítására a legújabban kifejlesztett, perifériás defókuszú, vagy magas aszfericitással rendelkező anti-myopiás szemüvegek a legmegfelelőbbek (224–230). Az anti-myopiás szemüveg hatékony és a legkevésbé invazív, ezért a beavatkozások közül fiatalabb korban az első választás lehet.
Kontaktlencsés korrekció:
Bizonyos helyzetekben a szemüveg nem a legmegfelelőbb, például a gyermek nem hajlandó hordani, rendszeres sporttevékenység miatt nem tudja hordani, vagy nem megengedett a viselése. A kontaktlencsék a myopiakontroll intervenciók között jelentős szerepet játszanak.
A kontaktlencse viselésének legsúlyosabb szövődménye a mikrobás keratitis, amelynek kockázata a napi eldobható kontaktlencsét viselő gyerekeknél nagyon ritka (1:431). Az orthokeratológia esetében ez a kockázat magasabb (1:67). Mindkét kockázati arány azonban még mindig alacsonyabb, mint a magas rövidlátás (–6,0 D vagy AL >26 mm) esetén kialakuló látásvesztéssel járó szövődmények kialakulásának kockázata, amely 1:10 (291).
Hogy a nappali eldobható lágy, vagy az éjszakai viselésű kemény gázáteresztő orthokeratológiai kezelést választjuk, több szempontot is figyelembe kell vennünk. Az első és egyik legfontosabb, hogy az éjszakai lencseviselés nagyobb fertőzési kockázattal jár (292).
Mint korábban említettük, az orthokeratológia dózisfüggő. Hagyományos orthokeratológia lencse esetén ahány dioptriával lelapítjuk a cornea felszínét, annyit emelünk ki a középperifériás részén, tehát annyira lesz hatékony a perifériás retinán létrehozott myopiás shift révén (270). A jelenleg Magyarországon elérhető lágy nappali lassító lencsében 2,0 dioptriás addíciós zóna van optikailag beépítve, tehát a hatékonysága 2,0 dioptriás myopiás shiftnek felel meg a hátsó póluson. Így a hatékonyságot tekintve, az orthokeratológia 2,0 dioptria felett hatékonyabban működhet a myop gyermekeknél, illetve, ha fordítva nézzük, kisfokú myopia esetén egyértelműen a lágy nappali kontaktlencse a választandó opció.
A pupillaméret is mérvadó lehet. Ha a pupilla 4,5 mm, vagy kisebb, a rövidlátás progressziója jobban kezelhető a nappali lágy anti-myopia kontaktlencsékkel, mint a hagyományos, éjszakai viselésű orthokeratológiai lencsékkel. Ez utóbbi esetén a cornea centrumában lévő és a távoli éles látást biztosító optikai zóna általában 6,0 mm-es, így szűk pupilla esetén jobban érvényesül a lágy kontaktlencsék lassító hatása (125, 279, 293), ahol e terápiás zóna 5,0 mm-en belül van. Természetesen a pupillaméret a cornea kezelési zónájával nem 1:1 arányú, hiszen látóterünk tágul az optikai zónától a külvilág felé.
Szükség esetén az orthokeratológiai lencse kialakításának egyedi testreszabása szükséges (customized ortho-K). Változtatható a tóricitása, átmérője, de kis dioptria esetén növelhető a myopiás shiftet okozó hatása (125, 278), illetve szűkebb pupilla esetén csökkenthető az optikai zóna átmérője is, növelve a progressziót lassító effektivitást (125, 279).
Az orthokeratológia 4,5 dioptria myopiáig működik a legjobban. Nagyfokú rövidlátás (>6,0 D) esetén szemüveges felülkorrekciót érdemes alkalmazni. Fontos azonban megjegyezni, hogy ebben a helyzetben más lehetőségek is rendelkezésre állnak, például anti-myopiás szemüveg használata, vagy astigmatizmus nélküli refrakció esetén nappali lágy anti-myopia kontaktlencse is szóba jön (202, 125).
Astigmatizmus esetén antimyopiás szemüveg, a cilinder értékétől függően hagyományos, vagy tórikus ortho-K kontaktlencse használható. Alternatívaként a lágy progressziót lassító kontaktlencse cilinderes szemüveggel való felülkorrekciója jön szóba, mivel a korrigálatlan astigmatizmus befolyásolhatja a szemgolyó megnyúlását (294). Külföldön már elérhető a lágy tórikus progressziót lassító kontaktlencse is.
7. 3. Farmakológiai beavatkozások
7.3.1. Atropin
Az atropin nem szelektív muszkarinreceptor-antagonista. A scleralis fibroblast sejtekben serkenti az extracelluláris mátrix bioszintézisét, ezáltal megerősíti a scleralis szövetet, csökkenti annak rugalmasságát és megnyúlásra való hajlamát. Ezenkívül az atropin más szövetekben is csökkentheti az ECM bioszintézisét, így például a chorioidea fibroblastjaiban, javítva a chorioidea ECM permeabilitását így a sclera perfúzióját és lassítva a rövidlátás progresszióját (295).
Csirkéken végzett kísérletekből arra is van bizonyíték, hogy az atropin növeli a dopamin neurotranszmitter felszabadulását az extracelluláris térben és az üvegtestben, ami semlegesítheti azokat a retinából jövő jeleket, amik a szemgolyó megnyúlásáért felelősek (296). Más állatkísérletek kimutatták, hogy a dopamin közvetlenül a szaruhártyára is hat (297, 298), így az atropin elsődleges hatáshelye ellentmondásos; egyes szerzők még azt is feltételezik, hogy a 0,01%-os atropin elsősorban a szaruhártyára van befolyással (299).
Az atropin dózisfüggő gátló hatást fejt ki a rövidlátás progressziójára. A nagy dózisú atropin (0,5%, 1,0%) kezdeti alkalmazása 2 év alatt több mint 75%-kal lassította a rövidlátás progresszióját (300). Az alacsonyabb dózisok (0,1%, és 0,01%) szintén akár 67%-os redukciós hatást érhetnek el, és kevesebb mellékhatással járnak (300–303).
Az atropinnal végzett első két jelentős vizsgálat az Atropine in the Treatment of Myopia (ATOM 1, 2) adatai is megerősítették a dózisfüggő hatékonyságot. A 0,5%-os, 0,1%-os és 0,01%-os atropin a rövidlátás progresszióját a becslések szerint 75%-kal, 70%-kal és 60%-kal, 2 év alatt 0,30 D, 0,38 D és 0,48 D szférikus egyenértékű változással tudta lassítani a placebo-kontrollcsoporthoz képest (304, 305). Amikor azonban az atropin cseppet 2 év után elhagyták, a rövidlátás hirtelen progrediált (rebound hatás), és azoknál a gyerekeknél, akik magasabb dózisban kapták, jelentősebb volt a myopia progressziója (306, 307). A rebound hatásnak köszönhetően az ötödik év végére a 0,01%-os csoportban volt a legalacsonyabb a rövidlátás romlása, kevesebb mellékhatással, ellentétben a magasabb, 0,1%, vagy 0,5% koncentrációkkal. A becslések szerint a 0,01%-os atropin összességében legalább 50%-kal lassította a rövidlátás progresszióját (308).
Újabb tanulmányok azonban felhívták a figyelmet arra is, hogy bár a refrakcióban a 0,01% atropin jól teljesített, de a bulbushosszra nem gyakorolt hasonlóan kedvező hatást (309, 310). Pedig a myopiaprogresszió monitorozására a szemtengelyhossz az alkalmasabb, nem a refrakció, hiszen a szemészeti komplikációk is ezzel állnak összefüggésben.
Az atropinnal kapcsolatos kutatások másik nagy vizsgálata a Low-concentration Atropine for Myopia Progression (LAMP I, II) study, amelyben a 0,01%-os, 0,025%-os és 0,05%-os atropinkoncentrációval egy éven keresztül kezelt kínai gyermekek esetében 27%-kal, 43%-kal és 67%-kal csökkent a progresszió a refrakcióban, és 12%-kal, 29%-kal és 51%-kal lassult a tengelyhossz-növekedés. Összességében a fénytörésre gyakorolt hatás nagyobb volt, mint a tengelyhosszra gyakorolt hatás. A kezelés idősebb életkorban történő elhagyása és az alacsonyabb koncentráció kisebb rebound hatással járt, és a rebound hatás klinikailag csekély volt mindhárom koncentráció esetén (311, 312). A LAMP-II vizsgálatban a 0,05%-os atropin kétszer olyan jól teljesített a myopiaprogresszió-gátló hatásban, mint a 0,01%-os szemcsepp, ezért a szerzők a 0,05%-os atropinkoncentrációt tartják optimálisnak (313).
Ezt a koncentrációt találta a legelőnyösebbnek egy másik, 16 randomizált, kontrollált vizsgálat (3272 résztvevő) adatait feldolgozó metaanalízis, amely szerint a három leghatékonyabb koncentráció a rövidlátás szabályozásában az 1%, a 0,5% és a 0,05%. Azonban figyelembe véve a pupillaméretet és az akkomodációra gyakorolt hatást, ők is a 0,05%-os koncentrációt találták a leghatékonyabbnak (314). Ennek ellenére, egyes szerzők szerint azoknál a gyermekeknél, akiknél felnőttkorban fennáll a magas rövidlátás kialakulásának kockázata, ajánlott 0,5%-os atropinkoncentrációval való indítás (315).
A fiatalabb gyermekeknél magasabb (0,05%-os) koncentrációval lehetett elérni ugyanazt a myopiaprogressziót lassító hatást, mint az idősebb gyermekeknél alacsonyabb (0,01%-os) koncentrációval. A fiatalabb életkor összefügg az alacsony koncentrációjú atropinra adott gyenge terápiás válasszal (316).
A gyermekek mintegy 10%-ánál még nagy dózisú atropin hatása mellett is kimutatható volt a gyors progresszió. A gyengébb reagálás a szemüveg viselésének fiatalabb korban történő megkezdésével, a kiinduláskori magasabb fokú rövidlátással, és a szülői rövidlátással volt összefüggésben (308, 317, 318).
Anisometropia esetén a hosszabb szemgolyónak megfelelően monokulárisan alkalmazott 0,125%-os atropinterápia hatékonyan csökkentette a szemek közötti különbséget az axiális megnyúlás lassítása révén (319).
A közelmúltban néhány tanulmány myopia megelőzésére vagy késleltetésére vizsgálta az alacsony dózisú atropin hatását. A 0,025%-os és 0,05%-os atropin effektíven késleltette, vagy megelőzte a myopia kialakulását premyopoknál (0,0 D és +1,0 D között) a kontrollcsoporthoz képest. Nyilvánvaló, hogy ebben a fiatal korcsoportban alacsony koncentrációval érdemes cseppenteni a mellékhatások minimalizálása érdekében, de ez a terület még további kutatásokat igényel (313, 320).
Nem szabad elfeledkeznünk az atropin mellékhatásairól sem. A lokális szemészeti mellékhatásai az iris sphincter és a ciliáris izmokra kifejtett gátló hatásából adódnak, ami mydrasist, fotofóbiát és csökkent akkomodációt eredményez. A fotokromatikus és progresszív szemüveg felírása segíthet a tüneteken. Előfordulhatnak súlyosabb helyi reakciók, mint például allergiás keratoconjunctivitis, szemhéj-erythema és kiütések (300, 301, 315, 321, 322). Egyéb lehetséges mellékhatások közé tartozik a bőr, a száj és a torok szárazsága, álmosság, nyugtalanság, ingerlékenység, delírium, tachycardia és az arc vagy a nyak kipirulása (216, 323). Azonban az atropin legnagyobb klinikai vizsgálatában, az ATOM 2 studyban jelentett súlyos mellékhatások (akut has, tüdőgyulladás, Ewing’s sarcoma) egyike sem állt vélhetően az atropinnal összefüggésben, és nem voltak jelentős szisztémás mellékhatások sem (305). A mellékhatások gyakoriságában nem azonosítottak különbséget az ázsiai és kaukázusi alanyok között (322).
7.3.2. Pirenzepin
A pirenzepin egy M1 muszkarinreceptor-antagonista. Egy ázsiai populáción végzett, 12 hónapos vizsgálatban a naponta kétszer lokálisan alkalmazott 2%-os pirenzepin gél 44%-kal csökkentette a rövidlátás progresszióját és 39%-kal a tengelynyúlást a kontrollcsoporthoz képest; 11%-ban észleltek mellékhatásokat (324).
Egy másik 2 éves, kettős maszkolású, placebokontrollált amerikai vizsgálat 2% pirenzepinnel 41%-os csökkenést mutatott a rövidlátás progressziójában, azonban a csoportok közötti különbség a szemtengely-változásban nem érte el a statisztikai szignifikanciát (325). Az atropinhoz hasonlóan a pirenzepin homályos közeli látást, fényérzékenységet, viszketést, valamint a szemhéjon vagy szempillákon gyógyszer-maradványok megjelenését okozhatja. Néhány gyermeknél kis csomók vagy dudorok alakulhatnak ki a szemhéj alatt (214, 238, 325).
Jelenleg, miután hatékonyságban az atropinhoz képest a pirenzepin alul marad, és többször is kell cseppenteni naponta, a pirenzepin nem vehető fel a rövidlátás szabályozását szolgáló kezelési lehetőségek közé (216).
7.3.3. 7-methylxantin (7-MX)
A szájon át alkalmazott 7-MX egy adenozin-antagonista, valamint a koffein és a teobromin metabolitja.
A közelmúltban kimutatták, hogy a 7-MX csökkenti a rhesus majomban a hyperopiás defókusz által okozott axiális myopiát, és fokozza a myopiás defókuszra adott választ (326).
Egy dániai vizsgálatban a 7-MX szájon át napi 2× alkalmazott szisztémás kezelése hatékonynak tűnt a myopiás gyermekek axiális megnyúlásának és a myopia progressziójának késleltetésében, viszonylag kevés mellékhatással. A 7-MX csoportban 24 hónapos követési idő után a tengelynyúlás 0,1 mm-rel, a fénytörési hiba pedig 0,22 D-val csökkent a placebocsoporthoz képest. A gyógyszer biztonságosnak és mellékhatásoktól mentesnek tűnt (327). Használata azonban még további vizsgálatokat igényel (328).
7.3.4. Farmakológiai szerek összefoglalása
Az atropin a rövidlátás kontrolljának alappillére, és a farmakológiai szerek jelenleg egyetlen elterjedten alkalmazott terápiája. Az elmúlt két évtizedben klinikai vizsgálatok meggyőző bizonyítékokat szolgáltattak a myopia progresszióban betöltött szerepére (308, 311, 316), de mindeddig számos országban off-label az alkalmazása. Az atropin hatékonysága, mint korábban láttuk dózisfüggő, mint ahogy elhagyásakor a rebound hatás, vagy alkalmazásakor a mellékhatások is (8, 216).
A fiatalabb gyermekeknél magasabb (0,05%-os) koncentrációval érdemes indítani, mivel a fiatalabb életkor összefügg az alacsony koncentrációjú atropinra adott gyengébb terápiás válasszal (316). Azoknál a gyermekeknél, akiknél fennáll a felnőttkori nagyfokú rövidlátás kialakulásának kockázata, egyes szerzők 0,5%-os atropin dózissal való kezdést javasolnak (315). Az esetleges mellékhatások mérséklése érdekében esetükben fényre sötétedő, progresszív szemüveg használata javasolt.
Bizonyítékon alapuló iránymutatásokat még nem dolgoztak ki arra vonatkozóan, hogy hogyan kell pontosan leépíteni az atropinkezelést. Az ATOM 2 vizsgálat alapján, ha az atropin alkalmazását 12 éves kor után fejezzük be, kisebb a rebound hatás, tehát 12 éves kor alatt nagyobb figyelmet kell fordítani az atropin elhagyása esetén, mint 12 évesnél idősebb gyermekeknél (307, 329). A 12 évesnél fiatalabb gyermekeknél, akiknél az elmúlt egy évben nem volt progresszió, a leállás lassú kell legyen (a csökkentés évente 1-2 nap/hét). Ha azonban a gyermekek 12 évesnél idősebbek, akkor a cseppentés gyorsabb ütemben is elhagyható (6 havonta 1-2 nap/hét). Ezt alkalmazva a legtöbb gyermek körülbelül 14-15 éves korára elhagyja az atropin használatát (329).
Nagyobb dózisú atropin hirtelen abbahagyása mindenképp a refrakció hirtelen növekedését vonhatja maga után, bár egyes publikációk szerint ez a rebound nincs hatással a tengelyhossz növekedésére. Mindezek ellenére a nagyobb koncentrációjú atropinnal kezelt gyermekek esetében a leállásnál érdemes először kisebb dózisra váltani, hogy minimalizáljuk a rebound hatást (315).
7.4. Sebészi beavatkozások
7.4.1. A hátsó pólusi sclera megtámasztás/Posterior scleral reinforcement (PSR)/contraction (PSC)
A PSR olyan sebészi beavatkozás, amely során a szemgolyó hátsó fala közvetlen mechanikai megerősítést kap, így lassítva a szem megnyúlását és gátolva a staphyloma kialakulását (330, 331). A műtét során különféle anyagok használatosak: fascia lata, liofilizált dura, íncsíkok, aorta és donor sclera (216). A témában végzett tanulmányok kimutatták, hogy nagyfokú myopiában az eljárás lassíthatja a rövidlátás progresszióját, azonban hatékonysága változó lehet (332–336).
Új műtéti technikának számít a hátsó sclera kontrakció, amely során természetes cross-linking anyaggal, genipin oldattal kezelik a donor sclerát, növelve a felhasznált anyag szilárdságát. A genipin biztonságos cross-linking anyag, stabil és biokompatibilis (337, 338).
Egy nemrégen készült, 26 klinikai vizsgálatot feldolgozó tanulmány alapján a PSR posztoperatív szövődményei elsősorban az ocularis hipertenzió, conjunctivaödéma, üvegtesti vérzés, retina- vagy chorioidea-vérzés, diplopia vagy szemmozgászavar, retinaleválás és látóidegsorvadás. A megerősítőnek használt anyag kilökődése, symblepharon, és chorioidea effúzió is előfordulhat. Intraoperatív szövődmények közé tartozhat a vortex vénasérülés és scleraperforáció. A cikkekben előforduló gyakori szövődmények azonban a felsoroltak közül csak az enyhébb formák voltak, és csak múló jelleggel jelentkeztek (330).
Jelenleg nagyfokú rövidlátás esetén főként Oroszországban, Kelet-Európában és Kínában végzik a PSR-beavatkozást, bár az Egyesült Államokból is vannak publikációk (334), és Ausztrál szerzők is publikáltak esettanulmányt szövődményről (339). Hazánkban a debreceni munkacsoport végez sclera megtámasztásos műtétet, melyet hatásos és biztonságos technikának találtak az elvégzett és publikált eredményeik alapján (340).
A PSR műtéti beavatkozás alkalmazása és biztonságossága ellentmondásos. Használatához a myopia progresszióban több tanulmányra lenne szükség (330).
7.4.2. Injekció alapú sclerális megerősítés/Injection-based scleral strengthening (SSI)
Az SSI során a sclera ECM biomechanikai megerősítését szolgáló reagenseket injektálnak a Tenon-tok alá. Golychev és munkatársai szerint az esetek 61%-ában stabilizálódott a rövidlátás ezzel a módszerrel a körülbelül 2 éves követési idő alatt (341). Egy másik oroszországi tanulmányban polivinilpirrolidon, akrilamidhidrazid és etilakrilát keverékét tartalmazó polimer gélt adtak be monokulárisan, a Tenon-tok alá. A beszámolók szerint a refrakció az SSI beavatkozás után 1 évvel a szemek 79,6%-ában stabil maradt, az esetek 52,9%-ában pedig 4-9 év elteltével sem progrediált (342).
7.4.3. Kollagén cross-linking (CCL)
A cross-linking beavatkozás ismerős lehet a keratoconus betegségben corneán alkalmazott módszer miatt. Hasonló mechanizmus alapján a sclerális cross-linking részt vehet a myopia progresszió lassításában (343), azonban a jelenlegi (UV-fény és riboflavin) módszerek retinakárosodást eredményezhetnek (344, 345). A biztonságosabb technikák, mint például a kék fény és a riboflavin, ígéretesebbnek tűnik (346), de hatékonyságát és toxicitását tekintve ez a terület még további vizsgálatokat igényel (347).
7.4.4. Sebészeti beavatkozások összefoglalása
A sebészeti beavatkozások invazív jellegük és a nagy randomizált vizsgálatok hiánya miatt nem ajánlhatók elsővonalbeli kezelési módszereként a myopia progressziójának megelőzésére, sem a mérsékelt, sem a nagyfokú myopia esetén (8).
7.5. Kombinált terápiák
A myopiakontrollban együttesen is alkalmazható több intervenció. Leginkább az optikai intervenciókat kombinálják általában kis dózisú atropinnal. Egy 3195 szemészettel foglalkozó szakembert megkérdező felmérés szerint világszerte, és Európában is a kombinált terápia a rövidlátás szabályozásának leghatékonyabb módszere (348).
Egy randomizált, kontrollált tanulmányban a 0,5%-os atropin a multifokális szemüveglencsékkel együtt alkalmazva jobban lassította a rövidlátás progresszióját, mint a multifokális szemüveg önmagában, vagy az egyfókuszú szemüveges kontrollcsoport. A multifokális szemüveglencsék önmagukban azonban nem mutattak nagyobb effektivitást az egyfókuszú szemüveges kontrollokhoz képest (349).
Jelenleg számos publikáció bizonyítja, hogy az alacsony dózisú atropin (0,01%) és az orthokeratológia kombinációja nagyobb myopia kontrolláló hatást eredményez, mint az orthokeratológia önmagában történő alkalmazása (349–355). Az atropinkezelés és az ortho-K-lencsék kombinált hatásának egyik lehetséges mechanizmusa, hogy az atropin pupillatágító hatását kihasználva, a retinára nagyobb területen érkeznek a beeső fénysugarak, így jobban érvényesül a kontaktlencse által a corneán képzett, a retinán myopiás defókuszt okozó zóna hatása. A másik elmélet szerint, a pupillaátmérő növekedése magasabb rendű aberrációkhoz vezet, amely lassítja a szem megnyúlását (356).
A kis dózisú atropint nemcsak az orthokeratológiai kontaktlencsével, hanem a nappali lágy lassító kontaktlencsével is vizsgálták. A 2017-ben indult Bifocal & Atropine in Myopia (BAM) tanulmány célja volt megtudni, hogy a 0,01%-os atropin és a +2,50 addíciójú lágy bifokális kontaktlencse együttes alkalmazása jobban lassítja-e a rövidlátás progresszióját, mint a lágy anti-myopiás kontaktlencse önmagában (357). A tanulmány azonban érdekes módon nem eredményezett jobb hatékonyságot az atropin hozzáadásával, mint a lencsék magukban való alkalmazása (358). Ennek oka az lehet, hogy az anti-myopiás kontaktlencse eleve hatékonyabb, mint a 0,01% atropin (244), illetve a lágy anti-myopiás kontaktlencséknél a lassító zóna már körülbelül 5,0 mm-átmérőn belül érvényesül, így a retinán létrejövő pozitív szférikus aberrációs hatásában nem jelent többlet előnyt a tágabb pupilla.
A rövidlátást lassító speciális szemüvegek megjelenésével lehetőség nyílt ezek atropinnal való kombinációjának vizsgálatára is. A DIMS-technológiájú szemüveg 0,01% atropinnal kombinálva hatékonyabbnak bizonyult, mint a DIMS-lencsék önmagukban (359, 360).
És hogy mi lehet a jövő? Már folyik olyan tanulmány, amely atropin-szulfát és a pirenzepin-dihidroklorid rövidlátást lassító farmakológiai oldatokba áztatott, kereskedelmi forgalomban kapható lágy kontaktlencsék hatékonyságát vizsgálja (361).
Kombinált terápiák összefoglalása:
Kombinált terápia indítása megfontolandó a már kisiskolás korban jelentkező, a szemgolyó növekedési görbéje alapján eleve hosszabb bulbussal rendelkező (50%-os görbe feletti) (174) myopiás gyerekeknél, illetve hatástalan vagy nem kellően hatékony monoterápia esetén.
Az atropin szemcsepp és multifokális szemüveg kombinációjával kezelt gyermekeknél lassabb volt a rövidlátás progressziója, mint a placebo szemcseppekkel és egyfókuszú szemüveglencsékkel kezelteknél. Az alacsony dózisú atropinnal kombinált orthokeratológia, vagy DIMS-technológiájú szemüveg szinergikus hatás révén bizonyítottan javította a rövidlátás kontrollját az önmagában alkalmazott orthokeratológiai, vagy szemüveges kezeléshez képest, azonban anti-myopiás lágy lencséknél az atropin nem járult hozzá a kezelés hatékonyságának fokozásához.
Az egyes terápiák mellékhatásait azonban mindig szem előtt kell tartanunk, hiszen a kombinált terápia a mellékhatások együttes reakciójával járhat.
7.6. Szekvenciális kezelési mód
Úgy tűnik, hogy a kezelések hatékonysága az idő múlásával csökken. A jelenlegi módszerek kumulatív abszolút redukciós hatása a bulbushosszban 0,44 mm (amely a refrakcióban körülbelül 1,0 D-t jelent), amennyivel lassíthatják a myopia progresszióját (362, 363). A kezelési módok hatásmechanizmusa azonban eltérő, így lehetséges, hogy a különböző kezelési módok egymás utáni alkalmazásával nagyobb kumulatív hatás érhető el, bár ezt még eddig nem vizsgálták (364).
7.7. Újabb módszer a rövidlátás lassításában
A jelenlegi kutatások szerint a Low-Level-Red-Light (LLRL) terápia hatékonyan lassítja a rövidlátás progresszióját (365–370). Az alkalmazott asztali lézerdiódás készülékek hosszú hullámhosszú (635–650 nm) fényt bocsátanak ki. A követési időtartam a jelenlegi vizsgálatokban akár a 2 évet is elérheti (368). Az eredmények biztatóak, de további megerősítő vizsgálatokra még szükség van. Az eddig mért hatások nagyságrendben meghaladják más farmakológiai és optikai beavatkozások eredményeit, ami a feltételezések szerint a chorioidea vastagodásán keresztül érhető el (368, 370). A terápia elhagyása csak kis mértékben mutatott rebound hatást (368, 371). A nemkívánatos események monitorozása jelenleg főként kérdőíveken, a legjobb korrigált látóélesség mérésén és az optikai koherencia tomográfiás (OCT) képalkotáson alapul (365, 370). A mellékhatások vizsgálata azért is aktuális, mert egy nemrégiben publikált esetismertetés retinakárosodásra hívta fel a figyelmet a terápiával kapcsolatosan (372).
8. A szemészek és szemészeti ellátók feladatai a myopia megelőzésében (9)
8.1. A primer prevenció (a betegség kialakulásának megelőzése)
Myopia esetében a rövidlátóság kialakulásának elkerülését vagy kialakulásának késleltetését elérő eljárásokat jelenti. A myopia megelőzését lehetővé tevő eljárásokat minden gyermek számára elérhetővé kell tenni.
A myopia kialakulásának megelőzhetőségét a legmagasabb szintű bizonyítékok támasztják alá a környezeti tényezők és az oktatás optimalizálása révén. Ezért nagyon fontos, hogy a gyermekek minél több időt töltsenek a szabadban, és kevesebb közeli látást igénybe vevő tevékenységet végezzenek (olvasás, tanulás vagy játék számítógép-képernyő előtt, mint PC, tablet okostelefon, játékkonzolok) (83, 101–109, 178). Oda kell figyelni a folyamatos közeli tevékenység korlátozására is [egyfolytában legyen kevesebb, mint 30–45 perc, (205, 206), és utána legyen 5-10 perc szünet (207, 208)]. Fontos a megnövelt olvasási távolság betartása (legyen több mint 30 cm) (205, 206), Beltérben is természetes fény használata vagy rendkívül erős világosítás (több mint 3000 lux) alkalmazása szintén előnyös a rövidlátás megelőzésére (197). Online tanulás (e-learning) esetén a televízió-képernyő és kivetítők használata a rövidlátóság megelőzése szempontjából előnyösebb, mint számítógépek, tabletek, vagy mobiltelefonok alkalmazása (101) (Részletesen lásd 7.1 fejezet).
Mint ebből a fenti felsorolásból is egyértelmű, a myopia kialakulásának megelőzése a gyermekek számára optimális környezeti, oktatási feltételek megteremtését és bevezetését igényli országosan. Ennek elérése érdekében a szemészorvosoknak kettős szerepük lehet. Egyrészt szükség van rá, hogy rávegyék a döntéshozókat és a politikusokat a rövidlátóság megelőzését lehetővé tevő döntések meghozatalára, és a környezeti/oktatási változások megvalósítására. Másrészről szükséges, hogy tájékoztassák a szülőket és a lakosságot is a rövidlátás veszélyeiről és azok megelőzési lehetőségeiről, hogy a szükséges életmódváltás megvalósulhasson a gyermekek körében, mind az iskolákban, mind otthonukban. A szemészek alkalmasak erre a feladatra, mert jól ismerik a myopia lényegét, veszélyeit és megelőzési lehetőségeit.
8. 2. A szekunder prevenció (a betegség felismerése és kezelése a tünetek megjelenése előtt)
A premyopia időbeni (iskoláskor előtti) felismerését és követését jelenti, amikor a myopia kialakulása még elkerülhető. Ehhez aktív lakossági gyermek-szűrés bevezetése és működtetése szükséges (8, 176, 202).
A gyermek első fénytörésének meghatározásához cycloplegiát kell alkalmazni. A refrakció cycloplegia nélküli meghatározása növelheti a myopia, vagy hypermetropia félrediagnosztizálásának rizikóját (7, 10).
A premyopia felismerését követően folyamatos monitorozás szükséges, leginkább a szemtengelyhossz-növekedés követésével, amelyhez szemtengelyhossz-növekedési görbék használata javasolt (174, 176, 373). Ha a követés során a szemgolyó progresszíven nő vagy binokuláris zavar áll fenn, akkor szemészeti beavatkozás(ok) szükséges(ek) (8, 125, 202, 374).
Azoknál a gyermekeknél, akiknél a rövidlátás 6 évesnél fiatalabb korban kezdődik, ki kell zárni a másodlagos rövidlátás olyan formáit, mint a Stickler-szindróma, Marfan-szindróma, Donnai–Barrow-szindróma és más betegségek (8, 61), és ezek kimutatása esetén az alapbetegségnek megfelelő szoros szemészeti és társszakmák általi kezelése válhat szükségessé.
A szemészek feladata, hogy felhívják az illetékesek figyelmét a premyopok szűrésének fontosságára, és hogy elérjék azt, hogy az országos tömeges szűrőprogramokat kidolgozzák, és az megvalósuljon az óvodáskorú gyermekek számára. A szemészek felhívhatják a közvélemény figyelmét is a premyopok szűrésének fontosságára.
A szemtengely-növekedési görbék és a rizikófaktorok alapján magasabb kockázatú gyermekeket arra kell ösztönözni, hogy több időt töltsenek a szabadban, mivel ez a legfontosabb bizonyítékokon alapuló stratégia, amely hatásosnak tűnik a rövidlátás előfordulásának csökkentésében, kialakulásának gátlásában (126).
8.3. A tercier prevenció (a betegség súlyosbodásának megelőzése)
A myopia progressziójának csökkentését, a patológiás, nagyfokú rövidlátóság kialakulásának elkerülését jelenti. Ez a feladat csak a szemész szakemberek aktív közreműködésével valósulhat meg: a megfelelő vizsgálati módszerek alkalmazásával, és a szükséges myopiaellenes beavatkozások elrendelésével, valamint a kezelés alatt álló myopok folyamatos követésével. (A részleteket illetően lásd a 7.2., 7.3., és 7.5. fejezeteket).
Világviszonylatban már számos ország mutatott kedvező és eredményes példát a rövidlátóság hatékony országos prevenciójának kialakításában és megvalósításában, amely példákat érdemes tanulmányozni és a hazánkban is alkalmazható megoldásokat átvenni (9, 202, 375–377).
9. Következtetések
A nagyfokú rövidlátás kialakulásának elkerülése érdekében a szemész szakorvosok felelőssége kiemelkedően fontos. Alapvető szerepet játszanak a páciensek és a szülők kockázati tényezőkről és a rendelkezésre álló kezelési lehetőségekről való felvilágosításban. Fontos a rizikófaktorral és a már myopia tüneteivel rendelkező gyermekek rendszeres nyomon követése, és személyre szabott és bizonyítékokon alapuló ellátása
Nyilatkozat
A szerzők kijelentik, hogy a vonatkozó irodalom feldolgozásával kiegészített eredeti közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Holden BA, Fricke TR, Wilson DA, et al. Global prevalence of myopia and high myopia and temporal trends from 2000 through 2050. Ophthalmology 2016; 123: 1036–1042.
https://doi.org/10.1016/j.ophtha.2016.01.006
2. Morgan IG, Ohno-Matsui K, Saw SM. Myopia. Lancet 2012 May 5; 379(9827): 1739–48.
https://doi.org/10.1016/S0140-6736(12)60272-4
3. Fricke TR, Holden BA, Wilson DA, Schlenther G, Naidoo KS, Resnikoff S, Frick KD. Global cost of correcting vision impairment from uncorrected refractive error. Bull World Health Organ 2012 Oct 1; 90(10): 728–38.
https://doi.org/10.2471/BLT.12.104034
4. Wu L, Sun X, Zhou X, et al. Causes and 3-year-incidence of blindness in Jing-An District, Shanghai, China 2001–2009. BMC Ophthalmol 2011; 11: 10.
https://doi.org/10.1186/1471-2415-11-10
5. Resnikoff S, Jonas JB, Friedman D, et al. Myopia – a 21st century public health issue. Invest Ophthalmol Vis Sci 2019; 60: MI–MII.
https://doi.org/10.1167/iovs.18-25983
6. Jong M, Jonas JB, Wolffsohn JS, et al. IMI 2021 Yearly Digest Invest Ophthalmol Vis Sci 2021; 62(5): 7.
https://doi.org/10.1167/iovs.62.5.7
7. Sankaridurg P, Berntsen DA, Bullimore MA, et al. IMI 2023 Digest Invest Ophthalmol Vis Sci 2023; 64(6): 7.
https://doi.org/10.1167/iovs.64.6.7
8. Németh J, Tapasztó B, Aclimandos WA, et al. Update and guidance on management of myopia. European Society of Ophthalmology in cooperation with International Myopia Institute. Eur J Ophthalmol 2021 May; 31(3): 853–883.
https://doi.org/10.1177/1120672121998960
9. Németh J, Aclimandos WA, Tapasztó B, et al. The impact of the pandemic highlights the urgent need for myopia guidelines: The clinicians’ role. Eur J Ophthalmol 2022 Nov 29; 33(2): 11206721221143008.
https://doi.org/10.1177/11206721221143008
10. Flitcroft DI, He M, Jonas JB, et al. IMI – Defining and Classifying Myopia: A Proposed Set of Standards for Clinical and Epidemiologic Studies. Invest Ophthalmol Vis Sci 2019 Feb 28; 60(3): M20–M30.
https://doi.org/10.1167/iovs.18-25957
11. Troilo D, Smith EL 3rd, Nickla DL, et al. IMI – Report on Experimental Models of Emmetropization and Myopia. Invest Ophthalmol Vis Sci 2019 Feb 28; 60(3): M31–M88.
https://doi.org/10.1167/iovs.18–25967
12. Chakraborty R, Read SA and Vincent SJ. Understanding myopia: pathogenesis and mechanisms. In: Ang M and Wong TY (eds.) Updates on myopia. A clinical perspec- tive. 1st ed. Singapore: Springer; 2020. pp. 65–95.
https://doi.org/10.1007/978-981-13-8491-2_4
13. Smith III EL, Arumugam B, Hung LF, et al. Eccentricity-dependent effects of simultaneous competing defocus on emmetropization in infant rhesus monkeys. Vision Res 2020 Dec; 177: 32–40.
https://doi.org/10.1016/j.visres.2020.08.003
14. Smith EL III and Hung LF. Form-deprivation myopia in monkeys is a graded phenomenon. Vis Res 2000; 40: 371–381.
https://doi.org/10.1016/s0042-6989(99)00184-4
15. Smith EL III, Hung LF, Huang J, et al. Effect of optical defocus on refractive development in monkeys: evidence for local, regionally selective mechanisms. Invest Ophthtlmol Vis Sci 2010; 51: 3864–3873.
https://doi.org/10.1167/iovs.09-4969
16. Wildsoet C and Pettigrew JD. Experimental myopia and anomalous eye growth patterns unaffected by optic nerve section in chickens: evidence for local control of eye growth. Clin Vis Sci 1988; 3: 99–107.
17. Smith EL III, Ramamirtham R, Qiao-Grider Y, et al. Effects of foveal ablation on emmetropization and formdeprivation myopia. Invest Ophthalmol Vis Sci 2007; 48: 3914–3922.
https://doi.org/10.1167/iovs.06-1264
18. Schaeffel F, Glasser A and Howland HC. Accommodation, refractive error and eye growth in chickens. Vision Res 1988; 28: 639–657.
https://doi.org/10.1016/0042-6989(88)90113-7
19. Smith EL III, Kee C, Ramamirtam R, et al. Peripheral vision can influence eye growth and refractive development in infant monkeys. Invest Ophthtlmol Vis Sci 2005; 46: 3965–3972.
https://doi.org/10.1167/iovs.05-0445
20. Charman WN and Radhakrishnan H. Peripheral refraction and the development of refractive error: a review. Ophthalmic Physiol Opt 2010; 30: 321–338.
https://doi.org/10.1111/j.1475-1313.2010.00746.x
21. Wildsoet C and Wallman J. Choroidal and scleral mechanisms of compensation for spectacle lenses in chicks. Vis Res 1995; 35: 1175–1194.
https://doi.org/10.1016/0042-6989(94)00233-c
22. Wallman J, Wildsoet C, Xu A, et al. Moving the retina: choroidal modulation of refractive state. Vis Res 1995; 35: 37–50.
https://doi.org/10.1016/0042-6989(94)e0049-q
23. Harper AR and Summers JA. The dynamic sclera: extracellular matrix remodeling in normal ocular growth and myopia development. Exp Eye Res 2015; 133: 100–111.
https://doi.org/10.1016/j.exer.2014.07.015
24. Charman WN. Aberrations and myopia. Ophthalmic Physiol Opt 2005; 25: 285–301.
https://doi.org/10.1111/j.1475-1313.2005.00297.x
25. Lau JK, Vincent SJ, Collins MJ, et al. Ocular higher-order aberrations and axial eye growth in young Hong Kong children. Sci Rep 2018; 8: 6726.
https://doi.org/10.1038/s41598-018-24906-x
26. Hiraoka T, Kotsuka J, Kakita T, et al. Relationship between higher-order wavefront aberrations and natural progression of myopia in schoolchildren. Sci Rep 2017; 7: 7876. /
https: //doi.org/10.1038/s41598-017-08177-6
27. Nickla DL. The phase relationships between the diurnal rhythms in axial length and choroidal thickness and the association with ocular growth rate in chicks. J Comp Physiol A 2006; 192: 399–407.
https://doi.org/10.1007/s00359-005-0077-2
28. Kearney S, O’Donoghue L, Pourshahidi LK, et al. Myopes have significantly higher serum melatonin concentrations than non-myopes. Ophthalmic Physiol Opt 2017; 37: 557– 567.
https://doi.org/10.1111/opo.12396
29. Jee D, Morgan IG and Kim EC. Inverse relationship between sleep duration and myopia. Acta Ophthalmol 2016; 94: 204–210.
https://doi.org/10.1111/aos.12776
30. Cohen Y, Belkin M, Yehezkel O, et al. Dependency between light intensity and refractive development under lightdark cycles. Exp Eye Res 2011; 92: 40–46.
https://doi.org/10.1016/j.exer.2010.10.012
31. Norton TT. What do animal studies tell us about the mechanism of myopia-protection by light? Optom Vis Sci 2016; 93: 1049–1051.
https://doi.org/10.1097/OPX.0000000000000917
32. Wang M, Schaeffel F, Jiang B, et al. Effects of light of different spectral composition on refractive development and retinal dopamine in chicks. Invest Ophthalmol Vis Sci 2018; 59: 4413–4424.
https://doi.org/10.1167/iovs.18-23880
33. Wang D, Chun RKM, Liu M, et al. Optical Defocus Rapidly Changes Choroidal Thickness in Schoolchildren. Plos One 2016; 11(8): e0161535.
https://doi.org/10.1371/journal.pone.0161535
34. Williams KM, Verhoeven VJM, Cumberland P, et al. Prevalence of refractive error in Europe: the European Eye Epidemiology (E3) Consortium. Eur J Epidemiol 2015; 30: 305–315.
https://doi.org/10.1007/s10654-015-0010-0
35. Kinge B, Midelfart A, Jacobsen G, et al. The influence of near-work on development of myopia among university students: a three-year longitudinal study among engineering students in Norway. Acta Ophthalmol Scand 2000; 78: 26–29.
https://doi.org/10.1034/j.1600-0420.2000.078001026.x
36. McCullough SJ, O’Donoghue L and Saunders KJ. Six year refractive change among white children and young adults: evidence for significant increase in myopia among white UK children. PLoS One 2016; 11: e0146332.
https://doi.org/10.1371/journal.pone.0146332
37. Hagen LA, Gjelle JVB, Arnegard S, et al. Prevalence and possible factors of myopia in Norwegian adolescents. Sci Rep 2018; 8: 13479.
https://doi.org/10.1038/s41598-018-31790-y
38. Hansen MH, Hvid-Hansen A, Jacobsen N, et al. Myopia prevalence in Denmark – a review of 140 years of myopia research. Acta Ophthalmol Epub ahead of 6 August 2020.
https://doi.org/10.1111/aos.14562
39. Morgan IG and Rose KA. Is the nature-nurture debate finally over? Clin Exp Optom 2019; 102: 3–17.
https://doi.org/10.1111/cxo.12845
40. World Health Organisation. World report of vision. Geneva, Switzerland: WHO, 2019, p. 154.
https: //www.who.int/publications/i/item/9789241516570
41. Grzybowski A, Kanclerz P, Tsubota K, et al. A review on the epidemiology of myopia in school children worldwide. BMC Ophthalmol 2020; 20: 27.
https://doi.org/10.1186/s12886-019-1220-0
42. McCrann S, Loughman J, Butler JS, et al. Smartphone use as a possible risk factor for myopia. Clin Exp Optom 2020; 104(1): 13092.
https://doi.org/10.1111/cxo.13092
43. Rudnicka AR, Kapetanakis VV, Wathern AK, et al. Global variations and time trends in the prevalence of childhood myopia, a systematic review and quantitative meta-analysis: implications for aetiology and early prevention. Br J Ophthalmol 2016; 100: 882–890.
https://doi.org/10.1136/bjophthalmol-2015-307724
44. Németh J, Nagy ZZ, Tapasztó B, et al. Szemészeti eredmények Magyarország Átfogó Egészségvédelmi Szűrőprogramjában, 2011–2022. Orvosi Hetilap 2023; 164(7): 253–259.
https://doi.org/10.1556/650.2023.32701
45. Németh J, Daiki T, Dankovics G, et al. Prevalence of refractive errors in Hungary reveals three-fold increase in myopia. Int J Ophthalmol. 2022 Jul 18; 15(7): 1174–1179.
https://doi.org/10.18240/ijo.2022.07.19
46. Pärssinen O, Soh ZD, Tan CS, et al. Comparison of myopic progression in Finnish and Singaporean children. Acta Ophthalmol Epub ahead of 24 July 2020.
https://doi.org/10.1111/ aos.14545.
47. Chua SY, Sabanayagam C, Cheung YB, et al. Age of onset of myopia predicts risk of high myopia in later childhood in myopic Singapore children. Ophthalmic Physiol Opt 2016; 36: 388–394.
https://doi.org/10.1111/opo.12305
48. Bullimore MA, Reuter KS, Jones LA, et al. The study of progression of adult nearsightedness (SPAN): design and baseline characteristics. Optom Vis Sci 2006; 83: 594–604.
https://doi.org/10.1097/01.opx.0000230274.42843.28
49. Thorn F, Gwiazda J and Held R. Myopia progression is specified by a double exponential growth function. Optom Vis Sci 2005; 82: 286–297.
https://doi.org/10.1097/01.opx.0000159370.66540.34
50. Smirnova I, Prediger V and Potykova JU. Epidemiology of disorders of refraction, accommodation and convergence, at schoolchildren of Siberia. Mod Optom 2017; 102: 19–28.
51. Logan N. Modern trends in refractogenesis in Siberian schoolchildren. Poster abstract P 003. Ophthalmic Physiol Opt 2018; 38(3): 215–216.
52. COMET Group. Myopia stabilization and associated factors among participants in the Correction of Myopia Evaluation Trial (COMET). Invest Ophthalmol Vis Sci 2013; 54: 7871–7884.
https://doi.org/10.1167/iovs.13-12403
53. Lee MW, Lee SE, Lim HB, et al. Longitudinal changes in axial length in high myopia: a 4-year prospective study. Br J Ophthalmol 2019; 104: 600–603.
https://doi.org/10.1136/bjophthalmol-2019-314619
54. Lee JTL, Guo X, Li Z, et al. Progression and longitudinal biometric changes in highly myopic eyes. Invest Ophthalmol Vis Sci 2020; 61: 34.
https://doi.org/10.1167/iovs.61.4.34
55. Alzahrani AS, Abu-Amero KK, Mousa A, et al. Myopia progression in young adults: a review of current understanding and prospects for future therapies. Expert review of Ophthalmology 2019; 14(4): 231-227.
56. Matamoros E, Ingrand P, Pelen F, et al. Prevalence of myopia in France: a cross-sectional analysis. Medicine 2015; 94: e1976.
https://doi.org/10.1097/MD.0000000000001976
57. Foster PJ and Jiang Y. Epidemiology of myopia. Eye (Lond) 2014; 28: 202–208.
https://doi.org/10.1038/eye.2013.280
58. Donovan L, Sankaridurg P, Ho A, et al. Myopia progression rates in urban children wearing single-vision spectacles. Optom Vis Sci 2012; 89: 27–32.
https://doi.org/10.1097/OPX.0b013e3182357f79
59. French AN, Morgan IG, Burlutsky G, et al. Prevalence and 5 to 6-year incidence and progression of myopia and hyperopia in Australian schoolchildren. Ophthalmology 2013; 120: 1482–1491.
https://doi.org/10.1016/j.ophtha.2012.12.018
60. Pärssinen O, Soh ZD, Tan CS, et al. Comparison of myopic progression in Finnish and Singaporean children. Acta Ophthalmol 2021; 99: 171–180.
https://doi.org/10.1111/aos.14545
61. Tedja MS, Haarman AEG, Meester-Smoor MA, et al. IMI-myopia genetics report. Invest Ophthalmol Vis Sci 2019; 60: 89–105.
https://doi.org/10.1167/iovs.18-25965
62. Rose KA, Morgan IG, Smith W, et al. High heritability of myopia does not preclude rapid changes in prevalence. Clin Exp Ophthalmol 2002; 30: 168–172.
https://doi.org/10.1046/j.1442-9071.2002.00521.x
63. Wong TY, Foster PJ, Hee J, et al. Prevalence and risk factors for refractive errors in adult Chinese in Singapore. Invest Ophthalmol Vis Sci 2000; 41: 2486–2494. PMID: 10937558.
64. Zylbermann R, Landau D and Berson D. The influence of study habits on myopia in Jewish children. J Pediatr Ophthalmol Strabismus 1993; 30: 319–322.
https://doi.org/10.3928/0191-3913-19930901-12
65. Megreli J, Barak A, Bez M, et al. Association of myopia with cognitive function among one million adolescents. BMC Public Health 2020; 20: 647.
https: //doi.org/10.1186/s12889-020-08765-8
66. Jiang X, Tarczy-Hornoch K, Cotter SA, et al. Association of parental myopia with higher risk of myopia among multiethnic children before school age. JAMA Ophthalmol 2020; 138: 501–509.
67. Hysi PG, Choquet H, Khawaja AP, et al. Meta-analysis of 542,934 subjects of European ancestry identifies new genes and mechanisms predisposing to refractive error and myopia. Nat Genet 2020; 52: 401–407.
https://doi.org/10.1038/s41588-020-0599-0
68. Li J and Zhang Q. Insight into the molecular genetics of myopia. Mol Vis 2017; 23: 1048–1080. PMCID: PMC5757860.
69. Morgan IG, Wu P-C, Ostrin LA, et al. IMI Risk factors for myopia. Invest Ophthalmol Vis Sci 2021; 62(5): 3.
https://doi.org/10.1167/iovs.62.5.3
70. Dolgin E. The myopia boom. Nature 2015; 519: 276–278.
https://doi.org/10.1038/519276a
71. Williams KM, Bertelsen G, Cumberland P, et al. Increasing prevalence of myopia in Europe and the impact of education. Ophthalmology 2015; 122: 1489–1497.
https://doi.org/10.1016/j.ophtha.2015.03.018
72. Hua WJ, Jin JX, Wu XY, et al. Elevated light levels in schools have a protective effect on myopia. Ophthalmic Physiol Opt 2015; 35: 252–262.
https://doi.org/10.1111/opo.12207
73. Read SA, Collins MJ and Vincent SJ. Light exposure and physical activity in myopic and emmetropic children. Optom Vis Sci 2014; 91: 330–341.
https://doi.org/10.1097/OPX.0000000000000160
74. Torii H, Ohnuma K, Kurihara T, et al. Violet light transmission is related to myopia progression in adult high myopia. Sci Rep 2017; 7: 14523.
https://doi.org/10.1038/s41598-017-09388-7
75. Williams KM, Bentham GC, Young IS, et al. Association between myopia, ultraviolet B radiation exposure, serum vita min D concentrations, and genetic polymorphisms in vitamin D metabolic pathways in a multicountry European study. JAMA Ophthalmol 2017; 135: 47–53.
https://doi.org/10.1001/jamaophthalmol.2016.4752
76. Xiong S, Sankaridurg P, Naduvilath T, et al. Time spent in outdoor activities in relation to myopia prevention and control: a meta-analysis and systematic review. Acta Ophthalmol 2017; 95: 551–566.
https://doi.org/10.1111/aos.13403
77. Cao K, Wan Y, Yusufu M, et al. Significance of outdoor time for myopia prevention: a systematic review and meta-analysis based on randomized controlled trials. Ophthalmic Res 2020; 63: 97–105.
https://doi.org/10.1159/000501937
78. Wolffsohn JS, Flitcroft DI, Gifford KL, et al. IMI-myopia control reports overview and introduction. Invest Ophthalmol Vis Sci 2019; 60: M1–M17.
https://doi.org/10.1167/iovs.18-25980
79. Pärssinen O and Lyyra AL. Myopia and myopic progression among schoolchildren: a three-year follow-up study. Invest Ophthalmol Vis Sci 1993; 34: 2794–2802 PMID: 8344801.
80. Morgan I and Rose K. How genetic is ‘school myopia’? Prog Retin Eye Res 2005; 24: 1–38.
https://doi.org/10.1016/j.preteyeres.2004.06.004
81. Mutti DO, Mitchell GL, Moeschberger ML, et al. Parental myopia, near work, school chievement, and children’s refractive error. Invest Ophthalmol Vis Sci 2002; 43: 384. 3633–3640. PMID: 12454029.
82. Rose KA, Morgan IG, Ip J, et al. Outdoor activity reduces the prevalence of myopia in children. Ophthalmology 2008; 115: 1279–1285.
https://doi.org/10.1016/j.ophtha.2007.12.019
83. Huang HM, Chang DS and Wu PC. The association between near work activities and myopia in children-a systematic review and meta-analysis. PLoS One 2015; 10: e0140419.
https://doi.org/10.1371/journal.pone.0140419
84. Morgan IG and Rose KA. Myopia and international educational performance. Ophthalmic Physiol Opt 2013; 33: 329–338.
https://doi.org/10.1111/opo.12040
85. Verhoeven VJM, Buitendijk GHS, Rivadeneira F, et al. Consortium for refractive error and myopia (CREAM). Education influences the role of genetics in myopia. Eur J Epidemiol 2013; 28: 973–980.
https://doi.org/10.1007/s10654-013-9856-1
86. Fan Q, Guo X, Tideman JWL, et al. Childhood gene-environment interactions and age-dependent effects of genetic variants associated with refractive error and myopia: the CREAM Consortium. Sci Rep 2016; 6: 25853.
https://doi.org/10.1038/srep25853
87. Mountjoy E, Davies NM, Plotnikov D, et al. Education and myopia: assessing the direction of causality by mendelian randomisation. BMJ 2018; 361: k2022.
https://doi.org/10.1136/bmj.k2022
88. Flitcroft DI.The complex interactions of retinal, optical and environmental factors in myopia aetiology. Prog Retin Eye Res 2012; 31: 622–660.
https://doi.org/10.1016/j.preteyeres.2012.06.004
89. Harper AR, Summers JA.The dynamic sclera: extracellular matrix remodeling in normal ocular growth and myopia development. Exp Eye Res 2015; 133: 100–111.
https://doi.org/10.1016/j.exer.2014.07.015
90. Gwiazda J, Thorn F, Bauer J, et al. Myopic children show insufficient accommodative response to blur. Invest Ophthalmol Vis Sci 1993; 34: 690–694. PMID: 8449687.
91. Gwiazda J, Bauer J, Thorn F, et al. A dynamic relationship between myopia and blur-driven accommodation in school-aged children. Vis Res 1995; 35: 1299–1304.
https://doi.org/10.1016/0042-6989(94)00238-h
92. Abbott ML, Schmid KL, Strang NC. Differences in the accommodation stimulus response curves of adult myopes and emmetropes. Ophthalmic Physiol Opt 1998; 18: 13–20. PMID: 9666906.
93. Aleman AC, Wang M, Schaeffel F.Reading and myopia: contrast polarity matters. Sci Rep 2018; 8: 10840.
https://doi.org/10.1038/s41598-018-28904-x
94. Summers JA. The choroid as a sclera growth regulator. Exp Eye Res 2013; 114: 120–127.
https://doi.org/10.1016/j.exer.2013.03.008
95. Enthoven CA, Tideman JWL, Polling JR, et al. The impact of computer use on myopia development in childhood: the Generation R study. Prev Med 2020; 132: 105988.
https://doi.org/10.1016/j.ypmed.2020.105988
96. Morgan IG, French AN, Rose KA. Risk factors for myopia: putting causal pathways into a social context. In: Ang M, Wong TY. (eds.) Updates on myopia. A clinical perspective. 1st ed. Singapore: Springer, 2020, pp.133–170.
https://doi.org/10.1167/iovs.62.5.3
97. Williams KM, Kraphol E, Yonova-Doing E, et al. Early life factors for myopia in the British twins early development study. Br J Ophthalmol 2019; 103: 1078–1084.
https://doi.org/10.1136/bjophthalmol-2018-312439
98. Saxena R, Vashist P, Tandon R, et al. Incidence and progression of myopia and associated factors in urban school children in Delhi: The North India Myopia Study (NIM Study). PLoS One 2017; 12: e0189774.
https://doi.org/10.1371/journal.pone.0189774
99. Foreman J, Salim AT, Praveen A, et al. Association between digital smart device use and myopia: a systematic review and metaanalysis. Lancet Digit Health 2021; 3: e806-e18.
https://doi.org/10.1016/S2589-7500(21)00135-7
100. Lanca C, Saw SM.The association between digital screen time and myopia: a systematic review. Ophthalmic Physiol Opt 2020; 40: 216–229.
https://doi.org/10.1111/opo.12657
101. Ma M, Xiong S, Zhao S, Zheng Z, Sun T, Li C. COVID-19 Home Quarantine Accelerated the Progression of Myopia in Children Aged 7 to 12 Years in China. Invest Ophthalmol Vis Sci 2021 Aug 2; 62(10): 37.
https://doi.org/10.1167/iovs.62.10.37
102. Wang J, Li Y, Musch DC, et al. Progression of myopia in school-aged children after COVID-19 home confinement. JAMA Ophthalmol 2021; 139: 293–300.
https://doi.org/10.1001/jamaophthalmol.2020.6239
103. Ma D, Wei S, Li SM, et al. Progression of myopia in a natural cohort of Chinese children during COVID-19 pandemic. Graefes Arch Clin Exp Ophthalmol 2021; 259: 2813–2820.
https://doi.org/10.1007/s00417-021-05305-x
104. Ma D, Wei S, Li SM, et al. The impact of study-at-home during the COVID-19 pandemic on myopia progression in Chinese children. Front Public Health 2022; 9: 720514.
https://doi.org/10.3389/fpubh.2021.720514
105. Mohan A, Sen P, Peeush P, et al. Impact of online classes and home confinement on myopia progression in children during COVID-19 pandemic: digital eye strain among kids (DESK) study 4. Indian J Ophthalmol 2022; 70: 241–245.
https://doi.org/10.4103/ijo.IJO_1721_21
106. Yang Z, Wang X, Zhang S, et al. Pediatric myopia progression during the COVID-19 pandemic home quarantine and the risk factors: a systematic review and meta-analysis. Front Public Health 2022; 10: 835449.
https://doi.org/10.3389/fpubh.2022.835449
107. Yum HR, Park SH, Shin SY. Influence of coronavirus disease 2019 on myopic progression in children treated with low-concentration atropine. PLoS One 2021; 16: e0257480.
https://doi.org/10.1371/journal.pone.0257480
108. Mohan A, Sen P, Shah C, et al. Prevalence and risk factor assessment of digital eye strain among children using online e-learning during the COVID-19 pandemic: digital eye strain among kids (DESK study-1). Indian J Ophthalmol 2021; 69: 140–144.
https://doi.org/10.4103/ijo.IJO_2535_20
109. Limwattanayingyong J, Amornpetchsathaporn A, Chainakul Met al. et al. The association between environmental and social factors and myopia: a review of evidence from COVID-19 pandemic. Front Public Health 2022; 10: 918182.
https://doi.org/10.3389/fpubh.2022.918182
110. Flitcroft DI, Harb EN, Wildsoet CF. The spatial frequency content of urban and indoor environments as a potential risk factor for myopia development. Invest Ophthalmol Vis Sci 2020; 61: 42.
https://doi.org/10.1167/iovs.61.11.42
111. Morris TT, Guggenheim JA, Northstone K, Williams C. Geographical variation in likely myopia and environmental risk factors: a multilevel cross classified analysis of a UK cohort. Ophthalmic Epidemiol 2020; 27: 1–9.
https://doi.org/10.1080/09286586.2019.1659979
112. Ip JM, Rose KA, Morgan IG, Burlutsky G, Mitchell P. Myopia and the urban environment: findings in a sample of 12-year-old Australian school children. Invest Ophthalmol Vis Sci 2008; 49: 3858–3863.
https://doi.org/10.1167/iovs.07-1451
113. Zhang M, Li L, Chen L, et al. Population density and refractive error among Chinese children. Invest Ophthalmol Vis Sci 2010; 51: 4969–4976.
https://doi.org/10.1167/iovs.10-5424
114. Choi KY, Yu WY, Lam CHI, et al. Childhood exposure to constricted living space: a possible environmental threat for myopia development. Ophthalmic Physiol Opt 2017; 37: 568–575.
https://doi.org/10.1111/opo.12397
115. Thykjaer AS, Lundberg K, Grauslund J. Physical activity in relation to development and progression of myopia – a systematic review. Acta Ophthalmol 2017; 95: 651–659.
https://doi.org/10.1111/aos.13316
116. Guggenheim JA, Northstone K, McMahon G, et al. Time outdoors and physical activity as predictors of incident myopia in childhood: a prospective cohort study. Invest Ophthalmol Vis Sci 2012; 53: 2856–2865.
https://doi.org/10.1167/iovs.11-9091
117. Lundberg K, Suhr Thykjaer A, Sogaard Hansen R, et al. Physical activity and myopia in Danish children - The CHAMPS Eye Study. Acta Ophthalmol 2018; 96: 134– 141.
https://doi.org/10.1111/aos.13513
118. Hansen MH, Laigaard PP, Olsen EM, et al. Low physical activity and higher use of screen devices are associated with myopia at the age of 16-17 years in the CCC2000 Eye Study. Acta Ophthalmol 2020; 98: 315–321.
https://doi.org/10.1111/aos.14242
119. Lim HT, Yoon JS, Hwang SS, Lee SY. Prevalence and associated sociodemographic factors of myopia in Korean children: the 2005 third Korea National Health and Nutrition Examination Survey (KNHANES III). Jpn J Ophthalmol 2012; 56: 76–81.
https://doi.org/10.1007/s10384-011-0090-7
120. Shimizu N, Nomura H, Ando F, Niino N, Miyake Y, Shimokata H. Refractive errors and factors associated with myopia in an adult Japanese population. Jpn J Ophthalmol. 2003; 47: 6–12.
https://doi.org/10.1016/s0021-5155(02)00620-2
121. Xiang F, He M, Morgan IG. The impact of parental myopia on myopia in Chinese children: population-based evidence. Optom Vis Sci 2012; 89: 1487–1496.
https://doi.org/10.1097/OPX.0b013e31826912e0
122. Tideman JWL, Polling JR, Hofman A, et al. Environmental factors explain socioeconomic prevalence differences in myopia in 6-year-old children. Br J Ophthalmol 2017; 102: 243–247.
https://doi.org/10.1136/bjophthalmol-2017-310292
123. Lim LS, Gazzard G, Low YL, et al. Dietary factors, myopia, and axial dimensions in children. Ophthalmology 2010; 117: 993–997.
https://doi.org/10.1016/j.ophtha.2009.10.003
124. Berticat C, Mamouni S, Ciais A, et al. Probability of myopia in children with high refined carbohydrates consumption in France. BMC Ophthalmol 2020; 20: 337. 2020/08/20.
https: //doi.org/10.1186/s12886-020-01602-x
125. Michaud L, Marcotte-Collard R, Simard P, et al. Diagnosis and treatment plan. In: Managing myopia – One child at a time. 1st ed. Dougmar Publishing Group Inc March 2022 pp. 133–186.
https://managing-myopia.com
126. Gifford KL, Richdale K, Kang P, et al. IMI-clinical management guidelines report. Invest Ophthtlmol Vis Sci 2019; 60: M184–M203.
https://doi.org/10.1167/iovs.18-25977
127. Lauber JK, Shutze Jv Mcginnis J. Effects of exposure to continuous light on the eye of the growing chick. Proc Soc Exp Biol Med 1961; 106: 871–872.
https://doi.org/10.3181/00379727-106-26505
128. Zhang DQ, Wong KY, Sollars PJ, Berson DM, Pickard GE, McMahon DG. Intraretinal signaling by ganglion cell photoreceptors to dopaminergic amacrine neurons. Proc Natl Acad Sci USA 2008; 105: 14181–14186.
https://doi.org/10.1073/pnas.0803893105
129. Muralidharan AR, Lanca C, Biswas S, et al. Light and myopia: From epidemiological studies to neurobiological mechanisms. Ther Adv Ophthalmol. 2021; 13: 25158414211059246.
https://doi.org/10.1177/25158414211059246
130. Chakraborty R, Ostrin LA, Nickla DL, Iuvone PM, Pardue MT, Stone RA. Circadian rhythms, refractive development, and myopia. Ophthalmic Physiol Opt 2018; 38: 217–245.
https://doi.org/10.1111/opo.12453
131. Liu XN, Naduvilath TJ, Wang J, et al. Sleeping late is a risk factor for myopia development amongst school-aged children in China. Sci Rep 2020; 10: 17194. 2020/10/16.
https://doi.org/10.1038/s41598-020-74348-7
132. Pärssinen O. Relation between refraction, education, occupation, and age among 26- and 46-year-old Finns. Am J Optom Physiol Opt 1987; 64: 136–143.
https://doi.org/10.1097/00006324-198702000-00010
133. Midelfart A, Kinge B, Midelfart S, et al. Prevalence of refractive errors in young and middle-aged adults in Norway. Acta Ophthalmol Scand 2002; 80: 501–505.
https://doi.org/10.1034/j.1600-0420.2002.800508.x
134. Sun J, Zhou J, Zhao P, et al. High prevalence of myopia and high myopia in 5060 Chinese university students in Shanghai. Invest Ophthalmol Vis Sci 2012; 53: 7504–7509.
https://doi.org/https: //doi.org/10.1167/iovs.11-8343
135. Gwiazda J, Hyman L, Dong LM, et al. Factors associated with high myopia after 7 years of follow-up in the Correction of Myopia Evaluation Trial (COMET) cohort. Ophthalmic Epidemiol 2007; 14: 230–237.
https://doi.org/10.1080/01658100701486459
136. Shrestha SP, Bhat KS, Binu VS, et al. Pattern of refractive errors among the Nepalese population: a retrospective study. Nepal J Ophthalmol 2010; 2: 87–96.
https://doi.org/10.3126/nepjoph.v2i2.3714
137. Rezvan F, Khabazkhoob M, Fotouhi A, et al. Prevalence of refractive errors among school children in Northeastern Iran. Ophthalmic Physiol Opt 2012; 32: 25–30.
https://doi.org/10.1111/j.1475-1313.2011.00879.x
138. Ip JM, Huynh SC, Robaei D, et al. Ethnic differences in the impact of parental myopia: findings from a population-based study of 12-year-old Australian children. Invest Ophthalmol Vis Sci 2007; 48: 2520–2528.
https://doi.org/10.1167/iovs.06-0716
139. Zhang X, Qu X, Zhou X.Association between parental myopia and the risk of myopia in a child. Exp Ther Med 2015; 9: 2420–2428.
https://doi.org/10.3892/etm.2015.2415
140. Wenbo L, Congxia B, Hui L. Genetic and environmental-genetic interaction rules for the myopia based on a family exposed to risk from a myopic environment. Gene 2017; 626: 305–308.
https://doi.org/10.1016/j.gene.2017.05.051
141. Jones-Jordan LA, Sinnott LT, Manny RE, et al. Early childhood refractive error and parental history of myopia as predictors of myopia. Invest Ophthalmol Vis Sci 2010; 51: 115–121.
https://doi.org/10.1167/iovs.08-3210
142. McMonnies CW. Clinical prediction of the need for interventions for the control of myopia. Clin Exp Optom 2015; 98: 518–526.
https://doi.org/10.1111/cxo.12212
143. Michaud L, Marcotte-Collard R, Simard P et al. What do we know. In: Managing myopia – One child at a time. 1st ed. Dougmar Publishing Group Inc March 2022 pp. 1–60.
https://managing-myopia.com
144. Jung SK, Lee JH, Kakizaki H, et al. Prevalence of myopia and its association with body stature and educational level in 19-year-old male conscripts in Seoul, South Korea. Invest Ophthalmol Vis Sci 2012; 53: 5579–5583.
https://doi.org/10.1167/iovs.12-10106
145. Terasaki H, Yamashita T, Yoshihara N, et al. Association of lifestyle and body structure to ocular axial length in Japanese elementary school children. BMC Ophthalmol 2017; 17: 123.
https://doi.org/10.1186/s12886-017-0519-y
146. Pärssinen O, Era P, Leskinen AL. Some physiological and psychological characteristics of myopic and non-myopic men. Acta Ophthalmol 1985; 173: 85–87.
https://doi.org/10.1111/j.1755-3768.1985.tb06852.x
147. Mandel Y, Grotto I, El-Yaniv R, et al. Season of birth, natural light, and myopia. Ophthalmology 2008; 115: 686–692.
https://doi.org/10.1016/j.ophtha.2007.05.040
148. McMahon G, Zayats T, Chen YP, et al. Season of birth, daylight hours at birth, and high myopia. Ophthalmology 2009; 116: 468–473.
https://doi.org/10.1016/j.ophtha.2008.10.004
149. Guggenheim JA, McMahon G, Northstone K, et al. Birth order and myopia. Ophthalmic Epidemiol 2013; 20: 375–384.
https://doi.org/10.3109/09286586.2013.848457
150. Guggenheim JA, Williams C. and UK Biobank Eye and Vision Consortium. Role of educational exposure in the association between myopia and birth order. JAMA Ophthalmol 2015; 133: 1408–1414.
https://doi.org/10.1001/jamaophthalmol.2015.3556
151. Booth A, Kee HJ. Birth order matters: the effect of family size and birth order on educational attainment. J Population Econ 2008; 22: 367–397.
https://doi.org/10.1007/s00148-007-0181-4
152. Garcia-Valenzuela E, Kaufman LM. High myopia associated with retinopathy of prematurity is primarily lenticular. J AAPOS 2005 Apr; 9(2): 121–8.
https://doi.org/10.1016/j.jaapos.2004.12.018
153. Németh J. Szemészeti ultrahang diagnosztika és biometria. Nyctalus Orvosi Kiadó; 1996.
154. Mirshahi A, Ponto KA, Laubert-Reh D, et al. Myopia and cognitive performance: results from the Gutenberg Health Study. Invest Ophthalmol Vis Sci 2016; 57: 5230–5236.
https://doi.org/10.1167/iovs.16-19507
155. Saw SM, Tan SB, Fung D, et al. IQ and the association with myopia in children. Invest Ophthalmol Vis Sci. 2004; 45: 2943–48.
https://doi.org/10.1167/iovs.03-1296
156. Karlsson JL. Influence of the myopia gene on brain development. Clin Genet 1975; 8: 314–318.
https://doi.org/10.1111/j.1399-0004.1975.tb01508.x
157. Polderman TJ, Benyamin B, de Leeuw CA, et al. Meta-analysis of the heritability of human traits based on fifty years of twin studies. Nat Genet 2015; 47: 702–709.
https://doi.org/https: //doi.org/10.1038/ng.3285
158. Sauce B, Matzel LD. The paradox of intelligence: heritability and malleability coexist in hidden gene-environment interplay. Psychol Bull 2018; 144: 26–47.
https://doi.org/10.1037/bul0000131
159. Shayer M, Ginsburg D. Thirty years on–a large anti-Flynn effect? (II): 13- and 14-year-olds. Piagetian tests of formal operations norms 1976-2006/7. Br J Educ Psychol 2009; 79: 409–418.
https://doi.org/10.1348/978185408X383123
160. Shayer M, Ginsburg D, Coe R. Thirty years on - a large anti-Flynn effect? The Piagetian test Volume & Heaviness norms 1975–2003. Br J Educ Psychol. 2007; 77: 25–41.
https://doi.org/10.1348/000709906X96987
161. Saw SM, Cheng A, Fong A, Gazzard G, Tan DT, Morgan I. School grades and myopia. Ophthalmic Physiol Opt 2007; 27: 126–129.
https://doi.org/10.1111/j.1475-1313.2006.00455.x
162. Gwiazda J, Grice K, Thorn F. Response AC/A ratios are elevated in myopic children. Ophthalmic Physiol Opt 1999; 19: 173–179.
https://doi.org/10.1046/j.1475-1313.1999.00437.x
163. Mutti DO, Jones LA, Moeschberger ML, et al. AC/A ratio, age, and refractive error in children. Invest Ophthalmol Vis Sci 2000; 41: 2469–2478. PMID: 10937556.
164. Mutti DO, Mitchell GL, Jones-Jordan LA, et al. The response AC/A ratio before and after the onset of myopia. Invest Ophthalmol Vis Sci 2017; 58: 1594–1602.
https://doi.org/10.1167/iovs.16-19093
165. Mutti DO, Mitchell L, Hayes JR, et al. Accommodation lag before and after the onset of myopia. Invest Ophthtlmol Vis Sci 2006; 47: 837–846.
https://doi.org/https: //doi.org/10.1167/iovs.05-0888
166. Gwiazda J, Thorn F, Held R. Accommodation, accommodative convergence, and response AC/A ratios before and at the onset of myopia in children. Optom Vis Sci 2005; 82: 273–278.
https://doi.org/10.1097/01.opx.0000159363.07082.7d
167. Rosenfield M, Desai R, Portello JK. Do progressing myopes show reduced accommodative responses? Optom Vis Sci 2002; 79: 268–273.
https://doi.org/10.1097/00006324-200204000-00014
168. Berntsen DA, Sinnott LT, Mutti DO, et al. A randomized trial using progressive addition lenses to evaluate theories of myopia progression in children with a high lag of accommodation. Invest Ophthalmol Vis Sci 2012; 53: 640–649.
https://doi.org/10.1167/iovs.11-7769
169. Berntsen DA, Sinnott LT, Mutti DO, et al. Accommodative lag and juvenile-onset myopia progression in children wearing refractive correction. Vision Res 2011; 51: 1039–1046.
https://doi.org/10.1016/j.visres.2011.02.016
170. Logan NS, Radhakrishnan H, Cruickshank FE, et al. IMI Accommodation and binocular vision in myopia development and progression. Invest Ophthalmol Vis Sci 2021; 62(5): 4.
https://doi.org/https: //doi.org/10.1167/iovs.62.5.4
171. Tideman JWL, Snabel MCC, Tedja MS, et al. Association of Axial Length With Risk of Uncorrectable Visual Impairment for Europeans With Myopia. JAMA Ophthalmol 2016 Dec 1; 134(12): 1355–1363.
https://doi.org/10.1001/jamaophthalmol.2016.4009
172. Bullimore MA. Brennan NA. Myopia Control: Why Each Diopter Matters. Optom Vis Sci. 2019 Jun; 96(6): 463–465.
https://doi.org/10.1097/OPX.0000000000001367
173. Haarman AEG, Enthoven CA, Tideman JWL, et al. The Complications of Myopia: A Review and Meta-Analysis. Invest Ophthalmol Vis Sci 2020 Apr 9; 61(4): 49.
https://doi.org/10.1167/iovs.61.4.49
174. Tideman JWL, Polling JR, Vingerling JR, et al. Axial in length growth and the risk of developing myopia European children. Acta Ophthalmol 2018; 96: 301–303.
https://doi.org/10.1111/aos.13603
175. Klaver C, Polling JR. and Erasmus Myopia Research Group. Myopia management in the Netherlands. Ophthalmic Physiol Opt 2020; 40: 230–240.
https://doi.org/10.1111/opo.12676
176. McCullough S, Adamson G, Breslin KMM, et al. Axial growth and refractive change in white European children and young adults: predictive factors for myopia. Sci Rep 2020; 10: 15189.
https://doi.org/10.1038/s41598-020-72240-y
177. Lanca C, Pang CP, Grzybowski A. Effectiveness of myopia control interventions: A systematic review of 12 randomized control trials published between 2019 and 2021. Front Public Health 2023 Mar 23; 11: 1125000.
https://doi.org/10.3389/fpubh.2023.1125000
178. Cao K, Wan Y, Yusufu M, Wang N. Significance of outdoor time for myopia prevention: a systematic review and meta-analysis based on randomized controlled trials. Ophthalmic Res 2020; 63: 97–105.
https://doi.org/10.1159/000501937
179. Wu PC, Chen CT, Lin KK, et al. Myopia prevention and outdoor light intensity in a school-based cluster randomized trial. Ophthalmology 2018; 125: 1239–1250.
https://doi.org/10.1016/j.ophtha.2017.12.011
180. Jones LA, Sinnott LT, Mutti DO, et al. Parental history of myopia, sports and outdoor activities, and future myopia. Invest Ophthalmol Vis Sci 2007; 48: 3524–3532.
https://doi.org/10.1167/iovs.06-1118
181. Jones-Jordan LA, Sinnott LT, Cotter SA, et al. Time outdoors, visual activity, and myopia progression in juvenile-onset myopes. Invest Ophthalmol Vis Sci 2012; 53: 7169–7175.
https://doi.org/10.1167/iovs.11-8336
182. Wu PC, Tsai CL, Wu HL, et al. Outdoor activity during class recess reduces myopia onset and progression in school children. Ophthalmology 2013; 120: 1080–1085.
https://doi.org/10.1016/j.ophtha.2012.11.009
183. He M, Xiang F, Zeng Y, et al. Effect of time spent outdoors at school on the development of myopia among children in China: a randomized clinical trial. JAMA Ophthalmol 2015; 314: 1142–1148.
https://doi.org/10.1001/jama.2015.10803
184. Jin JX, Hua WJ, Jiang X, et al. Effect of outdoor activity on myopia onset and progression in school-aged children in northeast china: The Sujiatun Eye Care Study. BMC Ophthalmol 2015; 15: 73.
https://doi.org/10.1186/s12886-015-0052-9
185. Sherwin JC, Reacher MH, Keogh RH, et al. The association between time spent outdoors and myopia in children and adolescents: a systematic review and meta-analysis. Ophthalmology 2012; 119: 2141–2151.
https://doi.org/10.1016/j.ophtha.2012.04.020
186. Jacobsen N, Jensen H, Goldschmidt E. Does the level of physical activity in university students influence development and progression of myopia? A 2-year prospective cohort study. Invest Ophthalmol Vis Sci 2008; 49: 1322–1327.
https://doi.org/10.1167/iovs.07-1144
187. Feldkaemper M, Schaeffel F. An updated view on the role of dopamine in myopia. Exp Eye Res 2013; 114: 106–119.
https://doi.org/10.1016/j.exer.2013.02.007
188. Prepas SB. Light, literacy and the absence of ultraviolet radiation in the development of myopia. Med Hypotheses 2008; 70: 635–637.
https://doi.org/10.1016/j.mehy.2007.07.023
189. French AN, Ashby RS, Morgan IG, et al. Time outdoors and the prevention of myopia. Exp Eye Res 2013; 114: 58–68.
https://doi.org/10.1016/j.exer.2013.04.018
190. Donovan L, Sankaridurg P, Ho A, et al. Myopia progression in Chinese children is slower in summer than in winter. Optom Vis Sci 2012; 89: 1196–1202.
https://doi.org/10.1097/OPX.0b013e3182640996
191. Gwiazda JE, Deng L, Manny RE, et al. Seasonal variations in the progression of myopia in children enrolled in the correction of myopia evaluation trial. Invest Ophthalmol Vis Sci 2014; 55: 752–758.
https://doi.org/10.1167/iovs.13-13029
192. Tideman JWL, Polling JR, Voortman T, et al. Low serum vitamin D is associated with axial length and risk of myopia in young children. Eur J Epidemiol 2016; 31: 491–499.
https://doi.org/10.1007/s10654-016-0128-8
193. Mutti DO, Marks AR. Blood levels of vitamin D in teens and young adults with myopia. Optom Vis Sci 2011; 88: 377–382.
https://doi.org/10.1097/OPX.0b013e31820b0385
194. Yazar S, Hewitt AW, Black LJ, et al. Myopia is associated with lower vitamin D status in young adults. Invest Ophthalmol Vis Sci 2014; 55: 4552–4559.
https://doi.org/10.1167/iovs.14-14589
195. Kwon JW, Choi JA, La TY. Serum 25-hydroxyvitamin D level is associated with myopia in the Korea national health and nutrition examination survey .Medicine 2016; 95: e5012.
https://doi.org/10.1097/MD.0000000000005012
196. Guggenheim JA, Williams C, Northstone K, et al. Does vitamin D mediate the protective effects of time outdoors on myopia? Findings from a prospective birth cohort. Invest Ophthalmol Vis Sci 2015; 55: 8550–8558.
https://doi.org/10.1167/iovs.14-15839
197. Wen L, Cao Y, Cheng Q, et al. Objectively measured near work, outdoor exposure and myopia in children. Br J Ophthalmol 2020; 104: 1542–1547.
https://doi.org/10.1136/bjophthalmol-2019-315258
198. Zhou Z, Chen T, Wang M, et al. Pilot study of a novel classroom designed to prevent myopia by increasing children’s exposure to outdoor light. PLoS One 2017; 12: e0181772.
https://doi.org/10.1371/journal.pone.0181772
199. Pan CW, Wu RK, Liu H, et al. Types of lamp for homework and myopia among Chinese school-aged children. Ophthal Epidemiol 2018; 25: 250–256.
https://doi.org/10.1080/09286586.2017.1420204
200. Behar-Cohen F, Martinsons C, Viénot F, et al. Light-emitting diodes (LED) for domestic lighting: any risks for the eye? Prog Retin Eye Res 2011; 30: 239–257.
https://doi.org/10.1016/j.preteyeres.2011.04.002
201. Baeza Moyano D and González-Lezcano RA. Pandemic of Childhood Myopia. Could New Indoor LED Lighting Be Part of the Solution? Energies 2021; 14(13): 3827.
https://doi.org/10.3390/en14133827
202. Jonas JB, Ang M, Cho P, et al. IMI prevention of myopia and its progression. Invest Ophthalmol Vis Sci. 2021; 62(5): 6).
https://doi.org/10.1167/iovs.62.5.6
203.
https: //www.wspos.org/swdcore/uploads/WSPOS-Myopia-Consensus-Statement-2023-1.pdf.
204.
https: //www.who.int/news-room/fact-sheets/detail/physical-activity
205. Ip JM, Saw SM and Rose KA. Role of near work in myopia: findings in a sample of Australian school children. Invest Ophthal Vis Sci 2008 Jul; 49(7): 2903–10.
https://doi.org/10.1167/iovs.07-0804
206. Li SM, Li SY, Kang MT, et al. Near work related parameters and myopia in Chinese children: the Anyang Childhood Eye Study. PLoS One 2015; 10: e0134514.
https://doi.org/10.1371/journal.pone.0134514
207. Pucker AD and Gawne TJ. Fighting Myopia with Intermittent Nearwork Breaks: 20 Seconds Every 20 Minutes Might Not Be Enough Time. Optom Vis Sci 2023 Jan 1; 100(1): 31–32.
https://doi.org/10.1097/OPX.0000000000001965
208. Kozeis N. Impact of computer use on children’s vision. Hippokratia 2009; 13: 230–231. PMCID: PMC2776336
209. Charman WN. Myopia, posture and the visual environment. Ophthalmic Physiol Opt 2011; 31: 494–501.
https://doi.org/10.1111/j.1475-1313.2011.00825.x
210. Guo L, Yang J, Mai J, et al. Prevalence and associated factors of myopia among primary and middle school-aged students: a school-based study in Guangzhou. Eye 2016; 30: 796–804.
https://doi.org/10.1038/eye.2016.39
211. https: //www.who.int/publications/i/item/9789240042377.
212. Kim SH, Suh YW, Choi YM, Han JY, Nam GT, You EJ, Cho YA. Effect of watching 3-dimensional television on refractive error in children. Korean J Ophthalmol 2015 Feb; 29(1): 53–7.
https://doi.org/10.3341/kjo.2015.29.1.53
213. Hale L et Guan S. Screen time and sleep among school-aged children and adolescents: a systematic literature review. Sleep Med Rev 2015 Jun; 21: 50.
https://doi.org/10.1016/j.smrv.2014.07.007
214. Walline JJ, Lindsley KB, Vedula SS, et al. Interventions to slow progression of myopia in children. Cochrane Database of Syst Rev 2020; 1: CD004916.
https://doi.org/10.1002/14651858.CD004916.pub4
215. Logan NS, Wolffsohn JS. Role of un-correction, under-correction and over-correction of myopia as a strategy for slowing myopic progression. Clin Exp Optom 2020; 103: 133–137.
https://doi.org/10.1111/cxo.12978
216. Wildsoet CF, Chia A, Cho P, et al. IMI-interventions for controlling myopia onset and progression report. Invest Ophthtlmol Vis Sci 2019; 60: M106–M131.
https://doi.org/10.1167/iovs.18-25958
217. Tang WC, Leung M, Wong ACK, et al. Optical interventions for myopia control. In: Ang M, Wong TY. (eds.) Updates on myopia. A clinical perspective. 1st ed. Singapore: Springer; 2020. pp. 289–305.
https://doi.org/10.1007/978-981-13-8491-2_15.
218. Walline JJ, Lindsley K, Vedula SS, et al. Interventions to slow progression of myopia in children. Cochrane Database Syst Rev 2011; 12: CD004916.
https://doi.org/10.1002/14651858.CD004916.pub3
219. Hasebe S, Jun J, Varnas SR. Myopia control with positively aspherized progressive addition lenses: a 2-year, multicenter, randomized, controlled trial. Invest Ophthalmol Vis Sci 2014; 55: 7177–7188.
https://doi.org/10.1167/iovs.12-11462
220. Gwiazda JE, Hyman L, Everett D, et al. Five–year results from the correction of myopia evaluation trial (COMET). Invest Ophthalmol Vis Sci 2006; 47: 1166.
221. Hasebe S, Ohtsuki H, Nonaka T, et al. Effect of progressive addition lenses on myopia progression in Japanese children: a prospective, randomized, double-masked, crossover trial. Invest Ophthalmol Vis Sci 2008; 49: 2781–2789.
https://doi.org/10.1167/iovs.07-0385
222. Jensen H. Myopia progression in young school children. A prospective study of myopia progression and the effect of a trial with bifocal lenses and beta blocker eye drops. Acta Ophthalmol Suppl 1991; 200: 1–79.
https://doi.org/10.1167/iovs.07-0385
223. Pärssinen O, Hemminki E, Klemetti A. Effect of spectacle use and accommodation on myopic progression: final results of three-year randomised clinical trial among schoolchildren. Br Med J 1989; 73: 547–551.
https://doi.org/10.1136/bjo.73.7.547
224. Lam CSY, Tang WC, Tse DY, et al. Defocus incorporated multiple segments (DIMS) spectacle lenses slow myopia progression: a 2-year randomised clinical trial. Br J Ophthalmol 2020; 104: 363–368.
https://doi.org/10.1136/bjophthalmol-2018-313739
225. Zhang H Lam CSY, Tang WC, et al. Myopia Control Effect Is Influenced by Baseline Relative Peripheral Refraction in Children Wearing Defocus Incorporated Multiple Segments (DIMS) Spectacle Lenses. J Clin Med 2022 Apr 20; 11(9): 2294.
https://doi.org/10.3390/jcm11092294
226. Carlà MM, Boselli F, Giannuzzi F, et al. Overview on Defocus Incorporated Multiple Segments Lenses: A Novel Perspective in Myopia Progression Management. Vision (Basel). 2022 Apr 2; 6(2): 20.
https://doi.org/10.3390/vision6020020
227. Lu Y, Lin Z, Wen L, et al. The Adaptation and Acceptance of Defocus Incorporated Multiple Segment Lens for Chinese Children. Am J Ophthalmol 2020; 211: 207–216.
https://doi.org/10.1016/j.ajo.2019.12.002
228. Lam CS, Tang WC, Lee PH, et al. Myopia control effect of defocus incorporated multiple segments (DIMS) spectacle lens in Chinese children: results of a 3-year follow-up study. Br J Ophthalmol 2022 Aug; 106(8): 1110–1114.
https://doi.org/10.1136/bjophthalmol-2020-317664
229. Horváth H, Knézy K, Szigeti A, et al. Myopiaprogresszió lassítása DIMS-technológiájú szemüveglencsével. Szemészet 2023; 160(2): 58–65.
https://doi.org/10.55342/szemhungarica.2023.160.2.58
230. Bao J, Huang Y, Li X, et al. Spectacle Lenses With Aspherical Lenslets for Myopia Control vs Single-Vision Spectacle Lenses: A Randomized Clinical Trial. JAMA Ophthalmol 2022; 140(5): 472–478.
https://doi.org/10.1001/jamaophthalmol.2022.0401
231. Rappon J, Chung C, Young G, et al. Control of myopia using diffusion optics spectacle lenses: 12-month results of a randomised controlled, efficacy and safety study (CYPRESS). Br J Ophthalmol 2022 Sep 1: bjophthalmol-2021-321005.
https://doi.org/10.1136/bjo-2021-321005
232. Walline JJ, Jones LA, Sinnott L, et al. A randomized trial of the effect of soft contact lenses on myopia progression in children. Invest Ophthalmol Vis Sci 2008; 49: 4702–4706.
https://doi.org/10.1167/iovs.08-2067
233. Marsh-Tootle WL, Dong LM, Hyman L, et al. Myopia progression in children wearing spectacles vs. switching to contact lenses. Optom Vis Sci 2009; 86: 741–747.
https://doi.org/10.1097/OPX.0b013e3181a6a250
234. Perrigin J, Perrigin D, Quintero S, et al. Silicone-acrylate contact lenses for myopia control: 3-year results. Optom Vis Sci1990; 67: 764–769.
https://doi.org/10.1097/00006324-199010000-00003
235. Stone J. The possible influence of contact lenses on myopia. Br J Physiol Opt 1976; 31: 89–114. PMID: 1052437
236. Katz J, Schein OD, Levy B, et al. A randomized trial of rigid gas permeable contact lenses to reduce progression of children’s myopia. Am J Ophthalmol 2003; 136: 82–90.
https://doi.org/10.1016/s0002-9394(03)00106-
237. Walline JJ, Jones LA, Mutti DO, et al. A randomized trial of the effects of rigid contact lenses on myopia progression. Arch Ophthalmol 2004; 122: 1760–1766.
https://doi.org/10.1001/archopht.122.12.1760
238. Walline JJ. Myopia control: a review. Eye Contact Lens 2016; 42: 3–8.
https://doi.org/10.1097/ICL.0000000000000207
239. Anstice NS, Phillips JR. Effect of dual-focus soft contact lens wear on axial myopia progression in children. Ophthalmology 2011; 118: 1152–1161.
https://doi.org/10.1016/j.ophtha.2010.10.035
240. Paune J, Morales H, Armengol J, et al. Myopia control with a novel peripheral gradient soft lens and orthokeratology: a 2-year clinical trial. Biomed Res Int 2015; 2015: 507572.
https://doi.org/10.1155/2015/507572
241. Li SM, Kang MT, Wu SS, et al. Studies using concentric ring bifocal and peripheral add multifocal contact lenses to slow myopia progression in school-aged children: a meta-analysis. Ophthalmic Physiol Opt 2017; 37: 51–59.
https://doi.org/10.1111/opo.12332
242. Ruiz-Pomeda A, Perez-Sanchez B, Valls I, et al. MiSight Assessment Study Spain (MASS). A 2-year randomized clinical trial. Graefes Arch Clin Exp Ophthalmol 2018; 256: 1011–1021.
https://doi.org/10.1007/s00417-018-3906-z
243. Chamberlain P, Peixoto-de-Matos SC, Logan NS, et al. A 3-year randomized clinical trial of MiSight lenses for myopia control. Optom Vis Sci 2019; 96: 556–567.
https://doi.org/10.1097/OPX.0000000000001410
244. Chamberlain P, Bradley A, Arumugam B, et al. Long-term Effect of Dual-focus Contact Lenses on Myopia Progression in Children: A 6-year Multicenter Clinical Trial Optom Vis Sci 2022 Mar 1; 99(3): 204–212.
https://doi.org/10.1097/OPX.0000000000001873
245. Lam CSY, Tang WC, Tse DY-Y, et al. Defocus incorporated soft contact (DISC) lens slows myopia progression in Hong Kong Chinese schoolchildren: a 2-year randomised clinical trial. Br J Ophthalmol 2014; 98: 40–45.
https://doi.org/10.1136/bjophthalmol-2013-303914
246. Walline JJ, Walker MK, Mutti DO, et al. Effect of high add power, medium add power, or single-vision contact lenses on myopia progression in children: The BLINK Randomized Clinical Trial. JAM 2020; 324: 571–580.
https://doi.org/10.1001/jama.2020.10834
247. Shen EP, Chu HS, Cheng HC, Tsai TH. Center-for-near extended-depth-of-focus soft contact lens for myopia control in children: 1-year results of a randomized controlled trial. Ophthalmol Ther 2022; 11: 1577–1588.
https://doi.org/10.1007/s40123-022-00536-5
248. Weng R, Lan W, Bakaraju R, et al. Efficacy of contact lenses for myopia control: Insights from a randomised, contralateral study design. Ophthalmic Physiol Opt 2022; 42: 1253–1263.
https://doi.org/10.1111/opo.13042
249. Cho P, Cheung SW. Retardation of myopia in Orthokeratology (ROMIO) study: a 2-year randomized clinical trial. Invest Ophthalmol Vis Sci 2012; 53: 7077–7085.
https://doi.org/10.1167/iovs.12-10565
250. Walline JJ, Holden BA, Bullimore MA, et al. The current state of corneal reshaping. Eye Contact Lens 2005; 31: 209–214.
https://doi.org/10.1097/01.icl.0000179709.76832.4f
251. Nichols JJ, Marsich MM, Nguyen M, Barr JT, Bullimore MA. Overnight orthokeratology. Optom Vis Sci 2000; 77: 252–259.
https://doi.org/10.1016/j.clae.2020.03.018
252. Vincent, S.J. et al. CLEAR–Orthokeratology. Cont Lens Anterior Eye 2021; 44(2): 240–69.
https://doi.org/10.1016/j.clae.2021.02.003
253. Cho P, Cheung SW, Edwards M. The longitudinal orthokeratology research in children (LORIC) in Hong Kong: a pilot study on refractive changes and myopic control. Curr Eye Res 2005; 30: 71–80.
https://doi.org/10.1080/02713680590907256
254. Walline JJ, Jones LA, Sinnott LT. Corneal reshaping and myopia progression. Br J Ophthalmol 2009; 93: 1181–1185.
https://doi.org/10.1136/bjo.2008.151365
255. Kakita T, Hiraoka T, Oshika T. Influence of overnight orthokeratology on axial elongation in childhood myopia. Invest Ophthalmol Vis Sci 2011; 52: 2170–2174.
https://doi.org/10.1167/iovs.10-5485
256. Hiraoka T, Kakita T, Okamoto F, et al. Longterm effect of overnight orthokeratology on axial length elongation in childhood myopia: a 5-year follow-up study. Invest Ophthalmol Vis Sci 2012; 53: 3913–3919.
https://doi.org/10.1167/iovs.11-8453
257. Santodomingo-Rubido J, Villa-Collar C, Gilmartin B, et al. Myopia control with orthokeratology contact lenses in Spain: refractive and biometric changes. Invest Ophthalmol Vis Sci 2012; 53: 5060–5065.
https://doi.org/10.1167/iovs.11-8005
258. Charm J, Cho P. High myopia-partial reduction ortho-k: a 2-year randomized study. Optom Vis Sci 2013; 90: 530–539.
https://doi.org/10.1097/OPX.0b013e318293657d
259. Chen C, Cheung SW, Cho P.Myopia control using toric orthokeratology (TO-SEE study). Invest Ophthalmol Vis Sci2013; 54: 6510–6517.
https://doi.org/10.1167/iovs.13-12527
260. Zhu MJ, Feng HY, He XG, et al. The control effect of orthokeratology on axial length elongation in Chinese children with myopia. BMC Ophthalmol 2014; 14: 141.
https://doi.org/10.1186/1471-2415-14-141
261. Smith EL, III. Prentice award lecture 2010: a case for peripheral optical treatment strategies for myopia. Optom Vis Sci 2011; 88: 1029–1044.
https://doi.org/10.1097/OPX.0b013e3182279cfa
262. Hiraoka T, Kakita T, Okamoto F, et al. Influence of ocular wavefront aberrations on axial length elongation in myopic children treated with overnight orthokeratology. Ophthalmology 2015; 122: 93–100.
https://doi.org/10.1016/j.ophtha.2014.07.042
263. Tarrant J. Spherical aberration, accommodation and myopia. PhD Thesis, University of California, Berkeley, CA, 2010.
https: //escholarship.org/content/qt1g0559kd/qt1g0559kd.pdf?t=mtfrak
264. Chen Z, Xue F, Zhou J, et al. Effects of orthokeratology on choroidal thickness and axial length. Optom Vis Sci 2016; 93: 1064–1071.
https://doi.org/10.1097/OPX.0000000000000894
265. Long W, Li Z, Hu Y, Cui D, Zhai Z, Yang X. Pattern of axial length growth in children myopic anisometropes with orthokeratology treatment. Curr Eye Res. 2020; 45: 834–838.
https://doi.org/10.1080/02713683.2019.1701685
266. Lu W, Jin W. Clinical observations of the effect of orthokeratology in children with myopic anisometropia. Cont Lens Anterior Eye 2020; 43: 222–225.
https://doi.org/10.1016/j.clae.2020.03.002
267. Zhang Y, Sun X, Chen Y. Controlling anisomyopia in children by orthokeratology: A one-year randomised clinical trial. Cont Lens Anterior Eye 2021; 46: 101537.
https://doi.org/10.1016/j.clae.2021.101537
268. Ji N, Niu Y, Qin J, Fu AC, Cui C. Orthokeratology lenses versus administration of 0.01% atropine eye drops for axial length elongation in children with myopic anisometropia. Eye Contact Lens 2022; 48: 45–50.
https://doi.org/10.1097/ICL.0000000000000848
269. Zhang KY, Lyu HB, Yang JR, Qiu WQ. Efficacy of long-term orthokeratology treatment in children with anisometropic myopia. Int J Ophthalmol 2022; 15: 113–118.
https://doi.org/10.18240/ijo.2022.01.17
270. Benavente-Perez A, Nour A and Troilo D. Axial eye growth and refractive error development can be modified by exposing the peripheral retina to relative myopic or hyperopic defocus. Invest Ophthalmol Vis Sci 2014; 55: 6765–6773.
https://doi.org/10.1167/iovs.14-14524
271. Wan K, Lau JK, Cheung SW, et al. Orthokeratology with increased compression factor (OKIC): study design and preliminary results BMJ Open Ophthalmology 2020; 5: e000345.
https://doi.org/10.1136/bmjophth-2019-000345
272. Hu Y, Wen C, Li Z, Zhao W, Ding X, Yang X. Areal summed corneal power shift is an important determinant for axial length elongation in myopic children treated with overnight orthokeratology. Br J Ophthalmol 2019; 103(11): 1571–1575.
https://doi.org/10.1136/bjophthalmol-2018-312933
273. Zhong Y, Chen Z, Xue F, et al. Central and Peripheral Corneal Power Change in Myopic Orthokeratology and Its Relationship With 2-Year Axial Length Change. Invest Ophthalmol Vis Sci. 2015 Jul; 56(8): 4514–9.
https://doi.org/10.1167/iovs.14-13935
274. Lin W, Li N, Gu T, et al. The treatment zone size and its decentration influence axial elongation in children with orthokeratology treatment. BMC Ophthalmol 2021 Oct 12; 21(1): 362.
https://doi.org/10.1186/s12886-021-02123-x
275. Yang X, Li Z, Zeng J. A Review of the Potential Factors Influencing Myopia Progression in Children Using Orthokeratology. Asia Pac J Ophthalmol (Phila) 2016 Nov/Dec; 5(6): 429–433.
https://doi.org/10.1097/APO.0000000000000242
276. Zhang Z, Zhou J, Zeng L, Xue F, Zhou X, Chen Z. The effect of corneal power distribution on axial elongation in children using three different orthokeratology lens designs. Cont Lens Anterior Eye 2023 Feb; 46(1): 101749.
https://doi.org/10.1016/j.clae.2022.101749
277. Faria-Ribeiro M, Navarro R, González-Méijome JM. Effect of pupil size on wavefront refraction during orthokeratology. Optom Vis Sci 2016; 93: 1399–1408.
https://doi.org/10.1097/OPX.0000000000000989
278. Guo B, Cheung SW, Kojima R, Cho P. One-year results of the Variation of Orthokeratology Lens Treatment Zone (VOLTZ) Study: a prospective randomised clinical trial. Ophthalmic Physiol Opt 2021 Jul; 41(4): 702–714.
https://doi.org/10.1111/opo.12834
279. Pauné J, Fonts S, Rodríguez L, et al. The Role of Back Optic Zone Diameter in Myopia Control with Orthokeratology Lenses. J Clin Med 2021; Jan18; 10(2): 336.
https://doi.org/10.3390/jcm10020336
280. Zhang Z, Chen Z, Zhou J, Pauné J, Xue F, Zeng L, Qu X, Zhou X. The Effect of Lens Design on Corneal Power Distribution in Orthokeratology. Optom Vis Sci 2022 Apr 1; 99(4): 363–371.
https://doi.org/10.1097/OPX.0000000000001888
281. Cho P, Cheung SW. Discontinuation of orthokeratology on eyeball elongation (DOEE). Cont Lens Anterior Eye 2017; 40: 82–87.
https://doi.org/10.1016/j.clae.2016.12.002
282. Lee TT, Cho P. Discontinuation of orthokeratology and myopic progression. Optom Vis Sci 2010; 87: 1053–1056.
https://doi.org/10.1097/OPX.0b013e3181fd5efc
283. Santodomingo-Rubido J, Villa-Collar C, Gilmartin B, et al. Long-term efficacy of orthokeratology contact lens wear in controlling the progression of childhood myopia. Curr Eye Res 2017; 42: 713–720.
https://doi.org/10.1080/02713683.2016.1221979
284. Liu YM, Xie P. The safety of orthokeratology-a systematic review. Eye Contact Lens 2016; 42: 35–42.
https://doi.org/10.1097/ICL.0000000000000219
285. Lipson MJ, Brooks MM, Koffler BH.The role of orthokeratology in myopia control: a review. Eye Contact Lens 2018; 44: 224–230.
https://doi.org/10.1097/ICL.0000000000000520
286. Lawrenson JG, Shah R, Huntjens B, et al. Interventions for myopia control in children: a living systematic review and network meta-analysis. Cochrane Database of Systematic Reviews 2023, Issue 2. Art. No.: CD014758.
https://doi.org/10.1002/14651858.CD014758.pub2
287. Chung K, Mohidin N, O’Leary DJ.Undercorrection of myopia enhances rather than inhibits myopia progression. Vision Res 2002; 42: 2555–2559.
https://doi.org/10.1016/s0042-6989(02)00258-4
288. Adler D, Millodot M. The possible effect of undercorrection on myopic progression in children. Clin Exp Optom 2006; 89: 315–321.
https://doi.org/10.1111/j.1444-0938.2006.00055.x
289. Li SY, Li SM, Zhou YH, et al. Effect of undercorrection on myopia progression in 12-year-old children. Graefes Arch Clin Exp Ophthalmol 2015; 253: 1363–1368.
https://doi.org/10.1007/s00417-015-3053-8
290. Zhao HL, Jiang J, Yu J, Xu HM. Role of short-wavelength filtering lenses in delaying myopia progression and amelioration of asthenopia in juveniles. Int J Ophthalmol 2017 Aug 18; 10(8): 1261–1267.
https://doi.org/10.18240/ijo.2017.08.13
291. Gifford KL. Childhood and lifetime risk comparison of myopia control with contact lenses. Contact Lens Ant Eye 2020 Feb; 43(1): 26–32.
https://doi.org/10.1016/j.clae.2019.11.007
292. Stapleton F, Keay L, Edwards K, et al. The incidence of contact lens-related microbial keratitis in Australia. Ophthalmology 2008; 115: 1655–1662.
https://doi.org/10.1016/j.ophtha.2008.04.002
293. Chen Z, Niu L, Xue F, Qu X, Zhou Z, Zhou X, Chu R. Impact of pupil diameter on axial growth in orthokeratology. Optom Vis Sci 2012 Nov; 89(11): 1636–40.
https://doi.org/10.1097/OPX.0b013e31826c1831
294. Gwiazda J, Grice K, Held R, et al. Astigmatism and the development of myopia in children. Vision Research Vol: 40 Issue: 8 April 2000, Pages 1019–1026.
https://doi.org/10.1016/s0042-6989(99)00237-0
295. Cristaldi M, Olivieri M, Pezzino S, et al. Atropine differentially modulates ECM production by ocular fibroblasts, and its ocular surface toxicity is blunted by colostrum. Biomedicines 2020; 8: 78.
https://doi.org/10.3390/biomedicines8040078
296. Schwahn HN, Kaymak H, Schaeffel F. Effects of atropine on refractive development, dopamine release, and slow retinal potentials in the chick. Vis Neurosci 2000; 17: 165–176.
https://doi.org/10.1017/s0952523800171184
297. Cavallotti C, Pescosolido N, Artico M, et al. Localization of dopamine receptors in the rabbit cornea. Cornea 1999; 18: 721–728.
https://doi.org/10.1097/00003226-199911000-00016
298. Grüb M, Mielke J, Rohrbach M, et al. Dopamine receptors of the corneal epithelium and endothelium in German. Klin Monbl Augenheilkd 2012; 229: 822–825.
https://doi.org/10.1055/s-0031-1299240
299. Gong Q, Janowski M, Liu L. Low-dose atropine for myopia control: considering all the data. comment and response. In reply. JAMA Ophthalmol 2018; 136: 303–304.
https://doi.org/10.1001/jamaophthalmol.2017.6641
300. Chua WH, Balakrishnan V, Chan YH, et al. Atropine for the treatment of childhood myopia. Ophthalmology 2006; 113: 2285–2291.
https://doi.org/10.1016/j.ophtha.2006.05.062
301. Chia A, Chua WH, Cheung YB, et al. Atropine for the treatment of childhood myopia: safety and efficacy of 0.5%, 0.1%, and 0.0 1% doses (atropine for the treatment of myopia 2). Ophthalmology 2012; 119: 347–354.
https://doi.org/10.1016/j.ophtha.2011.07.031
302. Yam JC, Jiang Y, Tang SM, et al. Low-concentration atropine for myopia progression (LAMP) study: a randomized, double-blinded, placebo-controlled trial of 0.05%, 0.025%, and 0.01% atropine eye drops in myopia control. Ophthalmology 2019 Jan; 126(1): 113-124.
https://doi.org/10.1016/j.ophtha.2018.05.029
303. Huang J, Wen D, Wang Q, et al. Efficacy comparison of 16 interventions for myopia control in children: a network meta-analysis. Ophthalmology 2016; 123: 697–708.
https://doi.org/10.1016/j.ophtha.2015.11.010
304. Chua WH, Balakrishnan V, Chan YH, et al. Atropine for the treatment of childhood myopia. Ophthalmology 2006; 113: 2285–2291.
https://doi.org/10.1016/j.ophtha.2006.05.062
305. Chia A, Chua WH, Cheung YB, et al. Atropine for the treatment of childhood myopia: safety and efficacy of 0.5%, 0.1%, and 0.01% doses (atropine for the treatment of myopia 2). Ophthalmology 2012; 119: 347–354.
https://doi.org/10.1016/j.ophtha.2011.07.031
306. Tong L, Huang XL, Koh AL, et al. Atropine for the treatment of childhood myopia: effect on myopia progression after cessation of atropine. Ophthalmology 2009; 116: 572–579.
https://doi.org/10.1016/j.ophtha.2008.10.020
307. Chia A, Chua WH, Wen L, et al. Atropine for the treatment of childhood myopia: changes after stopping atropine 0.01%, 0.1% and 0.5%. Am J Ophthalmol 2014; 157: 451–457.
https://doi.org/10.1016/j.ajo.2013.09.020
308. Chia A, Lu QS, Tan D. Five-year clinical trial on atropine for the treatment of myopia 2: myopia control with atropine 0.01% eyedrops. Ophthalmology 2016; 123: 391–399.
https://doi.org/10.1016/j.ophtha.2015.07.004
309. Bullimore MA, Berntsen DA. Low-dose atropine for myopia control: considering all the data. JAMA Ophthalmol 2018; 136: 303.
https://doi.org/10.1001/jamaophthalmol.2017.6638
310. Bullimore MA, Richdale K. Myopia control 2020: where are we and where are we heading? Ophthalmic Physiop Opt 2020; 40: 254–270.
https://doi.org/10.1111/opo.12686
311. Yam JC, Jiang Y, Tang SM, et al. Low-concentration atropine for myopia progression (LAMP) study: a randomized, double-blinded, placebo-controlled trial of 0.05%, 0.025%, and 0.01% atropine eye drops in myopia control. Ophthalmology 2019 Jan; 126(1): 113–124.
https://doi.org/10.1016/j.ophtha.2018.05.029
312. Li FF, Zhang Y, Zhang X, et al. Age Effect on Treatment Responses to 0.05%, 0.025%, and 0.01% Atropine: Low-Concentration Atropine for Myopia Progression Study. Ophthalmology 2021 Aug; 128(8): 1180–1187.
https://doi.org/10.1016/j.ophtha.2020.12.036
313. Yam JC, Li FF, Zhang X, et al. Two-year clinical trial of the low-concentration atropine for myopia progression (LAMP) study: phase 2 report. Ophthalmology 2020; 127: 910–919.
https://doi.org/10.1016/j.ophtha.2019.12.011
314. Ha A, Kim SJ, Shim SR, Kim YK, Jung JH. Efficacy and Safety of 8 Atropine Concentrations for Myopia Control in Children: A Network Meta-Analysis. Ophthalmology 2022 Mar; 129(3): 322–333.
https://doi.org/10.1016/j.ophtha.2021.10.016
315. Polling JR, Tan E, Driessen S, et al. A 3-year follow-up study of atropine treatment for progressive myopia in Europeans. Eye (Lond) 2020 Nov; 34(11): 2020–2028.
https://doi.org/10.1038/s41433-020-1122-7
316. Li FF, Zhang Y and Zhang X. Age Effect on Treatment Responses to 0.05%, 0.025%, and 0.01% Atropine: Low-Concentration Atropine for Myopia Progression Study, Ophthalmology August 2021; 28(8): 1180–1187.
https://doi.org/10.1016/j.ophtha.2020.12.036
317. Wu PC, Yang YH, Fang PC. The long-term results of using low-concentration atropine eye drops for controlling myopia progression in schoolchildren. J Ocul Pharmacol Ther 2011; 27: 461–466.
https://doi.org/10.1089/jop.2011.0027
318. Loh KL, Lu Q, Tan D, et al. Risk factors for progressive myopia in the atropine therapy for myopia study. Am J Ophthalmol 2015; 159: 945–949.
https://doi.org/10.1016/j.ajo.2015.01.029
319. Kao PH, Chuang LH, Lai CC, et al. Evaluation of axial length to identify the effects of monocular 0.125% atropine treatment for pediatric anisometropia. Sci Rep 2021; 11: 21511.
https://doi.org/10.1038/s41598-021-96414-4
320. Fang PC, Chung MY, Yu HJ, Wu PC. Prevention of myopia onset with 0.025% atropine in premyopic children. J Ocul Pharmacol Ther 2010; 26(4): 341–5.
https://doi.org/10.1089/jop.2009.0135
321. Shih YF, Chen CH, Chou AC, et al. Effects of different concentrations of atropine on controlling myopia in myopic children. J Ocul Pharmacol Ther 1999; 15: 85–90.
https://doi.org/10.1089/jop.1999.15.85
322. Gong Q, Janowski M, Luo M, et al. Efficacy and adverse effects of atropine in childhood myopia: a meta-analysis. JAMA Ophthalmol 2017; 135: 624–630.
https://doi.org/10.1001/jamaophthalmol.2017.1091
323. North R, Kelly ME. A review of the uses and adverse effects of topical administration of atropine. Ophthalmic Physiol Opt 1987; 7: 109–114.
https://doi.org/10.1111/j.1475-1313.1987.tb01004.x
324. Tan DT, Lam DS, Chua WH, et al. One-year multicenter, doublemasked, placebo-controlled, parallel safety and efficacy study of 2% pirenzepine ophthalmic gel in children with myopia. Ophthalmology 2005; 112: 84–91
325. Siatkowski RM, Cotter SA, Crockett RS, et al. Two-year multicenter, randomized, double-masked, placebo-controlled, parallel safety and efficacy study of 2% pirenzepine ophthalmic gel in children with myopia. J AAPOS 2008; 12: 332–339.
https://doi.org/10.1016/j.ophtha.2004.06.038
326. Hung LF, Arumugab B, Ostrin L, et al. The adenosine receptor antagonist, 7-methylxanthine, alters emmetropizing responses in infant macaques. Invest Opthalmol Vis Sci 2018; 59: 472–486.
https://doi.org/10.1167/iovs.17-22337
327. Trier K, Munk Ribel-Madsen S, Cui D, et al. Systemic 7-methylxanthine in retarding axial eye growth and myopia progression: a 36-month pilot study. J Ocul Biol Dis Infor 2008; 1: 85–93.
https://doi.org/10.1007/s12177-008-9013-3
328. Singh H, Sahajpal NS, Singh H, et al. Pre-clinical and cellular toxicity evaluation of 7-methylxanthine: an investigational drug for the treatment of myopia. 2019; 12: 1–10.
https://doi.org/10.1080/01480545.2019.1635615
329. Chia A and Tay SA. Clinical management and control of myopia in children. In: Ang M, Wong TY. (eds) Updates on myopia. A clinical perspective. 1st ed. Singapore: Springer; 2020. pp. 187–200.
330. Huang V, Duan A, Qi Y.Posterior scleral reinforcement to prevent progression of high myopia. Asia Pac J Ophthalmol2019; 8: 366–370.
https://doi.org/10.1097/APO.0000000000000257
331. Süveges I, Deák A. Gyermekkorban végzett myopiaellenes scleramegtámasztás eredményei. Szemészet 1995;132: 79–83.
332. Xue A, Bao F, Zheng L, et al. Posterior scleral reinforcement on progressive high myopic young patients. Optom Vis Sci 2014; 91: 412–418.
https://doi.org/10.1097/OPX.0000000000000201
333. Li XJ, Yang XP, Li QM, et al. Posterior scleral reinforcement for the treatment of pathological myopia. Int J Ophthalmol 2016; 9: 580–584.
https://doi.org/10.18240/ijo.2016.04.18
334. Ward B, Tarutta EP, Mayer MJ. The efficacy and safety of posterior pole buckles in the control of progressive high myopia. Eye 2009; 23: 2169–2174.
https://doi.org/10.1038/eye.2008.433
335. Coroneo MT, Beaumont JT, Hollows FC. Scleral reinforcement in the treatment of pathologic myopia. Aust N Z J Ophthalmol 1988; 16: 317–320.
https://doi.org/10.1111/j.1442-9071.1988.tb01234.x
336. Dong X, Liu J, Bu J. The efficacy of modified posterior scleral reinforcement with round scleral patches in Chinese children with high myopia. Graefes Arch Clin Exp Ophthalmol 2020; 258: 1543–1547.
https://doi.org/10.1007/s00417-020-04646-3
337. Su Y, Pan A, Wu Y, et al. The efficacy of posterior scleral contraction in controlling high myopia in young people. Am J Trans Les 2018; 10: 3628–3634. PMID: 30662614
338. Xue A, Zheng L, Tan G, et al. Genipin-crosslinked donor sclera for posterior scleral contraction/reinforcement to fight progressive myopia. Invest Ophthalmol Vis Sci 2018; 59: 3564–3573.
https://doi.org/10.1167/iovs.17-23707
339. Park JJ, Gole GA. Corticosteroid-induced glaucoma in a child after a scleral reinforcement procedure. Clin Exp Ophthalmol 2002; 30: 372–374.
https://doi.org/10.1046/j.1442-9071.2002.00560.x
340. Széll N, Boross A, Facskó A, Sohajda Z. Results with Posterior Scleral Reinforcement for Progressive Highly Myopic Children in Hungary. Klin Monatsbl Augenheilkd 2021; 238: 1–9.
https://doi.org/10.1055/a-1328-2586
341. Golychev VN, Medvetskaia GA, Golubeva LA, et al. Our experience with the use of sclera-strengthening injections in the prevention of progressive myopia [in German]. Vestnik Oftalmologii 1989; 105: 26–27. Russian. PMID: 2749965.
342. Avetisov ES, Tarutta EP, Iomdina EN, et al. Nonsurgical and surgical methods of sclera reinforcement in progressive myopia. Acta Ophthalmol Scand 1997; 75: 618–623.
https://doi.org/10.1111/j.1600-0420.1997.tb00617.x
343. Wollensak G, Spoerl E. Collagen crosslinking of human and porcine sclera. J Cataract Refract Surg 2004; 30: 689–695.
https://doi.org/10.1016/j.jcrs.2003.11.032
344. Hamdaoui ME, Levy AM, Stuber AB, et al. Scleral crosslinking using genipin can compromise retinal structure and function in tree shrews. Exp Eye Res 2022; 219: 109039.
https://doi.org/10.1016/j.exer.2022.109039
345. Guo Hua R, Zhang X, et al. Scleral cross-linking in formdeprivation myopic guinea pig eyes leads to glaucomatous changes. Invest Ophthalmol Vis Sci 2022; 63: 24.
https://doi.org/10.1167/iovs.63.5.24
346. Iseli HP, Spoerl E, Wiedemann P, Krueger RR, Seiler T. Efficacy and safety of blue-light scleral cross-linking. J Refract Surg 2008; 24: S752–S755.
https://doi.org/10.3928/1081597X-20080901-21
347. Liu C, Li Y, Wang M, Li J, Wang N, Zhang F. Changes in intraocular pressure and ocular pulse amplitude of rhesus macaques after blue light scleral cross-linking. BMC Ophthalmol 2022; 22: 87.
https://doi.org/10.1186/s12886-022-02306-0
348. Wolffsohn JS, Whayeb Y, Logan NS, Weng R. the International Myopia Institute Ambassador Group*; IMI–Global Trends in Myopia Management Attitudes and Strategies in Clinical Practice—2022 Update. Invest Ophthalmol Vis Sci 2023; 64(6): 6.
https://doi.org/10.1167/iovs.64.6.6
349. Shih YF, Hsiao CK, Chen CJ, et al. An intervention trial on efficacy of atropine and multi-focal glasses in controlling myopic progression. Acta Ophthalmol Scand 2001; 79: 233–236.
https://doi.org/10.1034/j.1600-0420.2001.790304.x
350. Kinoshita Kinoshita N, Konno Y, Hamada N, et al. Additive effects of orthokeratology and atropine 0.01% ophthalmic solution in slowing axial elongation in children with myopia: first year results. Jpn J Ophthalmol 2018; 62: 544–553.
https://doi.org/10.1007/s10384-018-0608-3
351. Chen Z, Huang S, Zhou J, et al. Adjunctive effect of orthokeratology and low dose atropine on axial elongation in fast-progressing myopic children-a preliminary retrospective study. Cont Lens Anterior Eye 2019; 42: 439–442.
https://doi.org/10.1016/j.clae.2018.10.026
352. Wan L, Wei C-C, Chen CS, et al. The synergistic effects of orthokeratology and atropine in slowing the progression of myopia. J Clin Med 2018; 7: 259.
https://doi.org/10.3390/jcm7090259
353. Tan Q, Ng AL, Choy BN, et al. One-year results of 0.01% atropine with orthokeratology (AOK) study: a randomised clinical trial. Ophthalmic Physiol Opt 2020; 40: 557–566.
https://doi.org/10.1111/opo.12722
354. Sánchez-González JM, De-Hita-Cantalejo C, Baustita-Llamas MJ, et al. The combined effect of low-dose atropine with orthokeratology in pediatric myopia control: review of the current treatment status for myopia. J Clin Med 2020; 9: 2371.
https://doi.org/10.3390/jcm9082371
355. Gao C, Wan S, Zhang Y, et al. The Efficacy of Atropine Combined With Orthokeratology in Slowing Axial Elongation of Myopia Children: A Meta-Analysis. Eye Contact Lens 2021; 47: 98–103.
https://doi.org/10.1097/ICL.0000000000000746
356. Tsai HR, Wang JH, Huang HK, Chen TL, Chen PW, Chiu CJ. Efficacy of atropine, orthokeratology, and combined atropine with orthokeratology for childhood myopia: A systematic review and network meta-analysis. J Formos Med Assoc 2022 Dec; 121(12): 2490–2500.
https://doi.org/10.1016/j.jfma.2022.05.005
357. Huang J, Mutti DO, Jones-Jordan LA, et al. Bifocal & atropine in myopia study: baseline data and methods. Optom Vis Sci 2019; 96: 335–344.
https://doi.org/10.1097/OPX.0000000000001378
358. Jones JH, Mutti DO, Jones-Jordan LA, Walline JJ. Effect of Combining 0.01% Atropine with Soft Multifocal Contact Lenses on Myopia Progression in Children. Optom Vis Sci 2022 May; 99(5): 434–442.
https://doi.org/10.1097/OPX.0000000000001884
359. Nucci P, Lembo A, Schiavetti I, et al. A comparison of myopia control in European children and adolescents with defocus incorporated multiple segments (DIMS) spectacles, atropine, and combined DIMS/atropine. PLoS One 2023 Feb 16; 18(2): e0281816.
https://doi.org/10.1371/journal.pone.0281816
360. Huang Z, Chen XF, He T, et al. Synergistic effects of defocus-incorporated multiple segments and atropine in slowing the progression of myopia. Sci Rep 2022; 12: 22311.
https://doi.org/10.1038/s41598-022-25599-z
361. Hui A, Bajgrowitz-Cieslak M, Phan CM, et al. In vitro release of two anti-muscarinic drugs from soft contact lenses. Clin Ophthalmol 2017; 11: 1657–1665.
https://doi.org/10.2147/OPTH.S141404
362. Brennan NA, Toubouti YM, Cheng X, Bullimore MA. Efficacy in myopia control. Prog Retin Eye Res 2020; 27: 100923.
https://doi.org/10.1016/j.preteyeres.2020.100923
363. Bullimore MA, Brennan NA. Myopia control: why each diopter matters. Optom Vis Sci 2019; 96: 463–5.
https://doi.org/10.1097/OPX.0000000000001367
364. Wolffsohn JS, Jong M, Earl L. Smith EL, et al. IMI 2021 Reports and Digest – Reflections on the Implications for Clinical Practice. Invest Ophthalmol Vis Sci 2021; 62(5): 1.
https://doi.org/10.1167/iovs.62.5.1
365. Jiang Y, Zhu Z, Tan X, et al. Effect of Repeated Low-Level Red-Light Therapy for Myopia Control in Children: A Multicenter Randomized Controlled Trial. Ophthalmology 2022 May; 129(5): 509–519.
https://doi.org/10.1016/j.ophtha.2021.11.023
366. Tian L Cao K, Ma DL. Investigation of the Efficacy and Safety of 650 nm Low-Level Red Light for Myopia Control in Children: A Randomized Controlled Trial. Ophthalmol Ther 2022 Dec; 11(6): 2259–2270.
https://doi.org/10.1007/s40123-022-00585-w
367. Zhou L, Xing C, Qiang W, Hua C, Tong L. Low-intensity, long-wavelength red light slows the progression of myopia in children: An Eastern China-based cohort. Ophthalmic Physiol Opt 2022; 42: 335–344.
https://doi.org/10.1111/opo.12939
368. Xiong R, Zhu Z, Jiang Y, et al. Sustained and Rebound Effect of Repeated Low-Level Red-Light Therapy on Myopia Control: A 2-year Post-Trial Follow-Up Study. Clin Exp Ophthalmol 2022 Dec; 50(9): 1013–1024.
https://doi.org/10.1111/ceo.14149
369. Dong J, Zhu Z, Xu H. Myopia Control Effect of Repeated Low-Level Red-Light Therapy in Chinese Children. Ophthalmology 2023 Febr; 130(2): 198–204.
https://doi.org/10.1016/j.ophtha.2022.08.024
370. Xiong R, Zhu Z, Jiang Y. Longitudinal Changes and Predictive Value of Choroidal Thickness for Myopia Control after Repeated Low-Level Red-Light Therapy. Ophthalmology 2023 March; 130(3): 286–296.
https://doi.org/10.1016/j.ophtha.2022.10.002
371. Chen H, Wang W, Liao Y, et al. Low-intensity red-light therapy in slowing myopic progression and the rebound effect after its cessation in Chinese children: A randomized controlled trial. Graefes Arch Clin Exp Ophthalmol 2023; 261: 575–584
. https://doi.org/10.1007/s00417-022-05794-4
372. Liu H, et al. Retinal Damage After Repeated Low-level Red-Light Laser Exposure. JAMA Ophthalmol 2023 May 25.
https://doi.org/10.1001/jamaophthalmol.2023.1548
373. He M, Chen Y and Hu Y. Prevention of myopia onset. In: Ang M and Wong TY (eds.) Updates on myopia. A clinical perspective. 1st ed. Singapore: Springer; 2020. pp. 171–186.
374. Cooper J, Aller T, Smith EL 3rd, et al. Retrospective Analysis of a Clinical Algorithm for Managing Childhood Myopia Progression. Optom Vis Sci 2023 Jan 1; 100(1): 117–124.
https://doi.org/10.1097/OPX.0000000000001978
375. Petty AD, Wilson G. Reducing the impact of the impending myopia epidemic in New Zealand. N Z Med J 2018; 131: 80–85. PMID: 30543614
376. Jan C, Li L, Keay L, et al. Prevention of myopia, China. Bull World Health Organ 2020; 98: 435–437.
https://doi.org/10.2471/BLT.19.240903
377. Seet B, Wong TY, Tan DT, et al. Myopia in Singapore: taking a public health approach. Br J Ophthalmol 2001; 85: 521–526.
https://doi.org/10.1136/bjo.85.5.521
