A case report of endogenous endophthalmitis caused by iatrogenic harm during the COVID-19 pandemic
doi: 10.55342/szemhungarica.2023.160.3.137
Case report
Summary
Introduction: Endogenous endophthalmitis is a severe form of intraocular inflammation, potentially leading to blindness, caused by the haematogenous spread of a pathogen.
Objective and methods: The aim of this study is to present a case of bilateral endogenous endophthalmitis of iatrogenic origin during the COVID-19 pandemic, overview diagnostic and therapeutic decision-making, and review the literature.
Case report: A 61-year-old male patient with secondary immunodeficiency after splenectomy presented to our outpatient clinic with visual impairment of the right eye. Due to his poor general condition and advanced ocular inflammation, he was admitted to the Infectology Department for endogenous endophthalmitis and sepsis based on clinical signs.
Despite the empirical topical and systemic antimicrobial therapy, his condition deteriorated rapidly. Upon revealing that it was due to a bilateral gluteal abscess in the area of the intramuscularly administered non-steroidal anti-inflammatory injections, the abscesses were resected urgently. In the same session, the rapidly progressive inflammatory process necessitated the enucleation of the right eyeball, which developed phthisis. Treatment of the symptomatic left eye was also initiated. At the end of 1.5 years of follow-up, an uneventful status was found on the right side, suitable for wearing a prosthetic eye; the left eye healed with residual symptoms, and its best corrected visual acuity was 1.0.
Conclusion: Prompt diagnosis and initiation of local and systemic treatment of endophthalmitis of endogenous origin are crucial. In presenting this case, we would like to draw attention not only to the severity and rapid progression of the disease and the difficulties of therapy, but also to the importance of taking a thorough medical history.
Összefoglaló
Bevezetés: Az endogén endophthalmitis az intraocularis gyulladások súlyos, potenciálisan vaksághoz vezető formája, amelyet a kórokozó hematogén úton való terjedése okoz.Célkitűzés és módszerek: A tanulmány célja, egy iatrogén eredetű, COVID-19-pandémia idején jelentkező, kétoldali endogén endophthalmitis esetének bemutatása, a diagnosztikus és terápiás döntéshozatal áttekintése, a szakirodalom ismertetésével.
Esetbemutatás: A 61 éves, lépeltávolítás miatt szekunder immundeficiens férfi beteg, jobb szem látásromlása miatt jelentkezett szakvizsgálatra ambulanciánkon. Rossz általános állapota és előrehaladott szemészeti gyulladása miatt Infektológiai Osztályos felvétele történt, a klinikai tünetek alapján felmerülő endogén endophthalmitis és szepszis miatt. Az empirikus lokális és szisztémás antimikrobás terápia ellenére is gyorsan progrediáló állapota hátterében az intramuscularisan adott, nem szteroid gyulladáscsökkentő injekciós kezelés területén kialakult, kétoldali farizom-tályog igazolódott, amelyet sürgősséggel szanáltak. Ezzel egy ülésben, a rapidan progresszív gyulladásos folyamat miatt a phthisisbe hajló jobb bulbus enukleációja vált szükségessé, illetve a tünetessé váló bal szem kezelése is megkezdődött. 1,5 éves nyomon követése végén, jobb oldalon békés, vendégszem viselésére alkalmas kötőhártyazsák, bal oldalon maradványtünetekkel gyógyult békés szem, legjobb korrigált látóélessége 1,0.
Következtetés: Az endogén eredetű endophthalmitisek prompt diagnózisa és az azonnali, lokális és szisztémás kezelése kulcsfontosságú. A bemutatott esettel nemcsak a betegség súlyosságára, rapid lefutására, a diagnosztikus és terápiás nehézségekre, hanem az alapos anamnézisfelvétel fontosságára is szeretnénk felhívni a figyelmet.
Keywords
endogén endophthalmitis, immunszuppresszió, lépeltávolítás, intraocularis tályog
Kulcsszavak
endogén endophthalmitis, immunszuppresszió, lépeltávolítás, intraocularis tályog
Bevezetés
Az endophthalmitisek a szemgolyó súlyos gyulladásos folyamatai, amelyek esetén a kórokozó az elülső és a hátulsó szegmentumban is gyulladást okoz. A mikroorganizmus bejutási útja alapján lehetnek exogén- (szemfelszínről vagy a környezetből inokulációval) és endogén (hematogén úton, szóródással – „metasztatikus gyulladás”) eredetűek. Az endogén endophthalmitisek az összes endophthalmitis 2-8%-áért (12) vagy akár 5-15%-áért (4) is felelősek lehetnek, földrajzi területtől, genetikai faktoroktól, illetve a szocioökonómiai viszonyoktól függően. A patogént az esetek 66%-ában sikerül azonosítani (4).
A szemgolyó egy immunprivilegizált szerv, amiért elsősorban a vér–retina gát felel. Normál állapotban ez a struktúra meg tudja gátolni a kórokozók, nagy molekulájú anyagok és a vérben található, a szemgolyó szöveteit is károsító immunrendszeri szereplők bejutását a szem belsejébe. Endogén endophthalmitisekben a patogén által okozott vér–retina gát károsodása miatt a szemgolyó saját, rezidens immunsejtjei elvesztik a védekezési képességüket. Emiatt a hematogén úton érkező kórokozó el tudja érni a hátulsó szegmentumot, valamint létrejöhet a szem szöveteit károsító forszírozott immunreakció is (13). Immunkompetens egyénekben ritkán fordul elő, immunkompromittált állapotokban emelkedett az endogén endophthalmitis kialakulásának rizikója. A leggyakoribb ilyen állapotok a hospitalizáció, a diabetes mellitus, a recidív húgyúti infekciók és állandó katéterviselés, a szolid daganatok, a szisztémás autoimmun kórképek, az elhúzódó neutropénia, a HIV-infekció, az intravénás droghasználat (2).
A léphiány is egy másodlagos immundefektushoz vezető állapot. A léphiány oka lehet organikus (veleszületett hiány vagy lépeltávolítás következménye) és funkcionális (infiltratív betegségek, lép ereinek trombózisa). Léphiány esetén fokozott a rapid, fulmináns fertőzések kockázata; a tokos baktériumok elleni védekezőképesség csökkent, ezért típusosan H. influenzae, Pneumococcus, Meningococcus és egyéb Streptococcusok és E. coli infekciók halmozódására számíthatunk (13). Kiemelendő az úgynevezett OPSI-szindróma, (Owerwhelming post-splenectomy infection) a lépeltávolítást követő, uralhatatlan szepszis, amely a lép eltávolítását követő első 3 évben a leggyakoribb, de akár 20 évvel a splenectomia után is kialakulhat (7). Prevalenciája 0,1-0,5%-ra tehető, mortalitása 50% (11). Enyhe, influenzaszerű tünetekkel indul, amelyet akár 24-48 órán belül bekövetkező szeptikus sokk követhet (9). Prevencióját a megfelelő betegedukáció, a megelőző vakcináció és az antibiotikumprofilaxis jelenti.
A tanulmányunk célja egy iatrogén eredetű, COVID-19-pandémia idején szekunder immunszuppresszió talaján kialakult, kétoldali endogén endophthalmitis esetének bemutatása, a diagnosztikus és terápiás döntéshozatal áttekintése a szakirodalmi adatok alapján.
Esetbemutatás
A 61 éves férfi beteg, jobb szem fájdalom és látásromlás miatt jelentkezett ambulanciánkon, a COVID-19-pandémia első hullámában. Anamnéziséből kiemelendő korábbi lépruptúra miatti splenectomia, pancreastályog miatti műtét. Szemészeti panaszai mellett, több napja fennálló lázról és derékfájásról tett említést. Első szemészeti vizsgálatakor a jobb szem legjobb korrigált látóélessége (BCVA) kézmozgás-látás, az intraocularis nyomás 24,0 Hgmm, a szaruhártya ödémás, hátlapján precipitátumok és Descemet-redők, a csarnokban 3 mm-nyi hypopyon állt. A pupilla tág, fénymerev, a lencse sejthető. Ekkor panaszmentes, békés bal szemén BCVA 1,0. Jobb szemről kötőhártya- és szaruhártya-leoltás történt.
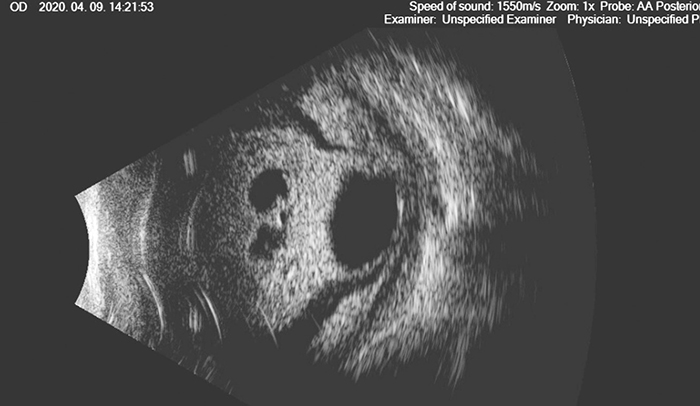
Ultrahang B-scan vizsgálatakor az üvegtesti térben intragél közepes echogenitású pontechók ábrázolódtak, a retina körben az alapján feküdt. 5×1 csepp Tobradex (tobramycin és dexamethazon), valamint 2×1 csepp Kiranol (dorzolamid és timolol) szemcseppel történő kezelést indítottunk és parabulbaris Gentamycin (40 mg) injekció beadására is sor került. A rossz általános állapota és magas láza miatt infektológiai osztályos felvétele történt a szemészeten véleményezett endophthalmitis és a hátterében valószínűsített szepszis miatt. Hemokultúra levételét követően szisztémás antibiotikum (vancomycin és ciprofloxacin), valamint gomba ellenes (fluconazol) kezelése indult. A beteg szemfájdalmának, szubjektív panaszainak csökkenése mellett szemészeti státuszának rapid, egy napon belüli progresszióját láttuk. A szaruhártya egészében elfehéredett és a szemgolyó-UH B-scan vizsgálata a hátsó szegmentum gyulladásos folyamatát és a szemlencse elsüllyedését igazolta (1. ábra).
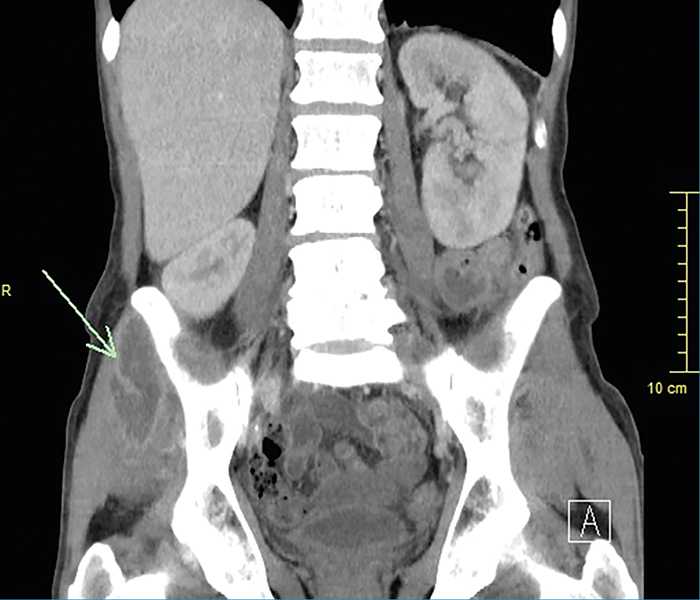
Bal szeme előtt foltlátás jelentkezett, amelynek hátterében a makulában megjelent vérzések mutatkoztak. Koponyaűri góc kizárása céljából natív agykoponya-CT-vizsgálata készült, amelyen a jobb bulbusban a nervus opticus magasságában dorsalisan a szemlencsének megfelelő képlet ábrázolódott, agyi eltérést nem találtak. A szepszis forrásának felderítésére hasi-kismedencei natív- és kontrasztanyagos CT-vizsgálata történt, amelyen jobb oldali gluteus medius és bal oldali gluteus maximus tályog ábrázolódott (2. ábra).
A beteg anamnéziséből kiderült, hogy a lumbágója miatt többszöri, farizomba adott intramuscularis Voltaren (diclofenac) injekciós kezelésben részesült. Rapidan romló szisztémás állapota miatt sürgősséggel, intratrachealis narkózisban, szepszisforrás-kontroll céljából a glutealis tályogok szanálása, valamint a jobb szem enukleációja történt, terápiás próbálkozásaink ellenére kialakult phthisis miatt. A tünetessé váló bal szembe intravitrealis Vancomycin injekciót (1 mg/0,1 ml) kapott a műtéttel egy ülésben.
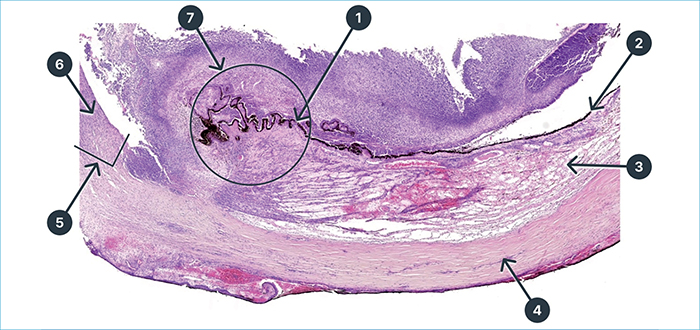
A jobb bulbus szövettani vizsgálata a corneát és a sclera szemlencse előtti részét, az íriszt, a lencsét és a retinát szinte teljes egészében destruáló masszív, abszcedáló endophthalmitist igazolt. A gyulladás a látóidegre is ráterjedt. A szövettani mintából PAS, Gram- és Ziehl–Neelsen-festéssel, Grocott és Warthin–Starry-ezüstözéssel kórokozót kimutatni nem tudtak (3. ábra).
Többszöri kötőhártya- és szaruhártya-leoltása negatív eredménnyel zárult. A farizom-tályogokból vett mintából kórokozó nem tenyészett ki.
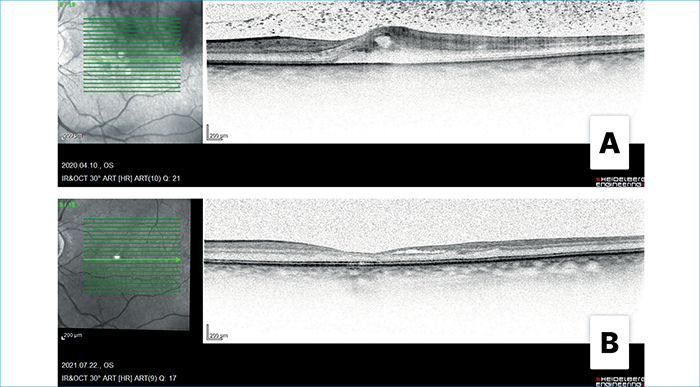
A jobb szem enukleációt követően a bal szem BCVA 0,1-re romlott, makulában ödéma és vérzések jelentek meg, az üvegtesti térben kiszórással. Antimikrobás kezelését 500 mg Solu-Medrol (metilprednizolon) infúzióval egészítettük ki. A kezelés hatására makulaödémája fokozatosan csökkent, majd megszűnt, a foveában atrófia vált láthatóvá (4. ábra).
Posztoperatív kilencedik napon heveny légzési elégtelenség, radiológiailag igazolt kétoldali, súlyos pneumónia miatt a Központi Intenzív Osztályra került áthelyezésre, ahol gépi légzéstámogatást kezdtek. SARS-CoV2 PCR-negativitás alapján a COVID-19 kizárható volt. Antibiotikumváltás – Imipenem/Cilastatin 3×500 mg – és intenzív szupportáció mellett gyulladásos paraméterei regrediáltak. Többszöri hemokultúra vizsgálatával kórokozót azonosítani nem sikerült. Emissziója előtti szemészeti kontrollvizsgálatakor bal szem BCVA 0,15. Másfél éves nyomon követése végén, jobb oldalon békés, vendégszem viselésére alkalmas kötőhártyazsák, bal oldalon békés szem, BCVA 1,0.
Megbeszélés
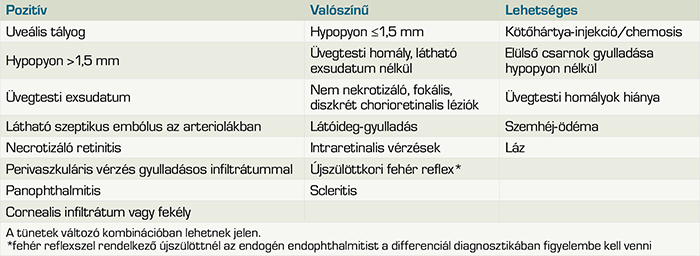
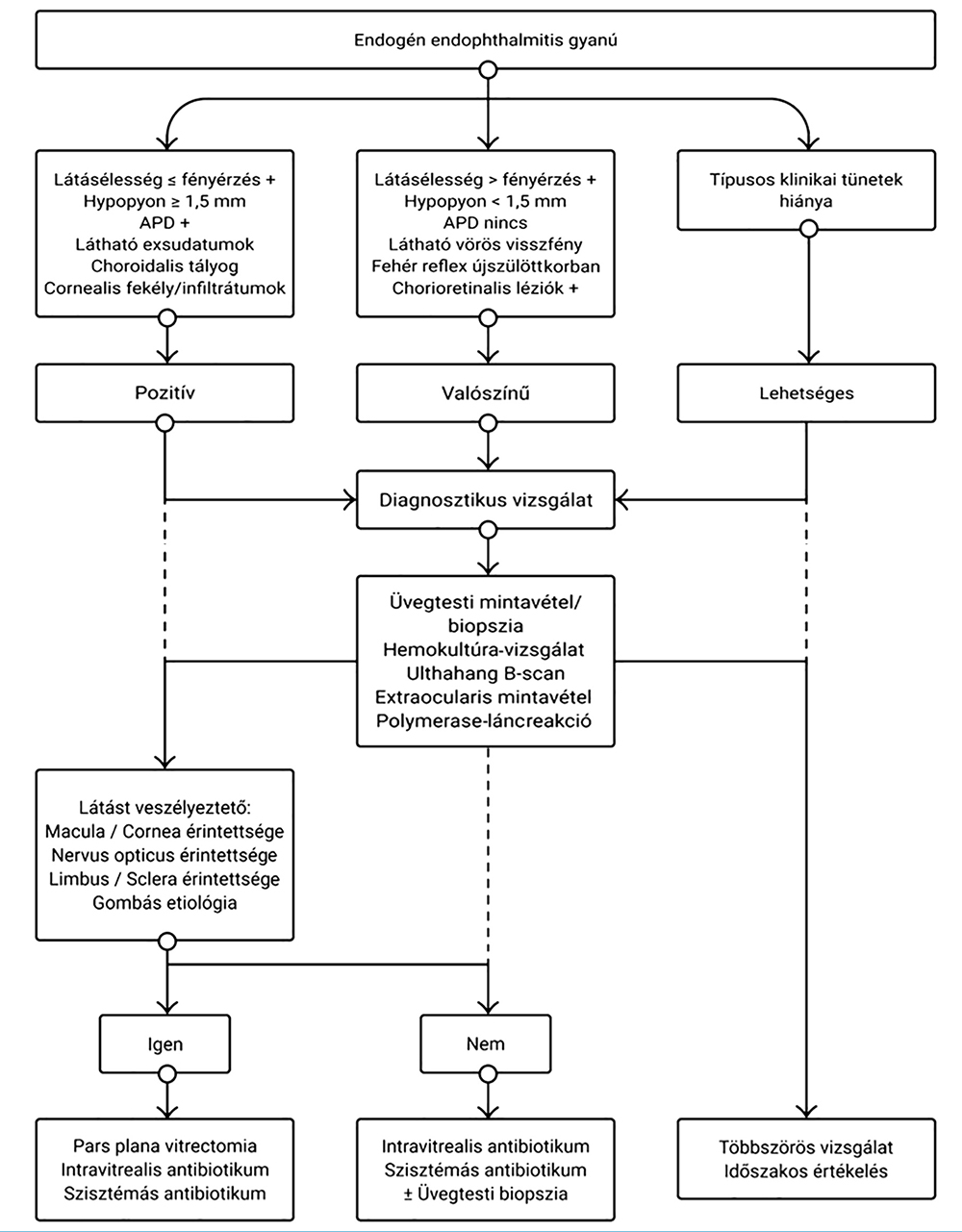
Az endogén endophthalmitis diagnosztizálása sokszor jelent kihívást. A hasonló tünetek (csökkent látásélesség, fájdalom, hypopyon, vitritis) miatt gyakran, az esetek 25-33%-ában félrediagnosztizált kórkép. Leggyakrabban uveitis, orbitális cellulitis, intraocularis daganatok, gyermekek esetében retinoblastoma merül fel differenciáldiagnosztikai nehézségként (6). Az 1. táblázatban az endogén endophtalmitis lehetőségét felvető szemészeti- és a társuló szisztémás tüneteket tüntettük fel, míg az 5. ábrán a diagnózis felmerülése esetén javasolható diagnosztikus és terápiás döntéshozatal folyamatát ábrázoltuk.
Mint minden diagnózis felállításakor, alapvető a pontos, részletes anamnézisfelvétel. Esetünkben is kulcsfontosságú információhoz jutottunk, a beteg anamnéziséből kiderült a korábbi lépruptúra miatti lépeltávolítása és az ebből adódó másodlagos immundefektusa, fokozott fertőzésveszélye.
Az elülső szegmens érintettsége és az üvegtesti gyulladásos infiltrátum miatt a szemgolyó B-scan ultrahangvizsgálata az, amely nem specifikus ugyan, de noninvazív módon a hátulsó szegmentum érintettségéről, így a gyulladás súlyosságáról a legtöbb információt adja.
A klinikai diagnózis megerősítése céljából a gyulladás helyéről, lokálisan vagy szisztémásan vett minták mikrobiológiai tenyésztése szükséges. A vizsgált anyag lehet a csarnokvíz, az üvegtest, a vér vagy a vizelet egyaránt. Szakirodalmi adatok szerint a hemokultúra az esetek 75%-ában mutat pozitivitást (4). A csarnokvíz és az üvegtesti minták tenyésztését (pozitivitása az esetek 60-90%-ában várható) nem feltétlenül tartják megbízhatónak, tekintettel arra, hogy sok esetben a lokális vagy a szisztémás antibiotikum adását követően történik a mintavétel, illetve a mintavétel technikája is befolyásolja a kapott eredményt (4). Az üvegtesti mintavétel történhet üvegtesti biopsziával, illetve vitrectomia formájában. Lingappan és munkatársai tanulmánya szerint a vitrectomia során vett minta tenyésztése magasabb pozitivitást mutat (92%) az üvegtesti biopsziához (44%) képest, amit a gyulladásos terület jobb megközelíthetősége és a minta mennyisége magyaráz (8). A vitrectomia diagnosztikus értéke mellett terápiás hatással is bír, mivel a fertőzött üvegtesttel együtt a kórokozó, annak toxinjai, nekrotikus szövettörmelék és a gyulladásos sejtek eltávolítása az akut gyulladás gyors oldódását teszi lehetővé (15). Mindemellett lehetőség nyílik az üvegtesti tér szilikonolajjal történő feltöltésére, ami megakadályozza a kórokozók szaporodását és terjedését (3, 15). Amennyiben lehetőség van annak időben történő elvégzésére, úgy a vitrectomia elvégzése jobb prognózist jelent a várható végső látásélesség szempontjából. Csökken a retinaleválás esélye és annak kockázata, hogy a fertőzés miatt a szemgolyó eltávolítása váljék szükségessé (14).
Az endogén endophthalmitisek a prompt diagnózist követő rapidan megkezdett terápia ellenére is sokszor kedvezőtlen kimenetelűek. Az esetek 40-90%-ában a lezajlott gyulladást követően a látóélesség nem éri el a 0,05-öt. Az esetek 24%-ában a szemgolyó eltávolítása válik szükségessé (6).
A patogén eredetére már az endogén gyulladás dinamikájából következtethetünk. Míg a bakteriális eredetű esetek akutan, fulminánsan zajlanak, addig a prognosztikalilag kedvezőtlenebb kimenetelű, gombás eredetű esetekre általában a szubakut, lassúbb lefolyás jellemző (5).
A diagnózis felállítását követően szisztémás, széles spektrumú antibiotikum adására van szükség, a háttérben álló fertőzéses góc miatt. Európában az esetek egyharmadában Gram-negatív, kétharmad részében Gram-pozitív baktériumok az endogén endophthalmitisek kórokozói (1). Gram-pozitív kórokozók ellen vancomycin, Gram-negatív kórokozók ellen ceftazidim a leggyakrabban alkalmazott antibiotikumterápia. Esetünkben, a vancomycinterápiát széles spektrumú ciprofloxacin adásával egészítette ki az Infektológiai Osztály a farizomban elhelyezkedő tályogok miatt. Antifungális szisztémás szerként az irodalom a fluconazolt és a voriconazolt ajánlja, mivel ezek magasabb koncentrációt érnek el az üvegtestben és kevesebb a szisztémás mellékhatásuk. Esetünkben a jobb szembe az intravitreálisan adott kezelésnek lehetősége nem volt, a bal szembe adva a gyulladás korai fázisában, időben bejuttatott antibiotikum hatékonynak bizonyult. Intravitreális és szisztémás szteroid használatának tekintetében nincs egyértelmű iránymutatás a szakirodalomban, habár a szteroidok a gyulladásos sejtek mennyiségét és a citokinek felszabadulását csökkentő, illetve a vér–retina barriert stabilizáló szerepe ismert (10). Esetünkben intravénás Solu-Medrol (metilprednizolon) használata mellett a beteg szisztémás, és szemészeti állapotának javulását tapasztaltuk.
Következtetések
Sokszor a rapid lefolyás, az előrehaladott károsodás miatt nincs lehetőség a gyulladt szem megmentésére, enukleáció válik szükségessé. A gyors, multidiszciplináris kezelésnek köszönhető, hogy esetünkben a beteg általános állapotának javulása mellett a bal szem látóélességét sikerült megőriznünk. A gyulladás következtében kialakult, makulát is érintő atrófia ellenére látóélességét 1,0-re lehetett korrigálni, amit terápiás sikerként könyvelhetünk el.
Nyilatkozat
A szerzők kijelentik, hogy a speciális esetet ismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Barna L, Lesch B, Nagy ZZs. Primer tüdőtumorban szenvedő beteg felső légúti infekciója talaján kialakult kétoldali endogén endophthalmitis. Szemészet 2020; 157: 18–21.
2. Connell PP, O’Neill EC, Fabinyi D, Islam FM, Buttery R, McCombe M, Essex RW, Roufail E, Clark B, Chiu D, Campbell W, Allen P. Endogenous endophthalmitis: 10-year experience at a tertiary referral centre. Eye (Lond) 2011; 25:66–72.
https://doi.org/10.1038/eye.2010.145
3. Cunningham ET, Flynn HW, Relhan N, Zierhut M. Endogenous Endophthalmitis. Ocul Immunol Inflamm 2018; 26: 491–495.
https://doi.org/10.1080/09273948.2018.1466561
4. Durand ML. Bacterial and Fungal Endophthalmitis. Clin Microbiol Rev 2017; 30: 597–613.
https://doi.org/10.1128/CMR.00113-16
5. Ecsedy M, Dohán J, Peskó G, Ludwig E, Mohammadpour B, Nagy ZZ, Récsán Z. Bilateral Fungal Endophthalmitis: A Multidisciplinary Challenge. J Clin Transl Ophthalmol 2023; 1: 3–10.
https://doi.org/10.3390/jcto1010002
6. Gajdzis M, Figuła K, Kaminska J, Kaczmarek R. Endogenous Endophthalmitis – The Clinical Significance of the Primary Source of Infection. J Clin Med 2022; 11:1183.
https://doi.org/10.3390/jcm11051183
7. King H, Shumaker H. Splenic studeis: I. susceptibility to infection after splenectomy performed in infacy. Annals of Surgery 1952; 136: 239–242.
https://doi.org/10.1097/00000658-195208000-00006
8. Lingappan A, Wykoff CC, Albini TA, Miller D, Pathengay A, Davis JL, Flynn HW Jr. Endogenous fungal endophthalmitis: causative organisms, management strategies, and visual acuity outcomes. Am J Ophthalmol 2012; 153: 162–166.
https://doi.org/10.3390/jof8060641
9. Lizamma A, Rajan ML, Xavier B, Jacob P, Rani KD, Lakshmi G. Microscopic study of human spleen in different age groups. Int J Res Med Sci 2015; 3: 1701–1706.
https://doi.org/10.18203/2320-6012.ijrms20150255
10. Sadiq MA, Hassan M, Agarwal A, Sarwar S, Toufeeq S, Soliman MK, Hanout M, Sepah YJ, Do DV, Nguyen QD. Endogenous endophthalmitis: diagnosis, management, and prognosis. J Ophthalmic Inflamm Infect 2015; 5: 32.
https://doi.org/10.1186/s12348-015-0063-y
11. Sarangi J, Coleby M, Trivella M, Reilly S: Prevention of post splenectomy sepsis: a population based approach. J Public Health Med 1997; 19: 208–212.
https://doi.org/10.1093/oxfordjournals.pubmed.a024611
12. Schiedler V, Scott IU, Flynn HW Jr, Davis JL, Benz MS, Miller D. Culture-proven endogenous endophthalmitis: clinical features and visual acuity outcomes. Am J Ophthalmol 2004; 137: 725–731.
https://doi.org/10.1016/j.ajo.2003.11.013
13. Tahir F, Ahmed J, Malik F. Post-splenectomy Sepsis: A Review of the Literature. Cureus 2020; 12: 6898
.https://doi.org/10.7759/cureus.6898
14. Vaziri K, Schwartz SG, Kishor K, Flunn HW. Endophthalmitis: State of the art. Clin Ophthalmol 2015; 9: 95–108.
https://doi.org/10.2147/OPTH.S76406
15. Xu H, Fu B, Lu C, Xu L, Sun J. Successful treatment of endogenous endophthalmitis with extensive subretinal abscess: a case report. BMC Ophthalmol 2018; 18:238.
https://doi.org/10.1186/s12886-018-0908-x
