Case report of choroidal neovascularization in pathological myopia, review and therapy methods
doi: 10.55342/szemhungarica.2023.160.2.66
Case report
Summary
Pathological myopia is one of the leading causes of vision loss worldwide, especially among young people of working age. Choroidal neovascularization is one of the most important causes of visual impairment in pathological myopia. The purpose of our announcement is to present a case of choroidal neovascularization developing in pathological myopia, to review the disease and to summarise the therapy methods.
Összefoglaló
A patológiás myopia világszerte a látásvesztés egyik meghatározó oka, amely az esetek nagy részében, a még aktív, fiatal korosztályt érinti. Jelentős, látást veszélyeztető komplikáció patológiás myopiában a chorioidea neovascularisatio kialakulása. Közleményünk célja a patológiás myopiában kialakuló chorioidea neovascularisatio egy esetének bemutatása, a kórkép áttekintése és a terápiás lehetőségek összegzése.Keywords
pathological myopia, choroideal neovascularisation, anti-VEGF
Kulcsszavak
patológiás myopia, choroidea neovascularisatio, anti-VEGF
Bevezetés
A patológiás myopia világszerte a látásvesztés egyik meghatározó oka. Prevalenciája 0,9-1,3% közé tehető, a patológiás myopia okozta látásromlásé pedig 0,1-0,5% között van (6). A vakság kialakulásának harmadik leggyakoribb oka világszerte. Magyarországi adatok szerint a vakság negyedik leggyakoribb oka a nedves-AMD, a glaukóma és a diabéteszes retinopathia után. A chorioidealis neovascularisatio (CNV) gyakorisága patológiás myopiában 5,2-11,3%, és 15%-ban bilaterálisan jelenik meg (10). Az esetek körülbelül felében az aktív, 50 év alatti korosztályt érinti.
Esetbemutatás
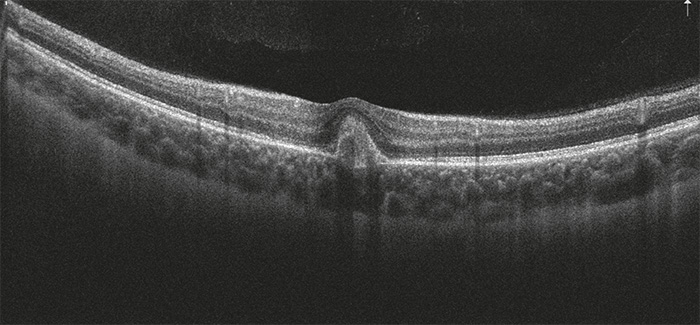
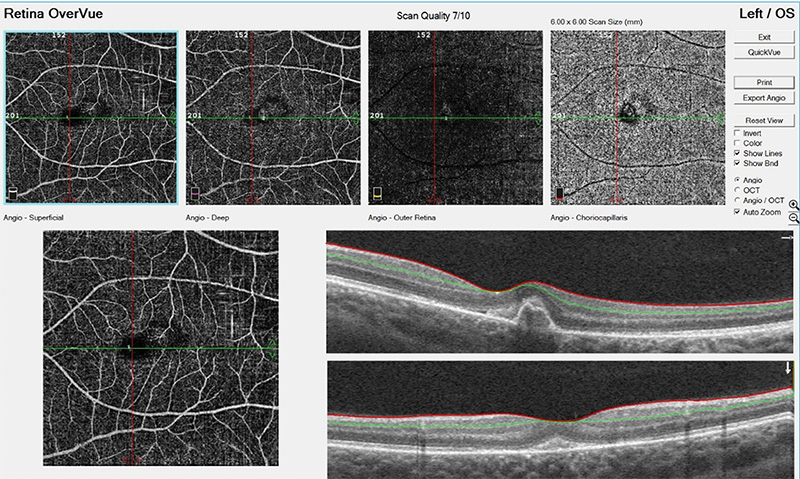
18 éves női páciens érkezett a Semmelweis Egyetem Szemészeti Klinika Általános Ambulanciájára, 1 hónapja tartó bal oldali látásromlás miatt. Területi szemészeten bal oldali chorioretinitis centralis serosa diagnózisát állították fel, non-szteroid-tartalmú szemcseppet (nepafenac) alkalmaztak. Hozott szemészeti dokumentációban az OCT-vizsgálat jobb oldalon ép makulát, bal oldalon serosus elemelkedést és cisztoid ödémát írt le. Területi szemészeti kontroll alkalmával a bal oldali serosus elemelkedés megszűnését látták, fovea alatt pigmentepithel-leválás alakult ki. Ambulanciánkon történt vizsgálat során az ismert rövidlátó páciensnél bal oldalon csökkent látóélességet (V: od: –4,0 Dsph = 1,0 // os: –3,75 Dsph = 0,25 stly nj; ünj), makula területén pigmentepithel-leválást (PED) és körülötte sarló alakban vérzést láttunk. Makula OCT-vizsgálat során PED igazolódott (1. ábra). Angio-OCT-vizsgálat során chorioidea neovascularisatióra utaló jeleket észleltünk (2. ábra). FLAG-vizsgálat elvégzése során, jobb oldalon eltérés nem igazolódott, bal oldalon kis aktivitásra utaló CNV képe volt detektálható (3. ábra).
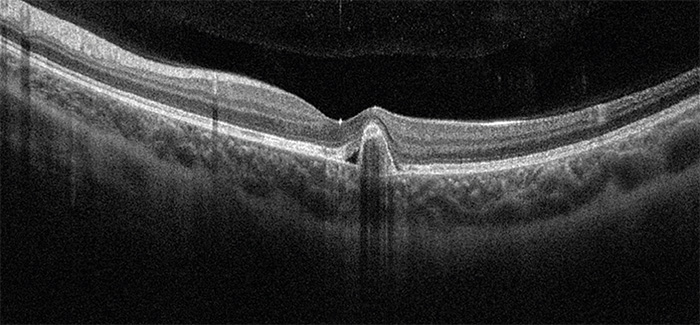
Páciensünk bal szemén intravitrealis anti-VEGF injekciós terápiát indítottunk (Aflibercept) myopiás CNV jelenléte miatt. A páciens 3 hónap alatt 3 intravitrealis aflibercept injekciót kapott (havonta egyet), látásélessége nagymértékben javult. (első injekció után 1 hónappal bal szemén 0,8 volt a visusa, második injekció után pedig 1,0. Harmadik injekció után egy hónappal szintén 1,0 volt a visusa bal szemén). A páciens kezelése három injekció után pro-re-nata terápiás séma szerint történik. Harmadik injekció utáni kontroll alkalmával (1 hónappal később) teljes látásélességű bal szemén kontroll OCT-felvétel készült, amelyen a centrumban a pigmentepithel alatt megvastagodást, jelzett subretinalis folyadékot észleltünk (4. ábra). Emiatt a páciens ismét intravitrealis aflibercept injekcióban részesült. A beteg kontrollvizsgálatát pro-re-nata protokollnak megfelelően folytatjuk.
Patológiás myopia
A patológiás myopia definíciója nem egységes. Általánosságban elmondható, hogy legalább –6,0 D fénytörési hiba, illetve a 26,5 mm-es vagy annál nagyobb szemtengelyhossz fordul elő leggyakrabban. A bulbus elongációja miatt szemfenéki eltérések (lacquer cracks; chorioretinalis atrófia, n. opticus szerkezeti eltérései) alakulnak ki, amelyek a súlyos látáscsökkenésért felelősek (2, 3, 5). Ennek leggyakoribb oka a chorioidea neovascularisatio (CNV) létrejötte; kis, szürkés membrán alakul ki az éleslátás területében. FLAG-vizsgálat során jól definiálható hiperfluoreszcencia jellemző a korai szakaszban, festékszivárgás pedig a késői szakaszban. A myop CNV úgynevezett 2-es típusú CNV, ami a pigmentepithel (PE) fölött alakul ki (1-es típusú CNV – neovascularis AMD – főként a PE alatti területen jellemző).
A myopiában kialakuló CNV-t egy egységes klasszifikációs rendszer 4 kategóriába sorolja (META-PM classification) (1. táblázat) (4).
Myop CNV három fázisra osztható (aktív, heges és atrófiás fázis). Aktív fázisban vérzéses vagy serosus retinaleválás alakul ki; heges fázisban fibrotikus heg jön létre, amelyek pigmentálódhatnak (Fuch’s-folt) (4, 7). Atrófiás fázisban chorioretinalis atrófia jön létre a visszafejlődött CNV területén, Bruch-membránon ennek megfelelően folytonossági hiány lesz látható. Kezelés nélkül rossz prognózisú, 5 éven belül 89%-ban, 10 éven belül 96%-ban alakul ki látásromlás (BCVA 0,1 alatt).
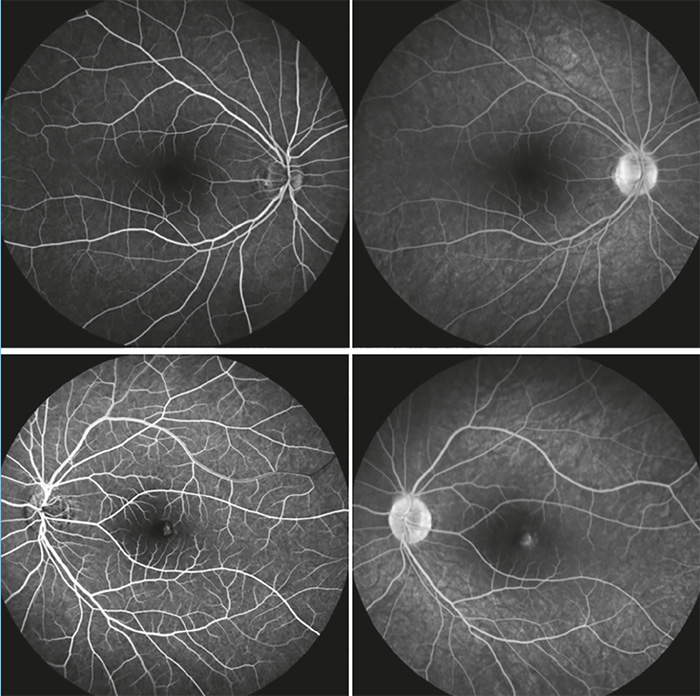
Myop CNV patogenezise nem teljesen ismert. Prekurzor lézió kialakulása indítja meg a folyamatot (hátsó pólus atrófia, elongáció), a pigment epithel – Bruch-membrán – choriocapillaris komplexben elváltozások jönnek létre (11). Choroidea erek mennyiségének relatív csökkenése és/vagy patológiás elváltozások kialakulása relatív hypoxiát eredményez a PE területén és a gliasejtekben, amelynek következtében a VEGF szintje megemelkedik (angiogén és vazopermeabilitásért felelős faktor). Vascularis endothelialis sejtek proliferálnak, amelynek következtében CNV alakul ki. Diagnosztikájában fontos a megfelelő, sokrétű vizsgálat. Funduson lapos, kicsi, szürkés subretinalis lézió látható közel a foveához, amely vérzéssel társulhat. A vérzés olyan mértékű lehet, hogy magát a CNV-t nem is látjuk. Macula OCT segítségével a CNV helyzete megfigyelhető. Angio-OCT segítségével pedig a retina microvasculaturája, hiperintenzitású vaszkuláris anasztomózis hálózat (CNV) ábrázolható. Diagnosztikai nehézséget jelenthet azonban PED jelenléte, nem mindig detektálható a myop CNV-re jellemző morfológia. Érfestéses vizsgálat (FLAG, esetleg ICGA) során vizsgálható az érújdonképződés elhelyezkedése, mérete, aktivitása. Hiperfluoreszcencia jellemző a korai fázisban és festékszivárgás a késői fázisban (3. ábra).
Terápia
Többféle, régebben alkalmazott kezelési módszer ismert (fokális termális lézer fotokoaguláció, verteporfinnal végzett fotodinámiás terápia – PDT –, műtéti beavatkozás), amelyek mára nagymértékben háttérbe szorultak. Amint azt a betegség patogenezisében megismertük a VEGF-molekula kulcsfontosságú szerepet tölt be a kórkép kialakulásában. A myopiában kialakuló CNV terápiája is ezen molekulára ható készítményekkel történik. Jelenleg az elfogadott, myopia esetén törzskönyvezett intravitrealis VEGF-gátlók a következőek: ranimizumab, aflibercept, bevacizumab. Újabb anti-VEGF-készítmények is léteznek (brolucizumab, faricimab), viszont ezek myopiában kialakuló CNV kezelésére nem törzskönyvezettek.
Klinikai kutatások
Többféle tudományos vizsgálat foglalkozott a myopiás CNV kezelésének lehetőségeivel. 2013-ban a REPAIR Study keretében multicentrikus tanulmány történt, 12 centrumban 65 páciens bevonásával (8). A vizsgálat során intravitrealis ranimizumab terápia pro-re-nata terápiás módját vizsgálták. Összességében a BCVA 86%-ban javulást mutatott, még 12 hónapos utánkövetés esetén is. 2014-ben, az ún. RADIANCE Study (9) során intravitrealis ranimizumab- és PDT-kezelés hatékonyságát vetették össze. Az 1-es csoportban lévők 1. nap és 1 hónap múlva ranimizumabterápiában részesültek, további terápiájuk a látásélességtől függött. A 2-es csoport tagjai 1. nap ranimizumab injekciót kaptak, utána csak aktivitás jelenléte mellett történt újrakezelés. A 3-as csoport tagjai PDT-kezelésben részesültek. A vizsgálat bebizonyította, hogy az anti-VEGF-terápia hatásosabb a PDT-kezelésnél. 2015-ben, a MYRROR Study keretein belül az aflibercept hatékonyságának vizsgálata történt 24 héten keresztül (1). Az aflibercepttel kezelt páciensek látásélessége javult, a kontrollcsoport esetén ez a javulás nem volt megfigyelhető. (24 hét után a kontrollcsoport tagjai is megkapták az aflibercept injekciót) Klinikánk munkacsoportjának 2017-es eredményei alapján szintén elmondható, hogy az intravitrealis ranibizumabkezelés hatására látásélesség-javulás várható (6).
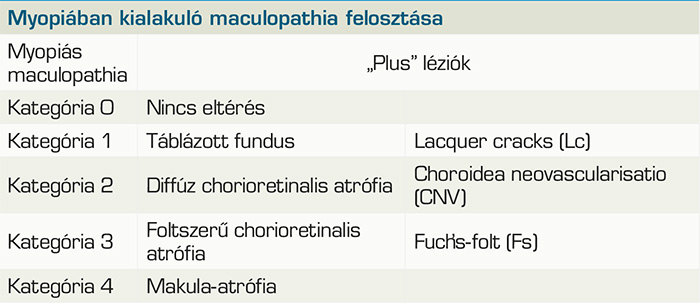
felosztás, myopiában kialakuló maculopathia
jellemzői (4)
Intravitrealis anti-VEGF-kezelés mellékhatásai
Az injekciós eljárással kapcsolatosan előfordulhat szemnyomás-emelkedés, szemfájdalom, üvegtesti homályok, retinavérzés, az injekció beadásának helyén suffusio alakulhat ki. Mint minden bulbust megnyitó beavatkozásnál, intravitrealis injekció következtében endophthalmitis is kialakulhat. Az intravitrealis anti-VEGF-re kialakult gyulladásos reakció – iridocyclitis, vitritis ritkán, de előfordulhat. Az anti-VEGF-molekula a keringésbe kerülhet – a ranimizumab felezési ideje igen rövid, viszont a bevacizumab és az aflibercept a se-VEGF-szintet csökkentheti. Mivel a bevacizumab és az aflibercept az IgG-molekulához hasonlít (Fc régió és Fab fragment), átjuthat a placentán (állatkísérletes modellekben kimutatták jelenlétét). Esetleges teratogén hatása miatt terhességben nem alkalmazható, valamint kezelés után a női pácienseknek 3 hónapig nem ajánlott a gyermekvállalás.
Kezelési irányelvek
Jelenleg elfogadott elsődleges terápia az intravitrealis anti-VEGF adása. Kezelés után az utánkövetés gyakorisága is fontos tényező: az első három hónapban havonta, majd az első év végéig 2-3 havonta, 1 év után 3-6 havonta szükséges kontroll alkalmával megvizsgálnunk a pácienst. Szükség esetén a kezelést ismételnünk kell. Természetesen ezek ajánlások, minden páciens utánkövetését személyre szabottan kell elvégeznünk és mérlegelnünk. A kórkép diagnosztikájához használt eszközök (főként OCT és angio-OCT) nagy segítséget nyújtanak a kezelés hatékonyságának monitorozásában.
Következtetés
A patológiás myopia gyakori látásromlást okozó kórkép, amelyben hirtelen alakul ki látásromlás, ha CNV-vel társul. Patomechanizmusa nem teljesen ismert. Jelenleg az intravitrealis anti-VEGF-terápiával javulás érhető el, de sok esetben a hosszabb távon kialakuló atrófia miatt ez a javulás átmeneti. Nagyon fontos a betegség korai felismerése és mihamarabbi kezelése. Szintén nagyon nagy hangsúlyt kell fektetnünk a betegek megfelelő edukációjára és tájékoztatására, szükséges, hogy felhívjuk a kórkép természetére a figyelmet (mivel 15%-ban bilaterálisan jelenik meg) (10). Ez azért fontos, hogy megfelelő időben kerüljenek a páciensek szakemberhez és mihamarabb megkaphassák a szükséges terápiát.
Nyilatkozat
A szerzők kijelentik, hogy esetismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Ikuno Y, Ohno-Matsui K, Wong TY, et al. Intravitreal aflibercept injection in patients with myopic choroidal neovascularization: the MYRROR study. America Academy of Ophthalmology 2015; 22(6): 1220–1227.
https://doi.org/10.1016/j.ophtha.2015.01.025
2. Németh J, Tapasztó B, et al. Update and guidance on management of myopia. European Society of Ophthalmology in cooperation with International Myopia Institute. European Journal of Ophthalmology 2021; 31(3): 853–883. https://doi.org/10.1177/1120672121998960
3. Kyoko Ohno-Matsuia, et al. Diagnosis and treatment guideline for myopic choroidal neovascularization due to pathologic myopia. Progress in Retinal and Eye Research 2018; 6: 392–106.
https://doi.org/10.1016/j.preteyeres.2017.10.005
4. Kyoko Ohno-Matsui, Ryo Kawasaki, Jost B. Jonas, et al. International Photographic Classification and Grading System for Myopic Maculopathy, for the Meta-Analysis For Pathologic Myopia (META-PM) Study Group. American Journal of Ophthalmology 2015.01.022. 877–883.e6.
https://doi.org/10.1016/j.ajo.2015.01.022
5. Kyoko Ohno-Matsui, Timothy YY. Lai Chi-Chun Lai, Chiu Ming Gemmy Cheung. Updates of pathologic myopia. Progress in Retinal Eye Research 2016; 52: 156–187. https://doi.org/10.1016/j.preteyeres.2015.12.001
6. Lukács R, Sándor G, Resch M, Szabó A, Barcsay Gy, Ecsedy M, Szepessy Zs, Nagy ZZs, Papp A. Patológiás myopia talaján kialakult érújdonképződés intravitrealis ranibizumab kezelése. Orvosi Hetilap 2017; 158(15: 579–586. https://doi.org/10.1556/650.2017.30704
7. Tae Yokoi, Kyoko Ohno-Matsui. Diagnosis and Treatment of Myopic Maculopathy. Asia-Pacific Journal of Ophthalmology 2018; 7: 415–421.
https://doi.org/10.22608/APO.2018290
8. Tufail A, Patel PJ, Sivaprasad S, et al. Ranibizumab for the treatment of choroidal neovascularization secondary to pathological myopia: interim analysis of the REPAIR study. Eye 2013; 27(6): 709–715.
https://doi.org/10.1038/eye.2013.8
9. Wolf S, Balciuniene VJ, Laganovska G, et al. RADIANCE: A randomized controlled study of ranibizumab in patients with choroidal neovascularization secondary to pathologic myopia. American Academy of Ophthalmology 2014; 121(3): 682–692.e2 https://doi.org/10.1016/j.ophtha.2013.10.023
