Treatment difficulties of ocular toxoplasmosis in a case study during the Covid-19 pandemic
doi: 10.55342/szemhungarica.2023.160.1.32
Case report
Summary
Uveitis may be infectious or non-infectious, often with idiopathic etiology. One of the most common forms of infectious posterior uveitis is toxoplasmosis caused by the protozoa Toxoplasma gondii. After the primary infection the process becomes inactive, dormant, and may recur, especially in immuno compromised individuals. In this case report, we would like to present the case of an immunocompetent young male patient who has been diagnosed with left eye toxoplasmosis years ago at a school ophthalmic screening test. This was followed by a targeted antibiotic and corticosteroid therapy, the process became inactive and then resumed four years later. Serious side effects of general corticosteroid therapy has been observed, so we were able to apply antiinflammatory therapy only locally, however, the process was regressing. Months later, during the Covid-19 pandemic, the process recurred in association with Sars-Cov-2 infection, his condition has worsened. Our patient was treated according to the European Uveitis Recommendations proposed for the Covid-19 pandemic period. Although the visual acuity in the eye with infection seemed impossible to improve based on the clinical overview, his condition became much better, the best-corrected vision was almost 100% (0.9). In this case, we would like to draw attention to the difficulties in the management of patients diagnosed with toxoplasmosis.
Összefoglaló
Az uveitisek fertőzéses és nem fertőzéses eredetűek lehetnek, gyakran ismeretlen az etiológia. Az infekciózus eredetű posterior uveitisek egyik leggyakoribb formája a Toxoplasma gondii protozoa által okozott toxoplasmosis, amely a primer fertőzést követően inaktív állapotba kerül, és főként immunkomprimált egyéneknél kiújulhat. Fiatal férfi betegünk esetében évekkel ezelőtt, iskolai szemészeti szűrővizsgálaton derült fény bal szem toxoplasmosisára. Célzott antibiotikum- és kortikoszteroid-terápiát követően a folyamat inaktívvá vált, majd négy évvel később kiújult. Az alkalmazott általános kortikoszteroid-terápia súlyos mellékhatásai jelentkeztek. További ellátásában gyulladáscsökkentő terápiát kizárólag lokálisan tudtunk alkalmazni, ennek ellenére a folyamat regrediált. Néhány hónappal később, a Covid-19-pandémia során, a folyamat Sars-Cov-2-infekcióval társultan súlyosbodva kiújult. Betegünk kezelése a Covid-19-időszakban használatos Európai Uveitis Ajánlások alapján történt. Látásjavulás mértéke ezen a szemen a klinikai kép alapján igencsak kétesnek tűnt, az alkalmazott terápia hatására viszont állapota jelentősen javult, legjobb korrigált visusa csaknem teljessé (0,9) vált. Esetünk kapcsán szeretnénk felhívni a figyelmet a toxoplasmosissal diagnosztizált páciensek kezelési nehézségeire.Keywords
posterior uveitis, toxoplasmosis, toxoplasma retinochorioiditis
Kulcsszavak
posterior uveitis, toxoplasmosis, toxoplasmás retinochorioiditis
Bevezetés
A Toxoplasma gondii okozta retinochorioiditis az infekciózus uveitisek leggyakoribb formája. A népesség egyharmada lehet krónikusan fertőzött, gyakrabban szerzett, de congenitalis forma is ismert. A T. gondii oocystáit tartalmazó víz vagy élelmiszer elfogyasztásával először a vékonybél epitheliuma fertőződik meg, majd bradyzoita ciszták a véráram útján alvó állapotukban különböző szervekbe, mint például szembe vagy agyba jutnak. A fertőzés egészséges egyénekben rendszerint kezelés nélkül gyógyul, azt követően a kórokozó látens állapotban maradhat, ez viszont reaktiválódhat, ilyenkor a bradyzoita ciszták ruptúrájával aktív tachyzoiták szabadulnak fel, főként immunkomprimált egyénekben (2, 3, 5, 6, 10).
A diagnózis alapjául a jellegzetes klinikai tünetek és szerológiai vizsgálatok szolgálnak. A toxoplasmosis immunkompetens személyeknél spontán is gyógyulhat, látásromlás esetén azonban azonnali terápia szükséges a makula és a látóideg veszélyeztetettségének csökkentésére (1).
Kezelésében célzott terápiaként antimikrobás szerek (pyrimethamin, sulfadiazin, spyramycin, clindamycin és trimethoprim-szulfamethoxazol) játszanak fontos szerepet. A gyulladás csökkentésére kiegészítésként kortikoszteroidot alkalmazhatunk. A clindamycin dózisa naponta háromszor 300 mg, kisdedek esetén pedig testsúlykilogrammonként 250 mg. Szisztémásan alkalmazott prednizolon csökkentheti a gyulladásos gócokat, amely gyermekek esetében minden másnap alkalmazandó 100-150 mg dózisban (4, 7, 8, 13, 15).
Egy fiatal, immunkompetens férfi beteg esetét szeretnénk bemutatni, különösen felhívva a figyelmet a megfelelő terápia kiválasztására.
Esetismertetés
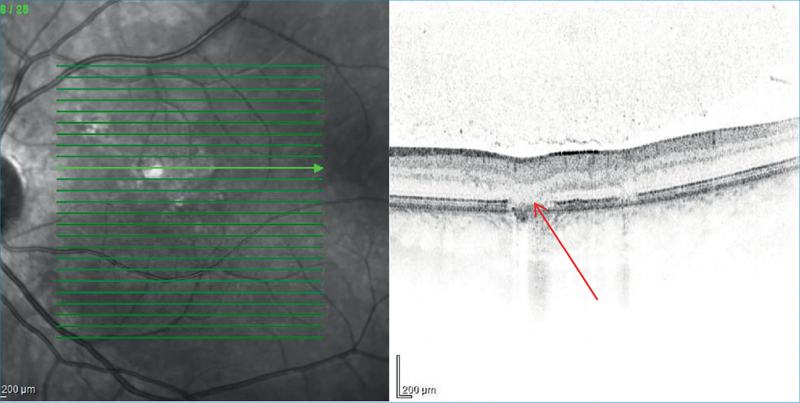
Tizennégy éves, immunkompetens férfi betegünk 2016 nyarán jelentkezett először intézményünkben. Két hónappal korábban, iskolai szűrővizsgálaton észlelték bal szem homályos látását, a gyermek szubjektíve panaszmentes volt. Helyi szemészeti vizsgálaton toxoplasmosis felmerült, szerológia igazolta a korábban lezajlott infekciót. Egy hónapon át napi 3×300 mg per os clindamycin és testsúlyának megfelelő dózisú metilprednizolon-terápiát alkalmaztak. Első, intézményünkben való megjelenése alkalmával jobb szemen 1,0, bal szemen korrekcióval 0,8 volt a látóélessége, kompenzált szemnyomás-értékekkel. Békés, gyulladásmentes elülső szegmentum mellett, bal szemen parafovealisan két inveterált góc, optikai koherencia tomográfia (OCT) alapján a gócoknak megfelelően retina pigmentepithelium-atrófia volt látható (1. ábra). A retinafolyamat inaktív állapota miatt obszerváció mellett döntöttünk.
Kontroll alkalmával gyulladásmentes elülső szegmens mellett az inveterált gócok demarkálódtak, ezzel szinkron az üvegtesti sejtes szórás regrediált, a látóélessége 1,0 lett. Ezt követően a beteg négy évig panaszmentes volt, 2020 nyarán bal szem foltlátása miatt jelentkezett másik intézményben, ahol chorioretinitis miatt dexamethason és ciclopentolat cseppet, illetve lökésterápiában szisztémás metilprednizolont indítottak antimikrobiális védelem nélkül. A kortikoszteroidot napi 500 mg-ról fokozatosan csökkentették a dózist háromnaponta felezve, majd per os terápiára váltottak. A kezelés végéhez közeledve gyomortájéki panaszok jelentkeztek, a beteg széklete sötét színűvé vált. Gasztroszkópia során Los-Angeles-felosztás szerinti C-stádiumú gastroesophagealis refluxbetegséget, oesophagealis, ventralis és duodenalis ulcerációkat találtak, ezért szelektív protonpumpagátló-terápia indult tüneti terápia mellett. Ezt követően intézményünkbe irányították, akkor látóélessége jobb szemen 1,0, bal szemen pedig 0,04 volt.
A korábban leírt parafovealis inveterált gócok mellett a makula területében egy papillányi friss, sárgás-fehér szatellita léziót láttunk a perifériás erek érintettségével (2. ábra).
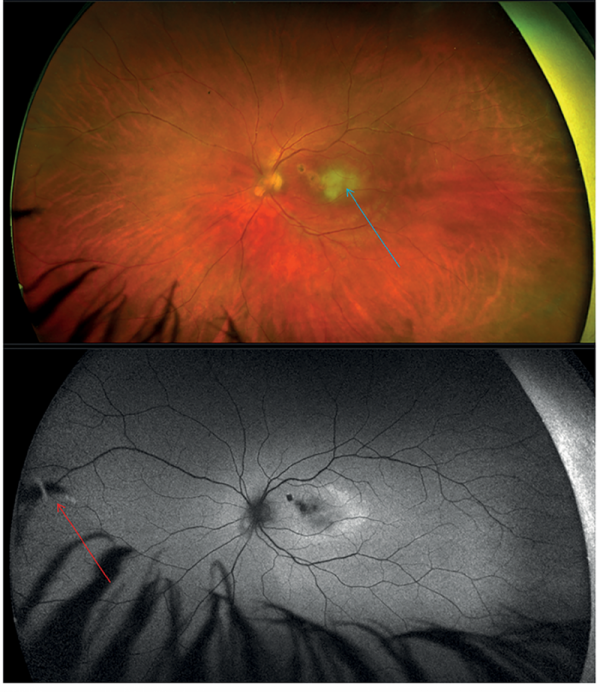
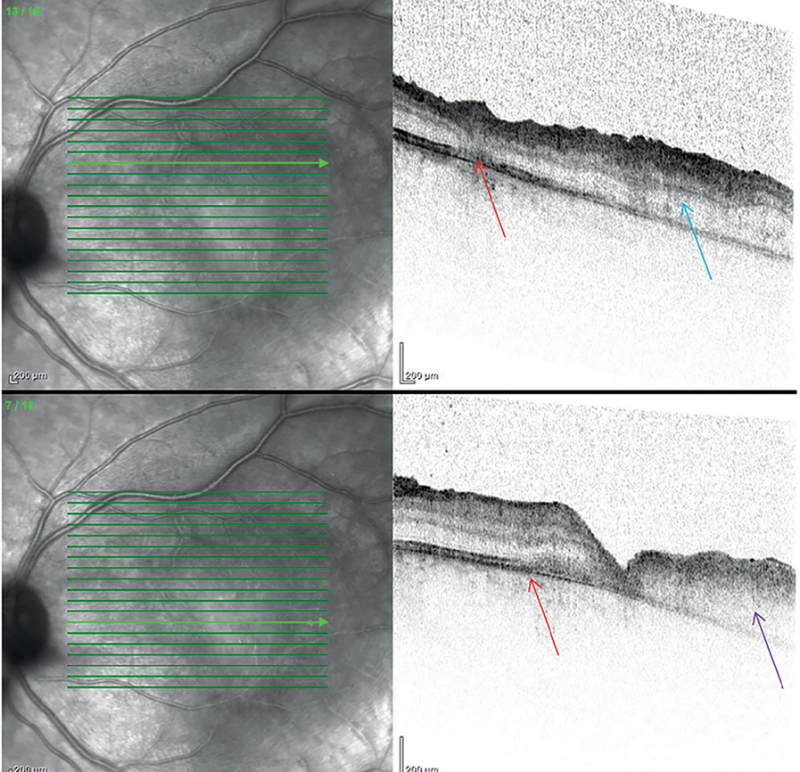
Disszeminációra utalt a nasalis felső érárkád mentén talált új góc, az OCT-felvétel intraretinalis ödémát igazolt (3. ábra).
További terápia céljából osztályos felvétel mellett döntöttünk, bentfekvése során a korábban szerológiailag igazolt toxoplasmosis alapján indult terápia: szisztémás clindamycin hét napon át, napi 4×300 mg dózisban. A gasztroenterológiai panaszok miatt kortikoszteroidot kizárólag szemcsepp és parabulbaris injekciók formájában alkalmaztuk. Státusza a bentfekvés alatt javult, gyulladás mérséklődött, bal szemen 0,3 legjobb korrigált látóélesség mellett emittáltuk. Otthonában per os napi 2×2 szulfamethoxazol (400 mg) és trimethoprim (80 mg) hatóanyag-tartalmú tabletta, napi 3× nonszteroid gyulladáscsökkentő szemcsepp terápia, és szoros obszerváció mellett a friss szatellita léziók demarkálódni kezdtek, látóélessége fokozatosan javult.
Egy hónappal későbbi kontroll alkalmával az üvegtesti térben friss gyulladásos sejtek jelentek meg az elülső szegmens érintettsége nélkül. Intravitrealis triamcinolon beadása mellett döntöttünk a per os antibiotikum- és lokális terápia kiegészítéseként, aminek következtében a gyulladás mértéke csökkent (4, 15). Antibiotikumterápiát további két hónapon át folytattuk. Kontroll alkalmával a legjobb korrigált látóélessége bal szemen 0,4 volt, üvegtesti térben gyulladásos sejtek már nem voltak láthatók. A folyamat inaktívvá vált, így a munkavégzést engedélyeztünk az akkor 18 éves, jó általános állapotú fiatalembernek azzal a kikötéssel, hogy kerülje a nehéz, fizikai és pszichés megterheléssel járó munkát.
2020 decemberében újabb shub miatt jelentkezett ambulanciánkon, bal szemen homályos látást, fényérzékenységet, felfelé tekintéskor nyomó, szúró fájdalmat panaszolt. Visusa jobb oldalon 1,0, bal szemen korrekcióval 0,55 volt. Szemészeti státuszában békés, lobmentes elülső szegmenst, tiszta üvegtestet, éles határú, kissé halványabb látóidegfőt, szabályos eredésű és lefutású ereket, makulatájékon parafovealisan két pigmentszegéllyel övezett, inveterált gócot, a temporális alsó érárkádot beszűrő sárgás exsudatiót, temporálisan-alul ödémás csillogást, valamint temporálisan vérzéseket láttunk. A gócok körül epiretinalis membrán volt sejthető (4. ábra).
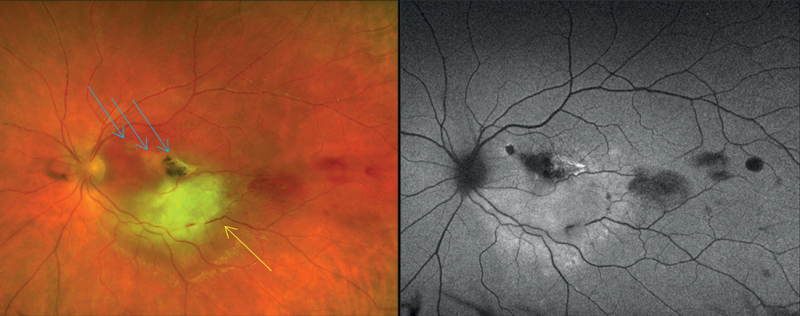
OCT-vizsgálattal a makula inferior részén friss serositast, a belső rétegek rendezetlenségét láttuk, és epiretinalis membrán is igazolódott. Angio-OCT-vel jól láthatóvá váltak a makula inferior részén a nonperfúziós területek, szekunder chorioidea neovaszkularizáció nélkül.
Reaktiváció miatt ismételt osztályos felvétel mellett döntöttünk, anamnéziséből kiemelendő, hogy beteghordóként kezdett el dolgozni a helyi Járványügyi Ellátó Központ Sars-Cov-2-fertőzött betegeket gondozó infektológia fekvőbeteg-osztályán. Elmondása szerint rendszeres gyorsteszt-szűréseket végeztek a dolgozókon, viszont a fokozódó beteglétszám, és a kevés munkaerő miatt a munkaórák száma, és a fizikai igénybevétel ugrásszerűen megnőtt. Erre való tekintettel felvételét megelőzően Sars-Cov-2-gyorstesztet végeztünk, majd PCR-teszt céljából nasopharyngealis mintavétel történt. A gyorsteszt negatív eredményét követően megismételtük a szerológiai vérvételt. Laborparaméterekben eltérést nem találtunk, szerológiai vizsgálat korábban lezajlott Herpes simplex, és Epstein–Barr-vírus-fertőzést, valamint Toxoplasma gondii IgG-szeropozitivitást igazoltak (186 UI/ml). Szisztémás antibiotikum- (clindamycin) terápiában részesült hét napon keresztül napi 4×600 mg dózisban. Tekintettel a korábbi anamnézisre, és arra, hogy az újabb fellángolás a Sars-Cov-2-pandémia közepén történt, kezelése az European Reference Network Uveitis ajánlásai alapján történt (15), így a parenterális antibiotikumterápia mellett kizárólag lokális gyulladáscsökkentő terápiát alkalmaztunk. Bent fekvése harmadik napján a korábban levett PCR-teszt koronavírus-fertőzést igazolt, emiatt a beteget intézetünkön belül izoláltuk, kezelését folytattuk. Betegünk végig láztalan volt, koronavírus-fertőzés tünetei nem jelentkeztek. Hospitalizációja ötödik napján megismételtük az intravitrealis triamcinolon injekciót helyi érzéstelenítésben (4, 15).
Tekintettel a makulát érintő korábbi és friss léziókra, szekunder CNV kialakulásának lehetőségével számoltunk, látásjavulás mértékét kétesnek tartottuk a távozási bal oldali 0,3-hez képest. Otthonában az antibiotikumterápiát szulfamethoxazol és trimethoprim kezeléssel folytattuk.
Kontrollvizsgálatok alkalmával szemfenéki képen gyulladás csökkenését láttuk, vérzések megszűntek, gócok mérete csökkenni kezdett, látásélessége fokozatosan javult. Legutóbbi megjelenésekor látása jobb szemen 1,0, bal szemen korrekcióval 0,9, üvegtesti térben néhány pigmentált sejt, szemfenéken korábbi inveterált gócok, atrófiás terület volt látható. Antibiotikumterápiát ezt követően hetekig folytatta, klinikai kép alapján a folyamat hegesedésirányba tart, aktivitást nem mutat. Betegünket jelenleg is szorosan obszerváljuk, amennyiben szekunder CNV kialakul, anti-VEGF-terápia szóba jön.
Megbeszélés
A toxoplasmosis világszerte a posterior uveitisek jelentős részéért felelős, az érhártya mellett gyakran érinti az üvegtestet, látóidegfőt, retinát ellátó ereket (10, 11, 12, 14).
A diagnózis felállításához a tünetek, valamint jellegzetes funduskép mellett fontos a szerológia vizsgálat. Az IgG-antitestek a primer fertőzést követően 1-2 héttel már kimutathatók a szérumból, és akár egy életen át is pozitívak lehetnek (14). Leggyakrabban fokális, nekrotizáló retinitises gócokat láthatunk, ami gyakran szövődik vitritissel, vasculitissel, ritkább esetekben papillitissel. Későbbi komplikációként gyakran előfordulhat cystoid makulaödéma, és epiretinalis membrán, amelyek a látást veszélyeztető legsúlyosabb szövődmények. Az esetek akár 80%-ában öt éven belül visszatér a gyulladás immunkompetens betegek esetében is (16). Az általunk bemutatott esetben hasonlót tapasztaltunk. A kezelés az ajánlásoknak megfelelően történt egy fiatal, társbetegségek nélküli, jó általános állapotú férfi beteg esetében, ennek ellenére a gyulladás közel 5 éves periódus alatt két alkalommal is reaktiválódott.
Az ellátást nagyban nehezítette a második shub elején fellépő, megadózisú kortikoszteroid-indukálta nyelőcsövet, gyomrot és patkóbelet is érintő fekélyes eróziók jelenléte, amelyek a korábban alkalmazott szisztémás kortikoszteroid-terápia következményei. A nemzetközi ajánlásokat figyelembe véve a gyulladás csökkentése céljából javasolt az általános kortikoszteroid-terápia, betegünk esetében a gasztrointesztinális szövődmények miatt kizárólag lokálisan alkalmazhattuk (7, 8, 9, 14, 16). Az időben elkezdett és célzott antibiotikumterápia, illetve a lokális kortikoszteroid-injekciók együttes alkalmazásával a folyamat regrediált, a gócok demarkálódni kezdtek, az állapot inaktívvá vált.
Fontos a szoros obszerváció, ugyanis a reaktiváció sokszor tünetmentes is lehet. Kontroll alkalmával bár a beteg panaszmentes volt, láthatóvá vált az üvegtest friss gyulladásos állapota, tekintettel a makulát fenyegető reaktiválódott gócra, lokális terápia mellett döntöttünk. Az időben alkalmazott intravitrealis triamcinolon, valamint a célzott antibiotikumterápia folytatása után csökkent a gyulladásos folyamat. Mivel látása is javuló tendenciát mutatott, fizikai kíméletet a továbbiakban nem tartottuk indokoltnak, viszont a panaszmentes periódus ebben az esetben már jelentősen rövidebb volt.
Javaslatunkkal ellentétben, a páciens beteghordóként kezdett el dolgozni egy igencsak sok beteget ellátó járványellátó központban, ahol komoly pszichés és fizikális stressznek volt kitéve, elmondása szerint a hét majdnem minden napján dolgoznia kellett, és állandó fizikális kontaktusban volt a Covid-19 vírussal fertőzött, bent fekvő betegekkel. Felmerült, hogy a fokozott fizikai igénybevétel miatti gyengült immunstátusz okozta a gyulladás reaktivációját. Lehetséges viszont, hogy a tünetmentes Covid-19-infekció következtében lángolt fel a toxoplasmosis. A kiváltó ok jelen esetben nem volt egyértelmű.
A makulát érintő elváltozások miatt nem vártunk jelentős látásjavulást, a folyamat későbbi kimenetele a szekunder chorioidealis neovaszkularizáció, és atrófia kialakulásától függött. A kontrollvizsgálatok folyamán csökkenő méretű gócokat, valamint fokozatosan javuló látóélességet tapasztaltunk. Az OCT egy bármikor reprodukálható, a diagnosztikában, illetve utánkövetésben rendszeresen, rutinszerűen használt vizsgáló módszer, az általa adott kép elemzése mégis szubjektív, a látott képet a klinikummal együtt kell értékelni. Ez alapján sem vártunk jelentős javulást visus, és a status tekintetében, mégis egy jó általános állapotú, 18 éves fiatal szervezettel álltunk szemben.
A maximális – lehetőségek nyújtotta – terápia mellett, megadva az esélyt az akár csekély javulásnak is, kezelését folytattuk. Legutóbbi kontroll alkalmával az érintett szemen, bár a gócok a makula területét továbbra is nagy részben kitöltik, jelentős zsugorodást láthattunk, demarkálódó, hegesedés irányába tartó folyamattal, és jelentős látásjavulással.
További rendszeres kontrollt tervezünk az inaktív gyulladás későbbiekben történő fellángolásának lehetősége miatt.
Következtetések
A toxoplasmosis-inaktivációt követően immunkompetens betegeknél is bármikor kiújulhat. Fellángolás esetén az időben elindított, célzott antibiotikumterápia mellett gyulladáscsökkentés céljából kortikoszteroid adása is fontos. Amennyiben szisztémás felhasználásra nincs lehetőség, a lokális terápia (intraocularis injekció) is jó eredménnyel alkalmazható. Esetünkben, bár a beteg immunstátuszát a Covid-19-infekció is gyengítette, a helyileg alkalmazott gyulladáscsökkentő és célzott szisztémás antimikrobás kezelés mellett a beteg állapota a fellángolásokat követően regrediált, visusa csaknem teljes (0,9).
Következésképpen, főként fiatal betegek esetében, a képalkotó diagnosztikai módszerekkel látott képet mindig egyénre szabottan, a klinikai képpel együtt kell értékelni, megadva az esélyt a további javulásra.
Nyilatkozat
A szerzők kijelentik, hogy speciális esetet ismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Antoniazzi E, Guagliano R, Meroni V, Pezzotta S, Bianchi PE. Ocular impairment of toxoplasmosis. Parassitologia 2008; 50: 35–6. PMID: 18693554
2. Bertrand PJ, Jamilloux Y, Ecochard R, Richard-Colmant G, Gerfaud-Valentin M, Guillaud M, Denis P, Kodjikian L, Sève P. Uveitis: Autoimmunit and Beyond. Autoimmunity Reviews 2019 september; 189: 102351.
https://doi.org/10.1016/j.autrev.2019.102351
3. Butler NJ, Furtado JM, Winthrop KL, Smith JR. Ocular toxoplasmosis II: clinical features, pathology and management. Clin Experiment Ophthalmol 2013; 41: 95–108.
https://doi.org/10.1111/j.1442-9071.2012.02838.x
4. Casoy J, Nascimento H, Silva LMP, Fernandez-Zamora Y, Muccioli C, Dias JRO, Nobrega MJ, Nobrega HAJ, Zummo J, Belfort R. Jr. Effectiveness of treatments for ocular toxoplasmosis. Ocul Immunol Inflamm 2020; 28: 249–255.
https://doi.org/10.1080/09273948.2019.1569242
5. Chung SA, Kim C, Lim JY, Chung YR. Optic perineuritis as an initial presentation of ocular toxoplasmosis: a case report. Int J Ophthalmol 2022 Dec 18; 1512: 2043–2046.
https://doi.org/10.18240/ijo.2022.12.25
6. Hadarits F, Sohár N, Kovács A. Okuláris toxoplasmosis diagnosztikája és kezelése centrális serosus chorioretinopathiával szövődött toxoplasmás retinochorioiditis eset kapcsán. Szemészet 2020; 1571: 11–17.
7. Jasper S, Vedula SS, John SS, Horo S, Sepah YJ, Nguyen QD. Corticosteroids as adjuvant therapy for ocular toxoplasmosis. Cochrane Database Syst Rev 2013 April; 4: CD007417.
https://doi.org/10.1002/14651858.CD007417.pub2
8. Lin HY, Lee WA. The Role of Corticosteroids in Treating Acute Ocular Toxoplasmosis in an Immunocompetent Patient: A Case Report. Front Med Lausanne 2022 Jun 29; 9: 843050.
https://doi.org/10.3389/fmed.2022.843050
9. Porter D, Vemulakonda GA. Toxoplasmosis. American Academy of Ophthalmology. EyeSmart® Eyehealth.
https://www.aao.org/eye-health/diseases/toxoplasmosis-8. Accessed March 25, 2019.
10. Salmon JF. Kanski’s Clinical Ophthalmology Ninth edition 2020. p. p. 456–461.
11. Shodi GS. Uveitis classification Overview. Medscape, updated 18 February, 2020;
12. Smith JR, Liam MA, Arruda SL, Cordeiro CA, Lie S, Rochet E, Belfort R, Furtado JM. Pathogenesis of Ocular Toxoplasmosis. Progress in Retinal and Eye Research 2021. march; 81: 100882.
https://doi.org/10.1016/j.preteyeres.2020.100882
13. Sohár N. Gyermekkori gyulladásos szembetegségek. Szemészet 2015; 1511: 6–22.
14. Süveges I, Csákány B, Dohán J, Erdei A, Fodor M, Géhl Zs, Módis L, Resch M, Sohár N, Szekanecz Z, Szepessy Zs. Uveitis. Medicina könyvkiadó Zrt.; 2023. pp. 29–36., 53–59., 118–122.
15. Touhami S, Bodaghi B, Tucker W. Recommendations for patients with uveitis during the Covid-19 Pandemic. ERN-EYE 2020 april; N003 v1.0
16. Young-Hoon P, Ho-Woo N. Clinical Features and Treatment of Ocular Toxoplasmosis. The Korean Journal of Parasitology 2013. august; 514: 393–399.
https://doi.org/10.3347/kjp.2013.51.4.393
