Serous retinal detachments: diagnostic and therapeutic considerations
doi: 10.55342/szemhungarica.2023.160.1.2
Referential scientific paper
Summary
The aim of this publication is to present our knowledge about serous retinal detachments using case reports, literature reviews, and our own clinical experiences. Serous detachment of the neurosensory retina can occur in the course of several illnesses, such as central serous chorioretinopathy, drug-induced serous retinal detachments, autoimmune and inflammatory disorders, or developmental malformations. By presenting our instructive clinical cases, we summarise the new diagnostic modalities that aid diagnosis and the selection of the most effective available therapeutic tool.
Összefoglaló
Célunk, hogy közleményünkben összefoglaljuk a szerózus retinaleválásokkal kapcsolatos ismereteket, az irodalmi adatok és a saját klinikai tapasztalatok tükrében. A retina neuroszenzoros rétege és pigmenthámja közötti folyadékgyülem kialakulásának hátterében számos betegség állhat, mint a chorioretinopathia centrális serosa, gyógyszer indukálta szerózus leválások, autoimmun és gyulladásos betegségek és fejlődési rendellenességek. Érdekes eseteink bemutatásán keresztül részletezzük a kórkép diagnosztikáját elősegítő multimodális képalkotási módszereket és összegezzük, hogy melyik alcsoportban milyen terápiás lehetőségek alkalmazása a legcélravezetőbb.Keywords
serous retinal detachment, differential diagnosis, therapy
Kulcsszavak
szerózus retinaleválás, differenciáldiagnózis, terápiás lehetőségek
Bevezetés
Szerózus retinaleválás esetén a retina neuroszenzoros rétege és pigmenthámja között folyadékgyülem (1) figyelhető meg, amely ha a makulatájat érinti markáns látási panaszokat okoz és a betegeket jelentősen akadályozza mindennapi életük, munkájuk során. Kialakulásában jelen ismereteink szerint elsősorban az érhártya- (chorioidea) keringés patológiás változásai játszanak szerepet. A chorioidea-erek folyadéknyomásának és érfal permeabilitásának növekedésén keresztül a chorioidealis intersticiális térben folyadék-felhalmozódás jön létre, amely a pigmenthám szekunder károsodásait okozva, a neuroszenzoros retinarétegek alá diffundálva, ezek leválását váltja ki.
A jelenség hátterében számos betegség állhat. Az utóbbi években a multimodális képalkotás terén történt jelentős technikai fejlődés, mint az új generációs optikai tomográfiás (OCT) készülékek, OCT-angiográfia elterjedése, jelentősen gazdagította morfológiai ismereteinket; elősegítve az elváltozás különböző fenotípusainak elkülönítését, differenciáldiagnosztikáját. Ezzel szemben a terápiás lehetőségek esetében továbbra sem történt jelentős áttörés, sok esetben az oki tényezők feltárása és a trigger faktorok kiküszöbölése jelenthet végleges megoldást.
Összefoglaló közleményünkben a szerózus retinaleválások gyógyításában felmerülő diagnosztikus és terápiás problémákat ismertetjük; saját érdekes eseteink és az újabb irodalmi adatok tükrében.
Patofiziológia
A retinalis pigmentepithelium (RPE) és a neuroszenzoros retina szoros kapcsolata egymással, a Bruch-membránnal, illetve az érhártyával elengedhetetlen a normális sejtfolyamatokhoz és így a retina/fotoreceptorok egészséges működéséhez (1). A retina és a pigmenthám közötti szoros adhézió egyrészt az RPE microvillusok szintjében található ragasztószerű interfotoreceptor-matrixnak, másrészt a fotoreceptor külső szegmentek közötti interdigitációnak köszönhető. Ezen hatásokat kiegészíti az RPE-n keresztül zajló, aktív metabolikus transzport és a magas ozmotikus nyomás a chorioideában, amelyet az érhártya szövetközti folyadékában oldott nagy molekulák biztosítanak (2). A másik oldalon a pigmenthám bazálmembránjának a Bruch-membrán belső rétegéhez történő szoros kapcsolódása figyelhető meg, amelyet lamininból és IV., illetve V. típusú kollagén rostokból álló vékony filamentumok biztosítanak proteoglikánok és hemidesmosomák segítségével (3). Minden olyan patológiás folyamat, ami az RPE szintjében fentebb felsorolt erők egyensúlyát megváltoztatja, hatással lesz a retina és az RPE adhéziójára (4, 5). Számos hipotézis szerint a szerózus retinaleválások kialakulásának egyik kulcsmomentuma az érhártya szövetközti terében lévő folyadék felhalmozódása, amelynek hátterében a chorioidea-erek permeabilitásának, vagy hidrosztatikai nyomásának megváltozása állhat. A permeabilitás fokozódását kiválthatják gyulladásos, degeneratív, malignus vagy genetikai folyamatok (6). A hidrosztatikai nyomásváltozás hátterében Spaide indocianin-zöld-angiográfiás (ICG) felvételek alapján, chorioretinopathia centrális serosa és egyéb pachychorioidealis kórkép esetén, a chorioidea-erek anasztomózis képzését írta le a közelmúltban (7).
Etiológia, differenciáldiagnosztika (esetbemutatások)
CSCR és pachychorioideális kórképek
Makulatáji neuroszenzoros leválást a munkaképes korú lakosságnál leggyakrabban szerózus centrális chorioretinopathia (CSCR) esetén figyelhetünk meg. A betegség, mint az irodalomból is jól ismert főként A-típusú személyiséggel rendelkező fiatal vagy középkorú férfiaknál figyelhető meg és az esetek kétharmadában spontán gyógyul három hónapon belül. Legfőbb rizikófaktora az endogén vagy exogén kortizolhatás (8). Az utóbbi évek kutatásai azonban rávilágítottak, hogy az idősebb korosztály és a nők is érintettek lehetnek a betegségben. Esetükben azonban, a kórkép prognózisa lényegesen szerényebb, a recidívák, illetve hosszan tartó fennállás maradandó látáskárosodáshoz vezethet (9). Új diagnosztikus módszerek elterjedése (spectral domain, swept source és angio – OCT) a betegség klinikai képét jelentősen kibővítette, új klinikai formák és alcsoportok jelenlétét igazolta, amelyek közös jellemzője a chorioidea-erek jellegzetes anatómiai elváltozása, amely alapján a betegségspektrum új elnevezésként a pachychorioidealis kórképek nevet kapta. Az elsőként 2018-ban felállított klasszifikáció szerint a CSCR mellé; a pachychorioidealis pigmentepitheliopathiát (PPE), a pachychorioidealis neovasculopathiát (PNV), a polypoid chorioidealis vasculopathiát (PCV), a peripapillaris pachychorioidealis szindrómát (PPS) és a focalis chorioideaexcavatiót (FCE) sorolták az újonnan definiált betegségcsoportba (10). A pachychorioidealis kórképek közös jellemzője a chorioidea kvantitatív vagy kvalitatív eltérése, amelyhez gyakran subretinalis folyadékgyülem társul, esetenként pedig az érújdonképződésnek valamilyen formája is kialakul. A betegségcsoportnak jelenleg nincs standard kezelési protokollja, a többféle kezelési mód közül néhány eredményesebbnek bizonyult, az alcsoportok között azonban lényeges különbségek mutatkoztak (11). A következőkben két saját esetet ismertetünk, amelyek érzékeltethetik a betegség diagnosztikai és terápiás nehézségeit.
Első eset
Az első egy 51 éves metasztatikus emlőkarcinóma miatt multiplex onkológiai kezelésben (anastrozol: Letrozol, goserelin: Zoladex és ribociklib: Kisquali) részesülő nőbeteg, aki jobb szemén 3 hónapja fennálló torzlátás és olvasási nehézségek miatt jelentkezett klinikánkon. Szemészeti anamnéziséből kiemelendő, hogy bal szeme gyermekkora óta tompalátó. A beteg kezdeti legjobb korrigált látóélessége jobb szemen 0,3 bal szemen pedig 0,4 volt (Snellen-tábla). Az elvégzett fluoreszcein-angiográfiás (FLAG) és OCT-vizsgálatok a beteg jobb szemén, a makulatájon magas szerózus retinaleválást igazoltak, a parafoveális területen pigmenthámleválással, amely szélénél az angiográfián fokozódó festékszivárgást mutató forrópont ábrázolódott (1. ábra). Tekintettel a beteg súlyos panaszaira, hiszen a jól látó szemén a centrális látás csökkenése az életminőségét jelentősen megrontotta, számítógépes munkavégzését megakadályozta, Navilas-lézer segítségével a szivárgó pont küszöbérték alatti mikropulzus lézerkezelése (SMLT) mellett döntöttünk (1. ábra). Választásunkat a beteg általános állapota, onkológiai kezelése is indokolta; hiszen az SMLT esetében szisztémás mellékhatással egyáltalán nem kell számolnunk. A kezelést követő 3 hónap alatt a neuroszenzoros leválás fokozatosan megszűnt, a pigmenthám-leválás jelentősen csökkent és a beteg látóélessége a 3. hónapra 1,0-re javult, ami az eltelt 12 hónapos követési idő alatt tartósan meg is maradt.
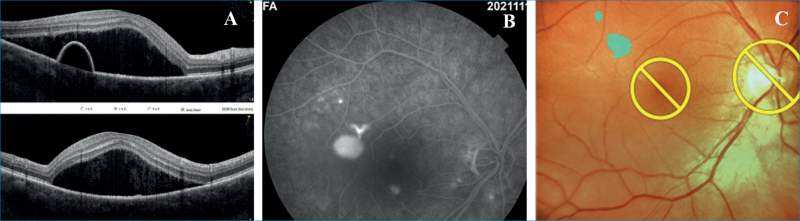
Második eset
Második betegünk egy 72 éves Takayasu-arteritisben szenvedő nőbeteg, akit 2016 óta követünk klinikánkon. A beteg alapbetegsége miatt folyamatos metilprednisolon (Medrol) kezelésben részesült. Szemészeti panaszai első megjelenése előtt 10 hónappal kezdődtek; bal szemén centrális homályos látással (legjobb korrigált látóélesség BCVA: 0,7 Snellen-táblán), amelynek hátterében OCT és fundus biomikroszkópia alapján bal oldali krónikus CSCR-t véleményeztünk. Érfestéses vizsgálatra a beteg kardiológiai állapota miatt nem volt lehetőségünk. A követés során a folyadékgyülem spontán fluktuációt mutatott, majd miután 2017-ben kardiológiai indikáció miatt a betegnél per os eplerenonkezelést indítottak, tartósan felszívódott és másfél éven keresztül a betegség inaktív stádiumba került. A beteg látóélessége 1,0-re javult. 2018 novemberében a beteg hirtelen látásromlást észlelt bal szemén (BCVA osin: 0,5), a szemfenéken premakuláris vérzést találtunk, az angio OCT en-face scaneken pedig a choriocapillaris rétegben érújdonképződéses membrán (CNV) ábrázolódott. A beteg anti-VEGF-kezelését a kardiológus nem javasolta, így a későbbiekben az állapot változását csak megfigyelni tudtuk. 2020 szeptemberére a subretinalis folyadék fokozatos spontán felszívódást mutatott a CNV hegesedésével, a beteg látóélessége 0,5-nél stabilizálódott (2. ábra).
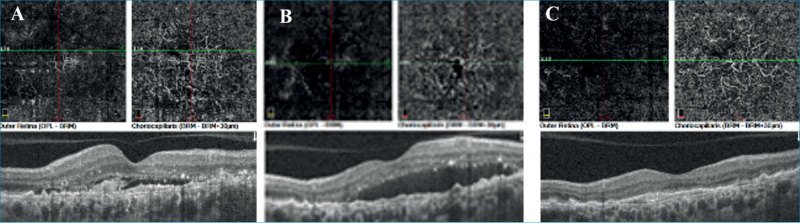
Gyógyszer okozta pseudo-CSCR
Egy 48 éves nőbeteg kétoldali homályos látás miatt kereste fel ambulanciánkat. A vizsgálat során mindkét szemén a látóélesség korrekció nélkül 0,8; +0,5 Dsph-al korrigálva 1,0 volt. A réslámpás vizsgálat az elülső szegmentumban kóros eltérést nem igazolt, szemnyomása a normáltartományban volt. A szemfenéken mindkét oldalon a foveában enyhe reflextorzulás volt megfigyelhető. A makula OCT-vizsgálata mindkét szemben az ETDRS (Early Treatment Diabetic Retinopathy Study) rács centrális 1 mm-es zónájában szerózus retinaleválást mutatott (3. A ábra). A beteg az általános anamnézis felvétele során elmondta, hogy 5 évvel a jelen vizsgálat előtt mellkasáról malignus melanomát távolítottak el. 2 hónapja nehézlégzést, mellkas- és derékfájdalmat észlelt, amely hátterében a komputertomográfiás (CT) vizsgálat pleurális térfoglalást véleményezett. A tüdőbiopszia BRAF-pozitív metasztázisokat igazolt (3. B ábra). Kombinált kobimetinib és vemurafenib onkológiai kezelést indítottak. A kobimetinib a mitogén-aktivált protein-kinázok (MAPK vagy MEK)-gátlók csoportjába tartozó enzim, amelynek az intracelluláris jelátvitelben van szerepe, a génexpressziót, a sejtosztódást és sejtproliferációt befolyásolva. A MEK-gátlókat az onkológia kezelés során általában szerin-treonin-protein-kináz (BRAF)-gátlókkal adják kombinációban. A BRAF-gátlók (pl. vemurafenib) inoperábilis malignus melanomák és azok áttétei esetén alkalmazzák a tumor/metasztázis volumenének csökkentésére. Esetünkben az onkológus a szempanaszok jelentkezését követően a kezelést 1 hónapra felfüggesztette, majd alacsonyabb dózis mellett újraindította. A subretinalis folyadék a gyógyszer felfüggesztését követően eltűnt (3. A ábra), majd annak ismételt szedése mellett szubjektív panaszok nélkül hullámzó mértékben perzisztált. Fél évvel a szempanaszok megjelenését követően a kontroll-CT-vizsgálat kifejezett progressziót mutatott, disszeminált metasztázisokkal (3. C ábra), amelyek következtében a beteg elhunyt.
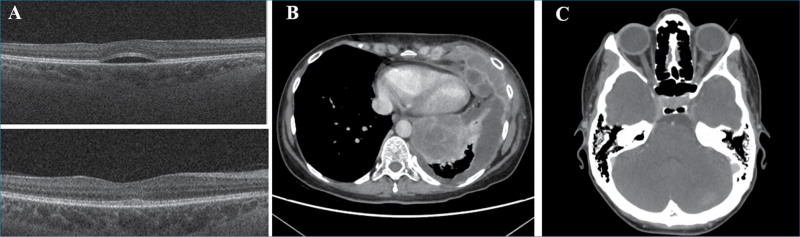
A mitogén-aktivált proteinkináz- gátló szedéséhez kapcsolódó retinopathiát (MEKAR) 2011-ben írták le először (12). A retinopathia rapidan jelentkezik a gyógyszer első dózisát követően. A leggyakrabban előforduló szemészeti panaszok a homályos látás, a metamorphopsia és a színlátás zavarai (13). A panaszok hátterében az OCT-vizsgálat leggyakrabban szoliter vagy multifokális szerózus retinaleválást, cisztoid makulaödémát, illetve az ellipszoid réteg kiszélesedését igazolja. Ritkán subretinalis granuláris lerakódás is megfigyelhető. A MEKAR-ra nem jellemző a chorioretinopathia centralis serosa (CSCR) eseteiben kimutatható festékszivárgás a fluoreszcein-angiográfiás (FA), illetve indocianin-zöld-angiográfiás (ICGA) felvételeken (14). A retinopathia valószínűleg a MEK-gyógyszerek direkt RPE toxikus hatása következtében alakul ki. Ez a toxikus hatás eddigi ismereteink szerint a transzportfolyamatokban résztvevő ioncsatornákat és pumpákat érinti, azonban leírtak anti-retinalis és anti-RPE autoantitestek jelenlétét is MEKAR-os betegekben (15). A subretinalis folyadékgyülem általában a gyógyszer folyamatos szedése mellett is spontán eltűnik, a beteg funkcionális panaszai javulnak.
Aromás aminosavakat tartalmazó, kereskedelmi forgalomban elérhető hajfestékek használata mellett is leírtak kétoldali szimmetrikus subretinalis folyadékgyülemet. Az elváltozások általában pár nappal a behatást követően alakulnak ki. A képalkotó vizsgálatok a MEKAR-hoz hasonló elváltozásokat mutatnak, amelyek spontán regrediálnak. A folyamat hátterében itt is direkt RPE-toxicitást valószínűsítenek, amely a fibroblaszt növekedésifaktor-receptor és a mitogén-aktivált protein-kináz jelátviteli utakat érintheti (16).
A metasztatikus melanomák és tüdődaganatok, valamint a Hodgkin-lymphomák kezelésénél alkalmazott checkpoint-inhibitorok (pl. prembolizumab, nivolibumab) mellékhatásaként leírtak Birdshot-retinopathiára hasonlító szemfenéki eltéréseket (17). A szemfenéki eltérések spektruma igen széles lehet – a jellegzetes több fókuszú sárgás érhártya eltérések mellett – leírtak olyan eseteket is, amelyben kizárólag subretinalis folyadékgyülem volt megfigyelhető. A retinopathia hátterében a monoklonális ellenanyagok T-szupresszor-sejteket gátló hatása áll, amely a T-sejtes immunválasz fokozódásán keresztül alakít ki egy autoimmun folyamatot a retinában (18). A retinopathia a checkpoint-inhibitor-kezelés felfüggesztésével és/vagy lokális kortikoszteroidok alkalmazása mellett megszűnik.
A popper-ek az aromás nitritek kémiai csoportjába tartozó parti- és szexdrogok. A popper-ek leggyakrabban alkil-nitriteket, vagy izopropil-nitriteket tartalmaznak. Ezeket az anyagokat nemcsak az illegálisan árult drogok tartalmazhatják, hanem egyszerű háztartási termékekben, mint pl. légfrissítők is előfordulnak. Orron keresztül belélegezve értágulattal, szívfrekvencia-növekedéssel járó izgalmi állapotot, „rush”-t okoznak (18). A leggyakoribb szemészeti tünet a szer használatát követően a homályos látás és átmeneti centrális látótérkiesés. A látáspanaszok hátterében a szemfenéken uni- vagy bilaterális sárgás szemfenéki depozitumok figyelhetők meg. Az OCT-vizsgálaton az ellipszoidréteg megszakadása látható, amely gyakran összetéveszthető egy körülírt subretinalis folyadékgyülemmel (20). Az FA- és ICGA-vizsgálatok ilyen esetben sem mutatnak festékszivárgást, azonban az autofluoreszcenciás vizsgálatnál (FAF) – a depozitumoknak megfelelően – enyhe hiperfluoreszcencia jelenhet meg. A szer elhagyását követően a szemfenéki eltérések lassan visszafejlődnek (21).
Neuroszenzoros leválások gyulladásos és egyéb kórképekben
Szerózus retinaleválások jelentkezhetnek autoimmun/gyulladásos kórképekben is. Ha nemcsak a makulatájon látható neuroszenzoros retina-elemelkedés, hanem a retina perifériáján is, mindig gondoljunk autoimmun betegségekre, illetve ha az elülső vagy a hátsó szegmentumban gyulladásos jelek mutatkoznak.
A leggyakoribb gyulladásos ok a hátsó uveitisek közé tartozó chorioiditisek/white-dot szindrómák és plakoid chorioretinopathiák valamint a Vogt–Koyanagi–Harada- szindróma.
Első eset
Egy 38 éves nőbeteg bal szem látásromlása, centrális foltlátása miatt került intézetünkbe. Anamnézisében sem szemészeti, sem belgyógyászati betegség nem szerepelt. Szemészeti vizsgálatakor a legjobb korrigált látóélessége jobb szemén 1,0, bal szemén pedig 0,1 volt. Amsler-rács segítségével a bal szemén centrális scotoma volt kimutatható. Réslámpás-vizsgálat során mindkét oldalon békés elülső szegmentumot láttunk. Biomikroszkópos vizsgálatakor jobb oldalon ép fundus, bal oldalon a makulát magába foglaló, a teljes hátsó pólust érintő nagy, sárgásfehér, plakoid, halvány szélű, összefolyó elváltozás volt megfigyelhető. FLAG-vizsgálaton a plakoid léziónak megfelelően a korai felvételeken leopárdmintás festéktelődést láttunk (4. ábra). A beteg általános kivizsgálása során rutin laborleletében eltérés nem volt. Tuberkulózis és sarcoidosis kizárása céljából rendelt mellkas-röntgenvizsgálat nem mutatott kórosat, illetve az elvégzett Quantiferon TB Gold-teszt is negatív eredménnyel zárult. A beteg szerológiai vizsgálata során azonban Treponema pallidum IgM-pozitivitás igazolódott. Más szerológiai laboreltérése nem volt kimutatható (Borrelia, Toxoplasma, EBV, HSV1, VZV, HSV2, CMV, HIV-teszt eredménye negatív lett). A klinikai kép és a szerológiai eredmény alapján akut szifiliszes poszterior plakoid chorioiditist (ASPPC) diagnosztizáltunk. Betegünknél ezután neurológiai vizsgálat történt; koponya-mágnesesrezonancia (MR) és liquorpunkciója eltérést nem mutatott. Szisztémás, intravénás penicillinterápiában részesült 3 héten keresztül, amelynek hatására bal szemén látóélessége javult, majd teljessé vált. A makula OCT-vizsgálatakor a subretinalis folyadék felszívódását észleltük. A szemfenéki eltérések 3 hónap után már nem voltak kimutathatók.
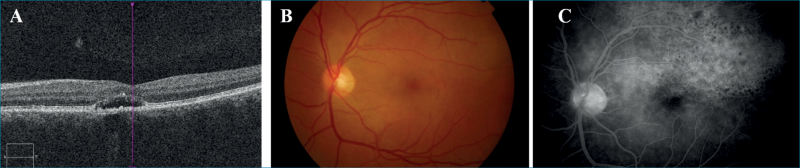
Második eset
Következő esetünk egy 41 éves nőbeteg, aki 3 hete tartó kétoldali látásromlással, valamint gyakori szem-, illetve fejfájással jelentkezett intézetünkben. Szemműtéte, szemsérülése nem volt. Legjobb korrigált látóélessége 0,5/0,5 volt. Az elülső szegmentumban granulomatosus gyulladásra jellemző „szalonnás” precipitátumok mellett; a makulában mindkét oldalon magas szerózus retinelaválás és perifovealisan pedig kisebb multiplex, szerózosus retinaleválások voltak láthatóak. FLAG-vizsgálaton csökkent chorioidea-perfúziót, a korai felvételeken pedig pontszerű festékszivárgásokat („pinpoint”), míg a késői felvételeken festékhalmozást találtunk a szerózus retinaleválásoknak megfelelően (5. ábra).
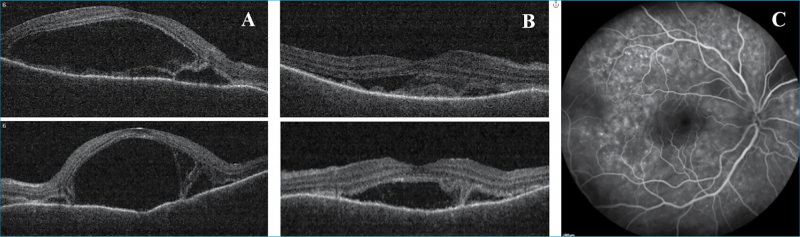
A beteg általános kivizsgálása során a szerológiai vizsgálat aktív fertőzést nem (korábban átvészelt EBV, HSV1, Rubeola, Toxoplasma gondii, VZV) igazolt. Tuberkulózis és sarcoidosis sem igazolódott. A beteg látásromlását megelőzően néhány hete fejfájásról panaszkodott, illetve felvételét követően fülzúgása alakult ki. Neurológiai vizsgálata során neurológiai kórjelet nem találtak és koponya-MR-vizsgálata is negatív eredménnyel zárult (lumbálpunkciótól eltekintettek a neurológusok). Fül-orr-gégészeten bal fül halláscsökkenését véleményezték. A klinikai kép alapján inkomplett Vogt–Koyanagi–Harada-szindrómát feltételeztünk, és szisztémás szteroidterápiát (1,5 mg/tskg/nap) indítottunk, kétnaponta csökkenő dózisban. A szisztémás szteroidterápia hatására látóélessége javult, elülső szegment gyulladása és a szerózus retinaleválások megszűntek. Majd a kezelés elindítása után egy hónappal a betegnél megjelentek a betegség bőrgyógyászati tünetei: az alopecia és a poliosis is, így a Vogt–Koyanagi–Harada-szindróma komplett formáját diagnosztizálhattuk. A betegnél szisztémás szteroidterápia mellett immunszuppresszív terápiát vezettünk be (cyclosporin). Jelenleg a beteg legjobb korrigált látóélessége 1,0/1,0; a beteg panaszmentes.
Posterior scleritiseknél is találkozhatunk szerózus retinaleválásokkal.
Nem szabad azt elfelejteni, hogy az endogén uveitisek kezelésekor alkalmazott szteroidterápia mellékhatásaként is jelentkezhet centrális serosus chorioretinopathia. Ekkor a szteroid elhagyása javasolt és a beteget minél előbb immunszuppresszív kezelésre kell átállítani.
Harmadik eset
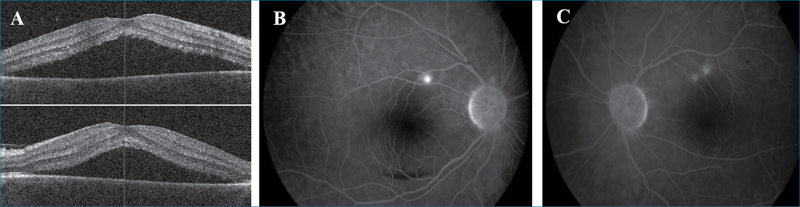
Következő esetünk: egy 35 éves férfi beteg, akinek anamnézisében 3 hónappal ezelőtti kétoldali panuveitis szerepelt (Vod 0,3; Vosin 0,4). Az elindított általános kivizsgálások sarcoidosist diagnosztizáltak, amelyet pulmonológusok általános szteroidterápiával kezeltek. A szteroidterápia után 6 héttel mindkét szemen látásromlás, centrális foltlátás alakult ki. Felmerült uveitis recidíva lehetősége, emiatt került ismételten intézetünkbe. Szemészeti vizsgálatakor a legjobb korrigált látóélessége mindkét szemén 0,7 volt. Réslámpás-vizsgálat során mindkét szemen békés elülső szegmentumot láttunk. Biomikroszkópos vizsgálat során mindkét oldalon a makulában neuroszenzoros retinaelemelkedés volt megfigyelhető, amelyet makula-OCT- és FLAG-vizsgálat is alátámasztott (6. ábra). Aktív gyulladásos jeleket az elülső és hátsó szegmentumban sem láttunk. A klinikai kép alapján szteroid indukálta centrális szerózus chorioretinopathiát diagnosztizáltunk. Betegünknél ezután a szteroidterápiát immunszupresszív kezelésre (metothrexat) váltottuk, amely hatására a látóélesség 1,0 lett, a szerózus retinaleválás a makulában mindkét oldalon megszűnt.
Diagnosztika – Multimodális képalkotás
A betegség diagnosztikájában, tekintettel az etiológia széles spektrumára, a beteg részletes szemészeti és általános anamnézisfelvétele kulcsfontosságú, különös tekintettel a beteg által szedett általános vagy topikális gyógyszerekre, étrend-kiegészítőkre, életmódi jellemzőkre.
A multimodális képalkotó eszközök közül a korábban használt érfestéses vizsgálatok; mint az indocianin-zöld vagy a fluoreszcein-angiográfia szerepe az utóbbi években jelentősen visszaszorult az optikai koherenciatomográfia elterjedésével. Szerózus retinaleválások esetén az angiográfiás vizsgálatok azonban számos esetben jelenleg sem mellőzhetőek, mert jelentős, olykor kizárólagos segítséget nyújthatnak a szerózus leválás kialakulását okozó esetleges háttérbetegségek megtalálásában, illetve kizárásában. Az indocianin-zöld-angiográfia nélkülözhetetlen a chorioideális gyulladásos folyamatok diagnózisához, és a terápia tervezésében is jelentős segítséget nyújt a fotodinámiás kezelések esetében a lézerezendő terület nagyságának és lokalizációjának megválasztásában. A fluoreszcein-angiográfia a szivárgó pontok identifikálására (főként a lézeres terápiák tervezésénél) és a neovaszkuláris vagy polypoideális komponensek detektálására továbbra is hasznos módszer (22).
A chorioidea háromdimenziós szerkezetének, rétegeinek elemzésére az optikai koherenciatomográfia új generációs modelljei segítségével lett lehetőség. A spectral domain (SD-) OCT új fejlesztése, a kiterjesztett mélységi képalkotás (enhanced depth imaging, EDI-OCT) szoftver kitüntetett pontokban készített manuális mérések felhasználásával képes a chorioidea morfológiájának és vaszkularizációjának jellemzésére, a swept source (SS-) OCT pedig a jobb áthatolóképességnek köszönhetően az üvegtest, a chorioidea és a sclera egyidejű ábrázolására is képes (23 ,24, 25).
Krónikusan fennálló CSCR, valamint gyulladásos betegségek esetében, a chorioretinitises gócban vagy környezetében jelentkező neuroszenzoros elemelkedésnél különösen fontos a chorioidealis neovaszkularizáció (CNV) kizárása, amely differenciálásában, napjainkban már az OCT-angiográfia lehet segítségünkre (26). Ez a terápia (anti- VEGF-kezelés) megválasztásában döntő fontosságú (6. ábra).
Terápiás lehetőségek
A szerózus retinaleválások esetén terápiás célpontként a pigmenthámsejtek, illetve a chorioidea érhálózata jöhet szóba. Egyes próbálkozások az RPE pumpafunkcióinak javításával célozzák a szerózus folyadékgyülem mihamarabbi eltávolítását a subretinalis térből. Más esetekben a chorioiodea-erek permeabilitásának helyreállítása, illetve az érhártya folyadékterhelésének csökkentése segíthet a folyadék retina alá vándorlásának megakadályozásában.
A pachychorioidealis kórképekre azonban, a mai napig nincs jól bevált kezelési protokoll. Az utóbbi években a CSCR elsődlegesen választandó kezelése a verteporfinos fotodinámiás terápia, amely azonban sajnálatos módon jelenleg, hazánkban és a világ nagy részén a verteporfin gyártási problémái miatt elérhetetlenné vált. A korábban reménykeltő megoldásként bevezetett mineralokortikoid-antagonista (eplerenon) kezelés használatát pedig, a VICI-tanulmány óta megkérdőjelezik (27). A kezelés alapját az adta, hogy az érhártyában mineralokortikoid-receptorok jelenlétét igazolták, amelyek aktivációja állatkísérletes és farmakológiai tanulmányokban ezen erek tágulatát és permeabilitás-fokozódását váltotta ki, subretinalis folyadékgyülem kialakulásához vezetve (28, 29). A legújabb metaanalízis is az eplerenonkezelés gyenge hatékonyságát véleményezte mind a látóélesség javulása, mind a subretinalis folyadék felszívódása szempontjából (30). A küszöbérték alatti mikropulzus lézerkezelés (SMLT) alkalmazásával is számos esetsorozat-tanulmány látott napvilágot igen kedvező hatékonysági és biztonságossági eredménnyel, bár az ezekben észlelt folyadékfelszívódási arányt az azóta publikált prospektív, randomizált klinikai vizsgálatban (PLACE STUDY) nem sikerült reprodukálni (31, 32, 33, 34). A kezelést kétféle módszerrel ajánlják: egyik esetben a FLAG-on ábrázolódó szivárgó pontot kezelik komputeres (Navilas-lézer), vagy manuális identifikálás után, másik esetben a neuroszenzoros leválás egész területén végeznek a foveát is magában foglaló SMLT-kezelést. Az SMLT-kezelés PDT-vel összehasonlítva; hatékonyságát tekintve szerényebb eredményt mutatott, biztonságossági profilja azonban kedvezőbb; sem általános sem helyi károsodást nem írtak le alkalmazását követően (34, 35). A kezelés sikerességének szempontjából egyik legfontosabb tényezőnek a betegség fennállási idejét tartják, minél hamarabb döntünk az SMLT alkalmazása mellett, annál valószínűbb a kedvező kimenetel (35). A gyógyszer vagy egyéb kemikália által okozott szekunder szerózus leválások kezelésében természetesen elsődleges a kiváltó ok felismerése és annak lehetőség szerinti elkerülése.
Amennyiben chorioideális neovaszkularizáció is jelen van, a választandó terápia az anti-VEGF-szerek intravitreális alkalmazása. Az injekciók gyakorisága, és a szükséges injekciószám azonban kevésbé standardizált, mint a multicentrikus tanulmányokban vizsgált időskori makula degeneráció (AMD), vagy diabéteszes makulaödéma esetében (36). Gyulladásos kórképek, illetve krónikus CSCR vagy PNV esetén általában lényegesen kevesebb injekcióval sikerül a retina szárazságát biztosítani (37). Ezzel szemben polypoid vasculopathia kialakulásakor, az AMD-ben használatos töltő dózis és „treat and extend” protokoll szerényebb eredményeket garantál. Ezeknél a betegeknél korábban az anti-VEGF-kezelés PDT-vel történő kombinációját ajánlották (38). Jelenleg pedig megfontolandó a töltődózis 6 injekcióra emelése, illetve a későbbi szorosabb monitorizálás, intenzívebb kezelés a legjobb eredmény elérése érdekében (38).
Ha a szerózus leválás hátterében gyulladásos kórkép igazolódik, az alapbetegség kezelése jelenthet megoldást szisztémás szteroid adásával. Nem szabad elfelejtenünk azonban, hogy endogén uveitisek kezelésekor alkalmazott szteroidterápia mellékhatásaként is jelentkezhet centrális szerózus chorioretinopathia. Ekkor a szteroid elhagyása, és a beteg immunszuppresszív kezelésre történő átállítása javasolt.
Következtetések
A szerózus retinaleválások hátterében számos szisztémás betegség állhat, amelyek az érhártya perfúzióját, illetve érpermeabilitását befolyásolják különböző patofiziológiai folyamatok által. A pontos diagnózis felállításában ezért jelentős segítséget nyújthat a modern multimodális képalkotás; különös tekintettel az érhártya leképezését is biztosító angiográfiás (ICG) és új generációs OCT-készülékekre (EDI üzemmód, Swept-source OCT). Az OCT-angiográfia pedig különösen hasznos a betegséghez esetlegesen társuló CNV-k kimutatásában.
Az elváltozás hátterében gondoljunk gyulladásos eredetre, ha a beteg autoimmun kórképben szenved, gyulladásos jeleket látunk az elülső vagy a hátsó szegmentumban, a perifériás chorioideában/retinában is látható elváltozás. A retinaleválás hátterében mindig gondoljunk beteg által szedett általános vagy topikális gyógyszerek, étrend-kiegészítők lehetséges retinára gyakorolt mellékhatására is. A szerózus retinalis folyadékgyülemek kezelésére jelenleg nem létezik egységes protokoll. Leggyakrabban a háttérbetegség kezelése, vagy a kiváltó állapot megszüntetése jelenthet végleges megoldást.
Nyilatkozat
A szerzők kijelentik, hogy speciális eseteket ismertető továbbképző közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Marmor MF. Structure, function, and disease of the retinal pigment epithe-lium. In The Retinal Pigment Epithelium. Edited by Marmor MF, Wolfens-berger TJ. New York: Oxford University Press; 1998. p. 3–9.
2. Wolfensberger TJ, Chiang RK, Takeuchi A, et al. Inhibition of membrane bound carbonic anhydrase enhances subretinal fluid absorption and retinal adhesiveness. Graefes Arch Clin Exp Ophthalmol 2000; 238: 76–80.
http://doi.org/10.1007/s004170050013
3. Marshall J, Hussain AA, Starita C, et al. Aging and Bruch membrane. In TheRetinal Pigment Epithelium. Edited by Marmor MF, Wolfensberger TJ. New York: Oxford University Press; 1998. p. 669–692.
4. Yoon YH, Marmor MF: Retinal pigment epithelium adhesion to Bruch’s membrane is weakened by hemicholinium-3 and sodium iodate. Ophthalmic Res 1993; 25: 386–392. http://doi.org/10.1159/000267341
5. Chiang RK, Yao XY, Takeuchi A, et al. Cytochalasin D reversibly weakens retinal adhesiveness. Curr Eye Res 1995; 14: 1109–1113.
http://doi.org/10.3109/02713689508995817
6. Wolfensberger TJ, Tufail A. Systemic disorders associated with detachment of the neurosensory retina and retinal pigment epithelium. Current Opinion in Ophthalmology 2000; 11: 455–461.
http://doi.org/10.1097/00055735-200012000-00012 PMID: 11141641
7. Spaide RF, Gemmy Cheung CM, Matsumoto H, et al. Venous overload choroidopathy: A hypothetical framework for central serous chorioretinopathy and allied disorders. Progress in Retinal and eye Research 2022 Jan; 86: 100973. PMID: 34029721 http://doi.org/10.1097/00055735-200012000-00012
8. Pryds A, Sander B, Larsen M. Characterization of subretinal fluid leakage in central serous chorioretinopathy. Invest Ophthalmol Vis Sci 2010; 51(11): 5853–5857. http://doi.org/10.1167/iovs.09-4830
9. Perkins SL, Kim JE, Pollack JS, et al. Clinical characteristics of central serous chorioretinopathy in women. Ophthalmology 2002; 109: 262–266.
http://doi.org/10.1016/s0161-6420(01)00951-4
10. Daruich A, Matet A, Dirani A, et al. Central serous chorioretinopathy: recent findings and new physiopathology hypothesis. Prog Retin Eye Res 2015; 48: 82–118.
http://doi.org/10.1016/j.preteyeres.2015.05.003. Epub 2015 May 27.
11. Gergely R, Ecsedy M, Kovács I, Papp A, Resch M, Récsán Zs, Szabó A, NagyZ Pachychorioidealis kórképek. Orvoi Hetilap 2021; 162(20): 770–781.
http://doi.org/10.1556/650.2021.32062
12. Velez-Montoya R, Olson J, Petrach M. Acute Onset Central Serous Retinopathy In Association With Mek Inhibitor Use For Metastatic Cancer. IOVS 2011; 52: 2153. ARVO Annual Meeting Abstract
13. de la Cruz-Merino L, Di Guardo L, Grob JJ, et al. Clinical features of serous retinopathy observed with cobimetinib in patients with BRAF-mutated melanoma treated in the randomized coBRIM study. J Transl Med 2017; 15(1): 146.
http://doi.org/10.1186/s12967-017-1246-0
14. van Dijk EH, van Herpen CM, Marinkovic M, Haanen JB, et al. 2015. Serous Retinopathy Associated with Mitogen-Activated Protein Kinase Kinase Inhibition (Binimetinib) for Metastatic Cutaneous and Uveal Melanoma. Ophthalmology 122: 1907–1916.
http://doi.org/10.1016/j.ophtha.2015.05.027
15. van Dijk EH, Duits DE, Versluis M, Luyten GP, Bergen AA, et al. Loss of MAPK Pathway Activation in Post-Mitotic Retinal Cells as Mechanism in MEK Inhibition-Related Retinopathy in Cancer Patients. Medicine (Baltimore) 95: e3457.
http://doi.org/10.1097/MD.0000000000003457
16. Chiang RK, Yao XY, Takeuchi A, et al.: Cytochalasin D reversibly weakens retinal adhesiveness. Curr Eye Res 1995; 14: 1109–1113.
http://doi.org/10.3109/02713689508995817
17. Wolfensberger TJ, Tufail A. Systemic disorders associated with detachment of the neurosensory retina and retinal pigment epithelium. Current Opinion in Ophthalmology 2000; 11: 455–461. http://doi.org/10.1097/00055735-200012000-00012
18. Spaide RF, Gemmy Cheung CM, Matsumoto H, Kishi S, Boon CJF, van Dijk EHC, Mauget-Faysse M, Behar-Cohen F, Hartnett ME, Sivaprasad S, Iida T, Brown DM, Chhablani J, Maloca PM. Venous overload choroidopathy: A hypothetical framework for central serous chorioretinopathy and allied disorders. Prog Retin Eye Res 2022 Jan; 86: 100973.
https://doi.org/10.1016/j.preteyeres.2021.100973
19. Davies AJ, Kelly SP, Bhatt PR. “Poppers maculopathy” an emerging ophthalmic reaction to recreational substance abuse. Eye 2012 Jun; 26(6): 888.
http://doi.org/10.1038/eye.2012.37
20. Gruener AM, Jeffries MA, El Housseini Z, et al. Poppers maculopathy. Lancet 2014; 384(9954): 1606.
http://doi.org/10.1016/S0140-6736(14)60887-4. Epub 2014 Jun 19.
21. Docherty G, Eslami M, O’Donnell H. “Poppers Maculopathy”: a case report and literature review. Can. J Ophtalmol 2018; 53(4): e154–e156.
https//doi.org/10.1016/j.jcjo.2017.10.036
22. Kerényi Á, Seres A, Süveges I. Fluorescein és indocyaninzöld angioigráfia chorioreti nopathia centrális serosaban. Szemészet 2000; 137: 39–45.
23. Freeman WR, Bartsch DU, Mueller AJ, et al. Simultaneous indocyanine green and fluorescein angiography using a confocal scanning laser ophthalmoscope. Arch Ophthalmol 1998; 116: 455–463. http://doi.org/10.1001/archopht.116.4.455
24. Laviers H, Zambarakji H. Enhanced depth imaging-OCT of the choroid: a review of the current literature. Graefes Arch Clin Exp Ophthalmol 2014; 252: 1871–1883. Epub 2014 Nov 4. http://doi.org/10.1007/s00417-014-2840-y.
25. Ruiz-Medrano J, Flores-Moreno I, Peña-García P, et al. Macular choroidal thickness profile in a healthy population measured by swept-source optical coherence tomography. Invest Ophthalmol Vis Sci 2014; 55: 3532–3542.
http://doi.org/10.1167/iovs.14-13868
26. Siggel R, Spital CH, Lentzsh A, Liakopoulos S. Optical coherence tomography angiography for the detection of macular neovascularization – comparison of en face versus cross-sectional view. Eye 2022; 1: 1–7.
Epub 2022 Jan 6. http://doi.org/10.1038/s41433-021-01892-5
27. Lotery A, Sivaprasad S, O’Connell A, et al. Eplerenone for chronic central serous chorioretinopathy in patients with active, previously untreated disease for more than 4 months (VICI): a randomised, double-blind, placebo-controlled trial. Lancet 2020; 395(10220): 294–303. http://doi.org/10.1016 S0140-6736(19)32981-2
28. Zhao M, Célérier I, Bousquet E, et al. Mineralocorticoid receptor is involved in rat and human ocular chorioretinopathy. J Clin Invest 2012; 122(7): 2672–2679. Epub 2012 Jun 11.
http://doi.org/10.1172/JCI61427
29. van Dijk EHC, Nijhoff MF, de Jong EK, et al. Central serous chorioretinopathy in primary hyperaldosteronism. Graefe’s Arch Clin Exp Ophthalmol 2016; 254(10): 2033–2042.
http://doi.org/10.1007/s00417-016-3417-8. Epub 2016 Jul 8
30. Felipe CQ, Biancardi AL, Civile VT, Carvas Junior N, Serracarbassa PD, Koike MK. Mineralocorticoid receptor antagonists for chronic central serous chorioretinopathy: systematic review and meta-analyses. Int J Retina Vitreous 2022 Jun 7; 8(1): 34.
http://doi.org/10.1186/s40942-022-00385-1
31. Yadav NK, Jayadev C, Mohan A, et al. Subthreshold micropulse yellow laser (577 nm) in chronic central serous chorioretinopathy: safety profile and treatment outcome. Eye. 2015; 29: 258–64.
http://doi.org/10.1038/eye.2014.315
32. Kim JY, Park HS, Kim SY. Short-term efficacy of subthreshold micropulse yellow laser (577-nm) photocoagulation for chronic central serous chorioretinopathy. Graefes Arch Clin Exp Ophthalmol 2015; 253: 2129–35. Epub 2015 Feb 26. Jan 23.
http://doi.org/10.1007/s00417-015-2965-7
33. Malik KJ, Sampat KM, Mansouri A, et al. Low-intensity/highdensity subthreshold micropulse diode laser for chronic central serous chorioretinopathy. Retina 2015; 35: 532.
http://doi.org/10.1097/IAE.0000000000000285
34. van Dijk EHC, Fauser S, Breukink MB, et al. Half-dose photodynamic therapy versus high-density subthreshold micropulse laser treatment in patients with chronic central serous chorioretinopathy: The place trial. Ophthalmology 2018; 125(10): 1547–55. Epub 2018 Jun 14.
http://doi.org/10.1016/j.ophtha.2018.04.021
35. Roca JA, Wu L, Fromow-Guerra J, et al. Yellow (577 nm) micropulse laser versus half-dose verteporfin photodynamic therapy in eyes with chronic central serous chorioretinopathy: results of the Pan-American Collaborative Retina Study (PACORES) Group. Br J Ophthalmol 2018.
http://doi.org/10.1136/bjophthalmol-2017-311291
36. Mathis T, Holz FG, Sivaprasad S, et al. Characterisation of macular neovascularisation subtypes in age-related macular degeneration to optimise treatment outcomes. Eye 2022; 9: 1–8.
https://doi.org/10.1038/s41433-022-02231-y
37. Yoon J, Yoon W, NA SK, et al. Long-term outcome of intravitreal anti-vascular endothelial growth factor treatment for pachychoroid neovasculopathy. Sci Rep 2021; 11: 12052.
https://doi.org/10.1038/s41598-021-91589-2
38. Fenner BJ, Cheung CMG, Sim SS, et al. Evolving treatment paradigms for PCV. Eye 2022; 36: 257–265.
https://doi.org/10.1038/s41433-021-01688-7
