A new era in the treatment of ocular surface inflammatory diseases: “soft” topical steroids in the anti-inflammatory therapeutic algorithm
doi: 10.55342/szemhungarica.2023.160.1.13
Review
Summary
Many pathological factors can cause inflammatory diseases on the ocular surface. The most common and therefore the clinically most relevant ocular surface inflammatory disease is the dry eye disease, which is a growing health problem affecting an increasingly large population. The reduction of chronic ocular surface inflammation is a major therapeutic challenge, as prolonged topical application of the prompt-acting steroids is limited by a number of ocular side effects. The latest advances in the research of anti-inflammatory treatment options are the development of "soft" steroids. A "soft" drug is a biologically active compound that, after achieving a local therapeutic effect, inactivates predictably at the site of action to a non-toxic substance. The advent of the soft steroid drugs opens a new chapter in the topical ophthalmic anti-inflammatory treatment algorithm, as the well-known ophthalmic side effects of topical steroids (ocular hypertension and cataractogenic effects) are minimised with these agents. The aim of the present work is to summarize the clinico-pharmacological characteristics, clinical application, the efficacy and side-effect profile of the "soft" topical steroids.
Összefoglaló
A szemfelszínen számos kóroki tényező hozhat létre gyulladásos megbetegedéseket. A leggyakoribb és ezért a legnagyobb klinikai relevanciával járó szemfelszíni gyulladásos kórkép a száraz szem betegség, amely egyre szélesebb populációt érintő, növekvő egészségügyi probléma. A krónikus szemfelszín gyulladás csökkentése jelentős terápiás kihívás, hiszen a prompt hatású szteroid hosszabb ideig történő lokális alkalmazását számos szemészeti mellékhatás limitálja. A gyulladáscsökkentő kezelési lehetőségek kutatásának legújabb eredménye a „soft” – lágy szteroidok kifejlesztése. A „lágy” gyógyszer olyan biológiailag aktív vegyület, amely a lokális terápiás hatásának elérése után kiszámíthatóan, a hatás helyén inaktiválódik nem toxikus anyaggá. A lokális szemészeti szteroid kezelési algoritmusban új fejezetet jelent a lágy szteroid típusú hatóanyag megjelenése, hiszen a lokális szteroidok szemészetileg jól ismert mellékhatásai (szemnyomás emelő hatás és kataraktogén hatás) ezen készítmények esetében minimálisra redukálódnak. Jelen közlemény célja a „lágy” típusú topikális szteroid, mint terápiás lehetőség kliniko-farmakológiai jellemzőinek, klinikai alkalmazásának, hatás-mellékhatás profiljának ismertetése.Keywords
ocular surface inflammation, soft steroid eyedrop
Kulcsszavak
szemfelszín gyulladás, lágy szteroid csepp
A gyulladáscsökkentés jelentősége a krónikus szemfelszín betegség –
száraz szem kezelésében
A szemfelszínen számos kóroki tényező hozhat létre gyulladásos megbetegedéseket. Klasszikus értelemben akkor beszélhetünk szemfelszín gyulladásról, ha a szemfelszín (conjunctiva, cornea) szövetein kívül mélyebb (intraokuláris) struktúrák, kompartmentek nem érintettek.
A leggyakoribb és ezért a legnagyobb klinikai relevanciával járó szemfelszíni gyulladásos kórkép a száraz szem betegség, amely egyre szélesebb populációt érintő, növekvő egészségügyi probléma. A könnyfilm instabilitásához vezető reakciósort számos, egymástól eltérő etiológiájú kóroki tényező iniciálhatja, amelyek részben a csökkent folyadéktermelődés (folyadék deficiens száraz szem), részben a könnyfilm fokozott párolgása (evaporatív száraz szem) révén vezethetnek a szemfelszín károsodásához (6). Az esetek többségében a két mechanizmus nem izoláltan, hanem együttesen, de különböző arányban, jelentős átfedésekkel van jelen (vegyes forma). Akár a csökkent könnytermelés, akár a fokozott párolgás áll a szemszárazság hátterében, a patológiás folyamatok kialakulásának középpontjában a könnyfilm ozmolaritásának megnövekedése áll. A hiperozmolárissá váló könnyfilm a szemfelszín epitélsejtjeiben ozmotikus stresszt vált ki, ami sejtkárosító folyamatok kaszkádszerű láncolatát indítja el.
Mivel a gyulladás alapvető szerepet játszik a száraz szem okozta szövetkárosodás kialakulásában, csökkentése a kórkép kezelésének fontos részét képezi. A gyulladáscsökkentő terápia bevezetésével semmiképpen nem szabad megvárni a szemfelszíni epitélium jelentősebb érintettségét, hiszen a késlekedés akár irreverzibilis károsodások kialakulásának láncolatát indukálhatja (4).
A klinikai gyakorlatban, hazánkban rendelkezésre álló, topikálisan alkalmazható két fő gyulladáscsökkentő hatóanyagcsoport a szteroidszármazékok, illetve a kalcineurin-antagonisták.
Az erőteljes gyulladáscsökkentő és immunszupresszív hatással rendelkező glukokortikoidok lokális alkalmazása jelentősen csökkenti a száraz szem szubjektív tüneteit és javítják a szemfelszín állapotát (22). A glukokortikoidok a T-sejt működés szuprimálása révén számos proinflammatorikus citokin csökkent termelődését eredményezik, az arachidonsav kaszkád blokkolásával mind a ciklo-oxigenáz, mind pedig a lipoxigenáz reakcióutat gátolják, így számos gyulladásos mediátor (prosztaglandinok, leukotriének, tromboxánok) termelődését blokkolják. Az immunszupresszív hatás a limfociták és a fagociták működésének befolyásolása révén jön létre (18). A szteroidok hosszabb távú alkalmazásának azonban súlyos szemészeti mellékhatásai ismeretesek (szemnyomás emelkedése, kataraktogén hatás, opportunista fertőzések kialakulásának emelkedő kockázata, szemfelszíni hámosodási folyamatok szuprimálása).
A lokális ciklosporin A hatékonyan alkalmazható a deszikkáló stressz okozta szemfelszín gyulladás csökkentésére, a könnytermelés fokozására (17, 19). A gyulladáscsökkentő hatás hosszabb ideig (6 hét – 2 hónap) tartó kezelés után válik láthatóvá (2). A ciklosporin-tartalmú szemcseppek becsepegtetését viszonylag jelentős arányban kíséri szemfelszíni égő érzés, amely jelentősen csökkenthető, ha a ciklosporin szemcsepp használata előtt néhány perccel a beteg tartósítószer mentes műkönnyet csepegtet.
A krónikus szemfelszín gyulladás csökkentése jelentős terápiás kihívás, hiszen a prompt hatású szteroid hosszabb ideig történő lokális alkalmazását számos szemészeti mellékhatás limitálja, a ciklosporin-származékok terápiás gyulladáscsökkentő hatásának kialakulása pedig hosszabb időt vesz igénybe. Jelentős kutatás-fejlesztési erőfeszítések irányultak olyan lokálisan alkalmazható szteroidkészítmények fejlesztésére, amelyek speciális szerkezeti tulajdonságuk révén lényegesen jobb mellékhatás profillal rendelkeznek az eddig általánosan elérhető készítményeknél („soft” – „lágy” szteroidok) (5, 9).
Jelen összefoglaló célja a „lágy” típusú topikális szteroid (0,335% hidrokortizon), mint terápiás lehetőség kliniko-farmakológiai jellemzőinek, klinikai alkalmazásának, hatás-mellékhatás profiljának ismertetése.
Topikális szteroidok – lágy szteroidok
A szteroidok szemcsepp (esetleg szemkenőcs) formában történő alkalmazásával jelentős szemfelszíni gyulladáscsökkentő hatás – és az alkalmazott szteroid struktúrájától függően – különböző csarnokvíz koncentráció érhető el.
Az elért gyulladáscsökkentő hatás függ az alkalmazott szteroid erősségétől, a biológiai hozzáférhetőségétől, a koncentrációtól, illetve az adagolás frekvenciájától. A biológiai hozzáférhetőséget nagymértékben determinálja a szteroid formulációja. Az acetát-, illetve alkohol vivőanyagok liposzolubilisek, így átjutnak a korneális epitélen és endotélen, míg a foszfát formuláció vízoldékony, így nem penetrál az intakt kornea epitéliumon (11, 23).
Számos szteroidkészítmény érhető el topikális formulációban. A szteroid hatóanyag erősségétől és a biológiai hozzáférhetőségétől függően erős (betametazon, dexametazon), illetve közepes erősségű (fluorometolon) topikális készítmények vannak forgalomban. A közepes erősségű szerek elsősorban a szemfelszíni gyulladások kezelésére alkalmasak, kevésbé hatásosak az intraokuláris gyulladások csökkentésére. Szemnyomást emelő és kataraktogén mellékhatásuk alacsonyabb ugyan, mint az erős szteroidoké, de ezen mellékhatásokkal a kezelés folyamán számolnunk kell (3, 8, 12).
A gyulladáscsökkentő kezelési lehetőségek kutatásának legújabb eredménye a „soft” – lágy szteroidok kifejlesztése. A „lágy” gyógyszer olyan biológiailag aktív vegyület, amely a lokális terápiás hatásának elérése után kiszámíthatóan, a hatás helyén inaktiválódik nem toxikus anyaggá. Az ilyen típusú gyógyszerek célja a toxicitás csökkentése és a célszerven kifejtett specifikusabb hatás fokozása. A lokális szemészeti szteroidkezelési algoritmusban új fejezetet jelent a lágy szteroid hatóanyag típusú megjelenése, hiszen a lokális szteroidok szemészetileg jól ismert mellékhatásai (szemnyomás emelő hatás és kataraktogén hatás) ezen készítmények esetében minimálisra redukálódnak (1, 14).
A „lágy” kortikoszteroid típusú hidrokortizon preklinikai vizsgálati eredményei, klinikofarmakológiai jellemzői, és klinikai alkalmazásának előnyei a szemfelszíni gyulladás csökkentésében
A hidrokortizon egy természetes, gyors hatású kortikoszteroid, amelynek relatív alacsony a gyulladáscsökkentő potenciálja a szintetikus kortikoszteroidokhoz képest. Fiziológiás körülmények között a szaruhártya hámsejtjeiben a hidrokortizon autokrin szintézise zajlik, amely feltételezhetően hozzájárul a szemfelszíni nyálkahártya immunvédelméhez. Szemfelszíni betegségekben a „toll-like” receptorok aktivációja és a citokintermelés csökkentik ezt a folyamatot, mérsékelve a hidrokortizon bioszintézisét, elősegítve ezzel a gyulladásos sejtek toborzását (25).
Preklinikai vizsgálatok eredményei
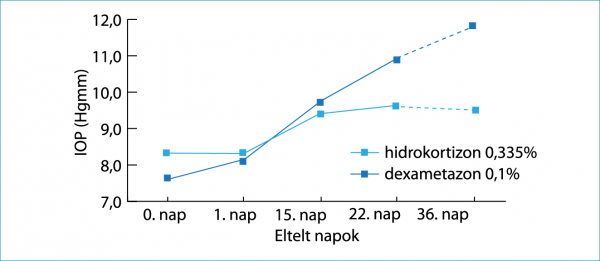
A tartósítószer mentes 0,355%-os hidrokortizon szemcsepp a preklinikai vizsgálatok során bizonyította biztonságosságát (alacsony szemnyomás emelő hatás) és hatásosságát (szemfelszíni gyulladásos markerek szintjének csökkenése). Albínó patkányok esetében két különböző módon kiváltott szárazszem-modellben (deszikkáló és hiperozmoláris stressz) hasonlították össze a 0,335%-os hidrokortizon és a 0,1%-os dexametazon hatását a szemnyomás-emelkedésre, valamint bizonyos szemfelszíni gyulladásos markerek (interleukin-6 és CCL2 kemokin) szintjének változására vonatkozóan (21). A dexametazon cseppet kapott állatok esetében a szemnyomás folyamatos emelkedése volt detektálható egészen a kísérleti periódus végéig (36 nap), míg a hidrokortizonnal kezelt csoportban a szemnyomás kis mértékben, statisztikailag nem szignifikánsan emelkedett az első 15 napban, majd stabilizálódott (1. ábra).
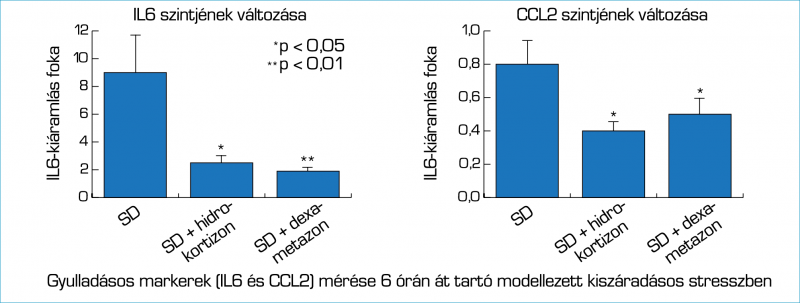
A gyulladásos szemfelszíni markerek szintjének csökkenése tekintetében a hidrokortizon ekvivalensen jól teljesített a dexametazonhoz viszonyítva: szemfelszíni gyulladáscsökkentő hatása statisztikailag nem különbözött a lényegesen erősebb glukokortikoid aktivitással és így potenciálisan mellékhatásokat provokáló effektussal rendelkező dexametazonétól (2. ábra).
Klinikai vizsgálati eredmények
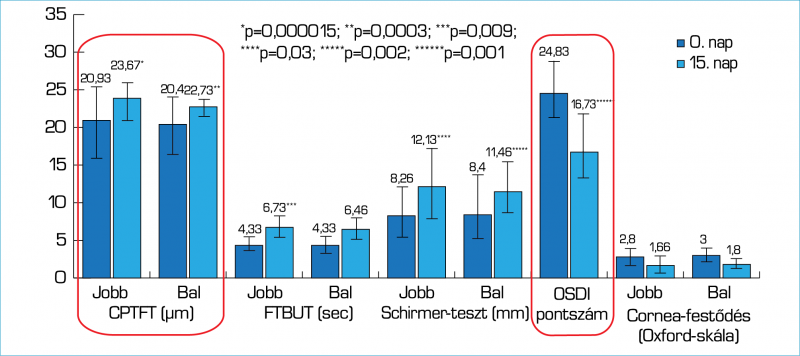
A lokális alkalmazási forma magas kortikoszteroid koncentrációt biztosít a szemfelszínen, ezért a szemfelszíni betegségekben nincs szükség erős glukokortikoid aktivitásra. A topikális kortikoszteroidok alacsony dózisai hatékonynak bizonyultak a krónikus, súlyos szemfelszíni irritációban szenvedő, refrakter betegeknél. A kiváló mellékhatás-profil miatt – amennyiben a klinikai kép azt szükségessé teszi – szoros obszerváció mellett elhúzódóbb idejű alkalmazásra is lehetőség nyílhat. Klinikai hatékonyságát és biztonságosságát klinikai vizsgálatok igazolják: a naponta kétszer, 15 napon keresztül adott 0,335%-os hidrokortizon szemcsepp készítmény hatékonyan csökkentette a szemfelszíni gyulladás klinikai jeleit és szubjektív tüneteit. Statisztikailag szignifikáns mértékben nőtt a centrális prekorneális könnyfilm vastagsága, a könnyfilm felszakadási idő, valamint a könnytermelés, csökkentve ezzel a szaruhártya hámsejtek károsodását és javítva a betegek életminőségét (3. ábra) (14).
Alacsony intraokuláris penetráció
A szemészeti mellékhatások elkerülése érdekében alacsony intraokuláris penetrációra van szükség (20). Az erős kortikoszteroidok, mint a prednizolon-acetát és a dexametazon-alkohol magas koncentrációt érnek el az elülső csarnokban (669,9 ng/ml, illetve 31 ng/ml). A hidrokortizon intraokuláris koncentrációja ezzel szemben igen alacsony, a szemfelszínre juttatott hatóanyag tartalom mindössze 1,5%-a penetrál az elülső csarnokba (3, 8, 13, 18).
Rövid hatástartam
A hidrokortizon rövid hatású kortikoszteroid, amely a kívánt farmakológiai hatást eléri, majd gyorsan inaktív metabolitokká metabolizálódik a nem kívánt hatások elkerülése érdekében (9).
Jó biztonsági profil
Terápiás hatásuk mellett a lokálisan alkalmazott kortikoszteroidok számos helyi káros mellékhatással járhatnak. Kiemelendő a szteroid okozta szemnyomás emelkedés, a fertőzésekkel szembeni alacsonyabb ellenállóképesség, a szürkehályog kialakulásának kockázata és a hámosodási-reparációs folyamatok lassulása (1, 10). A szemnyomás emelkedése és a katarakta kialakulásának kockázata a „soft” szteroidok esetében minimális, azonban a szemfelszíni fertőzésekre való fogékonyság növekedésére és a szaruhártya hámosodásának lassulására – főleg elhúzódó alkalmazás esetén – számítani kell (8, 10, 23).
Alacsony szisztémás felszívódás
Azoknál a betegeknél, akik magas dózisban használnak lokális szteroidot, klinikailag szignifikáns mennyiségű gyógyszer szisztémás felszívódására lehet számítani, ami az endogén kortizoltermelés szupresszióját eredményezheti, potenciálisan szisztémás mellékhatásokat okozva (24). A soft steroid szemcseppek esetében a hatóanyag szisztémás felszívódása olyan alacsony, hogy a klinikai gyakorlatban nem kell szisztémás szteroid mellékhatások megjelenésével számolni.
Tartósítószer mentes készítmény
Általánosságban elmondható, hogy a benzalkónium-klorid (BAK) tartósítószer tartalom megváltoztatja a lokális szemészeti kortikoszteroid készítmények farmakokinetikáját (20). BAK hatására a szaruhártya hámsejtek membránjának parciális dezintegrációja, a sejt-sejt kapcsolatok megbomlása következik be, ami növeli a kortikoszteroidok intraokuláris penetrációját (11). Ezen túlmenően a BAK toxikus és proinflammatorikus hatásai, valamint detergens tenzioaktív tulajdonságai miatt okozhat szemfelszín gyulladást vagy súlyosbíthatja a már meglévő gyulladásos folyamatokat. A Magyarországon elérhető 0,335%-os hidrokortizon szemcsepp egyadagos kiszerelésű, tartósítószer mentes formulációjú.
A lágy szteroidok a klinikai gyakorlatban: adagolási ajánlások
A lágy szteroid szemcseppek esetében a napi cseppentés frekvenciája arányos a szemfelszínen elért hatóanyag koncentrációval és az így elért gyulladáscsökkentő hatással. Ugyan napi kétszeri becsepegtetéssel már terápiás szemfelszíni szöveti koncentráció érhető el, súlyos gyulladás esetén az alkalmazási frekvencia növelése fokozhatja a gyulladáscsökkentő hatást és csökkentheti a gyulladás indukálta szövetkárosodás mértékét. A szemfelszíni epitélium súlyosabb károsodásának megakadályozása alapvető terápiás cél, így javasolható, hogy már enyhe-mérsékelt epitél érintettség esetén (kötőhártya-szaruhártya festődés: Oxford 1-2) elkezdődjön az effektív gyulladáscsökkentés (7).
Az adagolás megfelelő csökkentése, a leépítés ugyanolyan fontos, mint a kezdeti dózis optimális megválasztása. A kortikoszteroidok hosszan tartó alkalmazása csökkenti a keringésben lévő érettebb leukocita elemeket. Ha a szteroid adagolás hirtelen felfüggesztődik, az éretlen sejtek szaporodása nagy mennyiségű antitestet termel a szövetben még megmaradt minimális antigénnel szemben, ami „rebound” gyulladást eredményezhet. Ez szisztémás szteroidok esetében gyakoribb, mint a helyi alkalmazásnál, de a hosszan tartó helyi kezelés (általában egy hónapnál hosszabb) is okozhat ilyet. Ha a gyulladást sikerült kontrollálni, a helyi „soft” szteroidok dózisa fokozatosan felezhető (adott időintervallumonként felére csökkenthető). Minél hosszabb a kezelési időszak, annál lassabban célszerű leépíteni a lokális szteroid adagolást (16).
A lágy szteroid szemcsepp alkalmazásának fontos területe a ciklosporin A kezelést igénylő elhúzódó, krónikus szemfelszín gyulladásos megbetegedések. Mivel a ciklopsporin A terápiás gyulladáscsökkentő hatása hosszabb ideig (6 hét – 2 hónap) tartó kezelés után válik láthatóvá, így az ajánlások szerint 4-5-6 hét „lágy” szteroid szemcsepp alkalmazása mellett célszerű elindítani a ciklosporin A kezelést (12).
Következtetések
A tartósítószer mentes, 3,35 mg/ml koncentrációjú hidrokortizon hatóanyagú topikális szteroid kiválóan alkalmas a szemfelszín gyulladásos megbetegedéseinek (száraz szem, allergiás kötőhártya gyulladás, autoimmun kórképekhez társuló szemfelszín gyulladás) kezelésére. Tekintettel arra, hogy a készítmény intraokuláris penetrációja alacsony, szemnyomás emelő és kataraktogén hatása elhanyagolható, így lényegesen jobb mellékhatás profillal, biztonságosabban alkalmazható, mint az eddig elérhető topikális szteroid készítmények.
Nyilatkozat
Az összefoglaló közlemény megjelenését a Sager Pharma Kft. támogatta. A cikk termékmegjelenítést nem tartalmaz.
Irodalom
1. Amon M, Busin M. Loteprednol etabonate ophthalmic suspension 0.5%: efficacy and safety for postoperative anti-inflammatory use. Int Ophthalmol 2012; 32: 507–17.
2. Aragona P, Roland M. Towards a dynamic customized therapy for ocular surface dysfunction. Br J Ophthalmol 2013 Aug; 97(8): 955–60.
https://doi.org/10.1136/bjophthalmol-2012-302568
3. Awan M, Agarwal P, Watson D, et al. Penetration of topical and subconjunctival corticosteroids into human aqueous humour and its therapeutic significance. Br J Ophthalmol 2009; 93(6): 708–13.
https://doi.org/10.1136/bjo.2008.154906
4. Berta A, Tóth-Molnár E, Csutak A. Új nemzetközi konszenzus nyilatkozat a száraz szem definíciójáról, felosztásáról, etiológiájáról, diagnosztikájáról és terápiájáról. Orvosi Hetilap 2018; 159(20): 775–785.
https://doi.org/10.1556/650.2018.31077
5. Bodor N, Buchwald P. Soft drug design: general principles and recent applications. Med Res Rev 2000; 20(1): 58–101.
https://doi.org/10.1002/(sici)1098–1128(200001)20:13.0.co; 2-x
6. Bron AJ, dePavia CS, Chauhan SK et al. TFOS DEWS II pathophysiology report. Ocul Surf 2017; 15: 438–510.
https://doi.org/10.1016/j.jtos.2017.05.011
7. Bron AJ, Evans VE, Smith JA. Grading of corneal and conjunctival staining in the context of other dry eye tests. Cornea 2003; 22: 640–50.
https://doi.org/10.1097/00003226-200310000-00008
8. Cantrill HL, Palmberg PF, Zink HA, Waltman SR, Podos SM, Becker B. Comparison of in vitro potency of corticosteroids with ability to raise intraocular pressure. Am J Ophthalmol 1975; 79: 1012–17.
https://doi.org/10.1016/0002-9394(75)90687-x
9. Comstock TL, Sheppard J.D. Loteprednol etabonate for inflammatory conditions of the anterior segment of the eye: twenty years of clinical experience with a retrometabolically designed corticosteroid. Expert Opin Pharmacother 2018; 19: 337–53.
https://doi.org/10.1080/14656566.2018.1439920
10. Cutolo CA, Barabino S, Bonzano C, Traverso CE. The use of topical corticosteroids for treatment of dry eye syndrome Ocul Immunol Inflamm 2017; 14: 1–10.
https://doi.org/10.1080/09273948.2017.1341988
11. Green K, Downs SJ. Prednisolone phosphate penetration into and through the cornea. Invest Ophthalmol 1974; 13: 316–9.
12. Holland Ej, Darwish M, Nichols KK, Jones L, Karpecki PM. Efficacy of topical ophthalmic drugs in the treatment of dry eye disease: A systematic literature review. Ocul Surf 2019; 17: 412–23.
https://doi.org/10.1016/j.jtos.
13. Holmberg BJ, Maggs DJ. The use of corticosteroids to treat ocular inflammation. Vet Clin North Am Small Anim Pract 2004; 34: 693–705.
https://doi.org/10.1016/j.cvsm.2003.12.007
14. Kuzmanović EK, Markocic L, Bjelos M, Busic M, Miletic D, Kos E. A Retrospective Data Review Confirms That Topical Preservative – Free Hydrocortisone Improves Inflammation in Dry Eye Disease. Clin Ophthalmol 2020; 14: 3691–3697.
https://doi.org/10.2147/OPTH.S283655
15. Lee HK, Ryu IH, Seo KY, Hong S, Kim HC, Kim EK. Topical 0.1% prednisolone lowers nerve growth factor expression in keratoconjunctivitis sicca patients. Ophthalmology 2006; 113: 198–205.
https://doi.org/10.1016/j.ophtha.2005.09.033
16. Leibowitz HM, Kupperman A. Uses of Corticosteroids in the Treatment of Corneal Inflammation. In Leibowitz HM (ed). Corneal Disorders, Clinical Diagnosis and Management. Philadelphia: W.B. Saunders, 1984. p. 286–307.
17. Leonardi A, Van Setten G, Amrane M et al. Efficacy and safety of 0.1% cyclosporine A cationic emulsion in the treatment of severe dry eye disease: a multicenter randomized trial. Eur J Ophthalmol 2016; 26: 287–96.
https://doi.org/10.5301/ejo.5000779
18. Longwell AM, Birss SA, Keller N. The relationship between hydrocortisone acetate distribution and efficacy in inflamed eyes: continuous vs intermittent delivery. Ann Ophthalmol 1976; 8: 600–8.
19. Matsuda S, Koyasu S. Mechanisms of action of cyclosporine. Immunopharmacology 2000; 47: 119–25.
https://doi.org/10.1016/s0162-3109(00)00192-2
20. McGhee CN, Dean S, Danesh-Meyer H. Locally administered ocular corticosteroids: benefits and risks. Drug Safety 2002; 25: 33–55.
https://doi.org/10.2165/00002018-200225010-00004
21. Olmiere C, Raveu AL, Baudouin C. T1565, a new efficient and safe preservative free hydrocortisone, Poster in ARVO 2017 Annual Meeting, B0367
22. Pflugfelder SC, Maskin SL, Anderson B, et al. A randomized, double-masked, placebo-controlled, multicenter comparison of loteprednol etabonate ophthalmic suspension, 0.5%, and placebo for treatment of keratoconjunctivitis sicca in patients with delayed tear clearance. Am J Ophthalmol 2004; 138: 444–57.
https://doi.org/10.1016/j.ajo.2004.04.052
23. Rolando M, Vagge A. Safety and Efficacy of Cortisol Phosphate in Hyaluronic Acid Vehicle in the Treatment of Dry Eye in Sjogren Syndrome. J Ocul Pharmacol Ther 2017; 33: 383–90.
https://doi.org/10.1089/jop.2016.0147
24. Sandhu SS, Smith JM, Doherty M, James A, Figueiredo FC. Do topical ophthalmic corticosteroids suppress the hypothalmic-pituitary-adrenal axis in post-penetrating keratoplasty patients? Eye (Lond) 2012; 26: 699–702.
https://doi.org/10.1038/eye.2012.12
25. Susarla R, Liu L, Walker EA, Bujalska IJ, Alsalem J, Williams GP, Sreekantam S, Taylor AE, Tallouzi M, Southworth HS, Murray PI, Wallace GR, Rauz S. Cortisol biosynthesis in the human ocular surface innate immune response. PLoS One 2014; 9: e94913.
https://doi.org/10.1371/journal.pone.0094913
