The effect of carotid artery stenosis on retinal microcirculation with optical coherence tomography angiography
doi: 10.55342/szemhungarica.2022.159.4.174
Original scientific paper
Summary
Introduction: Carotid artery stenosis (CAS) is among the leading causes of mortality and permanent disabilities in the Western world. CAS is a consequence of systemic atherosclerotic disease affecting the majority of the aging population. Optical coherence tomography angiography (OCTA) is a novel imaging technique for visualizing retinal blood flow. It is a non-invasive and fast method for qualitative and quantitative assessment of the microcirculation. Cerebral and retinal circulation share similar anatomy, physiology and embryology, thus retinal microvasculature provides a unique opportunity to study pathogenesis of cerebral small vessel disease in vivo.
Methods: A total of 112 eyes of 56 patients with significant carotid stenosis and 90 eyes of 45 healthy control subjects were included in the study. We obtained three consecutive 3x3 mm scans of the macular area and evaluated the vessel density.
Results: Supporting the results of our previous studies, we found that image quality influences the measured data, significantly. Furthermore, we described that the density of the superficial retinal vascular network in the carotid stenosis group was significantly lower compared to the control group.
Conclusion: Our results confirm that the presence of significant carotid stenosis correlates with changes in the microcirculation. OCTA might help in the assessment of cerebral circulation in patients with CAS due to its ability to detect subtle changes in retinal microcirculation.
Összefoglaló
Bevezetés: A carotis-szűkület a nyugati világban a halálozás és a tartós egészségkárosodás egyik vezető oka. A betegség a szisztémás ateroszklerózis következménye, amely az idősödő populáció nagy részét érinti. Az optikai koherencia tomográfia-angiográfia (OCTA) egy új vizsgálómódszer a retinalis érhálózat vizsgálatára. A gyors, könnyen megismételhető, nem invazív vizsgálat segítségével kvalitatív és kvantitatív információt nyerhetünk a mikrokeringésről. Az agyi- és retinalis keringés hasonló anatómiai, fiziológiai és embriológiai tulajdonságokkal bír, így a retina mikrokeringésének vizsgálata egyedülálló lehetőséget nyújt az agyi kisérbetegségek patogenezisének in vivo tanulmányozására.Módszerek: Jelen vizsgálatunk során 56, carotis-szűkületes beteg 112 szemének OCTA-adatait hasonlítottuk össze 45 egészséges kontrollszemély adataival. A vizsgálatok során három egymást követő, 3×3 mm-es felvételt készítettünk a makula területéről, majd ezeken vizsgáltuk az érhálózat sűrűségét.
Eredmények: Megállapítottuk, hogy a képminőség jelentősen befolyásolja a mért adatokat, ezzel ismételten alátámasztva korábbi vizsgálataink eredményeit. Továbbá leírtuk, hogy a felszínes retinalis érhálózat sűrűsége a carotis-szűkületes csoportban szignifikánsan alacsonyabb volt a kontrollcsoporthoz viszonyítva.
Következtetések: Eredményeink alátámasztják, hogy a szignifikáns carotis-szűkület megléte összefüggést mutat a mikrocirkuláció változásaival. Az OCTA-vizsgálat segítségünkre lehet az agyi keringés állapotának megítélésére a retinalis érhálózat finom eltéréseinek detektálásával.
Keywords
optical coherence tomography angiography, carotid stenosis
Kulcsszavak
optikai koherencia tomográfiás angiográfia, carotis-szűkület
Bevezetés
A carotis-szűkület (carotid artery stenosis – CAS) a legjelentősebb egészségügyi problémák egyike, tekintettel arra, hogy igen gyakran vezet átmeneti iszkémiás roham (transient ischemic attac – TIA) vagy iszkémiás stroke kialakulásához, amely a halálozás és a tartós egészségkárosodás egyik vezető oka (2, 5). A legjelentősebb rizikófaktorok az 50 év fölötti életkor, hyperlipidaemia, dohányzás, koszorúér-betegség, perifériás artériás betegség, korábbi stroke vagy TIA a beteg anamnézisében, vagy a családtagok körében 60 éves kor előtt bekövetkező kardiovaszkuláris esemény (18). A kezelés történhet konzervatív módon vagy sebészi úton. A tünetmentes esetekben, amikor a szűkület mértéke 70% alatti, vagy ha a sebészi beavatkozás rizikója túl magas a várható előnyökhöz képest, a konzervatív terápia választandó. Amennyiben műtétre kerül sor, az elsődlegesen választandó módszer az endarterectomia, köszönhetően az alacsonyabb perioperatív stroke előfordulási aránynak (3, 12).
A CAS diagnosztikájában jelenleg a Duplex ultrahang az aranystandard, amelynek segítségével morfológiai információt is nyerhetünk, valamint a szűkület mértékének számszerűsítését is lehetővé teszi, azonban a módszer megbízhatóságát számos emberi tényező befolyásolja (17). A CT- és MR-angiográfia objektívebb vizsgálómódszerek, amelyek jelenleg főként a rekonstrukció tervezésében használatosak.
A carotisbetegség több úton vezethet szemészeti szövődmények kialakulásához, amelyek gyakran közelgő agyi történések előjelei lehetnek. A keringés átmeneti zavara amaurosis fugax-hoz vezet, amely egyoldali fájdalmatlan látásvesztés, ami többnyire másodperceken vagy perceken belül spontán oldódik. Az azonos oldali carotis internából származó embólus elzárhatja a retinát ellátó ereket, így okozva tartós látásvesztést vagy látótérkiesést az érintett artéria ellátási területétől függően. A carotisbetegség krónikus hipoperfuzió útján okuláris iszkémia kialakulásához vezethet, ami egy erős fájdalommal kísért, fokozatosan progrediáló látásromlás. Azonban a tünetmentes formákban is előfordulhat agyi- és a szemet érintő keringészavar, amelyek kimutatására a jelenlegi klinikai gyakorlatban használt vizsgálómódszerek szenzitivitása nem megfelelő.
A CAS szemészeti szövődményeinek vizsgálata hagyományosan réslámpás vizsgálattal és szemfenékvizsgálattal történt. Az erek vizualizálására fluoreszcein-angiográfia volt az elsődleges vizsgálómódszer, amely során intravénásan beadott festékanyag használatával történt az erek leképezése. Az optikai koherencia tomográfia-angiográfia (OCTA) egy új módszer a retina és chorioidea keringésének vizsgálatára. A vizsgálat festékanyag beadása nélkül, mozgás-kontraszt elv alapján képezi le az érhálózatot. Az OCTA gyorsan elvégezhető, nem invazív vizsgálat lévén bármikor könnyen megismételhető a betegek követése során. Számos vizsgálat leírta a módszer pontosságát és a mért paraméterek reprodukálhatóságát egészséges egyének esetében (1, 4, 11, 16, 21, 23, 24) csak úgy, mint diabéteszes betegek (6), glaukómások (22), iszkémiás opticus neuropathia (20) vagy a retina keringési betegségeinek (10, 15) esetén. Fontos azonban szem előtt tartani, hogy a képminőség jelentősen befolyásolja a mérési hibát (8, 13, 18) és a mért paramétereket (9) is, így felvetődik egy korrekciós faktor bevezetésének szükségessége a hosszú távú követés során.
Jelen vizsgálatunk során célkitűzésünk volt megvizsgálni, hogy carotis-szűkületes betegek OCT-angiográfiás vizsgálatával kimutatható-e a csökkent retina keringés az egészséges populációhoz viszonyítva.
Betegek és módszerek
A prospektív keresztmetszeti vizsgálatba 56 carotis-szűkületes beteget valamint 45 egészséges kontrollszemélyt vontunk be a Semmelweis Egyetem Érsebészeti és Endovaszkuláris Tanszéken valamint a Semmelweis Egyetem Szemészeti Klinika retina ambulanciáján vizsgált betegek közül. A tanulmány a Helsinki Deklaráció elveinek figyelembevételével, valamint a Tudományos és Kutatásetikai Bizottság engedélyével zajlott. A résztvevők mindegyike beleegyező nyilatkozatot írt alá.
A bevonási kritériumok a következők voltak: egyoldali szignifikáns carotis-szűkület (≥70%) és tervezett endarterectomia. Kizárási kritérium volt az ismert szemészeti betegség (úgymint időskori makuladegeneráció, glaukóma, vitreomacularis határfelszín-betegségei), korábban beadott anti-VEGF-injekció, vagy klinikailag szignifikáns lencsehomály megléte.
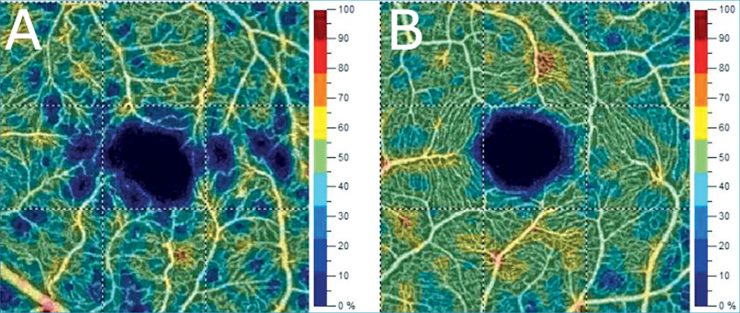
A vizsgálati alanyok mindkét szeméről három egymást követő, 3×3 mm nagyságú OCT-angiográfiás felvétel történt a makula területéről. A felvételeket standardizált körülmények között ugyanazon gyakorlott személy végezte. A vizsgálatokat AngioVue OCTA-készülékkel (RTVue-XR Avanti, Optovue, Fremont, CA, USA) végeztük. A mozgási műtermékeket és szegmentációs hibákat tartalmazó képeket kizártuk. A tanulmányba csak azokat a szemeket vontuk be, ahol a készülék által meghatározott képminőség (scan quality – SQ) magasabb volt, mint 5.
A statsztikai analízist SPSS program segítségével végeztük (SPSS 23.0, IBM, Armonk, NY, USA). Az eredményeket többváltozós regressziós modellben elemeztük, a képminőséget kontroll alatt tartva.
Eredmények
Összesen 56 carotis-szűkületes beteg 112 szemét és 45 egészséges személy 90 szemét vizsgálatuk. A két csoport között nem volt statisztikailag szignifikáns különbség az életkor és a nem tekintetében.
Az SQ-értékek 6 és 10 között voltak, az átlagos SQ 7,45±1,01 volt.
A carotis-szűkületes csoportban a képminőség tekintetében nem volt különbség a szűkületes oldal és az ellenoldal között (7,49±0,99 vs. 7,41±1,01; p=0,12). A képminőség változása mindkét csoportban szignifikáns hatással volt az érsűrűség (vessel density – VD) mért értékére, az SQ egységnyi növekedésével a VD-érték növekedését figyeltük meg (2,392%±0,097%; p<0,001). Ez a növekedés mindkét szemen megfigyelhető volt.
A képminőséget kontroll alatt tartva elemeztük az érhálózat sűrűségét a felszínes rétegekben és a VD szignifikáns csökkenését találtuk a kontrollcsoporthoz viszonyítva (4,32±0,356%; p<0,001).
Következtetések
Jelen tanulmányunkban kimutattuk, hogy szignifikáns carotis-szűkület fennállása esetén a retinalis érhálózat sűrűsége jelentősen csökkent az egészséges kontrollszemeken mért értékekhez képest. Az általunk leírt, 4% fölötti csökkenés igen jelentős mértékű figyelembe véve azt, hogy egyéb, a mikrokeringést befolyásoló betegségekben, például diabéteszben ennél kisebb mértékű befolyásoló hatást írtak le (7). A csökkenés a szűkület oldalán, illetve az ellenoldalon is megfigyelhető volt. A szimmetrikus csökkenés hátterében feltehetően a Willis-kör keringésének a szűkület hatására bekövetkező átrendeződése állhat, azonban ennek alátámasztására további vizsgálatok szükségesek. Ismét megerősítettük, hogy a képminőség szignifikánsan befolyásolja a mért érékeket, így a további OCTA-vizsgálatok értékelés során is figyelembe kell venni.
A központi idegrendszer részeként a retina vizsgálata egyedülálló lehetőséget nyújt a mikrocirkuláció in vivo értékelésére. Az utóbbi évtizedekben a retina képalkotó vizsgálatára alkalmazott módszerek jelentős fejlődése új lehetőségeket biztosít az orvosok és kutatók számára, hogy betekintést nyerjenek az agyi érrendszeri patológiák kialakulásába és progressziójába. Korábban az anamnézis ismeretén kívül hagyományos vizsgálómódszerek segítették a keringési betegségek szemészeti szövődményeinek felismerését úgymint réslámpás- és szemfenékvizsgálat, valamint fluoreszcein-angiográfia, amely egy invazív vizsgálat a retinalis érhálózat vizualizására. Az OCTA alacsony koherenciájú interferometria segítségével képezi le a retina szerkezetét (19). Nagy felbontású keresztmetszeti képeken vizsgálhatjuk a retina rétegeit, míg ezzel egy időben keringési információt is nyerünk ugyanazon területről. Az OCTA egy gyors, nem invazív, könnyen ismételhető vizsgálat, amely alkalmasnak bizonyult a szemfenéki keringést érintő betegségek felismerésére és utánkövetésére. A módszer a mozgás kontraszt elv segítségével képezi le az érhálózatot. A makulatájon, illetve a peripapilláris területen az eredmények kvantitatív értékelésére is lehetőséget nyújt a strukturális eltérések detektálása mellett. A szoftver minden felvételt automatikusan egy képminőséget leíró értékkel (SQ) jellemez a rögzített kép jelintenzitásának megfelelően. Az SQ-értéket számos tényező befolyásolja, többek között a törőközegek borússága, pislogásból vagy szemmozgásokból adódó műtermékek, valamint a vizsgáló személye. Az SQ-érték egy mértékegység nélküli paraméter, amely egy 1–10 közötti skálán értékeli a képminőséget, a jobb minőségű képeket magasabb számmal jelölve. Mivel a képminőség jelentősen befolyásolja a mért OCTA-paramétereket, az eredmények értékelésekor a megbízható eredmények érdekében feltétlenül szükséges a figyelembe vétele.
Korábbi vizsgálataink során leírtuk, hogy carotis-szűkületes betegek esetében számos szisztémás faktor befolyásolja a retinalis keringést (14). A rizikófaktorok befolyásoló hatására a legszenzitívebb paraméternek a felszínes érhálózatban mért kapilláris sűrűség bizonyult. Jelen vizsgálat során, egészséges kontrollszemélyekkel összehasonlítva ismét megállapítottuk, hogy a retina felszíni rétegeiben mért VD-érték vizsgálata alkalmasnak bizonyul a carotis-szűkület szemfenéki keringésre kifejtett hatásának detektálására.
A vizsgálat limitációi közé tartozik, hogy a méréseket egy bizonyos típusú OCT-készülékkel végeztük, ami megnehezíti az eredményeink általánosítását. Azonban az eredményeink egyértelműen alátámasztják, hogy van összefüggés a tünetmentes carotis-szűkület megléte és a szemfenéki érhálózat-sűrűség között. További, nagyobb betegcsoportokon végzett vizsgálatok szükségesek az eredmények megerősítésére, valamint az agyi keringéssel való összefüggés felmérésére. Minden olyan eredmény kiemelkedő jelentőségű, ami az intracranialis keringés valós változásait képes detektálni, és a jövőbeli tanulmányok segítségünkre lehetnek az OCT-angiográfia ebben való lehetséges szerepének felmérésében. Véleményünk szerint az OCTA-vizsgálat diagnosztikus alkalmazása megfelelő módszer lehet a tünetmentes carotis-szűkületes betegek progressziójának és kezelésének pontosabb értékelésére.
Nyilatkozat
A szerzők kijelentik, hogy eredeti közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését..
Irodalom
1. Al-Sheikh M, Tepelus TC, Nazikyan T, Sadda SR. Repeatability of automated vessel density measurements using optical coherence tomography angiography. Br J Ophthalmol 04 2017; 101(4): 449–452.
http://doi.org/10.1136/bjophthalmol-2016-308764
2. Ay H, Arsava EM, Andsberg G, et al. Pathogenic ischemic stroke phenotypes in the NINDS-stroke genetics network. Stroke Dec 2014; 45(12): 3589–96.
http://doi.org/10.1161/STROKEAHA.114.007362
3. Brott TG, Hobson RW, Howard G, et al. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J MedJul 2010; 363(1): 11–23.
http://doi.org/10.1056/NEJMoa0912321
4. Coscas F, Sellam A, Glacet-Bernard A, et al. Normative Data for Vascular Density in Superficial and Deep Capillary Plexuses of Healthy Adults Assessed by Optical Coherence Tomography Angiography. Invest Ophthalmol Vis Sci 07. 01. 2016; 57(9): OCT211–23.
http://doi.org/10.1167/iovs.15–18793
5. Flaherty ML, Kissela B, Khoury JC, et al. Carotid artery stenosis as a cause of stroke. Neuroepidemiology 2013; 40(1): 36–41.
http://doi.org/10.1159/000341410
6. Czakó C, Sándor G, Ecsedy M, et al. Intrasession and Between-Visit Variability of Retinal Vessel Density Values Measured with OCT Angiography in Diabetic Patients. Sci Rep Jul 13 2018; 8(1): 10598.
http://doi.org/10.1038/s41598-018-28994-7
7. Czakó C, Sándor GL, Ecsedy M, et al. Evaluation of diabetic microangiopathy using optical coherence tomography angiography. Orv Hetil Feb 2018; 159(8): 320–326.
http://doi.org/10.1556/650.2018.30962
8. Czakó C, István L, Ecsedy M, et al. The effect of image quality on the reliability of OCT angiography measurements in patients with diabetes. Int J Retina Vitreous 2019; 5: 46.
http://doi.org/10.1186/s40942-019-0197-4
9. Czakó C, István L, Benyó F, et al. The Impact of Deterministic Signal Loss on OCT Angiography Measurements. Transl Vis Sci Technol Apr 2020; 9(5): 10.
http://doi.org/10.1167/tvst.9.5.10
10. Dégi R. Az optikai koherencia tomográfia angiográfia szerepe a retina és a chorioidea betegségeinek diagnosztikájában. Szemészet 2017; 154(4): 170–179.
11. Guo J, She X, Liu X, Sun X. Repeatability and Reproducibility of Foveal Avascular Zone Area Measurements Using AngioPlex Spectral Domain Optical Coherence Tomography Angiography in Healthy Subjects. Ophthalmologica 2017; 237(1): 21–28.
http://doi.org/10.1159/000453112
12. Hill MD, Brooks W, Mackey A, et al. Stroke after carotid stenting and endarterectomy in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST). Circulation Dec 2012; 126(25): 3054–61.
http://doi.org/10.1161/CIRCULATIONAHA.112.120030
13. Holló G. Influence of Posterior Subcapsular Cataract on Structural OCT and OCT Angiography Vessel Density Measurements in the Peripapillary Retina. J Glaucoma 04 2019; 28(4): e61–e63.
http://doi.org/10.1097/IJG.0000000000001147
14. István L, Czakó C, Benyó F, et al. The effect of systemic factors on retinal blood flow in patients with carotid stenosis: an optical coherence tomography angiography study. Geroscience 02 2022; 44(1): 389–401.
http://doi.org/10.1007/s11357-021-00492-1
15. Lee M, Kim KM, Lim HB, Jo YJ, Kim JY. Repeatability of vessel density measurements using optical coherence tomography angiography in retinal diseases. Br J Ophthalmol 2019; 103: 704–710.
http://doi.org/10.1136/bjophthalmol-2018-312516
16. Lei J, Durbin MK, Shi Y, et al. Repeatability and Reproducibility of Superficial Macular Retinal Vessel Density Measurements Using Optical Coherence Tomography Angiography En Face Images. JAMA Ophthalmol 10 01 2017; 135(10): 1092-1098.
http://doi.org/10.1001/jamaophthalmol.2017.3431
17. Lui EY, Steinman AH, Cobbold RS, Johnston KW. Human factors as a source of error in peak Doppler velocity measurement. J Vasc Surg Nov 2005; 42(5): 972–9.
http://doi.org/10.1016/j.jvs.2005.07.014
18. Mathiesen EB, Joakimsen O, Bønaa KH. Prevalence of and risk factors associated with carotid artery stenosis: the Tromsø Study. Cerebrovasc Dis 2001; 12(1): 44–51.
http://doi.org/10.1159/000047680
19. Sakata LM, Deleon-Ortega J, Sakata V, Girkin CA. Optical coherence tomography of the retina and optic nerve – a review. Clin Exp Ophthalmol Jan 2009; 37(1): 90–9.
http://doi.org/10.1111/j.1442–9071.2009.02015.x
20. Sharma S, Ang M, Najjar RP, et al. Optical coherence tomography angiography in acute non-arteritic anterior ischaemic optic neuropathy. Br J Ophthalmol 08 2017; 101(8): 1045-1051.
http://doi.org/10.1136/bjophthalmol-2016-309245
21. Shiihara H, Sakamoto T, Yamashita T, et al. Reproducibility and differences in area of foveal avascular zone measured by three different optical coherence tomographic angiography instruments. Sci Rep 08 29 2017; 7(1): 9853.
http://doi.org/10.1038/s41598-017-09255-5
22. Van Melkebeke L, Barbosa-Breda J, Huygens M, Stalmans I. Optical Coherence Tomography Angiography in Glaucoma: A Review. Ophthalmic Res 2018; 60: 139–151.
http://doi.org/10.1159/000488495
23. Venugopal JP, Rao HL, Weinreb RN, et al. Repeatability of vessel density measurements of optical coherence tomography angiography in normal and glaucoma eyes. Br J Ophthalmol 03 2018; 102(3): 352–357.
http://doi.org/10.1136/bjophthalmol-2017-310637
24. Yanik Odabaş Ö, Demirel S, Özmert E, Batioğlu F. Repeatability of Automated Vessel Density and Superficial and Deep Foveal Avascular Zone Area Measurements Using Optical Coherence Tomography Angiography: Diurnal Findings. Retina Jun 2018; 38(6): 1238–1245.
http://doi.org/10.1097/IAE.0000000000001671
25. Yu JJ, Camino A, Liu L, et al. Signal Strength Reduction Effects in OCT Angiography. Ophthalmol Retina 10 2019; 3(10): 835–842.
http://doi.org/10.1016/j.oret.2019.04.029
