Potential use of amniotic membrane in ophthalmology. Review
doi: 10.55342/szemhungarica.2022.159.4.154
Review
Summary
The amniotic membrane (AM) has a long history of therapeutic use in the treatment of various ocular surface diseases. AM which contains pluripotent cells, highly organised collagen, antifibrotic and anti-inflammatory cytokines, immunomodulators, growth factors and matrix proteins, has outstanding tissue regeneration promoting properties and therefore the indication spectrum and the way of use of AM in ophthalmology is continuously expanding. The present review provides an overview of the anatomy of AM, the technical background of its use, different options for AM preservation, surgical techniques for AM transplantation (AMT) and indications for AM use in ophthalmology.
Összefoglaló
Az amnionmembrán (AM) terápiás célú felhasználása a szemfelszín különböző betegségeinek kezelésében hosszú múltra tekint vissza. A pluripotens sejteket, magasan szervezett kollagént, antifibrotikus és gyulladáscsökkentő citokineket, immunmodulátorokat, növekedési faktorokat és mátrixfehérjéket tartalmazó amnionmembrán szöveti regenerációt elősegítő tulajdonságai kiemelkedően magasak, emiatt napjainkban szemészeti célú felhasználásának indikációs spektruma és a felhasználás módja folyamatosan bővül. Jelen összefoglaló áttekintést ad az AM szemészeti célú alkalmazásának anatómia, technikai hátteréről, az AM prezervációjának különböző lehetőségeiről, az AM transzplantáció (AMT) sebészi technikáiról és az indikációs területekről.Keywords
amniotic membrane, transplantation, amniotic extract eyedrop
Kulcsszavak
amnionmembrán, transzplantáció, amnion extraktum szemcsepp
Bevezetés
Az amnionmembránt (AM) évtizedek óta használják szövetgyógyító adjuvánsként a medicina számos területén. Első irodalmi említése 1910-re nyúlik vissza: Davis és munkatársai bőr transzplantáció során történő felhasználásról számoltak be. Az AM első szemészeti célú felhasználása DeRoth nevéhez fűződik, azonban a kezdeti nem egyértelműen pozitív eredmények néhány évtizedre visszavetették a szemészeti terápiás célú alkalmazását (14). Az 1990-es évek eleje új fejezetet nyitott az AM szemészeti célú felhasználásában: egyre szélesebb terápiás területen alkalmazható sikeresen az egyre finomodó technológiai-műtéttechnikai innovációknak köszönhetően (6, 26, 59). Előnye, hogy könnyen hozzáférhető, megfelelő körülmények között hosszú ideig tárolható, így elég idő állhat rendelkezésre a műtét megtervezésére. Szinte egyedülálló szövetbiológiai tulajdonságai, úgymint az epitelizáció elősegítése, a fibrózis gátlása, a gyulladáscsökkentő és angiogenezist gátló hatás, valamint az alacsony immunogenitás nagyban hozzájárul ahhoz, hogy a regeneratív medicina egyre szélesebb körben alkalmazza az AM-et (58).
Az AM anatómiai felépítése, biológiai- fiziko-kémiai tulajdonságai
Az AM felépítésének és tulajdonságainak részletes ismerete elengedhetetlen a cornea és a conjunctiva felszíni defektusainak eredményes kezelése miatt, hogy tudniillik melyek azon tulajdonságok, amelyek alkalmassá teszik az AM-et a sikeres helyreállításra.
Az AM érmentes, átlátszó, ellenálló, az oxigént és a tápanyagokat diffúzió révén az amnion folyadékból nyerő szöveti struktúra (1. ábra). Ezen tulajdonságai a corneával megegyeznek, a különbség az, hogy az AM idegeket nem tartalmaz, ugyanakkor a cornea (és a conjunctiva) beidegzése bőséges és a conjunctiva erekkel is gazdagon átszőtt.
Az AM szerkezetét tekintve 5 rétegből áll (9):
- az epitélium a legbelső, cuboid sejtsorból álló réteg, amely közvetlen kontaktusban van a magzatvízzel;
- a bazálmembrán retikuláris rostok hálózatából álló vékony réteg;
- a stróma nagy szakítószilárdságú, vastag, kompakt, sejtmentes, retikuláris rostokban gazdag réteg;
- a retikulinba ágyazott fibroblasztok laza hálózatából álló fibroblaszt réteg az AM legvastagabb rétege,
- a szivacsos réteg szorosan kapcsolódik a chorion membránhoz, laza, mucint is tartalmazó retikulin hálózat alkotja.
Maga a membrán a placenta legbelső rétege, amelynek szerkezete a corneával és a conjunctivával hasonlóságot mutatva teszi alkalmassá azt a szemfelszíni defektusok helyreállítására. Számos vizsgálat történt az AM, a cornea és a conjunctiva hasonlóságainak megismerése érdekében. Ezek eredményeképpen tudjuk azt, hogy mindhárom struktúra bazális membránjában megtalálható a IV-es típusú kollagén, amelyek azonban alfa láncaikban különböznek egymástól. E különbözőség alapján az AM és a conjunctiva bazális membránja hasonlóságot mutat, a corneáé viszont eltér. A bazális membrán többi alkotóeleme (laminin 1, laminin 5, fibronektin) mindhárom struktúrában megtalálható. Az AM metabolikus aktivitással is rendelkezik. Az epitélium számos bioaktív anyagot termel (vazoaktív anyagok, növekedési faktorok, citokinek, extracelluláris matrix proteinek). Ezen aktivitás sem a cornea, sem a conjunctiva szerkezetében nincs meg, azonban az AM ezen tulajdonsága előnyös a helyreállító műtét eredményes kimenetele szempontjából, mivel elősegíti a sejt proliferációt-differenciálódást és az epitelizációt (18).
Az AM kedvező tulajdonságai a sikeres műtéti eredmény eléréséhez
- Barrier funkció és fájdalomcsillapító hatás. Az AM megakadályozza a sérült felszín kiszáradását azáltal, hogy gátolja a folyadékveszteséget. Fájdalomcsillapító hatását az idegvégződések környezeti hatásokkal szembeni megvédése révén fejti ki (47).
- Epitelizáció elősegítése. Az amnion sejtek különböző növekedési faktorokat és ezek receptorait tartalmazzák (epidermal growth factor (EGF), keratinocyte growth factor (KGFR), hepatocyte growth factor (HGF). Ezen anyagok felelősek az epitélsejtek proliferációjáért, migrációjáért, differenciálódásáért. Az AM bazális membránja stabil és biztonságos környezetet biztosít a növekvő epitélsejtek számára, elősegítve a sérült felszín gyors hámosodását (10). A bazális membránban lévő adhezív glikoproteinek, a különböző laminin formák (laminin 5) megkönnyítik a cornea epitél- és progenitor sejtek adhézióját és expanzióját, többek között ezzel magyarázható az AM sikeressége a limbális őssejt-deficiencia kezelésében (8).
- Fibrózis és hegesedés gátlás. A sebgyógyulás során a fibroblasztok aktiválódása indítja el a heg kialakulását a sérült felszínen. A folyamatért a „basic fibroblast growth factor” (bFGF) és a transforming growth factor béta (TGFB) felelős. A bFGF érképződést segítő anyag, amely elindítja a granulációs szövet kialakulását. A TGFB felelős az extracelluláris matrix proteinek szintéziséért, valamint a fibroblaszt-miofibroblaszt átalakulás szabályozásáért. Az AM gátolja a TGFB receptorok expresszióját, valamint a TGFB szignál transzdukciót a cornea és conjunctiva sejtekben. Ennek eredményeként a fibrózis folyamata lelassul. A membrán gátolja a keratinociták miofibroblaszttá való differenciálódását. Ezek az inhibitor funkciók segítenek abban, hogy a cornea transzparenciája és szilárdsága megmaradjon (10).
- Gyulladáscsökkentő hatás. A gyulladáscsökkentő hatásmechanizmusa nem teljesen ismert. Az AM-ben számos antiinflammatorikus mediátor található. Az egyik ilyen anyag az interleukin 10 (IL-10: humán citokin szintézist gátló faktor), amely egy sor proinflammatorikus citokin expresszióját csökkenti (granulocita-makrofág kolonizációt stimuláló faktor, tumor nekrózis faktor, interferon gamma, IL-2, IL-3). Az IL-10 antiinflammatorikus hatása részben bizonyos T-sejt szubpopulációk (Th1) aktiválásának gátlása, részben a makrofágok valamint a dendritikus sejtek aktiválódásának csökkentése, az antigén prezentáció folyamatának révén alakul ki. Az IL-10 továbbá növeli a B-sejtek túlélését, proliferációját és ellenanyag termelését. Az előbbieken kívül az AM a „tissue inhibitors of metalloproteinase” (TIMP) 1,2,3,4 és az IL-1 antagonista endostatin termelésével szintén a gyulladás kialakulásának gátlásához járul hozzá. Az erős gyulladáscsökkentő tulajdonságokkal rendelkező citokin központi szerepet játszik a kórokozókkal szemben iniciálódó gazdaszervezeti immunválasz korlátozásában, ezáltal megelőzi a gazdaszervezet károsodását és fenntartja a normális szöveti homeosztázist (13, 38, 44).
- Angiogenezis gátló hatás. Az érmentesség a sikeres AM műtét eredményességében elengedhetetlen. Számos olyan anyag (trombospondin-1, endostatin, TIMP 1,2,3,4) jelenléte bizonyított az AM-ben, amelyek egyértelműen angiogenezis gátló hatással bírnak.
- Immunválasz kiváltásának hiánya. Kezdeti tanulmányok szerint az AM nem expresszál humán leukocita antigén (HLA) A, B és DR antigéneket, azonban jelenleg egyételmű, hogy az AM-ben megtalálható a HLA Ia és Ib osztályba tartozó antigének mindegyike, a HLA II osztályba tartozók azonban hiányoznak. Friss AM transzplantátum esetében ugyan enyhe immunválaszra lehet számítani, amit az életképes epitélsejtek által expresszált HLA-I antigének okoznak, krioprezervált AM esetében a kilökődés esélye azonban minimális, mivel az élő epitélsejtek száma lecsökken a fagyasztás során, csökkentve a HLA-I antigének expresszióját is (3).
- Antimikrobás és antivirális hatás. A membránban jelenlévő cystatin E antivirális tulajdonságokat mutat. A defensin béta 3 ellenállóvá teszi az epiteliális felszínt a kórokozókkal szemben. A bazális membránban lévő kollagénrostok megakadályozzák a haematomák kialakulását, minimálisra csökkentve a kórokozók elszaporodásának esélyét. Az AM szemfelszínhez való erős kötődése szintén hozzájárul az infekciók megelőzéséhez, csökkentve a szerózus folyadék felhalmozódást.
Az AM felhasználásra való előkészítése
Mint minden átültetésre alkalmas szerv és szövet, így az AM is szigorú előírások figyelembevételével kerülhet kutatási és terápiás célú felhasználásra, amelyek egyaránt vonatkoznak a donor és a recipiens kiválasztására, valamint az AM előkészítésére (10).
A donorszemélyek kiválasztása esetében kiemelkedő fontossággal bír a kiterjedt anamnézis felvétel és fizikális vizsgálat, mivel a transzplantáció során fennáll a különböző fertőzések és a vérrel terjedő kórokozók átvitelének lehetősége. Az előzetes vizsgálat során ki kell térjünk arra, hogy a számításba vett donor élete során kapott-e transzfúziót, van-e valamilyen malignus betegsége, droghasználat ismert-e addigi életében. A megelőző vizsgálat, felvilágosítás során tájékoztatni kell az adományozót a membrán izolálási eljárásról és a felhasználás céljáról egyaránt.
Mikrobiológiai vizsgálatok
Az AMT során átvihető fertőzések minimalizálására a kiválasztott donorszemélytől szerológiai vizsgálat elvégzése céljából vért veszünk. Az arra alkalmas, akkreditált laboratóriumban a donor vérmintáját HIV, hepatitis B és C, valamint szifilisz kórokozók jelenlétére minden esetben teszteljük. A citomegalovírus és a toxoplasma szűrése – mint a legtöbb szövetátültetés során – itt sem kötelező (15). A vérvizsgálatot szeronegatív eredmény esetén is, 6 hónap múlva meg kell ismételni, hogy az esetleges fertőzéseket biztonsággal ki lehessen zárni. Ezen ,,ablak periódus” alatt a donor már fertőzött lehet, azonban a tesztek eredményei még nem pozitívak. A membrán minden esetben csak akkor használható fel, ha mindkét vizsgálat eredményei negatívak. Így a fertőzések átvitelének esélye minimálisra csökkenthető. Vannak azonban olyan betegségek (Creutzfeld–Jakob-kór) amelyek kimutatására még nem létezik biztonságos szűrővizsgálat, így ezek – bár igen kicsi, de – potenciális veszélyt jelenthetnek. A tesztek eredményeit és a vérmintákat a transzplantáció után 10 évig meg kell őrizni.
Minőségellenőrzés
Az AM az izolálás, előkészítés, tárolás és klinikai felhasználás során is kontaminálódhat, ezért szigorú szabályok betartása és steril körülmények biztosítása szükségesek az exogén fertőzések kialakulásának megelőzése érdekében. Minden körülmények között törekedni kell a membrán szerkezete és tulajdonságai minél nagyobb mértékű megelőzésére. Ezt a membrán izolálásától a beültetésig folyamatos ellenőrzéssel érhetjük el. Az előírások szerint mintát kell vennünk a tartósító és öblítő folyadékból, valamint a membránból az antibiotikumos oldatba helyezés és a csomagolás előtt egyaránt. A mintákban aerob, anaerob baktériumok és gombák jelenlétét vizsgáljuk.
A transzplantátumnak mind a donortól a recipiensig, mind pedig a recipienstől a donorig nyomon követhetőnek kell lenni, ezért az előkészített membránt címkével látjuk el, amelyen minden információ megtalálható a donorról, az előkészítés módjáról és a recipiensről. Összefoglalva: olyan membrán nem használható fel átültetés céljára, amely a felállított kritériumoknak nem felel meg, eredete nem tisztázott, tehát a recipiens számára akár minimális kockázatot is jelenthet.
Az AM tartósítására szolgáló eljárások
Krioprezerváció
A kriokonzerválás a legelterjedtebb és talán legegyszerűbben kivitelezhető prezerválási technika. Az eljárás során egy tárolóközegbe helyezik a szövetet (fiziológiás sóoldat vagy Dulbecco’s Modified Eagle Medium – DMEM) és –80 °C-ra lefagyasztják. Az alacsony hőmérsékeltre történő hűtés a nem szabályozott enzimatikus bomlási folyamatok legnagyobb részét leállítja és így a struktúra anatómiai-biokémiai sajátosságai lényegesen nem változnak meg (4). A hűtés során keletkező jégkristályok ugyanakkor potenciálisan károsíthatják a sejtmembránt, megbontva ezzel a sejtek integritását. A felolvasztási folyamat során a szolubilis fehérjék koncentrációja csökkenhet, ami az AM sebgyógyulási folyamatokban betöltött szerepét módosíthatja. Ezen tényezők azonban lényegesen nem csökkentik a krioprezervált AM terápiás hatékonyságát. A krioprezervációs tárolás speciális hűtési technológiát igényel.
Liofilizálás
A liofilizálás során először –80 °C-ra fagyasztják a szövetet, majd szublimációval eltávolításra kerül a struktúra víztartalma. A folyamat gátolja a biodegradációt okozó kémiai-biokémiai reakciókat. A liofilizált szövet szobahőmérsékleten tárolható, felhasználás előtt nem igényel felolvasztást.
A kriokonzervált és a liofilizált minták biológiai-biokémiai tulajdonságait összehasonlító tanulmányok igazolták a IV. típusú kollagén jelenlétét a bazálmembránban mindkét tartósítási mód esetén (48). A teljes protein koncentrációban, valamint – néhány fibroblaszt növekedési faktoron kívül, amelyek szöveti szintje a kriokonzervált mintákban magasabb volt – a többi növekedési faktor koncentrációjában nem mutatkozott szignifikáns különbség a kriokonzervált és a liofilizált AM-ek között.
Dehidrálás és alacsony hőmérsékletű liofilizálás
A nedvesség eltávolítására, a szövet dehidrálására levegő vagy hő használható. A dehidrált AM nem jár a liofilizált vagy kriokonzervált AM-mel kapcsolatos problémákkal, mivel nem tartalmaz olyan lépést, amikor a szövetet lefagyasztják (40). A szövet sterilizálására gamma-sugárzás alkalmazható. A dehidrálási folyamat során az intracelluláris organellumok épségének megóvása érdekében cukorvédő szerrel (pl. trehalóz) történő előkezelést alkalmaznak. A dehidrálás során eltávozó vizet az intracellulárisan mátrixot képző cukor helyettesíti, megvédve a sejtorganellumokat a degradációtól, így biztosítva a szövet viabilitását.
AMT-sebészi technikák
Az AM sebészi alkalmazása két, egymástól jól elkülönülő terápiás elv köré épül (16). Használható egyrészt sebészi graftként, amikor a beültetendő szövet integrálódik a befogadó, károsodott állományba, másrészt „biológiai kötszerként” fejtheti ki helyreállító hatását.
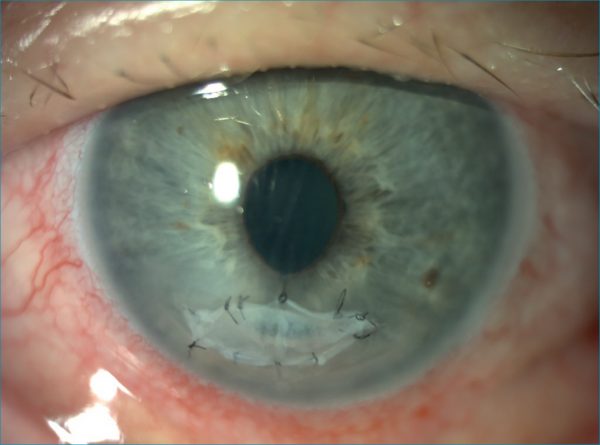
Graftként alkalmazva az AM tényleges vázat biztosít a reepitelizáció során, amelybe a felszíni hám bele tud nőni azon esetekben, amikor szövetelhalás, szövethiány áll fenn (2. ábra).
A másik típusú felhasználási mód a valódi kötszerként történő alkalmazás, amikor a felszín helyreállításához használt szövet nem integrálódik, hanem felszíni kötszerként segíti az alatta zajló gyógyulási folyamatot. Az újonnan képződött epitélium az AM alatt fedi be a hámfosztott területet. A gyógyulási folyamat előre haladásával a felszíni ,,bandázs” lelökődik és megközelítőleg 10-14 nap alatt degradálódik.
Inlay transzplantációs technika
A sebészi beavatkozás során az AM a szövethiányos területre kerül (3. A ábra). Ebben az esetben az amnion helyettesítő szerepet tölt be az elvesztett szövet pótlása révén, hiszen a graft a gyógyulási folyamat során tartósan beépül a gazdaszervezet szaruhártya mátrixába (23). A seb mélységétől függően, egy- vagy többrétegű graftok alkalmazhatók. Az amnion azon képessége, hogy integrálódni képes a szaruhártya strómába, a hemidezmoszóma-dezmoszóma képződésnek köszönhető. Az AM ebben az esetben az epiteliális felszínével felfelé („side-up”) kerül beültetésre. A recipiens ágy széli részének hám abráziója segíthet megakadályozni az AM alá történő nemkívánatos hám benövéseket. A regenerációs folyamat részeként idővel a beültetett AM „bazálmembránként” funkcionál, anatómiai alapot szolgáltatva a reepitelizációs folyamatoknak.
Onlay transzplantációs technika
Ebben az esetben az AM epitélium felszínnel lefelé („side down”) kerül beültetésre átmeneti biológiai kötszerként funkcionálva (3. B ábra) (15, 35). A beültetett AM szövet fizikai barrierként szolgál, megvédi a sebfelületet a kórokozók behatolásától, gátolja a symblepharon és ankyloblepharon képződést. Az AM által szekretált proteinek a szemfelszínen csökkentik a fibrózist, lehetővé téve a hatékony sebgyógyulást. Az onlay átültetett AM nem épül be a szaruhártyába, addig marad a szem felszínén, amíg el nem távolítják, vagy nem bomlik le/lökődik ki.
Multilayer technika
Mélyebb defektusok esetén alkalmazott eljárás, amelynek során a membránt rétegről rétegre helyezik a lézióra, így azok a léziót teljesen kitöltik (3. C ábra) (15). A mélyebbre helyezett rétegek sorrendje nem lényeges, a legfelső rétegnek azonban az epiteliális felszínével felfelé kell lennie. A fekély alján lévő rétegeket nem rögzítik varrattal, csupán a legfelső AM-t varrják a defektus széleihez. Ebben az esetben is az epitélsejtek ránőnek a membránra.
„Szendvics” technika
Az „inlay” és az „onlay” technikák előnyeit egyesíti a szendvics módszer (3. D. ábra). A graft biztosítja a strukturális integritást, míg a patch a graft fiziko-kémiai védelmét szolgálja a szöveti reparáció alatt (15). Mindkét típusú transzplantátum antiinflammatorikus és szöveti regenerációt elősegítő tulajdonságai érvényesülnek a gyógyulási folyamat során. A hám ebben az esetben a két transzplantátum réteg közé fog benőni.
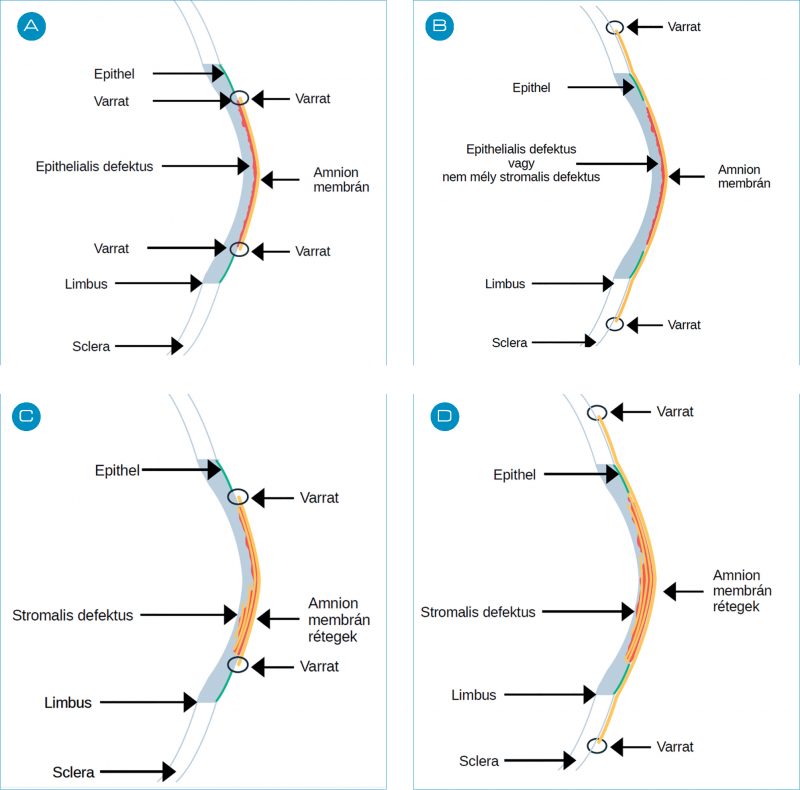
3. B ábra: Amnionmembrán onlay/patch transzplantációs technika sematikus ábrája
3. C ábra: Amnionmembrán transzplantáció „multilayer” típusú transzplantációs technikájának sematikus ábrája
3. D ábra: Amnionmembrán transzplantáció „szendvics” típusú transzplantációs technikájának sematikus ábrája
Az AMT szemészeti indikációi
Tekintettel arra, hogy az AMT szemfelszín rekonstrukciós és szemfelszíni sebgyógyulást elősegítő terápiás területei részlegesen átfedőek, az alábbiakban nem különválasztva, hanem összegezve mutatjuk be az AMT legfontosabb indikációit.
Cornea fekélyek, perzisztáló epitél defektusok
A szaruhártya fekélyek kezelésében jelentős szerepe van az AMT-nek. A fekély mélységétől és az elérni kívánt hatástól függően mindhárom típusú transzplantációs technikával (inlay, onlay, szendvics) jó eredmények érhetők el. Számos retrospektív klinikai vizsgálat igazolta az AMT terápiás hatékonyságát neurotrofiás keratitisben, bakteriális, gomba, illetve vírus etiológiájú keratitisek okozta fekélyek esetében (19, 25, 29, 32, 50). A korai AMT a bakteriális eredetű keratitisekben (2-5 napos antibiotikum-előkezelés után) kiváló hatékonyságú lehet (55).
Limbális őssejt-deficiencia
Fiziológiásan a kötőhártya forniceális és a szaruhártya limbális progenitor őssejtjei biztosítják a szemfelszín folyamatos regenerálódását, a szemfelszíni epitélsejtek megújulását. Ezeknek az őssejt-reservoiroknak a károsodása a szemfelszín irreverzibilis károsodásához, a szaruhártya transzparenciájának az elvesztéséhez vezet. A limbális őssejt-elégtelenség (limbal stem cell deficiency: LSCD) gyógyítása limbális őssejt-átültetéssel lehetséges (limbal stem cell transplantation: LSCT), amely eljárásnak – amennyiben autológ módon nem kivitelezhető – számos technikai és immunológiai nehézsége van (5).
Az AM-nek igen jelentős szerepe lehet a LSCD kezelésében, a LSCT kivitelezésében.
Kimutatták, hogy a szaruhártya hámsejtjei gyorsan vándorolnak, amikor a limbális explantátumokat denudált (epitélsejtektől megfosztott), de ép bazálmembránnal rendelkező AM-re helyezik. Lassabb a vándorlás intakt epitélium esetén, és leglassabb akkor, amikor csak a stromális felszín áll a corneális hámsejt-migráció rendelkezésére. A devitalizált AM-re helyezett limbális explantátum eredményesen expandálódik limbális őssejt fenotípussal rendelkező sejttenyészetté (36).
Az AM a LSCT-vel együtt alkalmazható az LSCD kezelésére. Különböző in vivo expanziós eljárások és sebészi technikák lehetnek célra vezetőek a klinikai képtől függően (egyszerű epiteliális limbális transzplantáció [SLET], az amnion-asszisztált conjunctiva epiteliális redirekció [ACER], a tenyésztett limbális őssejt-transzplantáció [CLET – humán limbális sejtek, COMET-orális mucosa]), az AM azonban mindegyik esetében fontos szerepet játszik (15, 28, 30, 49, 51, 53). Jelen összefoglaló kereteit meghaladja az eljárások részletes ismertetése.
Akut maródásos és égési sérülések
Kémiai, illetve égési sérülések kezelésében kiemelkedően fontos szerepe van az AMT-nek (11, 17, 37). Az AM-et epiteliotrop, gyulladáscsökkentő, anti-angiogén tulajdonsága, oxigénáteresztő képessége valamint a sérült területen általa létrehozott mechanikus védelem és a fájdalom csillapítása teszik ideális terápiás alternatívává a súlyos vegyi vagy termális combustiós sérülések esetében (56). Az AMT-nek a kémiai sérülések akut szakaszában hámosodást gyorsító, gyulladást és fájdalmat csökkentő, a későbbiekben symblepharon képződést redukáló szerepe lehet.
Szemfelszíni hegesedést okozó elváltozások (cicatrisalo conjunctivitis, ocularis pemphigoid)
Az AM gyulladáscsökkentő hatása kiemelkedő fontosságú a szemfelszíni gyulladásos-bullosus folyamatok (Steven’s–Johnson-szindróma, ocularis pemphigoid) kezelésében (33, 52). Ezen esetekben az intenzív gyulladás 2-3 hétig is tart, amely idő alatt a károsodott epitélsejtek a szemfelszínről teljes mértékben lelökődnek, szabad utat biztosítva a hegszövet kialakulásának. Ennek megelőzése az időben történő AMT-vel válik lehetővé, így a később már visszafordíthatatlan hegesedés megakadályozható vagy jelentősen csökkenthető. Az eljárás gyermekkorban is sikerrel alkalmazható (60).
Pterygium eltávolítása során a szabad sclera fedése, a kötőhártya defektus zárása
Az AMT ebben az indikációban ugyan számos közlemény által dokumentált, azonban az utóbbi időben alkalmazása kissé háttérbe szorult az autolog conjunctiva graft használata mögött (12). Metaanalízis szintű evidenciák állnak ugyanis rendelkezésre arra vonatkozóan, hogy conjunctiva autograft használata mellett alacsonyabb rekurrencia rátával lehet számolni (2, 45). Az AM transzplantáció előnye a conjunctiva autografttal szemben elsősorban az, hogy ebben az esetben nem keletkezik a conjunctiván a donor területnek megfelelően szövetdefektus.
Szemfelszíni neoplazmák eltávolításakor létrejött kötőhártya hiány pótlása
A kötőhártyán kialakult kiterjedtebb malignus vagy benignus szövetszaporulatok eltávolítása után kialakult szövethiány pótlására kiválóan alkalmas az AM (1, 43, 46). Az optimális posztoperatív szöveti regeneráció-reepitelizáció biztosításával igen alacsony a nemkívánatos szövet összenövések, hegesedések (symblepharon) kialakulásának esélye. Különösen malignus folyamatok esetén nagy jelentőségű, hogy az AM transzparens volta lehetővé teszi az esetleges rekurrens elváltozások mihamarabbi diagnosztizálását, míg pl. orális mucosával való kötőhártya pótlás során a lokális onkológiai követés/vizualizáció nehezítettebb lehet. Az AM anti-neoplasztikus hatásának mechanizmusa teljesen tisztázott ugyan, de anti-angiogén, pro-apoptotikus és immunmodulátor faktorok szekréciója révén szerepe lehet a mitotikusan aktív tumorsejtek elpusztításában is (22, 41, 42).
Okuloplasztikai célú felhasználás
Hegesedő szemhéj elváltozások műtéti megoldásához, symblepharolysis, fornix rekonstrukció, zsugorodó anophthalmikus kötőhártyazsák esetén szükségessé váló mucosa transzplantációhoz az AM ideális és optimális választás lehet (24, 27, 57). Különösen hasznos és sikeres lehet a használata olyan esetekben, amikor nagy felületen szükséges a nyálkahártya (kötőhártya) pótlása, illetve amikor hegesítő-fibrotizáló kötőhártya alapfolyamat miatt válik szükségessé az AMT. Ez utóbbi esetekben az AM antifibrotikus hatása kiemelt jelentőségű lehet (7, 21).
Új irányok az amnionmembrán felhasználásában
AM szemcsepp (AM extraktum szemcsepp)
Élénk kutatások folynak a különböző AM extraktumok (AME) tulajdonságait és terápiás jellegét illetően. Az AME számos olyan tulajdonsággal rendelkezik, mint a krioprezervált AM. Az AM-hez hasonlóan nagy mennyiségben tartalmaz számos növekedési faktort, többek között EGF-et, HGF-et, bFGF-et, proteáz gátlókat és egy új mátrixkomponenst, a nehézláncú hialuronsav-pentraxin 3-at (HC-HA/PTX3), amely megakadályozza a gyulladást, az angiogenezist és a hegesedést (5, 20, 54). Az AME megőrzi gyulladáscsökkentő hatását, és gyakran a makrofágok apoptózisának alulregulációján és indukcióján keresztül fejti ki hatását. Az AME és AMEED előállítására különböző módszerek léteznek, egységes szabványosítás nélkül. Az AMEED előállítható friss AM folyékony nitrogénben történő lefagyasztását követő homogenizálással, kriokonzervált vagy dehidrált AM porlasztásával, mikronizálással stb.
A különböző előkészítési módok különböző mennyiségű bioaktív komponenst eredményezhetnek. Egy AME vizsgálatban a kivont HGF 20%-kal magasabb volt a porítással, mint a homogenizálással előállított extraktum esetében. A proteáz inhibitor használata növeli, míg az ismételt centrifugálás akár meg is duplázhatja a kivont HGF mennyiségét. Az AME 6 hónapig –170 °F-on történő tárolása a HGF és a fehérje szintjének 50%-os csökkenését okozta (34).
Az extraktum hatékony klinikai alkalmazhatóságát egyre több klinikai vizsgálati eredmény támasztja alá (31, 39). A készítmény eredményesen alkalmazható a szemfelszín vegyi sérülései, perzisztáló epitél defektusok, parciális limbális őssejt elégtelenség, neurotrófiás keratitis esetén.
További klinikai vizsgálatokra van szükség az AMEED standardizálásának és hatékonyságának meghatározásához. Bár szövődményekről eddig nem számoltak be az AMEED-kezelés kapcsán, hosszabb megfigyelési időre és nagyobb betegpopulációra van szükség a biztonságosság értékeléséhez. A gyártás szabványosításával, a feldolgozás előtti jobb AM konzerválással, a biológiai aktivitás stabilizálásával és megfelelő, jól megtervezett klinikai vizsgálatokkal azonban az AME és származékai potenciálisan hasznosak lehetnek a szemfelszíni rendellenességek kezelési lehetőségeként és az olyan sebészeti eljárások kiegészítőjeként, mint az AMT és a különböző típusú limbális graft beültetések.
Következtetések
Az AM szemészeti célú felhasználása nagy múltra tekint vissza és napjainkban ismét reneszánszát éli. Az AM alkalmazásának indikációs területei, valamin a szövet felhasználásának formái folyamatosan szélesednek. Az AM-mel kapcsolatos biokémiai-biológiai ismereteink folyamatosan bővülnek, a prezerváció és a transzplantáció technikájának finomodása egyre nagyobb terápiás hatékonyságot eredményezhet. Az AM felhasználásának potenciális újabb területeiről még kevés irodalmi adat áll rendelkezésre, az adatok bővülésével ezek az új irányok megtalálhatják a helyüket a klinikai gyakorlatban.
Köszönetnyilvánítás
A szerzők köszönetüket fejezik ki dr. Árpádffy-Lovas Tamás (SZTE Szemészeti Klinika) rezidens kollégának a számítógépes grafikai munkálatokért és † dr. Fülöp Dórának.
Nyilatkozat
A szerzők kijelentik, hogy összefoglaló, továbbképző közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Agraval U, Rundle P, Rennie IG, Salvi S. Fresh frozen amniotic membrane for conjunctival reconstruction after excision of neoplastic and presumed neoplastic conjunctival lesions. Eye (Lond) 2017; 31(6): 884–889.
http://doi.org/10.1038/eye.2016.322
2. Akbari M, Soltani-Moghadam R, Elmi R, Kazemnejad E. Comparison of free conjunctival autograft versus amniotic membrane transplantation for pterygium surgery. J Curr Ophthalmol 2017; 29(4): 282–286.
http://doi.org/10.1016/j.joco.2017.08.003
3. Akle CA, Adinolfi M, Welshki KI, Leibowitz S, McColl I. Immunogenecy of human epithelial cell after transplantation into volunteers. Lancet 1981; 1: 1003–1005. http://doi.org/10.1016/s0140-6736(81)91212-5
4. Allen CL, Clare G, Stewart EA, et al. Augmented dried versus cryopreserved amniotic membrane as an ocular surface dressing. PLoS One 2013; 8(10): e78441. http://doi.org/10.1371/journal.pone.0078441
5. Baradaran-Rafii A, Asl NS, Ebrahimi M, et al. The role of amniotic membrane extract eye drop (AMEED) in in vivo cultivation of limbal stem cells. Ocul Surf 2017; 16(1): 146–153. http://doi.org/10.1016/j.jtos.2017.11.001
6. Batle JF, Perdomo FJ. Placental membranes as a conjunctival substitute. Ophthalmology 1993; 100: A107.
7. Barabino S, Rolando M, Bentivoglio G, et al. Role of amniotic membrane transplantation for conjunctival reconstruction in ocular cicatricial pemphigoid. Ophthalmology 2003; 110(3): 474–480.
http://doi.org/10.1016/ S0161-6420(02)01892-4
8. Baradan-Rafii A, Aghayan H-R, Arjmand B, Javadi M-A, Amniotic Membrane Transplantation. Iran J Ophthalmic Res 2007; 2(1): 58–75.
9. Bourne GL. The microscopic anatomy of the human amnion and chorion. Am J Obstetric 1960; 79: 1070–3.
http://doi.org/10.1016/0002-9378(60)90512-3
10. Chopra A, Betsy ST. Amniotic Membrane: A Novel Material for Regenerationand Repair. Biomimetics Biomaterials and Tissue Engineering 2013; 18: 1.
11. Clare G, Suleman H, Bunce C, Dua H. Amniotic membrane transplantation for acute ocular burns. Cochrane Database Syst Rev 2012; 9.
http://doi.org/10.1002/14651858.CD009379.pub2
12. Clearfield E, Muthappan V, Wang X, Kuo IC, Johnston V. Conjunctival autograft for pterygium. Cochrane Database Syst Rev 2016; 2: Cd011349.
http://doi.org/10.1002/14651858.CD004158.pub3
13. de Waal Malefyt R, Abrams J, Bennett B, Figdor CG, de Vries JE. Interleukin 10 (IL-10) inhibits cytokine synthesis by human monocytes: an autoregulatory role of IL-10 produced by monocytes. J Exp Med 1991; 174(5): 1209–20.
http://doi.org/10.1084/jem.174.5.1209.PMC2119001.PMID1940799
14. de Rotth A. Plastic repair of conjunctival defects with fetal membranes. Arch Ophthalmol 1940; 23(3): 522–525.
http://doi.org/10.1001/archopht.1940.00860130586006
15. Dua HS, Gomes JA, King AJ, Maharajan VS. The amniotic membrane in ophthalmology. Surv Ophthalmol 2004; 49(1): 51–77.
http://doi.org/10.1016/j.survophthal.2003.10.004
16. Dua HS, Miri A, Elalfy MS, Lencova A, Said DG. Amnion-assisted conjunctival epithelial redirection in limbal stem cell grafting. Br J Ophthalmol 2017; 101(7): 913–919.
http://doi.org/10.1136/bjophthalmol-2015-307935
17. Eslani M, Baradaran-Rafii A, Cheung AY, et al. Amniotic membrane transplantation in acute severe ocular chemical injury: a randomized clinical trial. Am J Ophthalmol 2019; 199: 209–215.
http://doi.org/10.1016/j.ajo.2018.11.001
18. Fairbain NG, Randolph MA, Redmond RW. The clinical applications of human amnion in plastic surgery. Journal of Plastic, Reconstructive & Aethetic Surgery 2014; 67: 662-675.
http://doi.org/10.1016/j.bjps.2014.01.031
19. Fuchsluger T, Tuerkeli E, Westekemper H, Esser J, Steuhl KP, Meller D. Rate of epithelialisation and re-operations in corneal ulcers treated with amniotic membrane transplantation combined with botulinum toxin-induced ptosis. Graefes Arch Clin Exp Ophthalmol 2007; 245(7): 955–964.
http://doi.org/10.1007/s00417-006-0493-1
20. He H, Li W, Chen SY, et al. Suppression of activation and induction of apoptosis in RAW264.7 cells by amniotic membrane extract. Invest Ophthalmol Vis Sci 2008; 49(10): 4468–4475.
http://doi.org/10.1167/iovs.08-1781
21. Honavar SG, Bansal AK, Sangwan VS, Rao GN. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson syndrome. Ophthalmology 2000; 107(5): 975–979.
http://doi.org/10.1016/S0161-6420(00)00026-9
22. Hossain L, Siddika A, Adnan MH, Diba F, Hasan Z, Asaduzzaman SM. Human Amniotic Membrane and Its Anti-cancer Mechanism: a Good Hope for Cancer Therapy. SN Compr Clin Med 2019; 1(7): 487–495.
http://doi.org/10.1007/s42399-019-00090-5
23. Jirsova K, Jones GLA. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting. Review Cell Tissue Bank 2017; 18(2): 193–204. http://doi.org/10.1007/ s10561-017-9618-5
24. Kheirkhah A, Ghaffari R, Kaghazkanani R, Hashemi H, Behrouz MJ, Raju VK. A combined approach of amniotic membrane and oral mucosa transplantation for fornix reconstruction in severe symblepharon. Cornea 2013; 32(2): 155–160.
http://doi.org/10.1097/ ICO.0b013e318247983d
25. Khokhar S, Natung T, Sony P, Sharma N, Agarwal N, Vajpayee RB. Amniotic membrane transplantation in refractory neurotrophic corneal ulcers: a randomized, controlled clinical trial. Cornea 2005; 24 (6): 654–660.
http://doi.org/10.1097/01.ico.0000153102.19776.80
26. Kim JC, Tseng SC. Transplantation of preserved human amniotic membrane for surface reconstruction in severely damaged rabbit corneas. Cornea 1995; 14(5): 473–484.
27. Kumar S, Sugandhi P, Arora R, Pandey PK. Amniotic membrane transplantation versus mucous membrane grafting in anophthalmic contracted socket. Orbit 2006; 25(3): 195–203.
http://doi.org/10.1080/01676830600575527
28. Le Q, Deng SX. The application of human amniotic membrane in the surgical management of limbal stem cell deficiency. Ocul Surf 2019; 17(2): 221–229. http://doi.org/10.1016/j.jtos.2019.01.003
29. Lee SH, Tseng SC. Amniotic membrane transplantation for persistent epithelial defects with ulceration. Am J Ophthalmol 1997; 123 (3): 303–312.
http://doi.org/10.1016/s0002-9394(14)70125-4
30. Li W, Hayashida Y, He H, Kuo CL, Tseng SC. The fate of limbal epithelial progenitor cells during explant culture on intact amniotic membrane. Invest Ophthalmol Vis Sci 2007; 48(2): 605–613.
http://doi.org/10.1167/iovs.06-0514
31. Liang L, Li W, Ling S, et al. Amniotic membrane extraction solution for ocular chemical burns. Clin Exp Ophthalmol 2009; 37(9): 855–863.
http://doi.org/10.1111/j.1442-9071.2009.02159.x
32. Liu J, Li L, Li X. Effectiveness of Cryopreserved Amniotic Membrane Transplantation in Corneal Ulceration: a Meta-Analysis. Cornea 2019; 38(4): 454–462.
http://doi.org/10.1097/ICO.0000000000001866
33. Ma KN, Thanos A, Chodosh J, Shah AS, Mantagos IS. A Novel technique for amniotic membrane transplantation in patients with acute stevens-johnson syndrome. Ocul Surf 2016; 14(1): 31–36.
http://doi.org/10.1016/j.jtos.2015.07.002
34. Mahbod M, Shahhoseini S, Khabazkhoob M, et al. Amniotic membrane extract preparation: what is the best method? J Ophthalmic Vis Res 2014; 9(3): 314–319. http://doi.org/10.4103/2008-322X.143367
35. Malhotra C, Jain AK. Human amniotic membrane transplantation: different modalities of its use in ophthalmology. World J Transplant 2014; 4(2): 111–121. http://doi.org/10.5500/wjt.v4.i2.111
36. Maharajan VS, Shanmuganathan V, Currie A, Hopkinson A, Powell-Richards A, Dua HS. Amniotic membrane transplantation for ocular surface reconstruction: indications and outcomes. Clin Exp Ophthalmol 2007; 35(2): 140–147.
http://doi.org/10.1111/j.1442-9071.2006.01408.x
37. Meller D, Pires RTF, Mack RJS, et al. Amniotic membrane transplantation for acute chemical or thermal burns. Ophthalmology 2000; 107(5): 980–989. http://doi.org/10.1016/S0161-6420(00)00024-5
38. Moore KW, de Waal Malefyt R, Coffman RL, O'Garra A. Interleukin-10 and the interleukin-10 receptor. Annual Review of Immunology 2001; 19(1): 683–765. PMID 11244051.
http://doi.org/10.1146/annurev.immunol.19.1.683.
39. Murri MS, Moshirfar M, Birdsong OC, Ronquillo YC, Ding Y, Hoopes PC. Amniotic membrane extract eyedrops: a review of literature and clinical application. Clin Ophthalmol 2018; 12: 1105–1112.
http://doi.org/10.2147/OPTH.S165553
40. Nakamura T, Yoshitani M, Rigby H, et al. Sterilized, freeze-dried amniotic membrane: a useful substrate for ocular surface reconstruction. Invest Ophthalmol Vis Sci 2004; 45(1): 93–99.
http://doi.org/10.1167/iovs.03-0752
41. Niknejad H, Yazdanpanah G. Anticancer effects of human amniotic membrane and its epithelial cells. Med Hypotheses 2014; 82(4): 488–489.
http://doi.org/10.1016/j.mehy.2014.01.034
42. Niknejad H, Yazdanpanah G, Ahmadiani A. Induction of apoptosis, stimulation of cell-cycle arrest and inhibition of angiogenesis make human amnion-derived cells promising sources for cell therapy of cancer. Cell Tissue Res 2016; 363(3): 599–608.
http://doi.org/10.1007/s00441- 016-2364-3
43. Paridaens D, Beekhuis H, van Den Bosch W, Remeyer L, Melles G. Amniotic membrane transplantation in the management of conjunctival malignant melanoma and primary acquired melanosis with atypia. Br J Ophthalmol 2001; 85(6): 658–661.
http://doi.org/10.1136/bjo.85.6.658"
44. Pestka S, Krause CD, Sarkar D, Walter MR, Shi Y, Fisher PB. Interleukin-10 and related cytokines and receptors. Ann Rev Immunol 2004; 22(1): 929–79. PMID 15032600.
http://doi.org/10.1146/annurev.immunol.22.012703.104622
45. Prajna NV, Devi L, Seeniraj SK, Keenan JD. Conjunctival autograft versus amniotic membrane transplantation after double pterygium excision: a randomized trial. Cornea 2016; 35(6): 823–826.
http://doi.org/10.1097/ICO.0000000000000812
46. Qin H. Excision combined with concavity-convex amniotic membrane transplantation in the treatment of intraepithelial epithelioma. Int J Ophthalmol 2017; 17: 404–408.
47. Rock T, Bartz-Schmidt KU, Landenberger J, Bramkamp M, Rock D. Amniotic membrane transplantation in reconstructive and regenerative ophthalmology. Ann Transplant 2018; 23: 160–165.
http://doi.org/10.12659/ AOT.906856
48. Rodriguez-Ares MT, Lopez-Valladares MJ, Tourino R, et al. Effects of lyophilization on human amniotic membrane. Acta Ophthalmol 2009; 87(4): 396–403. http://doi.org/10.1111/j.1755-3768.2008.01261.x
49. Sangwan VS, Basu S, MacNeil S, Balasubramanian D. Simple limbal epithelial transplantation (SLET): a novel surgical technique for the treatment of unilateral limbal stem cell deficiency. Br J Ophthalmol 2012; 96(7): 931.
http://doi.org/10.1136/bjophthalmol-2011-301164
50. Schuerch K, Baeriswyl A, Frueh BE, Tappeiner C. Efficacy of Amniotic Membrane Transplantation for the Treatment of Corneal Ulcers. Cornea 2019; 39: 479.
http://doi.org/10.1097/ICO.0000000000002179
51. Shanbhag S, Patel C, Goyal R, Donthineni P, Singh V, Basu S. Simple limbal epithelial transplantation (SLET): review of indications, surgical technique, mechanism, outcomes, limitations, and impact. Indian J Ophthalmol 2019; 67(8): 1265–1277.
http://doi.org/10.4103/ ijo.IJO_117_19
52. Sharma N, ThenarasunSA, KaurM, et al. AdjuvantRoleofamniotic membrane transplantation in acute ocular stevens-johnson syndrome: a randomized control trial. Ophthalmology 2016; 123(3): 484–491.
http://doi.org/10.1016/j.ophtha.2015.10.027
53. Shortt AJ, Secker GA, Lomas RJ, et al. The effect of amniotic membrane preparation method on its ability to serve as a substrate for the ex-vivo expansion of limbal epithelial cells. Biomaterials 2009; 30(6): 1056–1065.
http://doi.org/10.1016/j.biomaterials.2008.10.048
54. Szentmáry N, T Stachon, MF Wu et al. Amnionmembrán-szuszpenzió és saját savó szemcseppek hatása a szaruhártya sebgyógyulására. Milyen hatása lehet a növekedési faktorok és interleukinek koncentrációjának? Szemészet 2019; 156 (3): 134–137.
55. Tabatabaei SA, Soleimani M, Behrouz MJ, Torkashvand A, Anvari P, Yaseri M. A randomized clinical trial to evaluate the usefulness of amniotic membrane transplantation in bacterial keratitis healing. Ocul Surf 2017; 15(2): 218–226.
http://doi.org/10.1016/j. jtos.2017.01.004
56. Tandon R, Gupta N, Kalaivani M, Sharma N, Titiyal JS, Vajpayee RB. Amniotic membrane transplantation as an adjunct to medical therapy in acute ocular burns. Br J Ophthalmol 2011; 95(2): 199–204.
http://doi.org/10.1136/bjo.2009.173716
57. Thatte S, Jain J. Fornix reconstruction with amniotic membrane transplantation: a cosmetic remedy for blind patients. J Ophthalmic Vis Res 2016; 11(2): 193–197.
http://doi.org/10.4103/2008-322X.183916
58. Tseng SC, Espana EM, Kawakita T, et al. How does amniotic memabrane work? Ocul Surf 2004; 2(3): 177–187.
http://doi.org/10.1016/s1542-0124(12)70059-9
59. Tseng SC, Prabhasawat P, Lee SH. Amniotic membrane transplantation for conjunctival surface reconstruction. Am J Ophthalmol 1997; 124(6): 765–774.
http://doi.org/10.1016/s0002-9394(14)71693-9
60. Wildes MT, Cherof AM, Cerda AM, Lynch AM, Wagner BD, Gregory DG. Outcomes of amniotic membrane transplantation for treatment of Stevens-Johnson syndrome in the pediatric population: a retrospective review. J Am Assoc Pediatr Ophthalmol Strabismus 2016; 20(4): e24–e25.
http://doi.org/10.1016/j.jaapos.2016.07.093
