Corneal hydrops and its modern surgical management. Case report
doi: 10.55342/szemhungarica.2022.159.4.168
Case report
Summary
Purpose: To present corneal hydrops and the variety of its surgical approaches with a case report.
Case report: A young male patient came to our outpatient care with sudden vision loss of the right eye. Corneal hydrops was confirmed. There were no signs of keratoconus or other ectatic disease in the left eye. An intracameral 20% SF6 gas filling, combined with compression sutures, was performed on the affected eye. Corneal edema decreased from 1479 µm to 991 µm at postoperative day 7, 670 µm at postoperative month 1, 505 µm at postoperative month 6, and 530 µm at the 2-years follow-up. Visual acuity improved from preoperative hand movement to 0.2 at the 6th month and 0.3 at the 2-year follow-up. The cornea became clear, and only a minimal linear scar remained visible
Conclusion: Various surgical interventions have been developed over time to treat corneal hydrops. In accordance with the literature, intracameral gas filling and compression sutures proved to be an effective treatment method with quick improvement, which reduced the intrastromal edema on the first postoperative day. Thus, we managed to prevent extensive scarring and neovascularization of the cornea.
Összefoglaló
Célkitűzés: A keratoconus ismert, ritka szövődménye, a hydrops corneae és lehetséges sebészeti terápiáinak bemutatása egy eset kapcsán.Esetismertetés: Fiatal férfibeteg jobb oldali hirtelen látásromlásának hátterében hydrops corneae igazolódott. Bal szemén keratoconusra vagy más ektatikus betegségre utaló jel nem volt. Az érintett jobb szemen kompressziós varratbehelyezéssel kombinált intracamerális 20%-os SF6 gázfeltöltést végeztünk. A cornea ödémája 1479 µm-ről 991 µm-re csökkent a posztoperatív 7. napra, majd 670 µm-re a posztoperatív 1. hónapra, és 505 µm-re a posztoperatív 6. hónapra, a kétéves kontrollon pedig 530 µm volt. A látóélesség a preoperatív kézmozgáslátásról a 6. hónapra 0,2-re, a 2 éves kontrollra 0,3-ra javult. A cornea tisztává vált, csupán paracentrálisan maradt minimális vonalas heg.
Következtetés: Az akut cornealis hydrops kezelésére különböző sebészi beavatkozásokat dolgoztak ki az idők folyamán. Az általunk alkalmazott gázfeltöltés és kompressziós varratbehelyezés az irodalmi adatokkal összhangban hatékony, relatíve gyors javulást eredményező kezelési módszernek bizonyult, ami már a műtét másnapjára csökkentette az intrastromális ödémát, a cornea struktúrájának helyreállása hamar elkezdődött, és ezáltal sikerült megelőzni a cornea kiterjedt hegesedését és neovaszkularizációját.
Keywords
cornea, corneal hydrops, keratoconus, intracameral gas injection, compressive sutures
Kulcsszavak
cornea, hydrops corneae, keratoconus, intracamerális gázfeltöltés, kompressziós varratok
Bevezetés
A hydrops corneae (HC) vagy akut keratoconus, a keratoconus-betegség ismert, ritka szövődménye. Más ektatikus kórképekben is előfordulhat, a keratoconus mellett leggyakrabban pellucid marginális degenerációban találkozunk vele (19, 33, 36). Fiatal férfiakban gyakoribb (8). Hirtelen kialakulását a Descemet-membránon (DM) létrejövő szakadás okozza, következményes szaruhártya-ödémával. A diagnózis kellő tapasztalat birtokában már egy egyszerű réslámpás vizsgálattal felállítható, a modern diagnosztikai eljárások, úgymint az elülső szegmens optikai-koherenciatomográfia (As-OCT), a konfokális mikroszkópia pedig főként a követésben nyújtanak hasznos segítséget (11). A HC spontán módon vagy konzervatív terápia hatására az esetek többségében 2-4 hónap alatt hegesen meggyógyul, az ödéma lassú feszívódása miatt azonban nagy eséllyel cornealis neovaszkularizáció alakul ki, ami csökkenti a későbbi szaruhártya graft túlélési esélyét (2). Ezt felismervén az ödéma gyors megszüntetésére különféle sebészeti eljárásokat dolgoztak ki (5, 10, 30, 37).
Esetismertetés
2019 májusában 16 éves fiatal férfibeteg jelentkezett kórházunk ambulanciáján jobb oldali hirtelen látásromlással, fájdalommal és kifejezett fénykerülési panasszal. A látóélesség az érintett oldalon kézmozgáslátásra csökkent. Réslámpás vizsgálattal a jobb oldalon vastag, ödémás, mikrocisztás corneát találtunk, a DM függőleges irányú szakadását sejtettük, a mélyebb részeket nem lehetett megítélni. Réslámpa mellett hydrops corneae diagnózisát állítottuk fel (1. és 4. ábra). As-OCT-vel a cornea vastagsága 1479 µm volt. A bal szemen keratoconusra vagy más, ektatikus betegségre utaló jelet nem találtunk. A keratoconjunctivis vernalist kizártuk. Általános anamnézisében édesanyja preeclampsiája miatt koraszülöttség szerepelt, betegünk a 36. hétben született, ezért életének első hónapjában, oxigénterápiában részesült. 10 éves koráig rendszeresen jártak szemészeti kontrollra, ezalatt az idő alatt eltérést nem találtak.
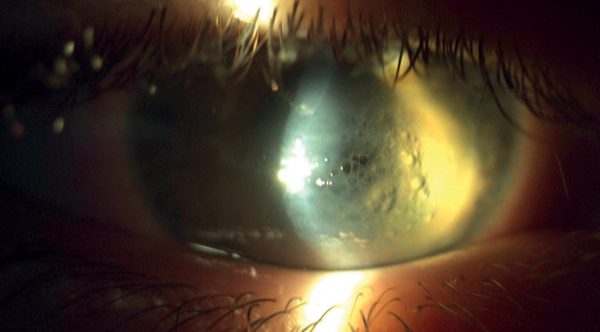
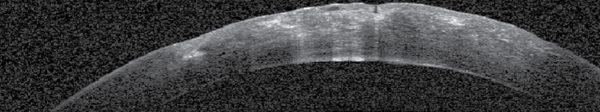
Műtéti kezelés mellett döntöttünk, altatásban kompressziós varratokkal kombinált intracamerális SF6 (kén-hexafluorid) gázfeltöltést végeztünk. Intracamerális injektált acetilkolin-kloriddal beszűkítettük a pupillát és 6 óránál basalis iridectomiát végeztünk. Az elülső csarnokba levegőbuborékot injektáltunk, hogy jobban lássuk a megvastagodott és szemitranszparens cornea hátsó felszínét és a Descemet-repedést, majd a repedésre merőlegesen pre-Descemetálisan vezetve 10/0 nejlonfonallal 4 db csomós varratot helyeztünk be a corneába. A varratok beszúrási és kivezetési pontja az ödémás és tiszta cornea határán volt. A varratokat erősen meghúztuk, hogy bevágódjanak a felpuhult stromába és a csomókat buktattuk. Az elülső csarnokban lévő levegőt 20%-os SF6 gázra cseréltük (2. és 5. ábra). A corneaödéma a posztoperatív első naptól csökkeni kezdett. A korrigált visus a posztoperatív 1. hónap végére 0,1-re javult, a 6. hónapban 0,2, a 2 éves kontrollkor 0,3 volt (3. ábra).
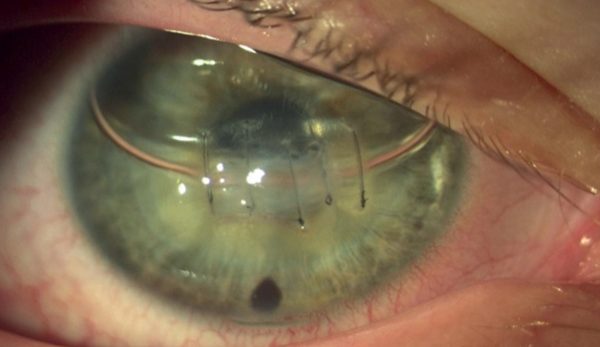
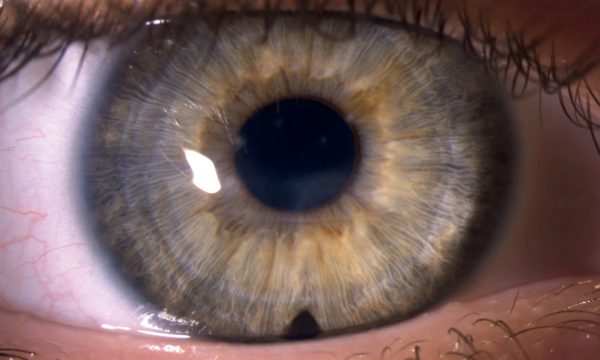
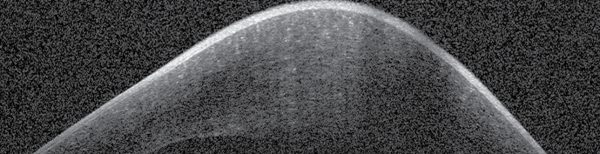
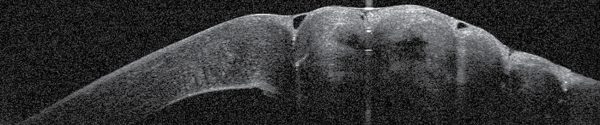
Az As-OCT-vel mért corneavastagság az 1 hetes kontrollkor a preoperatív 1479 µm-ről 991 µm-re csökkent, 1 hónappal 670 µm (6. ábra), 6 hónappal 505 µm, 2 évvel posztoperatíve pedig 530 µm volt (7. ábra). A posztoperatív 6. hónapban eltávolítottuk a corneavarratokat. A szaruhártya struktúrája csaknem teljesen helyreállt, csupán egy finom vonalas heg volt látható az alsó paracentrális régióban, érújdonképződés nélkül. A beteget rendszeresen kontrolláljuk.

Megbeszélés
A HC vagy akut keratoconus a keratoconus-betegség ritka szövődménye. Más, nem gyulladásos, ektatikus kórképekben is előfordul, úgymint a pellucid marginális degeneráció, keratoglobus, Terrien-féle marginális degeneráció, illetve leírták LASIK-asszociált és radiális keratotomia-asszociált keratectasiában, mély elülső lamelláris keratoplasztika, és perforáló keratoplasztika után is (19, 33, 36).
A HC-ről első alkalommal Terrien tett említést 1906-ban (29). A betegek átlagéletkora 25 év körüli a vizsgálatok többségében (17), férfiaknál háromszor gyakrabban fordul elő. Az Egyesült Királyságban egy 2009–2010 között végzett prospektív vizsgálat szerint incidenciája 0,2%–2,8% közé tehető (8). A keratoconus hydropsszá alakulásában több rizikófaktort azonosítottak: vernális keratoconjunctivitis, asztma, atopiás dermatitis, tanulási nehézségek, fekete bőrszín, 48 D fölötti minimum keratometriás értékek (7, 18, 35, 40). További rizikófaktor lehet a kemény gázpermeábilis kontaktlencse viselése (6), illetve a korábbi szemészeti trauma is (34).
Patogenézis
A keratoconus progressziója során a periférián szorosan tapadó DM körkörös feszülése fokozódik (12, 37), ami a membrán és az endothelium centrális szakadásához, széleinek felpöndörödéséhez vezet. Az így létrejött nyíláson át csarnokvíz szivárog a stromába és HC-t okoz (23).
Klinikai megjelenés
A HC jellemzően hirtelen látásromlással, markáns könnyezéssel, fájdalommal és szúrásérzéssel jelentkezik. Az elváltozás szabad szemmel is látható (13). Réslámpás vizsgálattal hyperaemiás conjuctivát látunk, jelentős epithelialis és stromális mikrocisztás ödémával. Az ödéma kiterjedése alapján 3 mm alatti, 3-5 mm, illetve 5 mm fölötti fokozatokat különítünk el. Ennek az a jelentősége, hogy a kiterjedés mérete fordított arányban áll a gyógyulási idővel és látóélességgel (7). Az elülső csarnok, az iris, és a mélyebb részek a masszív ödéma miatt általában nehezen megítélhetők.
Kivizsgálás, kórlefolyás követése
A HC diagnózisának felállítása általában klinikai feladat. A réslámpás vizsgálattal felállított diagnózis megerősítésében elsősorban az As-OCT-vizsgálat nyújt segítséget (5). As-OCT-vel pontosan ábrázolható az elváltozás horizontális és vertikális kiterjedése, ellenőrizhetjük a behelyezett kompressziós varratok mélységét, követhetjük a HC vastagságának változását. Az As-OCT-s regisztrátumon jól látható a HC korai fázisára jellemző ödéma, ami multiplex epithelialis mikrociszták és széles intrastromális lakunák képében jelenik meg. Az ödéma felszívódásával a mikrocisztákat és lakunákat subepithelialis hegek váltják fel, gyengén reflektív, finom, kereszteződő lineáris homályok formájában. Ezek a homályok később megvastagszanak, sűrű subepithelialis hálózatot alkotva. Bizonyítást nyert, hogy az As-OCT-vizsgálat a szövettani vizsgálat eredményei összecsengenek (21). Más szerzők sikeresen használták a HC diagnosztikájában és a kórlefolyás követésében a konfokális mikroszkópot, valamint az ultrahang-biomikroszkópot (15, 24, 27), ezek az eljárások azonban nem terjedtek el olyan széles körben, mint a fent említett As-OCT-s vizsgálat.
Differenciáldiagnosztikai szempontból az áthatoló sérüléstől, a keratoconjunctivitis vernalistól, a súlyos herpes zoster ophthalmicustól, a CMV-keratitistől, a szürkehályog- műtét utáni remanescens magdarabtól, illetve a Fuchs endothelialis disztrófia végstádiumától kell elkülöníteni a HC-t (4, 16, 42).
Konzervatív terápia
A HC konzervatív terápiája ma már nem tekinthető korszerűnek. A kezelés 2-4 hónapig tart (19), a beteg számára kellemetlen lehet és gyakran lép fel komplikáció. Pszeudociszták képződnek, a kiszakadt bullák területe pedig fertőzés melegágya lehet. A tartósan fennálló ödéma emellett nagyban növeli a nem kívánt cornea-vaszkularizáció kialakulásának valószínűségét és lecsökkenti a későbbi esetleges szaruhártya-átültetés után a donor túlélésének esélyét. A konzervatív eljárások között tartjuk számon a nyomókötést, a terápiás kontaktlencse-illesztést (14), a hipertóniás sóoldat csepegtetését és a kortikoszteroid cseppek használatát. A kortikoszteroidok pozitív hatásai között említendő, hogy csökkentik a gyulladást és elősegítik a cornea endotheliumának működését, valamint késleltetik a neovaszkularizáció kialakulását. Hosszú távú használat esetén ugyanakkor másodlagos glaukóma, katarakta, és infektív keratitis léphet fel (14).
Sebészi kezelés
A HC-vel kapcsolatban az irodalom számos különböző sebészi eljárást említ. Az intracamerális gázfeltöltést, a kompressziós varratok behelyezését, és az előbbi kettő kombinációját, valamint a mini-Descemet-membrán endotheliális keratoplasztikát (mini-DMEK) az akut fázisban végezzük, még a perforáló keratoplasztikát (PKP) és a mély elülső lamelláris kertoplasztikát (DALK) a konzervatív kezelést követően, vagy az akut sebészi ellátás után a látóélesség további rehabilitációja céljából választhatjuk.
A PKP indikációs gyakoriságát tekintve Nyugat-Európában és Ausztráliában a keratoconus áll első helyen (25). Több nagyobb tanulmány is összehasonlította a PKP sikerességét a korábban HC-vel kezelt, illetve a korábban HC-vel nem kezelt keratoconusos szemek esetében (1, 9, 26, 38). A korábban HC-vel kezelt szemeknél magasabb volt az endothelialis kilökődési reakciók száma, valószínűleg a neovaszkularizáció, illetve a vernalis keratoconjunctivitis gyakorisága miatt. A hosszú távú graft-túlélési időt tekintve azonban nem volt szignifikáns különbség a két csoport között (1, 9, 26).
A PKP alternatívájaként módosított DALK is végezhető a post-HC-ben. Ez a műtéti beavatkozás technikailag nagyobb kihívást jelent, mint a PKP. Nem könnyű a változó mélységű és sűrűségű hegszövetben közel a DM-ig preparálni, és emiatt gyakori a mikroperforáció (20).
Korábban a jelen közlemény szerzői is végeztek PKP-t a HC akut fázisában. A műtét technikailag nem volt könnyű, mert a recipiens széle ilyenkor óhatatlanul egyenlőtlen vastagságú és keménységű volt, a közép- és hosszú távú eredmények pedig mind optikailag, mind a graft ereződése szempontjából nem voltak kielégítőek. Fontos ezért még egyszer hangsúlyozni, hogy mind a PKP-t, mind a DALK-ot jó eredménnyel csak ödémamentes, a HC akut fázisán túljutott corneán érdemes végezni. Modern megközelítésben a továbbiakban ismertetett sebészi eljárások valamelyikét kell választani abból a célból, hogy megszüntessük a cornealis ödémát.
Intracamerális gázfeltöltés
Az elülső csarnokba juttatott levegőnek vagy gáznak két előnye van: segíti a DM kisimulását és nyomást gyakorol a DM-re és a duzzadó stromára (10, 28). A tiszta levegő hátránya, hogy gyorsan (3 nap alatt) felszívódik. Nem expandáló levegő-gáz keverék használatával nagyjából 10 napos tamponádot tudunk biztosítani. A kén-hexafluorid (SF6) és a perfluoropropán (C3F8) gáz alkalmazása általánosan elterjedt (22, 31, 32).
Basu és munkatársai összehasonlító vizsgálatot végeztek HC-betegeken (10). Az első betegcsoportot 14%-os C3F8-cal kezelték, míg a másik karon konzervatív kezelést írtak elő. A sebészileg kezelt esetekben a corneaödéma statisztikailag szignifikáns, gyorsabb felszívódását tapasztalták. Kórszövettani vizsgálatok igazolják, hogy a gyógyult HC esetén a DM stromához való tapadása jobb az intracamerális gáz használata után, mint kezelés nélkül (10). Az intracamerális gázfeltöltés előtt művi gyöki iridectomia elvégzését javasolják, akut zug elzáródás kivédése érdekében (Urrets–Zavala-szindróma) (3). Fontos továbbá, hogy a gázt az elülső csarnokba egyetlen buborékban juttassuk be – az apró buborékok nem gyakorolnak elégséges nyomást az DM-endothelre, illetve a stromába szivároghatnak (10).
Kompressziós varratok és intracamerális gázfeltöltés
E kombinált módszert Rajamaran és munkatársai írták le (30). A kompressziós varratok alapvető célja, hogy közelítse az elszakadt DM-széleket, és elősegítse a DM-stromához való illeszkedését. Egy nagy esetszámú (43 szem) retrospektív tanulmány szerint az ödéma átlagosan 14,8±3,5 nap alatt szívódott fel, az átlagos cornea vastagsága a preoperatív 1437 µm-ről posztoperatíve 543 µm-re csökkent (39).
A varratok a szaruhártya teljes vastagságában vagy pre-DM is elhelyezhetők, számuk lehet egy vagy több az ödéma kiterjedésének függvényében (37, 41). Kisebb HC esetén párhuzamosan beöltött varratok, a szinte teljes corneafelszínt érintő hydrops esetén négyzetrácsalakú, minden kvadránst érintő mintázat kialakítása javasolt. A kompressziós varratok megelőzik a levegő stromába való szivárgását, az intracamerális gáz pedig megakadályozza az elülső csarnok sekéllyé válását a posztoperatív időszakban.
Kompressziós varratok önálló, sikeres használatát is leírták egyes esetekben. Teljes vastagságú varratok esetén viszkoelasztikus anyagot juttatnak az elülső csarnokba a lencse védelmére, pre-DM-varratok esetén pedig levegőbuborékot injektálnak a varratbehelyezés jobb vizualizálása, és a DM-szakadás jobb láthatósága érdekében (37, 41).
Mini-Descemet Membrán Endothelialis Keratoplasztika (mini- DMEK). Bachmann és munkatársai DMEK-et alkalmaztak a szakadt DM pótlására (5). A technika intraoperatív OCT-vel felszerelt mikroszkópot igényel, mivel csak ennek segítségével érhető el, hogy a lamelláris graft a megfelelő helyre és endothelialis felszínével lefelé tapadjon fel az ödémás, átlátszatlan recipiensre (5). A módszer rutin klinikai gyakorlatban való alkalmazhatóságát majd a jövő dönti el (5).
Következtetés
Jelen pillanatban az akut HC kezelését illetően nincs egyértelmű szakmai konszenzus. Azt azonban a szakma legtöbb képviselője elfogadja, hogy a kórképpel összefüggő vizenyő felszívódását leggyorsabban intracamerális gázfeltöltéssel, kompressziós varratok behelyezésével, vagy az előbbi két beavatkozás kombinációjával érhetjük el. Amennyiben ezen eljárásokkal nem sikerül kielégítően helyreállítani a látásfunkciót, második lépcsőben PKP vagy módosított DALK végezhető. Esetünkben a fiatal férfibeteg akut HC-je jól reagált az intracamerális gázfeltöltésre és a kompressziós varratok behelyezésére, ezért saját tapasztalatunkra alapozva is javasoljuk a fenti eljárást, mint választandó első műtéti beavatkozást e ritka kórkép sebészi kezelésére.
Nyilatkozat
A szerzők kijelentik, hogy a speciális esetet ismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Akova YA, Dabil H, Kavalcioglu O, Duman S. Clinical features and keratoplasty results in keratoconus complicated by acute hydrops. Ocular immunology and inflammation 2000; 8(2): 101–9.
2. Al Suhaibani AH, Al-Rajhi AA, Al-Motowa S, Wagoner MD. Inverse relationship between age and severity and sequelae of acute corneal hydrops associated with keratoconus. The British journal of ophthalmology 2007; 91(7): 984–5. http://doi.org/10.1136/bjo.2005.085878
3. Aralikatti AK, Tomlins PJ, Shah S. Urrets-Zavalia syndrome following intracameral C3F8 injection for acute corneal hydrops. Clinical & experimental ophthalmology 2008; 36(2): 198–9.
http://doi.org/10.1111/j.1442-9071.2008.01687.x
4. Arenas E, Mieth A, Munoz D. Combined intrastromal injection of ganciclovir and depot betamethasone for the management of nummular keratitis: Case series. Arch Soc Esp Oftalmol (Engl Ed) 2019; 94 (7): 347–51.
http://doi.org/10.1016/j.oftal.2019.01.009
5. Bachmann B, Handel A, Siebelmann S, Matthaei M, Cursiefen C. Mini-Descemet Membrane Endothelial Keratoplasty for the Early Treatment of Acute Corneal Hydrops in Keratoconus. Cornea 2019 Aug; 38(8): 1043–1048. http://doi.org/10.1097/ICO.0000000000002001
6. Barr JT, Zadnik K, Wilson BS, Edrington TB, Everett DF, Fink BA, et al. Factors associated with corneal scarring in the Collaborative Longitudinal Evaluation of Keratoconus (CLEK) Study. Cornea 2000; 19(4): 501–7.
http://doi.org/10.1097/00003226-200007000-00020
7. Barsam A, Brennan N, Petrushkin H, Xing W, Quartilho A, Bunce C, et al. Case-control study of risk factors for acute corneal hydrops in keratoconus. The British journal of ophthalmology 2017; 101(4): 499–502.
http://doi.org/10.1136/bjophthalmol-2015-308251
8. Barsam A, Petrushkin H, Brennan N, Bunce C, Xing W, Foot B, et al. Acute corneal hydrops in keratoconus: a national prospective study of incidence and management. Eye 2015; 29(4): 469-74.
http://doi.org/10.1038/eye.2014.333
9. Basu S, Reddy JC, Vaddavalli PK, Vemuganti GK, Sangwan VS. Long-term outcomes of penetrating keratoplasty for keratoconus with resolved corneal hydrops. Cornea 2012; 31(6): 615–20.
http://doi.org/10.1097/ICO.0b013e31823d03e3
10. Basu S, Vaddavalli PK, Ramappa M, Shah S, Murthy SI, Sangwan VS. Intracameral perfluoropropane gas in the treatment of acute corneal hydrops. Ophthalmology 2011; 118(5): 934-9.
http://doi.org/10.1016/j.ophtha.2010.09.030
11. Basu S, Vaddavalli PK, Vemuganti GK, Ali MH, Murthy SI. Anterior segment optical coherence tomography features of acute corneal hydrops. Cornea 2012; 31(5): 479 85.
http://doi.org/10.1097/ICO.0b013e318223988e.
12. Bron AJ. Keratoconus. Cornea 1988; 7(3): 163–9.
13. Cameron JA, Al-Rajhi AA, Badr IA. Corneal ectasia in vernal keratoconjunctivitis. Ophthalmology 1989; 96(11): 1615–23.
http://doi.org/10.1016/s0161-6420(89)32677-7
14. Carter JB, Jones DB, Wilhelmus KR. Acute hydrops in pellucid marginal corneal degeneration. American journal of ophthalmology 1989; 107(2): 167–70. <a http://doi.org/10.1016/0002-9394(89)90217-1.
15. Cruzat A, Qazi Y, Hamrah P. In Vivo Confocal Microscopy of Corneal Nerves in Health and Disease. The ocular surface 2017; 15(1): 15–47.
http://doi.org/10.1016/j.jtos.2016.09.004
16. Faith SC, Durrani AF, Jhanji V. Cytomegalovirus keratitis. Current opinion in ophthalmology 2018; 29(4): 373–7.
http://doi.org/10.1097/ICU.0000000000000481
17. Fan Gaskin JC, Patel DV, McGhee CN. Acute corneal hydrops in keratoconus – new perspectives. American journal of ophthalmology 2014; 157(5): 921–8. http://doi.org/10.1016/j.ajo.2014.01.017
18. Galin MA, Berger R. Atopy and keratoconus. American journal of ophthalmology 1958; 45(6): 904–6.
http://doi.org/10.1016/0002-9394(58)90403-3
19. Grewal S, Laibson PR, Cohen EJ, Rapuano CJ. Acute hydrops in the corneal ectasias: associated factors and outcomes. Transactions of the American Ophthalmological Society 1999; 97: 187–98; discussion 98–203.
20. Jacob S, Narasimhan S, Agarwal A, Sambath J, Umamaheshwari G, Saijimol AI. Primary Modified Predescemetic Deep Anterior Lamellar Keratoplasty in Acute Corneal Hydrops. Cornea 2018; 37(10): 1328–33.
http://doi.org/10.1097/ICO.0000000000001693
21. Kallel S, Tahiri Joutei Hassani R, Liang H, Baudouin C, Labbe A. “En face” anterior segment optical coherence tomography findings in acute corneal hydrops. Journal francais ophtalmologie 2014; 37(8): 605–12.
http://doi.org/10.1016/j.jfo.2014.04.008
22. Kaushal S, Sharma N, Vajpayee RB. Treatment of acute corneal hydrops with intracameral C3F8 in a patient of pellucid marginal degeneration with keratoglobus. Clinical & experimental ophthalmology 2007; 35(8): 697–9. http://doi.org/10.1111/j.1442-9071.2007.01579.x
23. Laing RA, Sandstrom MM, Berrospi AR, Leibowitz HM. The human corneal endothelium in keratoconus: A specular microscopic study. Archives of ophthalmology 1979; 97(10): 1867–9.
http://doi.org/10.1001/archopht.1979.01020020315005
24. Lockington D, Fan Gaskin JC, McGhee CN, Patel DV. A prospective study of acute corneal hydrops by in vivo confocal microscopy in a New Zealand population with keratoconus. The British journal of ophthalmology 2014; 98(9): 1296–302. http://doi.org/10.1136/bjophthalmol-2013-304145
25. Matthaei M, Sandhaeger H, Hermel M, Adler W, Jun AS, Cursiefen C, et al. Changing Indications in Penetrating Keratoplasty: A Systematic Review of 34 Years of Global Reporting. Transplantation 2017; 101(6): 1387–99. http://doi.org/10.1097/TP.0000000000001281
26. Meyer JJ, Gokul A, Crawford AZ, McGhee CNJ. Penetrating Keratoplasty for Keratoconus With and Without Resolved Corneal Hydrops: Long-term Results. American journal of ophthalmology 2016; 169: 282–9.
http://doi.org/10.1016/j.ajo.2016.07.001
27. Nakagawa T, Maeda N, Okazaki N, Hori Y, Nishida K, Tano Y. Ultrasound biomicroscopic examination of acute hydrops in patients with keratoconus. American journal of ophthalmology 2006; 141(6): 1134–6.
http://doi.org/10.1016/j.ajo.2005.12.043
28. Panda A, Aggarwal A, Madhavi P, Wagh VB, Dada T, Kumar A, et al. Management of acute corneal hydrops secondary to keratoconus with intracameral injection of sulfur hexafluoride (SF6). Cornea 2007; 26(9): 1067–9. http://doi.org/10.1097/ICO.0b013e31805444ba
29. Pierse D, Eustace P. Acute keratoconus in mongols. The British journal of ophthalmology 1971; 55(1): 50–4.
http://doi.org/10.1136/bjo.55.1.50
30. Rajaraman R, Singh S, Raghavan A, Karkhanis A. Efficacy and safety of intracameral perfluoropropane (C3F8) tamponade and compression sutures for the management of acute corneal hydrops. Cornea 2009; 28(3): 317–20. http://doi.org/10.1097/ICO.0b013e31818ada0b
31. Sayadi JJ, Lam H, Lin CC, Myung D. Management of acute corneal hydrops with intracameral gas injection. American journal of ophthalmology case reports 2020; 20: http://doi.org/10.1016/j.ajoc.2020.100994
32. Shah SG, Sridhar MS, Sangwan VS. Acute corneal hydrops treated by intracameral injection of perfluoropropane (C3F8) gas. American journal of ophthalmology 2005; 139(2): 368–70.
http://doi.org/10.1016/j.ajo.2004.07.059
33. Sharma N, Maharana PK, Jhanji V, Vajpayee RB. Management of acute corneal hydrops in ectatic corneal disorders. Current opinion in ophthalmology 2012; 23(4): 317–23. http://doi.org/10.10d97/ICU.0b013e328354a2a8
34. Sharma R, Titiyal JS, Prakash G, Sharma N, Tandon R, Vajpayee RB. Clinical profile and risk factors for keratoplasty and development of hydrops in north Indian patients with keratoconus. Cornea 2009; 28(4): 367–70.
http://doi.org/10.1097/ICO.0b013e31818cd077
35. Spencer WH, Fisher JJ. The association of keratoconus with atopic dermatitis. American journal of ophthalmology 1959; 47(3): 332–44.
http://doi.org/10.1016/s0002-9394(14)76533-x
36. Sridhar MS, Mahesh S, Bansal AK, Nutheti R, Rao GN. Pellucid marginal corneal degeneration. Ophthalmology 2004; 111(6): 1102–7.
http://doi.org/10.1016/j.ophtha.2003.09.035
37. Subudhi P, Khan Z, Subudhi BNR, Sitaram S. To show the efficacy of compressive sutures alone in the management of acute hydrops in a keratoconus patient. BMJ case reports 2017; 2017.
http://doi.org/10.1136/bcr-2016-218843
38. Tuft SJ, Gregory WM, Buckley RJ. Acute corneal hydrops in keratoconus. Ophthalmology 1994; 101(10): 1738–44.
http://doi.org/10.1016/s0161-6420(94)31110-9
39. Vohra V, Shetty R, James E, Kundu G, D'Souza S. Evaluating the safety and efficacy of compression sutures with intracameral perfluoropropane (C3F8) in the management of acute corneal hydrops. International ophthalmology 2021; 41(6): 2027–31. http://doi.org/10.1007/s10792-021-01758-5
40. Weed KH, MacEwen CJ, Giles T, Low J, McGhee CN. The Dundee University Scottish Keratoconus study: demographics, corneal signs, associated diseases, and eye rubbing. Eye 2008; 22(4): 534–41.
http://doi.org/10.1038/sj.eye.6702692
41. Yahia Cherif H, Gueudry J, Afriat M, Delcampe A, Attal P, Gross H, et al. Efficacy and safety of pre-Descemet's membrane sutures for the management of acute corneal hydrops in keratoconus. The British journal of ophthalmology 2015; 99(6): 773–7.
http://doi.org/10.1136/bjophthalmol-2014-306287
42. Zhuang M, Fan W, Xie P, Yuan ST, Liu QH, Zhao C. Evaluation of the safety and quality of day-case cataract surgery based on 4151 cases. International journal of ophthalmology 2019; 12(2): 291–5.
http://doi.org/10.18240/ijo.2019.02.17
