Special forms of preretinal haemorrhages – case series
doi: 10.55342/szemhungarica.2022.159.3.119
Case report
Summary
The aetiology of preretinal haemorrhage is varied, and the majority of cases show spontaneous absorption. In this case series, we present the cases of our three female patients. We review the possible aetiologies of preretinal haemorrhage, the course of the disease, and the treatment options.
In the first case, we report a sub-internal limiting membrane (sub-ILM) haemorrhage as a complication of uncontrolled hypertension. In the second case, we present bilateral peripapillary and premacular haemorrhages as ophthalmic complications due to the underlying haematological disease (acute myeloid leukemia). In our third presentation, we describe a case of the rare Terson syndrome.
Összefoglaló
A preretinalis vérzések etiológiája változatos és az esetek legnagyobb része spontán felszívódást mutat. Három nőbetegünk esetének leírása kapcsán áttekintjük a preretinalis vérzések lehetséges okait, a kórkép lefolyását, kezelési lehetőségeit.Első betegünknél nem megfelelően beállított magasvérnyomás-betegséghez kapcsolódó, membrana limitans interna alatti (sub-ILM) vérzéssel szövődött keringészavar esetét ismertetjük. Második betegünknél hematológiai alapbetegsége (akut myeloid leukémia) következtében kialakult szemészeti szövődményt, kétoldali peripapilláris és premakuláris vérzés esetét, harmadik betegünknél a ritka Terson-szindróma képét mutatjuk be.
Keywords
hypertension, sub-ILM haemorrhage, Terson syndrome, preretinal haemorrhage
Kulcsszavak
hipertónia, sub-ILM-vérzés, Terson-szindróma, preretinalis vérzés
A szemfenéki vérzések a mindennapi szemészeti gyakorlatban rendszeresen látott eltérések. A vérzések lokalizációja, mérete és morfológiája utalhat a háttérben fennálló etiológiai tényezőre. A retinalis vérzések hátterében számos szisztémás, illetve szemészeti eltérés állhat a vaszkuláris, illetve hematológiai eredetű betegségektől kezdve az infektív, traumás, vagy intracranialis eltérésekig (11). Három esetünkben a preretinalis vérzések különleges megjelenési formáit mutatjuk be, és összefoglaljuk az aktuális kapcsolódó szakirodalmi ismereteket.
Esetismertetések
1. eset
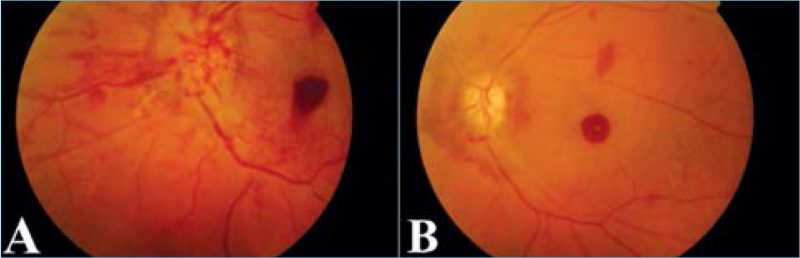
Az 51 éves nőbeteget hirtelen kialakult, fájdalmatlan bal oldali látásromlás miatt vizsgáltuk. Visusa 0,5 méter ujjolvasás (mou) volt, normál szemnyomás mellett. A szemfenéken elmosott határú, promineáló, hyperaemiás látóidegfőt, csíkolt peripapilláris vérzéseket és kiterjedt premakuláris vérzést találtunk (1. ábra, A).
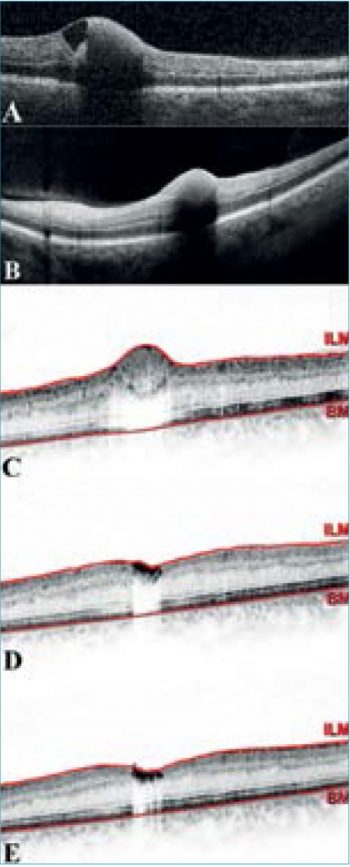
Makula optikaikoherencia-tomográfiás (OCT) vizsgálata a foveát is érintő, membrana limitans interna alatti (sub-ILM) vérzés képét mutatta (2. ábra, A).
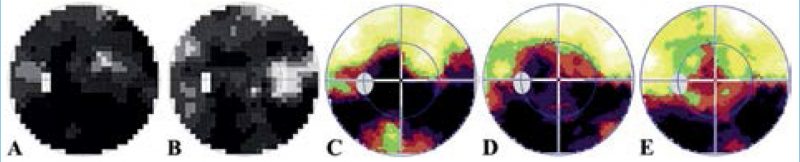
Látótérvizsgálata (30°) kezdetben a teljes látóteret magába foglaló kiesést mutatott (3. ábra, A).
Anamnézisében ingadozó, tenziókiugrásokkal járó hipertónia szerepelt. Rutin labor-, immun- és infektszerológia, szérum-angiotenzin-konvertáló enzim, valamint trombofília irányú (lupus antikoaguláns, antitrombin-III, aktivált protein C-rezisztencia, lupus érzékeny aktivált parciális tromboplasztin idő, protein C és S, kardiolipin és béta-2-glikoprotein antitest) vizsgálataiban kórjelző eltérés nem ábrázolódott. Carotis Doppler-vizsgálata kisfokú bilaterális ateroszklerózist mutatott, echokardiográfiás vizsgálata eltérést nem ábrázolt. Koponya MR-vizsgálata kisméretű jobb oldali frontális és bal oldali temporális meningeomát ábrázolt, amelyet szemfenéki vérzése szempontjából nem tartottunk kórjelzőnek. Az új típusú koronavírus (SARS-CoV-2) elleni védőoltásban nem részesült betegünknél felmerült tünetmentes koronavírus-fertőzés és szövődményként kialakult keringészavar, azonban szerológiai vizsgálata, SARS-CoV-2 spike fehérje elleni antitestszintje 0,4 U/ml (≥0,8 U/ml szeropozitív), míg spike és nucleocapsid elleni együttes antitestszintje 3 U/ml (≥15 U/ml szeropozitív) ezt kizárta. Szemfenéki eltérése hátterében tenziókiugrással összefüggő keringészavart véleményeztünk kiváltó tényezőként.
Betegünk osztályos kezelése alatt intravénás nootrop és hemorheológikus (piracetam, pentoxifillin), valamint kortikoszteroid-lökés-terápiában (metilprednizolon, 100 mg-mal kezdve) részesült. Emittálásakor (14. nap) a papillaödéma és a vérzés méretének csökkenését, valamint a látótérkiesés kis, centrális regresszióját figyeltük meg (1. ábra, B; 3. ábra, B). Ezt követően orális kortikoszteroid (1×4 mg metilprednizolon), nootrop (1200 mg piracetam) terápiában, illetve B1-, B6– és B12-vitamin-szupplementációban részesült. 3 hetes vizsgálatakor látótere jelentősen javult a felső látótérfél tisztulásával (3. ábra, C). 6 hetes vizsgálata alkalmával visusa már 0,1 volt, a sub-ILM-vérzés mértéke jelentősen csökkent, makula OCT-vizsgálata minimális szervült vér képét mutatta (2. ábra, D). 10 hét után a vér további felszívódását és a centrális látótérkiesés regresszióját láttuk (2. ábra, E; 3. ábra, E), azonban RNFL értéke kórosan csökkent volt, visusa nem javult tovább.
2. eset
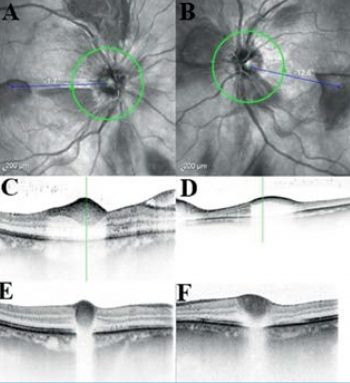
Az 53 éves, akut myeloid leukémia (AML) miatt kezelt nőbetegünket hirtelen kialakult, kétoldali centrális foltlátás miatt vizsgáltuk. Vizsgálatunk idején betegünknél súlyos thrombocytopenia (thrombocytaszám: 7 G/l) állt fent. Szemfenékvizsgálata során a makulában mindkét oldalon sub-ILM-vérzést, valamint több preretinalis, peripapilláris vérzést találtunk (4. ábra, A–D). Visusa a jobb szemen 0,15, a bal szemen 3 mou volt. Koponya CT-vizsgálata központi idegrendszeri vérzést nem mutatott. Szemfenéki eltéréseit alapbetegsége szövődményeként tartottuk számon, megfigyelést javasoltunk. Négy hét után látóélessége a jobb szemen 0,3, a bal szemen 0,2 volt, a vérzés részben felszívódott (4. ábra, E és F).
3. eset
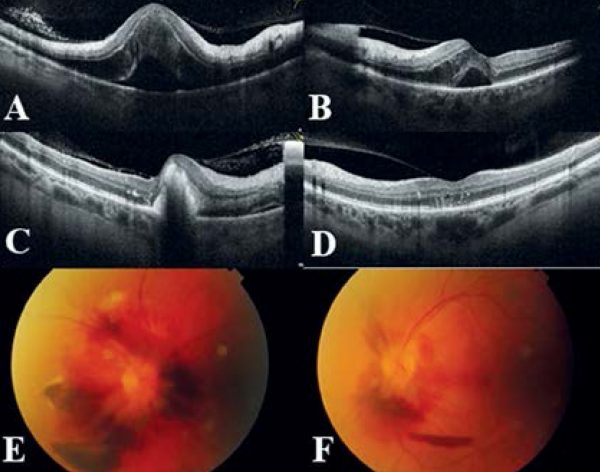
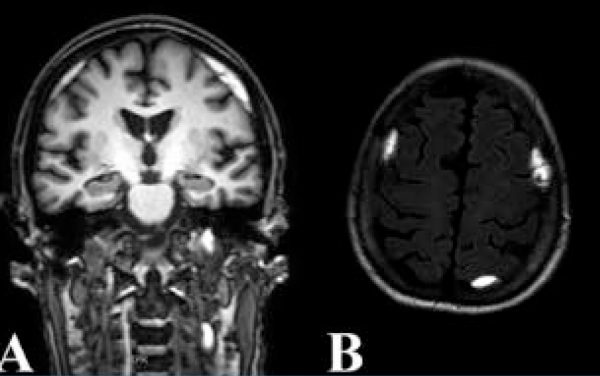
A 63 éves, pancitopeniával járó aplasztikus anémia miatt gondozott nőbetegünket hetek óta tartó homályos látás és perzisztáló fejfájás miatt vizsgáltuk. Látóélessége a jobb szemen 1 mou, a bal szemen 0,4 volt. Szemfenékvizsgálata során kétoldali preretinalis vérzést láttunk a papillomakuláris régióban és a papilla körül, amelyet kisfokú papillaödéma és makulaödéma kísért. Makula OCT-vizsgálata kétoldali makulaödéma, valamint körülírt subretinalis folyadékgyülem képét mutatta (5. ábra, A, B). Szemfenéki eltérése hátterében felmerült a pancitopenia szövődményeként kialakult vérzés, valamint az egyidejűleg fennálló kétoldali papillaödéma és a kísérő fejfájás miatt intracranialis nyomásfokozódás. Neurológiai vizsgálata során gócjelet nem észleltek. Koponya MR-vizsgálata a frontális régióban, illetve bal oldalon dorsoparietalisan szubakut subduralis haematomát írt le (6. ábra). Az eltérések jelentős térszűkületet nem okoztak, így idegsebészeti beavatkozás nem történt. Egy hónappal később a vérzések legnagyobb része spontán felszívódást mutatott (5. ábra E, F), azonban a jobb szemen novum subretinalis vérzés jelent meg (5. ábra, C). Látóélessége a jobb szemen 2 mou, a bal szemen 1,0 volt. A betegsége hátterében aplasztikus anémia szövődményeként kialakult subduralis vérzést és következményes Terson-szindrómát véleményeztünk.
Megbeszélés
Preretinalis vérzés kialakulhat a retina vaszkuláris eltéréseihez kapcsolódóan, pl. makroaneurizma vagy érmalformáció talaján (4, 9, 12). Típusos kórkép a Valsalva-manőverhez, traumás sérüléshez, hematológiai betegségekhez, illetve az akut intracranialis nyomásemelkedéshez (Terson-szindróma) kapcsolódó preretinalis vérzés (1, 2, 19). Hasonló megjelenésű vérzést észleltünk korábban többszörös transzfúzió adását követően (21). A preretinalis vérzések a makula területén az ILM-réteg alatt alakulnak ki, hirtelen és súlyos látásromlást okozva a betegnek (11). A látóélesség tekintetében többségében jó prognózisúak. Általában spontán, de lassú, átlagosan 2-3 hónapig tartó felszívódás várható, a vérzés méretétől függően (16). Az elhúzódó felszívódású esetekben azonban a vér lebomlása során keletkező degradációs termékek (hemoglobin, vas) toxikus hatással lehetnek a retina sejtjeire, irreverzibilis látáskárosodást okozva (13). A nagy kiterjedésű esetekben terápiás lehetőség a Nd:YAG membranotomia, amely során apró nyílást képeznek az ILM-rétegen, illetve az üvegtesti határhártyán, megnyitva ezzel a vér útját az üvegtest felé (12). A kezelést a három hétnél kevesebb ideje fennálló vérzéseknél javasolják (18). A perzisztáló esetekben, pars plana vitrectomia lehetősége merülhet még fel (6).
A hipertónia legismertebb szemészeti szövődménye a hipertenzív retinopathia, amelyben megfigyelhetőek az artériák fokozott rigiditása miatt kialakult eltérések (pl. szűk artériák, kereszteződési tünetek), illetve a vér-retina gát károsodása miatt kialakult exsudatív léziók (pl. vérzések, mikroaneurizmák, kemény exsudatumok, gyapottépés gócok) (5). A vérnyomás jelentős, akut emelkedése (180 Hgmm fölötti szisztolés, vagy 110 Hgmm fölötti diasztolés vérnyomás) során a látóidegfő is érintetté válhat és hipertenzív optikus neuropathia alakul ki, amely papillaödéma, hyperaemia és peripapilláris csíkolt vérzések képében jelentkezik. A folyamat pontos patomechanizmusa ismeretlen, de feltehetően szerepet játszik a látóidegfő perfúziós zavara és iszkémiája, amely permanens látásromláshoz vezethet (7). Első esetünkben nem megfelelően kontrollált, ingadozó vérnyomás állt fenn, és valószínűsíthetően panaszai jelentkezésekor hirtelen vérnyomásemelkedés következett be, amely a mikrocirkulációs zavar miatt a látódegfő károsodásához és szokatlan lokalizációjú, sub-ILM-vérzéshez vezetett. A vérzés spontán felszívódást mutatott, azonban a látóidegfő érintettsége miatt a látótérben maradandó károsodás lépett fel.
A hematológiai betegségekben kialakult vérképeltérések – pl. thrombocytopenia – következtében fokozott vérzéshajlam lép fel, amely gyakran szemfenéki vérzés képében jelentkezik (15). Egyes tanulmányok szerint a retinalis vérzés a leggyakoribb szemészeti szövődménye az AML-nek (20%-os prevalencia) és az aplasztikus anémiának is (67%-os prevalencia) (3, 20). 50 G/l thrombocytaszám alatt szignifinkánsan fokozódik a retinalis vérzések előfordulási gyakorisága (20). A fent bemutatott 2. esetben az AML szövődményeként súlyos látásromlást okozó preretinalis vérzés alakult ki. Az ilyen típusú vérzések a látóélesség tekintetében hosszú távon jó prognózisúak, és az alapbetegség kezelésével néhány hónap alatt oldódnak (8). A hematológiai betegségekben a coagulopathia miatt az idegrendszeri vérzéses szövődmények előfordulási gyakorisága is igen magas (17). Az akut intracranialis vérzések egyes esetekben intraocularis (üvegtesti, pre-, intra-, vagy subretinalis) vérzéssel szövődnek, amelyet Terson-szindrómának nevezünk (10). Feltételezhető, hogy a hirtelen nyomásemelkedés a peripapilláris, illetve retinalis kapillárisok rupturájához vezet, de felvetették az intracranialis vér látóidegfőn keresztüli beáramlásának lehetőségét is. A legújabb elmélet szerint a vér az ún. glimfatikus rendszeren keresztüli visszaáramlás útján jut el a szembe (14). Klinikailag az intracranialis nyomásfokozódás miatti neurológiai tünetek, valamint látásromlás jellemzi. Az intracranialis vérzések általában hirtelen alakulnak ki és többségében életet veszélyeztető állapotot okoznak, így a szemészeti eltérések gyakran nem kerülnek felismerésre. A fent bemutatott 3. esetben mégis a szemészeti vizsgálat vezetett pontos diagnózishoz, hiszen a beteg egyetlen neurológiai tünete a fejfájás volt. Intraocularis vérzés és egyidejűleg jelentkező neurológiai tünet esetén tehát gondolnunk kell Terson-szindrómára; különösen, ha coagulopathia is fennáll. A koponya képalkotó vizsgálata ebben az esetben elengedhetetlen.
Következtetés
A fentiekben három preretinalis vérzéssel járó esetet mutattunk be, amelyek nem megfelelően beállított hipertónia, akut myeloid leukémia, illetve aplasztikus anémia szövődményeként fellépő Terson-szindróma miatt alakultak ki. A fenti esetek jól prezentálják a preretinalis vérzések széles körű etiológiáját, illetve a szemészeti vizsgálat szerepét a szisztémás megbetegedésekhez társuló retinalis vérzéses szövődményekben.
Nyilatkozat
A szerzők kijelentik, hogy speciális eseteket ismertető közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Aboulhosn R, Raju B, Jumah F, Majmundar N, Prenner J, Matin T, et al. Terson's syndrome, the current concepts and management strategies: A review of literature. Clin Neurol Neurosurg 2021; 210: 107008.
https:/doi.org/10.1016/j.clineuro.2021.107008
2. Binenbaum G, Chen W, Huang J, Ying GS, Forbes BJ. The natural history of retinal hemorrhage in pediatric head trauma. J AAPOS 2016; 20: 131–135.
https:/doi.org/10.1016/j.jaapos.2015.12.008
3. Bukhari ZM, Alzahrani A, Alqarni MS, Alajmi RS, Alzahrani A, Almarzouki H, et al. Ophthalmic Manifestations in Acute Leukemia Patients and Their Relation With Hematological Parameters in a Tertiary Care Center. Cureus 2021; 13: e19384.
https:/doi.org/10.7759/cureus.19384
4. Chen T, Zheng H, Wang Y, Hu J, Chen C. Bilateral and multiple sub-internal limiting membrane hemorrhages in a familial retinal arteriolar tortuosity patient by Valsalva-like mechanism: an observational case report. BMC Ophthalmol 2020; 20: 151.
https:/doi.org/10.1186/s12886-020-01413-0
5. Cheung CY, Biousse V, Keane PA, Schiffrin EL, Wong TY. Hypertensive eye disease. Nat Rev Dis Primers 2022; 8:14.
https:/doi.org/10.1038/s41572-022-00342-0
6. De Maeyer K, Van Ginderdeuren R, Postelmans L, Stalmans P, Van Calster J. Sub-inner limiting membrane haemorrhage: causes and treatment with vitrectomy. Br J Ophthalmol 2007; 91: 869–872.
https:/doi.org/10.1136/bjo.2006.109132
7. Fraser-Bell S, Symes R, Vaze A. Hypertensive eye disease: a review. Clin Exp Ophthalmol 2017; 45: 45–53.
https:/doi.org/10.1111/ceo.12905.
8. Goel S, Das D, Saurabh K, Roy R, Das S, Nigam E. Bilateral sub-internal limiting membrane haemorrhage in acute myeloid leukaemia. Clin Exp Optom 2021; 104: 122–123.
https:/doi.org/10.1111/cxo.13106
9. Iijima H, Satoh S, Tsukahara S. Nd:YAG laser photodisruption for preretinal hemorrhage due to retinal macroaneurysm. Retina 1998; 18: 430–434.
https:/doi.org/10.1097/00006982-199805000-00008
10. Issiaka M, McHachi A, Rachid R, Belhadji MEL, Mahazou I, Banao M. Terson syndrome: Two case reports. Int J Surg Case Rep 2022; 90: 106700.
https:/doi.org/10.1016/j.ijscr.2021.106700
11. Kanukollu VM, Ahmad SS. Retinal Hemorrhage. StatPearls. Treasure Island (FL)2022.
12. Khadka D, Bhandari S, Bajimaya S, Thapa R, Paudyal G, Pradhan E. Nd:YAG laser hyaloidotomy in the management of Premacular Subhyaloid Hemorrhage. BMC Ophthalmol 2016; 16: 41.
https:/doi.org/10.1186/s12886-016-0218-0
13. Kumar V, Goel N. "Arcus retinalis": A novel clinical marker of sub-internal limiting membrane hemorrhage. Eur J Ophthalmol 2021; 31: 1986–1992.
https:/doi.org/10.1177/1120672120934958
14. Kumaria A, Gruener AM, Dow GR, Smith SJ, Macarthur DC, Ingale HA. An explanation for Terson syndrome at last: the glymphatic reflux theory. J Neurol 2022; 269: 1264–1271.
https:/doi.org/10.1007/s00415–021-10686-4
15. Mansour AM, Salti HI, Han DP, Khoury A, Friedman SM, Salem Z, et al. Ocular findings in aplastic anemia. Ophthalmologica 2000; 214: 399–402.
https:/doi.org/10.1159/000027532
16. Mennel S. Subhyaloidal and macular haemorrhage: localisation and treatment strategies. Br J Ophthalmol 2007; 91: 850–852.
https:/doi.org/10.1136/bjo.2007.114025
17. Naunheim MR, Nahed BV, Walcott BP, Kahle KT, Soupir CP, Cahill DP, et al. Diagnosis of acute lymphoblastic leukemia from intracerebral hemorrhage and blast crisis. A case report and review of the literature. Clin Neurol Neurosurg 2010; 112: 575–577.
https:/doi.org/10.1016/j.clineuro.2010.04.001
18. Oh BL, Yu HG. Different responses to two consecutive Nd:YAG laser membranotomies at different locations in a 3-week-old sub-internal limiting membrane hemorrhage. Indian J Ophthalmol 2018; 66: 1321–1322.
https:/doi.org/10.4103/ijo.IJO_310_18
19. Simakurthy S, Tripathy K. Valsalva Retinopathy. StatPearls. Treasure Island (FL)2022.
20. Soman S, Kasturi N, Srinivasan R, Vinod KV. Ocular Manifestations in Leukemias and Their Correlation with Hematologic Parameters at a Tertiary Care Setting in South India. Ophthalmol Retina 2018; 2: 17–23.
https:/doi.org/10.1016/j.oret.2017.05.009
21. Szilágyi Zs HH, Salomváry B, Nagy ZZs, Ecsedy M. Súlyos látásromlást okozó szemfenéki keringésszavar transzfúziót követően. Szemészet 2021; 158: 201–207.
