Proliferative vitreoretinopathy
doi: 10.55342/szemhungarica.2022.159.2.51
Review
Summary
Proliferative vitreoretinopathy (PVR) is a disease that can be a consequence of numerous vitreoretinal diseases, primarly retinal detachment. Despite the expanding knowledge of molecular biology and the pharmacological developments built on it, it is still primarily a surgical disease with many risk factors. In terms of its complexity, despite large-scale advances in surgical techniques and visualization, this vision-threatening condition has not been eliminated and remains a significant challenge for current and future vitreoretinal surgeons and general ophthalmologists alike. The purpose of this training paper is to present the latest results of the state of the art.
Összefoglaló
A proliferatív vitreoretinopathia (PVR) egy kóros állapot, amelyhez számos vitreoretinális kórkép, elsődlegesen a retinaleválás vezet. Az egyre bővülő molekuláris biológiai tudás, az arra épített farmakológiai fejlesztések ellenére jelenleg is elsődlegesen sebészi úton ellátandó betegség, amelynek számos kockázati tényezője van. Komplexitásában nézve a műtéti technika és vizualizáció nagyléptékű fejlődése mellett sem sikerült megszüntetni ezt a látást veszélyeztető kórképet és továbbra is jelentős kihívást jelent a jelenlegi és jövőbeli vitreoretinális sebészek és általános szemészek számára egyaránt. Jelen továbbképző közlemény célja a tudomány állásának naprakész eredményeit bemutatni.Keywords
proliferative vitreoretinopathy, retinal detachment, vitreous body, traction, cytokine
Kulcsszavak
proliferatív vitreoretinopathia, retinaleválás, üvegtest, trakció, citokin
Bevezetés
A proliferatív vitreoretinopathia (PVR) az egyik legrégebben felismert szemészeti kórkép, még ha nem is nevezték nevén sokáig. Az első szemészeti beavatkozások kapcsán észlelték, hogy ha üvegtest kerül a műtéti területre, az rossz előjelnek számít, hiszen gyakran a látás elvesztését eredményezte. Gonin, a retinaleválás ellenes műtétek sikeres kidolgozója 1934-ben már részletesen leírta a jelenség folyamatát. A PVR-ről egye több ismeret áll rendelkezésünkre a műtéti technika (mind a szürkehályog, de főleg az üvegtesti műtétek) és az operáló mikroszkópok fejlődésével. A bővülő tudás ellenére a mai napig jelentős kihívást jelent és nem határozható meg sok esetben a kialakulásának pontos oka.
A PVR a rhegmatogen retinaleválás miatt végzett műtétek sikertelenségéért leggyakrabban felelős elváltozás, amely az üvegtestben, a retina mindkét felszínén és intraretinálisan is membránok kialakulásával jár (30, 34). A hegesedés trakciós membránok kialakulásával, a retina megrövidülésével és ismételt leválásával jár együtt.
Jelen közleményben a PVR kialakulásával, kezelésével és megelőzésével kapcsolatos ismeretek irodalmi áttekintését tűztük ki célul.
Előfordulás
A PVR egy olyan szembetegség, amelynek számos formája és oka lehet, így pontos előfordulási adatokkal nem rendelkezünk. Legpontosabb adatok a retinaleválás után kialakult formával kapcsolatban ismeretesek, 5-10%-ra teszik incidenciáját (35, 37). A PVR incidenciája a prospektív vizsgálatok szerint nem csökkent érdemben, annak ellenére, hogy az utóbbi évtizedekben jelentősen fejlődött és fejlődik jelenleg is a vitreoretinális technika. A minimálisan invazív vitreoretinális sebészet (MIVS) magába foglalja a szelepekkel rendelkező trokárok és a kisebb méretű eszközök (23-25-27 G) alkalmazását. Mindezek megjelenésével a várt mértékhez képest kevésbé csökkent a PVR jelenléte (8, 27, 18, 31). Az esetek mintegy háromnegyede az eredeti retinaleválás ellenes műtét után egy hónappal jelenik meg és 95%-ban másfél hónapon belül (34, 35).
A PVR retinaleválások műtéti sikere jelentősen alacsonyabb (45-85%) az elsődleges, nem PVR mellett végzett retinaleválás ellenes műtétekhez képest (85-95%). A végső funkcionális siker (aminek alsó határát 0,02 visusnál határoztak meg a legtöbb tanulmányban) mindössze 26-67% (16, 50, 38, 11).
Kockázati tényezők
Számos olyan tényezőt azonosítottak, amelyek fokozzák a PVR előfordulását, multifaktoriális folyamatról van szó (35). A kockázatok gyakorlati szempontból talán leghasznosabb módon már a műtét előtt fennálló és a műtét közben, vagy utána keletkező elváltozásokra oszthatók fel (14) (1. táblázat).
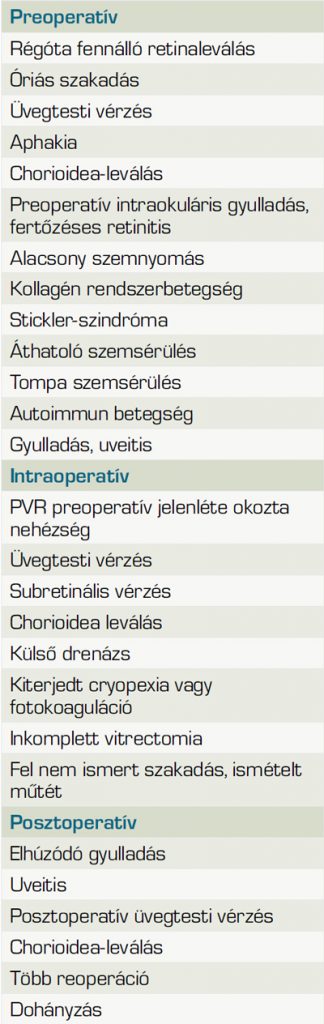
Az egyes kockázati tényezők nem függetlenek egymástól, összeadódhatnak a hatásaik. Például, minél kiterjedtebb a PVR, annál több műtétre van szükség. Minél több a műtét, annál nagyobb a gyulladásos komponens, de számos hasonló összefüggés sorolható még. A kórélettani háttér összetettsége miatt évről évre újabb tényezők és ezáltal újabb összefüggések kerülnek napvilágra.
Diagnosztika
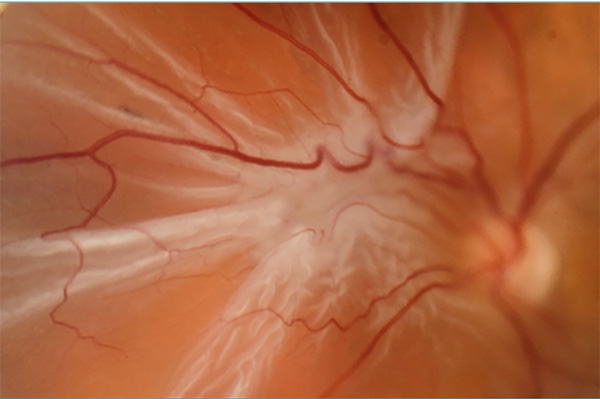
A PVR diagnosztikája alapvetően a hagyományos biomikroszkópos vizsgálaton alapul. Az anamnézis felvételekor fontos tisztázni a panaszok kezdetét, előfordul, hogy hónapokkal a műtét előtt már voltak elváltozások. Az üvegtesti homályok dinamikájára, jellegére rá kell kérdezni, az üvegtesti vérzés, a nagy mennyiségű pigment okozta homályok felvetik a PVR veszélyét. A biomikroszkópos vizsgálat során pontosan rögzítendő a PVR elhelyezkedése és kiterjedése (ld. alább formák és stádiumok), javasolt a rajzzal vagy fotóval való rögzítés. A hagyományos fotóhoz képest előnyös az ultraszéles látószögű kamerával készített fotó (1. ábra), amely a periféria áttekintő képét adja. A szöveges leírásban a retina motilitására, a szakadások elhelyezkedésére és a szakadás széleinek állapotleírására is törekedjünk. Ehhez hasonlóan az üvegtest státuszának leírása sem hanyagolandó el a fenti okok miatt. Esetleges subretinális vérzés, chorioidea-leválás nem mindig ítélhető meg biomikroszkóposan.
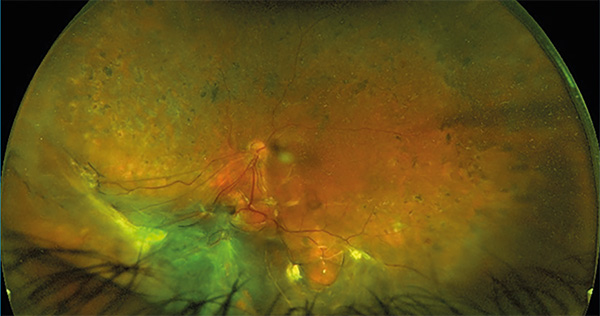
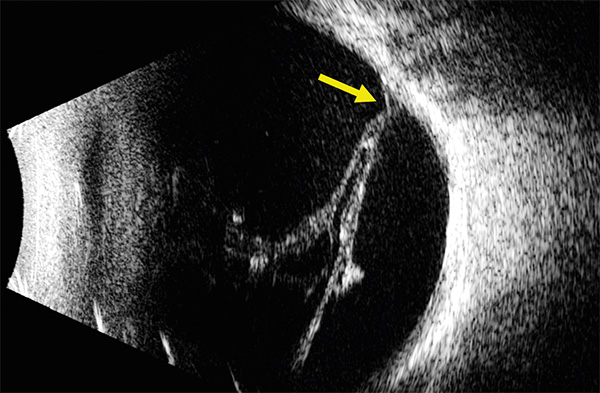
Az ultrahangvizsgálat további információt nyújt a törőközegek borússága esetén, a dinamikus vizsgálat a motilitás alapján segít a PVR kimutatásában, továbbá az üvegtesti trakciók sokszor jobban láthatók, mint a biomikroszkópos vizsgálat során (2. ábra). A subretinális vérzés és choiroidea-leválás diagnosztikájában is nagy segítséget nyújt az ultrahang. PVR esetén már operált szemekben az üvegtesti gázok, szilikonolaj-cseppek, perfluorokarbon folyadékmaradványok viselkedésének ismerete fontos, különösen annak tisztázása céljából, hogy valamely ezek közül subretinálisan helyezkedik-e el. Az OCT-vizsgálat egyrészt a makula állapotának követésében hasznos, pl. epiretinális membrán (3. ábra), makulalyuk, subretinális dekalincsepp kimutatásában. Az OCT segítségével a látóidegfő állapota, a látóidegrost-réteg vastagsága, illetve a ganglionsejtréteg vastagsága térképezhető fel. Utóbbi azért is fontos, mert az anatómiai siker ellenére számos esetben a funkcionális eredmény elmarad. Az OCT-angiográfia a retinális keringés állapotának leírására szolgál, hasonlatosan a fluoreszcein-angiográfiához, de noninvazív módon.
Formák és stádiumok
A PVR első beosztását a The Retina Society Terminology Committee alkotta meg 1983-ban (48). Az első beosztás szerint A-B-C- és D-kategóriákba sorolták a PVR-elváltozásokat, de a C-ben nem tettek különbséget az anterior és poszterior között. A C-stádiumot az érintett kvadránsok száma szerint tovább kategorizálták (1-2-3). Amennyiben minden kvadráns érintett volt, akkor a D-kategóriába esett, ami a tölcséres retinaleválásra vonatkozott, ebben az esetben az 1-2-3 kategória a tölcsér nyitottságát írta le. Ugyanezen társaság 1991-ben frissítette a beosztást (28) és a mai napig ez a használatos (2. táblázat). Fontos kiemelni, hogy a mindennapi megszokással ellentétben a korai (A- és B-fokozatokat) is már PVR-nek kell nevezni, nem csak az előrehaladottabb állapotokat.

A beosztás könnyen elsajátítható, segítségével a rutin ambuláns lapon is rögzíthető a beteg állapota.
Kórélettan
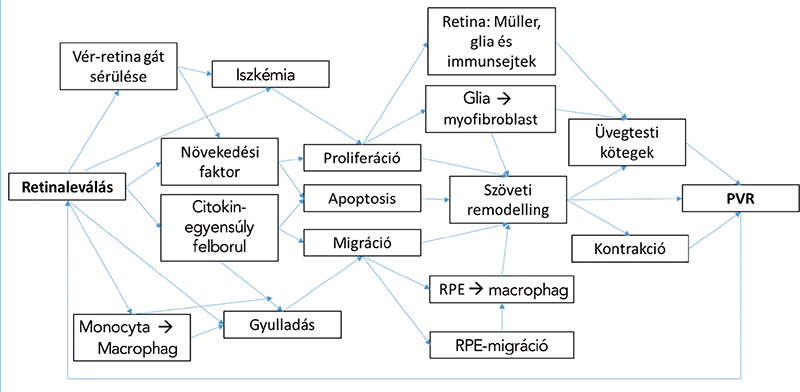
A PVR kialakulása számos tényező függvénye, amit leegyszerűsítve a kóros sebgyógyulás és hegesedés jellemez. A folyamat különböző összetevőinek kaszkádszerű reakciója zajlik le, amelyek a kóros állapotot kiváltják. A kaszkád kialakulását több tényező indíthatja el, úgymint a retina szakadása, a vér-retina gát sérülése, retina hipoxiája, gyulladás jelenléte, a retinális pigmentepithelium (RPE) sejtek üvegtestbe áramlása és megtapadása a retina felszínén, továbbá a gliasejtek migrálása a retina felszínére. Kórélettani szempontból citokinek, kemokinek és növekedési faktorok komplex együtthatása alakítja ki a kórfolyamatot (4. ábra, 3. táblázat). A molekulák részletes leírása meghaladná jelen közlemény kereteit, a 4. ábrán igyekeztünk kiemelni a legfontosabb patomechanizmusokat (4, 5). Részletes elemzés olvasható többek között Chaudhary közleményében (10).

A vér-retina gát sérülése kemotaktikus és mitogén aktivitás folyamatát váltja ki az üvegtestben, macrophágok, T- és B-lymphocyták jelennek meg, immunoglobulinok és a komplementrendszer aktiválódnak, a sejt közötti adhéziós molekulák (ICAM – intracellular adhesion molecules) a sejtek és az extracelluláris mátrix egyensúlyának felborulását okozzák. A citokinek, kemokinek és növekedési faktorok aktiválódásával láncreakció indul be, amely a PVR szemészeti tüneteit eredményezi a retina felszínén membránok megjelenésével, a retina hegesedésével, rövidülésével, trakciójával együtt. További tényező az iszkémia, amely retinaleválás esetén a retinát érinti, így a sejtek elpusztulását, apoptosisát eredményezi, kaszpáz enzimek jelenlétében. Az iszkémia jelei in vivo is tetten érhetők OCT-angiográfiás vizsgálattal (41). A fotoreceptorok apoptosisa további citokinek felszabadulását eredményezi, macrophágok, Müller-sejtek, astrocyták és mikrogliák megjelenését fokozza, oxidatív stressz alakul ki. A folyamat következő lépéseként a nem-neurális elemek (astrocyták, endothelsejtek, peryciták, mikrogliasejtek) proliferációja és migrációja jön létre. A PVR kialakulása nagy egyéni különbségeket mutat, genetikai háttér jelenlétét is feltételezik: az apoptosis és a profibrotikus hatásért felelős gének (pl. 953, MDM2, SMAD7, TNF) eltérései merültek fel.
A PVR patofiziológiai folyamatai és a stádiumai között összefüggés fedezhető fel. Három, részben egymást átfedő biológiai fázis figyelhető meg:
1. Sejtmigráció (PVR-A): RPE-sejtek migrálnak az üvegtestbe, gliasejtek migrálnak a retina felszínére. A sejtmozgások részben mechanikai hatásra alakulnak ki, részben a kemokinek és citokinek hatására. Ezek közül a pigmentsejtek migrációja látható biomikroszkópos vizsgálat során is, a többi kevésbé észlelhető.
2. Kontrakció (PVR-B): Vér-retina gát károsodása miatt a vér alkotóelemeinek exudációja indul be, fibrin, elasztin, fibronektin, növekedési faktorok és citokinek kerülnek az üvegtestbe és a retina felszíneire. Ennek a folyamatnak a következményei már jól láthatók réslámpás vizsgálat során: a szakadások széleinek felpöndörödése, a retina megvastagodása, rövidülése és motilitásának csökkenése.
3. Sejtproliferáció (PVR-C–D): Kollagén szintézisre utal a szemmel látható membránok megjelenése, trakciós kötegek kialakulása (14). Ez már egyértelműen látható jel, de műtét során tovább javítható a láthatósága vitális festékek alkalmazásával.
Megelőzés gyógyszeres lehetőségei
A PVR komplex kórélettani jellegzetessége alapján joggal merül fel annak lehetősége, hogy azt gyógyszeresen kedvező irányba befolyásoljuk. Habár ismert több kísérletes PVR elleni terápia, igazolt kedvező hatású szert még nem sikerült törzskönyvezni. A gyulladás általános vagy célzott csökkentésére, a sejtproliferáció és a fibrosis kontrollálására vannak farmakológiai eszközök a medicinában, de ezek szemészeti hatása PVR vonatkozásában még nem mondható sikeresnek. Komoly farmakokinetikai kihívást jelent, hogy az üvegtestben kell elérni megfelelő koncentrációt, amely a retinotoxikus hatás miatt nehezen kivitelezhető. Szisztémás adagolás esetén igen magas dózissal lenne elérhető a megfelelő retinális koncentráció, amely során az általános mellékhatásokkal kell számolnunk.
Néhány korábbi tanulmányban a PVR megelőzésében az intravitreálisan alkalmazott kortikoszteroidoknak kedvező hatását írták le. Intravitreálisan adott triamcinolon-acetonid csökkentette a PVR kialakulásáért felelős kemokinek (MCP-1, MIP-1ß és IP-10) koncentrációját az üvegtestben (24). Magas PVR-rizikójú retinaleválások esetén intraoperatív methotrexat infúziót alkalmaztak, amelyet követően alacsony PVR-előfordulást találtak (44). Az ígéretes eredmények ellenére a helyi vagy általánosan adott kortikoszteroidok nem hozták a várt hatást sem anatómiai sem funkcionális téren. A heparin és dexamethason intraopetatív alkalmazása fokozta a posztoperatív bevérzések kockázatát (1). A szilikonlaj-feltöltés mellett adott dexamethason-implantátumok nem nyújtottak kimutatható előnyt PVR C-ben (6).
Antiproliferatív és daganatellenes szerek alkalmazásával is rendelkezünk eredményekkel. Beszámoltak 5-fluorouracil (5-FU), daunorubicin, taxol, colchicin, retinolsav, ribozimek, vincristin, cisplatin, adriamycin, mitomycin, és dactomycin alkalmazásáról. Az antimetabolit hatású 5-FU állatkísérletben jótékony hatásúnak bizonyult a fibroblast-proliferáció ellen, de emberben nem érte el a kívánt hatást. Az 5-FU alacsony molekulasúlyú heparinnal (LMWH) kombinálva magas PVR-rizikójú betegeknél intraoperatív alkalmazást követően alacsonyabb PVR-kialakulást találtak a kontrollcsoporthoz képest, amely különbség a látóélességben nem volt kimutatható (3). Egy későbbi randomizált vizsgálatban az 5-FU szteroiddal, illetve LMWH-val együtt alkalmazva nem hozott kedvező eredményt PVR-ablációban alkalmazva (51).
A statinok szerepét is vizsgálták a PVR kialakulásának megelőzésében. Beszámoltak a statinok heges kontrakciót gátló hatásáról. Az intravitreális simvastatin dózisfüggően gátolta a progressziót in vivo PVR-modellben, illetve csökkentette a TGFß-2 szintjét, ami a myosin könnyűlánc foszforilációjáért és a gél kontrakciójáért felel (22). Az állatmodellen kívül humán RPE-sejtkultúrában és üvegtestben is tanulmányozták a statinok preventív hatását (29).
Egy másik TGFß-2-inhibitor, a salinomycin szerepét is vizsgálták a PVR megelőzésében. Egérmodellben hatásosan gátolta a salinomycin a PVR kialakulását, csökkentette a fibrotikus és gyulladásos molekulák koncentrációját a kontrollcsoporthoz képest (17).
A Daunorubicin Study Group eredményei szerint a szer sikeresen csökkentette a sejtmigrációt és ez által kis mértékben képes volt javítani a reoperációs rátát. A VEGF-gátló terápiák közül a bevacizumabot primer vitrectomia során, vagy akár a szilikonolajba injektálva PVR B és C esetén számoltak be jótékony hatásról, de sajnos az ellenkezőjéről is, hiszen a fibrosis hirtelen felerősödése is bekövetkezhet hatására (15, 49).
A szilikonolaj emulzifikációja is jelentős fejtörést okoz, hiszen nehezen jósolható meg, kinél milyen korán alakul ki. A PVR kialakulásában szerepet játszó fehérjék nagy valószínűséggel mozdítják elő az olaj szétesését cseppekre (47).
Sebészi kezelés
A PVR kezelése napjainkban is leginkább sebészi. A sebészi cél a retina fekvő helyzetének tartós biztosítása, amelyet a PVR jelentősen veszélyeztet. A fenti oknak köszönhetően Robert Machemer neve nemcsak a stádiumbeosztásnál, hanem a vitrectomia úttörőjeként is említendő (28).
Vitrectomia-technikák
Üvegtest és üvegtesti határhártya
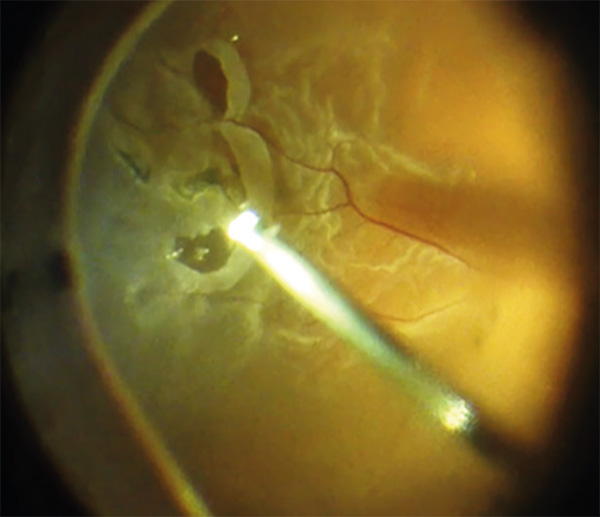
Az üvegtesti határhártya leválasztása és lehető legteljesebb eltávolítása, vitális festékek (pl. triamcinolon) alkalmazásával az elsődleges cél. Ezt persze maradéktalanul megvalósítani a gyakorlatban rendkívül ritkán lehetséges. Reoperáció esetén sokszor könnyebben látható az üvegtesti maradvány, mint primer műtét során (6. ábra).
Preretinális membránok és membrana limitans interna (ILM)
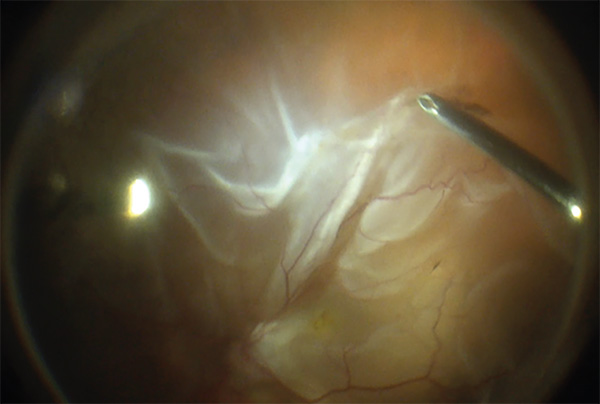
A preretinális membránok maradéktalan eltávolítása, a csillagredők oldása vitális festések alkalmazásával csökkenti a PVR kiújulását, kialakulását. Ehhez sokszor nemcsak a membrán, hanem az ILM levonása is szükséges, amely biztosítja, hogy több preretinális membrán az adott területen ne maradjon (7. ábra). Szintén ellentmondásos, hogy ha a hátsó póluson nincs PVR, indokolt-e az ILM peeling elvégzése (52). Maga a peeling annyiban tér el a pl. makulaműtéteknél végzett technikáktól, hogy sok esetben csak perfluorocarbon folyadék (PFCL) jelenlétében végezhető el a retinaleválás miatt (39, 2, 13).
Subretinális kötegek
A retina alatt húzódó kötegek változó mértékű hatást gyakorolnak a retinára, de sokszor akadályozzák a retina visszatapadását, szárítókötél-szerűen tartják elemelve. Eltávolításukat célszerű kis retinotomiás nyíláson keresztül elvégezni, amelyet a vizuális szempontból kevéssé jelentős retinaterületen javasolt elkészíteni. A köteg elvágása is sokszor elegendő lehet. A pars planahoz közeli membránok eltávolítása a nehéz láthatóság miatt különösen nehéz manőver, előfordulhat, hogy phakoemulzifikáció, vagy a lencse teljes eltávolítása szükséges a hozzáférés biztosításához.
A PFCL alkalmazása nagy segítség műtét során, stabilan tartja a retinát a membránok levonása közben, ugyanakkor fontos elkerülni a subretinális térbe kerülését, illetve tartósan az üvegtesti térben maradva a retina toxikus károsodásával kell számolnunk. A PFCL segíthet annak megítélésében, hogy tartós endotamponád esetén mennyire képes a retina kisimulni, de el is fedheti a maradék trakciókat.
Retinotomia és retinectomia
A retinán iatrogen sérülések okozása fokozza a PVR kockázatát, ugyanakkor paradox módon sokszor elkerülhetetlen annak műtéti ellátása során. Megfelelő haemostasis (endodiathermia) után a kis átmérőjű vitrectomokkal elvégezhető a retinectomia PFCL megtámasztása mellett. Fontos megjegyezni, hogy sokszor 180 fokban, vagy annál kiterjedtebb esetben is el kell végezni a retinectomiát annak érdekében, hogy a retina kellő relaxációja elérhető legyen.
Megvilágítás
A PVR miatt végzett műtét komplexitása miatt általában időigényes, ezért fokozottan számolni kell a már meglévő retinakárosodás mellett a fototoxicitás veszélyével. Ugyanakkor a jó megvilágítás feltétele a proliferatív membránok eltávolításának. További kiegészítő fényforrások (pl. chandelier) sclerához rögzített fény lehetővé teszi a bimanuális membrán peelinget, ezáltal a iatrogen retinasérülések kockázatának csökkentését. A világítással kombinált lézerszonda vagy spatula, illetve a világító külső bedomborító eszköz is segítséget nyújthat.
Endotamponád
A műtét végén a megfelelő endotamponád alkalmazása kulcsfontosságú. A Silicone Study megállapítása szerint a hosszú hatású gáz és a szilikonolaj egyformán hatásosak, de mindenképpen előnyösebbek a rövid hatású gáznál (26). A levegő PVR esetében ritkán javasolt, az expanzív gázok, mint az SF6, a C2F6 vagy a C3F8 általánosságban akkor jön szóba, ha a retina helyzete várhatóan stabil marad 2-3 hétig, nem számítunk a PVR gyors progressziójára. Kiterjedt hegesedés, vérzésveszély vagy retinectomia esetén, illetve ha a beteg pozícionálása nem biztosítható megfelelően, a szilikonolaj-feltöltés a legcélravezetőbb megoldás. A szilikonolaj számos komplikációhoz vezethet, de pl. monoculus beteg esetében biztosítja az önállósághoz szükséges visust már a korai posztoperatív időszakban. Az alsó retinafél gyakran érintett a PVR által, hiszen akár gáz, akár szilikonolaj-feltöltést végzünk, a citokinek elsősorban az alsó részen koncentrálódva a folyadékrésben gyűlnek össze, így nagyobb eséllyel okoznak PVR-t. A nehéz szilikonolaj megoldást jelenthet ezen esetekben akár primeren választott endotamponádként. Szerepe ellentmondásos, az FDA nem hagyta jóvá az alkalmazását. Nehézsége az eltávolítás korai időzítése (2-3 hónapon belül lehetőség szerint eltávolítandó) és az explantációhoz szükséges nagy lumenű eszköz, továbbá a retinához való időszakos tapadása (42).
Időzítés
A műtét időpontjának meghatározása meglehetősen ellentmondásos, hiszen túl korán elvégezve a membránok nem fejthetők le megfelelően a retináról, míg túl későn elvégezve az erős tapadás miatt már nem távolíthatók el a retina sérülése nélkül. Általános irányelvként az szabható meg leginkább, hogy a makula állapota határozza meg, mikor kell beavatkozást végezni.
Mind a 20 G, mind a kisebb lumenű eszköztár biztonságosnak és hatékonynak bizonyult a PVR sebészi ellátásában. Khan és munkatársai a 27 G-s pars plana vitrectomia hosszú távú kimenetelét vizsgálták, és eredményeik alapján alacsony komplikációs ráta volt megfigyelhető a primer és a komplex esetekben egyaránt (23). A kisebb átmérőjű technikák kisebb gyulladással járnak általánosságban, ezért előnyösebbek PVR tekintetében.
Külső bedomborítás
A kiegészítő külső bedomborítás (plomba vagy cerclage) elsősorban az alsó retinafél PVR elváltozásaiban nyújthatnak segítséget, a megrövidült retina és az üvegtesti bázis megtámasztása főleg az equator előtt elhelyezkedő anterior PVR esetében nyújt segítséget az anterior-posterior irányú trakció csökkentése által. A külső bedomborítás elvégzése primer beavatkozásként PVR esetében nem éri el azonban az 50%-ot (9, 46), de fiatal felnőttekben, phakiás szemben alsó PVR-leválások esetén jótékony hatású (32).
Költség
A fenti technikák és azok kombinációi, az ismételt műtét szükségessége, a megnövekedett műtéti idő, a hosszas ápolási idő és posztoperatív gyógyszeres kezelés, a rendszeres kontrollok igénye mellett is sok esetben a látásfunkció javulása elmarad az ideálistól. Mindezek miatt a PVR műtéti ellátása költségesnek mondható, de eredményesebb módszer egyelőre nem ismeretes.
Amennyiben sikerül kifejleszteni valóban hatékony gyógyszeres kezelést, várhatóan annak is magas lesz a költsége.
Szövődmények
A PVR maga is egyfajta szövődmény, így a PVR szövődményeit nehéz pontosan meghatározni. A PVR miatt végzett műtétek szövődményeit foglaljuk össze az alábbiakban.
Szubjektív tünetek
- Látászavarok: A legkülönfélébb panaszokhoz vezethet a PVR, a diplopia és metamorfózisa részben a retina hegesedéséből, torzulásából adódik, a több alkalommal adott para- vagy retrobulbáris érzéstelenítés vagy a külső bedomborító beavatkozások következtében lehetnek szemizom-eltérések.
- Látótérkiesések: A lézer vagy fagyasztásos kezelések következtében retinarészek működéshiánya miatt látótérkieséseket észlelhetnek a betegek. A manipuláció során a retinális látóidegrostok és a látóideg károsodása is magyarázhatja a scotomákat.
- Ptosis, blepharospasmus részben a szemfájdalom, részben a számos beavatkozás következménye lehet.
- Krónikus gyulladás, szemfájdalom.
- Szemszárazság.
Elülső szegmentum-szövődmények
- Subconjunctivális szilikoncseppek gyulladást tartanak fent és irritációt eredményeznek. A tartós szemcsepphasználat mellékhatásai is jelentkezhetnek.
- Cornea-dekompenzáció (szemnyomás-emelkedés, üvegtest, szilikonolaj csarnokba jutása).
- Band keratopathia (opacitas zonularis) általában évekkel később jelentkezik.
- Irisletapadás, elülső és hátsó synechiák megjelenése, seclusio pupillae. A PVR-t kiváltó fehérjék a csarnokvízben is felszaporodnak, főleg endotamponád és a beteg pozícionálása során, ezért az iris könnyen letapad a környező szövetekhez. Szabálytalan pupilla nemcsak optikailag káros, de a további műtéteket is akadályozza.
- Iris bombans a synechiák következtében alakul ki.
- Iris rubeosis kialakulása a retinaiszkémia következtében gyakori.
- Hyphaema: lehet hipotónia, vagy iris rubeosis következménye is.
- Szürkehályog-képződés: mind az üvegtesti manipuláció, az endotamponád, a gyulladás és a tartós szteroidhasználat közrejátszik.
- Műlencse- és szemlencse-diszlokáció. A legtöbb PVR miatt kezelt betegnél kialakul szürkehályog, amelyhez zonulagyengeség is társulhat, a kollagenáz és proteáz enzimek a lencsefüggesztő rostokat is gyengíthetik.
Szemnyomás
- Szekunder glaukóma: Gyakori elváltozás részben a synechiák, részben az endotamponád következtében jön létre. A gázfeltöltés általában átmeneti, a szilikonolaj-feltöltés tartós szemnyomás-emelkedést eredményezhet. A tartós szteroidhasználat is fokozza a másodlagos glaukóma kockázatát.
- Hipotónia, phthisis bulbi: Az alacsony szemnyomás magát a retinaleválást is kísérheti, de általában elülső PVR okozza, amely akár a szemgolyó zsugorodásához is vezethet.
Hátsó szegmentum-szövődmények
- Üvegtesti vérzés már gyakran a PVR korai fázisában észlelhető, de a kései hipotónia, szilikonolaj-lebocsátás után is megfigyelhető.
- Cisztoid makulaödéma – gyakori eltérés a trakciók és toxikus hatások miatt.
- Endophthalmitis ismételt, elhúzódó hátsó szegmentumműtétek esetén előfordulhat súlyosbítva az addig is meglévő állapotokat.
- Látóideg-atrófia: Gyakran korlátozza a látásfunkciót PVR következtében, a retina felszínén végzett manipuláció az idegrostréteg közvetlen károsodásához vezet, amely a látóideg sorvadását eredményezi. A szekunder glaukóma és a szilikonolaj használata tovább fokozzák a sorvadást.
- Subretinális vérzés, PFCL vagy szilikonolaj-retenció: A retinasérüléseken keresztül előfordulhat ilyen szövődmény, amely a retinát károsító hatású.
- Chorioidea-abláció, suprachorioidális vérzés: A hyperaemiás érhártya, a bedomborítás és a subretinális manipuláció során kialakulhatnak.
Funkcionális és anatómiai eredmények
Az ellátás célja a jó látásfunkció helyreállítása, amely nem választható el az anatómiai állapot restaurációjától. Anatómiai sikeren értjük azt, ha a retina fekvő helyzetű a szilikonolaj eltávolítása után. A retinaleválás esetében az „Egyetlen műtét utáni anatómiai siker – Single surgery anatomical success (SSAS)” arány mutatja meg az anatómiai sikert, amennyiben több műtétre is szükség van, akkor az „Összességében elérhető anatómiai siker – Overall anatomic success (OAS)”. A siker tekintetében a beavatkozások/reoperációk száma is mérvadó. A sok esetben többszöri műtét mellett a PVR-retinaleválások esetében mintegy 40%-ban érhető el hosszú távon stabil retinahelyzet (20). A PVR beosztásában is szereplő anterior PVR általában kedvezőtlenebb prognózist jelent (46). Az esetek és a követési idő különbözősége miatt nagyon tág határok között olvasható adat az anatómiai sikerről (34). A PVR nagymértékben rontja a kimenetelt, de a korai posztoperatív PVR nehezen jósolható előre (43).
Az életkor is befolyásolja a műtéti sikert a kiindulási állapoton kívül. Külön csoportot képeznek a gyermekek, Brown és munkatársai a fiatal felnőttek (18–30 év) csoportját vizsgálta (7). Nagy arányban végeztek külső bedomborítást önmagában, vagy vitrectomiával kombinálva. Az SSAS bedomborító műtétek esetén 74% és kombinált műtét esetén 64% volt, az OAS 93% és 100% volt ugyanebben a csoportosításban. Eseteik között a 18–30 éves korosztályban preoperatív PVR C már jelen volt 26-38%-ban, ami magasabb, mint az átlagos életkorban jelentett 5-12% (45, 25, 21). Amennyiben a pre- és posztoperatív PVR-rátát elemezték, PVR 61%-ban fordult elő, ami igen magas arány, a gyermekkorban jelentett 20-60%-nak felel meg (40).
Nem eldöntött vita a mai napig sem, hogy PVR esetében a primer bedomborítás (elsősorban cerclage) javítja-e a vitrectomia sikerét, ahogyan a szilikonolaj használata, különösen az alsó retinafélre terjedő PVR esetében mikor indokolt. Számos kérdést vet fel a nehéz szilikonolaj felhasználása, amely szintén megosztja a vitreoretinális sebészek közösségét. Az FDA nem hagyta jóvá mindeddig használatát, így az USA-ban készült statisztikák értelmezésénél ezt is figyelembe kell venni. Patel szerint a külső bedomborítás sikertelensége esetén az anatómiai és funkcionális eredmények korlátozottak (36).
A funkcionális siker elsődleges fokmérője a visus, amelynek feltétele a makula fekvő helyzete és megtartott szerkezete. Kedvező anatómiai siker (fekvő retina) esetében is számolnunk kell epiretináis membrán, pigmentatrófia, cisztoid makulaödéma, subretinális fibrosis lehetőségével, amelyek korlátozzák a látásfunkciót. A biomikroszkóposan látható kóros eltéréseken túl a képalkotó vizsgálatokkal (makula és papilla OCT, autofluoreszcencia, fluoreszcein-angiográfia) és funkcionális vizsgálatokkal (látótérvizsgálat) kimutatható az esetleges maradandó károsodás.
A 0,02 látóélesség elérése általában 40-80%-ban sikeres PVR esetében, a műtétek számának növekedésével a várható látóélesség általában csökkenő tendenciát mutat. A látóélesség teljessége esetén is előfordulhat a kontrasztérzékenység csökkenése, látótérszűkület, színlátászavar, torzlátás stb. Fontos tényező a makula állapota a műtét ideje előtt, illetve ezzel összefüggésben a kiindulási visus (33).
Israilevich és munkatársai a retinectomiát igénylő PVR sikerességét értékelve megállapították, hogy jobb posztoperatív látóélességet tett lehetővé a kisebb kiterjedésű retinaleválás, a primer és az ismételt leválás miatt végzett műtét között eltelt rövidebb idő és a jobb preoperatív visus (19). Anyagukban több mint 5000 esetből 345 esetben végeztek retinectomiát. A retinectomia mellett is elérhető volt 0,3-nél jobb visus az esetek harmadában.
Echegaray és munkatársai a sclerabedomborítással kombinált vitrectomia és az önmagában végzett vitrectomia összehasonlítása kapcsán azt tapasztalták, hogy a meglévő PVR rossz prognosztikai jel, mintegy 1,5-2 szeresére növeli az ismételt retinaleválás valószínűségét, illetve a műtét sikertelenségét (12). Mindkettő esetben hatványozottan növekszik a gyengébb látásfunkció kockázata.
A fentiekben elsődlegesen a retinaleválás kapcsán kialakult PVR-ről ejtettünk szót, de az anatómiai és funkcionális siker tovább romlik uveitis (különösen nekrotizáló retinitis) esetében, hiszen a citokinfelszabadulás és a hegesedési hajlam kifejezettebb. A PVR speciális esetét jelenti a nekrotizáló retinitis, amely során elsősorban a perifériás retina területén pókhálószerűen elvékonyodik a retina szerkezete. A retinális vasculitis további nehézséget okoz, hiszen az iszkémia és a gyulladásos citokinek koncentrációja magas.
A diabéteszes retinopathia proliferatív formája is említendő ezen a helyen, ahol az iszkémia krónikus fennállása és a sebgyógyulási zavar kifejezett proliferációk megjelenését és trakció kialakulását eredményezi. A proliferatív diabéteszes retinopathia és a PVR kialakulásában nagyon hasonló faktorok játszanak szerepet. A PVR kialakulása nem diabéteszes retinopathiás, de diabéteszes betegeknél is fokozott kockázatot jelent a siker tekintetében. Az érbetegségek, mint a retinális véna ág- vagy törzselzáródás, artériás okklúzió mind-mind elsődlegesen az iszkémia által rontják a PVR kimenetelét. A patológiás myopia, hátsó staphyloma esetében a PVR kialakulása az elvékonyodott retinaszövet mellett könnyen okoz retinaszakadásokat.
A non-rhegmatogén retinaleválások, exsudatív vitreoretinopathiák, retinális angiomatosisok (pl. Coats- betegség) is nehezen kezelhető formáit hozhatják létre a PVR-nek.
Jövő fejlesztései
A vitreoretinális sebészet fejlesztései mind a PVR-ellenes küzdelem jegyében születnek, beleértve a vitrectom frekvenciájának, vágási stabilitásának és finomságának fokozása érdekében, a hiperszonikus, mozgó alkatrészt nem is tartalmazó kézidarab is már elérhető. A megvilágítás fejlesztése a fototoxikus hatás csökkentése révén és a rögzített fényforrások mellett végezhető bimanuális manőverek sok új lehetőséget kínálnak. Az intraoperatív OCT a membránok levonásában nyújt segítséget, a vitális festések szintén a vitreoretinális felszín helyreállítását segítik. A gyógyszeres kezelések egyelőre még nem érték el az áttöréshez szükséges klinikai hatékonyságot, de ezek terén is várható a közeljövőben kézzel fogható eredmény. A tökéletes üvegtestpótló-anyag kifejlesztésén is számos helyen dolgoznak, bizakodva tekinthetünk az elé, hogy fiziológiásabb anyagokkal dolgozhatunk a közeljövőben. Az is nagy siker lenne, ha a szilikonolaj emulzifikációját tudnánk gyógyszeresen megakadályozni. Végezetül nem szabad megfeledkeznünk a beteg pszichológiai vezetéséről sem, az ismételt műtétek, az azzal járó kellemetlenségek, a munkából való kiesés komoly lelki terhet helyez mind a páciens, mind az ellátó orvos vállára. Ezek terén is sok tennivalónk van mi magunknak is.
Következtetések
A proliferatív vitreoretinopathia az egyre bővülő molekuláris biológiai tudás, az arra épített farmakológiai fejlesztések ellenére jelenleg is elsődlegesen sebészi úton ellátandó betegség, amelynek számos kockázati tényezői közül egy maga a műtétet végző orvos. Komplexitásában nézve a műtéti technika és vizualizáció nagyléptékű fejlődése mellett sem sikerült megszüntetni ezt a látást veszélyeztető kórképet és jelentős kihívást jelent a jelenlegi és jövőbeli vitreoretinális sebészek és általános szemészek számára egyaránt.
Nyilatkozat
A szerzők kijelentik, hogy a továbbképző, referáló közlemény megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Ahmadieh H, Feghhi M, Tabatabaei H, Shoeibi N, Ramezani A, Mohebbi MR. Triamcinolone acetonide in silicone-filled eyes as adjunctive treatment for proliferative vitreoretinopathy: a randomized clinical trial. Ophthalmology 2008; 115(11): 1938–1943. https://doi.org/10.1016/j.ophtha.2008.05.016
2. Akiyama K, Fujinami K, Watanabe K, Tsunoda K, Noda T. Internal Limiting Membrane Peeling to Prevent Post-vitrectomy Epiretinal Membrane Development in Retinal Detachment. Am J Ophthalmol 2016; 171: 1–10. https://doi.org/10.1016/j.ajo.2016.08.015
3. Asaria RH, Kon CH, Bunce C, Charteris DG, Wong D, Khaw PT, et al. Adjuvant 5-fluorouracil and heparin prevents proliferative vitreoretinopathy: Results from a randomized, double-blind, controlled clinical trial. Ophthalmology 2001; 108(7): 1179–83. https://doi.org/10.1016/s0161-6420(01)00589-9.
4. Balogh A, Milibák T, Szabó V, Nagy ZZ, Kaarniranta K, Resch MD. Immunological biomarkers of the vitreous responsible for proliferative alteration in the different forms of retinal detachment. BMC ophthalmology 2020; 20(1): 491. https://doi.org/10.1186/s12886-020-01745-x
5. Balogh A, Milibák T, Szabó V, Nagy ZZ, Resch MD. Position of macula lutea and presence of proliferative vitreoretinopathy affect vitreous cytokine expression in rhegmatogenous retinal detachment. PloS one 2020; 15(6): e0234525. https://doi.org/10.1371/journal.pone.0234525
6. Banerjee PJ, Quartilho A, Bunce C, et al. Slow-Release Dexamethasone in Proliferative Vitreoretinopathy: A Prospective, Randomized Controlled Clinical Trial. Ophthalmology 2017; 124(6): 757–767. https://doi.org/10.1016/j.ophtha.2017.01.021
7. Brown K, Yannuzzi NA, Callaway NF, Patel NA, Relhan N, Albini TA, Berrocal AM, Davis JL, Fortun JA, Smiddy WE, Sridhar J, Flynn HW Jr, Townsend JH. Surgical Outcomes Of Rhegmatogenous Retinal Detachment In Young Adults Ages 18–30 Years. Clin Ophthalmol 2019 Oct 31; 13: 2135–2141. https://doi.org/10.2147/OPTH.S213042
8. Charteris DG, Sethi CS, Lewis GP, Fisher SK. Proliferative vitreoretinopathy-developments in adjunctive treatment and retinal pathology. Eye Lond Engl 2002; 16(4): 369–374. https://doi.org/10.1038/sj.eye.6700194
9. Coffee RE, Jiang L, Rahman SA. Proliferative vitreoretinopathy: advances in surgical management. Int Ophthalmol Clin 2014; 54(2): 91–109. https://doi.org/10.1097/IIO.0000000000000023
10. Chaudhary R, Scott RAH, WallaceG, BerryM, Logan A, Blanch RJ. Inflammatory and fibrogenic factors in proliferative vitreoretinopathy development. Trans Vis Sci Tech 2020; 9(3): 23. https://doi.org/10.1167/tvst.9.3.23
11. de Silva DJ, Kwan A, Bunce C, Bainbridge J. Predicting visual outcome following retinectomy for retinal detachment. Br J Ophthalmol 2008; 92(7): 954–958. https://doi.org/10.1136/bjo.2007.131540
12. Echegaray JJ, Vanner EA, Zhang L, Fortun JA, Albini TA, Berrocal AM, Smiddy WE, Flynn HW Jr, Sridhar J, Gregori NZ, Townsend JH, Davis JL, Haddock LJ. Outcomes of Pars Plana Vitrectomy Alone versus Combined Scleral Buckling plus Pars Plana Vitrectomy for Primary Retinal Detachment. Ophthalmol Retina 2021 Feb; 5(2): 169–175. https://doi.org/10.1016/j.oret.2020.09.013
13. Foveau P, Leroy B, Berrod J-P, Conart J-B. Internal Limiting Membrane Peeling in Macula-off Retinal Detachment Complicated by Grade B Proliferative Vitreoretinopathy. Am J Ophthalmol 2018; 191: 1–6. https://doi.org/10.1016/j.ajo.2018.03.037
14. Garweg et al. Pathophysiology of proliferative vitreoretinopathy in retinal detachment. Survey of ophthalmology 2013; 58: 321–329. https://doi.org/10.1016/j.survophthal.2012.12.004
15. Ghasemi Falavarjani K, Hashemi M, Modarres M, Hadavand Khani A. Intrasilicone oil injection of bevacizumab at the end of retinal reattachment surgery for severe proliferative vitreoretinopathy. Eye Lond Engl 2014; 28(5): 576–580. https://doi.org/10.1038/eye.2014.2197
16. Grigoropoulos VG, Benson S, Bunce C, Charteris DG. Functional outcome and prognostic factors in 304 eyes managed by retinectomy. Graefes Arch Clin Exp Ophthalmol Albrecht Von Graefes Arch Klin Exp Ophthalmol 2007; 245(5): https://doi.org/10.1038/eye.2014.2197641–649. https://doi.org/10.1007/s00417-006-0479-z
17. Heffer AM, Wang V, Libby RT, Feldon SE, Woeller CF, Kuriyan AE. (2020) Salinomycin inhibits proliferative vitreoretinopathy formation in a mouse model. PloS one 15(12): e0243626. https://doi.org/10.1371/journal.pone.0243626
18. Heimann H, Bartz-Schmidt KU, Bornfeld N, et al. Scleral buckling versus primary vitrectomy in rhegmatogenous retinal detachment: a prospective randomized multicenter clinical study. Ophthalmology 2007; 114(12): 2142–2154. https://doi.org/10.1016/j.ophtha.2007.09.013
19. Israilevich RN, Starr MR, Mahmoudzadeh R, Salabati M, Swaminathan V, Huang D, Kuriyan AE, Yonekawa Y, Garg SJ, Mehta S, Regillo CD, Hsu J. Factors Associated with Good Visual Acuity Outcomes After Retinectomy in Eyes with Proliferative Vitreoretinopathy. Am J Ophthalmol 2022 Mar 11: S0002-9394(22)00096-4. https://doi.org/10.1016/j.ajo.2022.02.028
20. Iwahashi-Shima C, Sato T, Bando H, Ikeda T, Emi K. Anatomic and functional outcomes of 25-gauge vitrectomy for repair of eyes with rhegmatogenous retinal detachment complicated by proliferative vitreoretinopathy. Clin Ophthalmol Auckl NZ 2013; 7: 2043–2049. https://doi.org/10.2147/OPTH.S52260
21. Joeres S, Kirchhof B, Joussen AM. PVR as a complication of rhegmantogenous retinal detachement: a solved problem? Br J Ophthalmol 2006; 90(6): 796–797. https://doi.org/10.1136/bjo.2005.088856
22. Kawahara S, Hata Y, Kita T, Arita R, Miura M, Nakao S, Mochizuki Y, et al. Potent inhibition of cicatricial contraction in proliferative vitreoretinal diseases by statins. Diabetes 2008; 57(10): 2784–93. https://doi.org/10.2337/db08-0302
23. Khan MA, Kuley A, Riemann CD, et al. Long-Term Visual Outcomes and Safety Profile of 27-Gauge Pars Plana Vitrectomy for Posterior Segment Disease. Ophthalmology 2018; 125(3): 423–431. https://doi.org/10.1016/j.ophtha.2017.09.013
24. Kunikata H, Yasuda M, Aizawa N, Tanaka Y, Abe T, Nakazawa T. Intraocular concentrations of cytokines and chemokines in rhegmatogenous retinal detachment and the effect of intravitreal triamcinolone acetonide. American journal of ophthalmology 2013; 155(6): 1028–37.e1. https://doi.org/10.1016/j.ajo.2013.01.013
25. won OW, Song JH, Roh MI. Retinal detachment and proliferative vitreoretinopathy. Dev Ophthalmol 2016; 55: 154–162. https://doi.org/10.1159/000438972
26. Lean JS, Stern WH, Irvine AR, Azen SP. Classification of proliferative vitreoretinopathy used in the silicone study. The Silicone Study Group. Ophthalmology 1989; 96(6): 765–771. https://doi.org/10.1016/s0161–6420(89)32821–1
27. Leiderman YI, Miller JW. Proliferative vitreoretinopathy: pathobiology and therapeutic targets. Semin Ophthalmol 2009; 24(2): 62–69. https://doi.org/10.1080/08820530902800082
28. Machemer R, et al. An updated classification of retinal detachment with proliferative vitreoretinopathy. American journal of ophthalmology 1991; 112(2): 159–65. https://doi.org/10.1016/s0002-9394(14)76695-4
29. Mysore Y, Del Amo EM, Loukovaara S, Hagström M, Urtti A, Kauppinen A. Statins for the prevention of proliferative vitreoretinopathy: cellular responses in cultured cells and clinical statin concentrations in the vitreous. Sci Rep 2021; 11(1): 980. https://doi.org/10.1038/s41598-020-80127-1.
30. Nagasaki H, Shinagawa K, Mochizuki M. Risk factors for proliferative vitreoretinopathy. Prog Retin Eye Res 1998; 17(1): 77–98. https://doi.org/10.1016/s1350-9462(97)00007-4
31. Oellers P, Stinnett S, Hahn P. Valved versus nonvalved cannula small-gauge pars plana vitrectomy for repair of retinal detachments with Grade C proliferative vitreoretinopathy. Clin Ophthalmol Auckl NZ 2016; 10: 1001–1006. https://doi.org/10.2147/OPTH.S104901
32. Papp A, Lendvai Zs, Szalai I, Resch M. Hagyományos bedomborító műtétek eredményei rhegmatogén ideghártya-leválások esetén. Szemészet 2012; 149: (3) 152–154.
33. Papp A, Resch M. A foveát nem érintő „makula-on” ideghártya-leválások műtéti sürgősségéről. Szemészet 2019; 156: 127–133
34. Pastor JC. Proliferative vitreoretinopathy: an overview. Surv Ophthalmol. 1998; 43(1): 3–18. https://doi.org/10.1016/s0039-6257(98)00023-x
35. Pastor JC, de la Rúa ER, Martín F. Proliferative vitreoretinopathy: risk factors and pathobiology. Prog Retin Eye Res 2002; 21(1): 127–144. https://doi.org/10.1016/s1350-9462(01)00023-4
36. Patel SN, Salabati M, Mahmoudzadeh R, Obeid A, Kuriyan AE, Yonekawa Y, Klufas MA, Garg SJ, Hsu J, Khan MA. Surgical failures after primary scleral buckling for rhegmatogenous retinal detachment: Comparison of Eyes With and Without Proliferative Vitreoretinopathy. Retina 2021 Nov 1; 41(11): 2288–2295. https://doi.org/10.1097/IAE.0000000000003214
37. Pennock S, Haddock LJ, Mukai S, Kazlauskas A. Vascular endothelial growth factor acts primarily via platelet-derived growth factor receptor a to promote proliferative vitreoretinopathy. Am J Pathol 2014; 184(11): 3052–3068. https://doi.org/10.1016/j.ajpath.2014.07.026
38. Quiram PA, Gonzales CR, Hu W, et al. Outcomes of Vitrectomy with Inferior Retinectomy in Patients with Recurrent Rhegmatogenous Retinal Detachments and Proliferative Vitreoretinopathy. Ophthalmology 2006; 113(11): 2041–2047. https://doi.org/10.1016/j.ophtha.2006.05.039
39. Rao RC, Blinder KJ, Smith BT, Shah GK. Internal limiting membrane peeling for primary rhegmatogenous retinal detachment repair. Ophthalmology 2013; 120(5): 1102–1103.e1–2. https://doi.org/10.1016/j.ophtha.2012.12.010
40. Read SP, Aziz HA, Kuriyan A, et al. Retinal detachment surgery in a pediatric population: visual and anatomic outcomes. Retina 2018; 38 (7): 1393–1402. https://doi.org/10.1097/IAE.0000000000001725
41. Resch MD, Balogh A, Lászik G, Nagy ZZ, Papp A. Association between retinal vessel density and postoperative time after primary repair of rhegmatogenous retinal detachment. Plos one 2021; 16 (10), e0258126 https://doi.org/10.1371/journal.pone.0258126
42. Resch M, Seres A, Maneschg O, Pregun T, Papp A, Szabó A, Németh J. A nehéz szilikonolaj a retinaleválás sebészetében. Szemészet 2010; 147: 155–161.
43. Resch M, Barcsay Gy, Szabó A, Papp A. A retinaleválás korszerű ellátása. Mária utcai füzetek 2015; 1: 3–27.
44. Sadaka A, Sisk RA, Osher JM, Toygar O, Duncan MK, Riemann CD. Intravitreal methotrexate infusion for proliferative vitreoretinopathy. Clinical ophthalmology 2016; 10: 1811–7. https://doi.org/10.2147/OPTH.S111893
45. Sadaka A, Giuliari GP. Proliferative vitreoretinopathy: current and emerging treatments. Clin Ophthalmol 2012; 6: 1325–1333. https://doi.org/10.2147/OPTH.S27896
46. Sato T, Emi K, Bando H, Ikeda T. Retrospective comparison of 25-gauge vitrectomy for repair of proliferative vitreoretinopathy with or without anterior proliferation. Graefes Arch Clin Exp Ophthalmol Albrecht Von Graefes Arch Klin Exp Ophthalmol 2014; 252(12): 1895–1902. https://doi.org/10.1007/s00417-014-2846-5
47. Soós J, Resch MD, Berkó S, Kovács A, Katona G, Facskó A, Csányi E, Budai-Szűcs M. Comparison of hydrophilic ophthalmic media on silicone oil emulsification. PLoS One 2020 Jun 19; 15(6): e0235067. https://doi.org/10.1371/journal.pone.0235067
48. The classification of retinal detachment with proliferative vitreoretinopathy. Ophthalmology 1983; 90(2): 121–125. https://doi.org/10.1016/s0161-6420(83)34588-7
49. Tousi A, Hasanpour H, Soheilian M. Intravitreal Injection of Bevacizumab in Primary Vitrectomy to Decrease the Rate of Retinal Redetachment: A Randomized Pilot Study. J Ophthalmic Vis Res 2016; 11(3): 271–276. https://doi.org/10.4103/2008-322X.188390 [PubMed: 27621784]
50. Tseng JJ, Barile GR, Schiff WM, Akar Y, Vidne-Hay O, Chang S. Influence of relaxing retinotomy on surgical outcomes in proliferative vitreoretinopathy. Am J Ophthalmol 2005; 140(4): 628–636. https://doi.org/10.1016/j.ajo.2005.04.021
51. Wickham L, Bunce C, Wong D, McGurn D, Charteris DG. Randomized controlled trial of combined 5-Fluorouracil and low-molecular-weight heparin in the management of unselected rhegmatogenous retinal detachments undergoing primary vitrectomy. Ophthalmology 2007; 114(4): 698–704. https://doi.org/10.1016/j.ophtha.2006.08.042
52. Yannuzzi NA, Callaway NF, Sridhar J, Smiddy WE. Internal limitingmembrane peelingduring pars plana vitrectomy for rhegmatogenous retinal detachment: cost analysis, reviewof the literature, and meta-analysis. Retina 2018; 38: 2081–2087. https://doi.org/10.1097/IAE.0000000000002248
