Immunofluorescence testing in cicatrizing conjunctivitis
doi: 10.55342/szemhungarica.2022.159.1.24
Original scientific paper
Summary
Objectives: The aim of the research is to assess the results of immunofluorescence tests carried out in the group of patients with cicatrizing conjunctivitis. Materials and methods: Immunofluorescence test results of 23 patients with cicatrizing conjunctivitis were reviewed retrospectively. In all cases, patients underwent direct immunofluorescence testing from a conjunctival sample. Indirect immunofluorescence tests were performed in 11 cases, and salt-split-skin test was done in one case. Results: The DIF test was performed 30 times in 23 patients and tested positive 16 times (53.3%). In 13 cases, mucous membrane pemphigoid was confirmed (OcMMP). In 4 cases, another oculodermal disease was diagnosed (pemphigus vulgaris, paraneoplastic pemphigoid, bullous pemphigoid, linear IgA disease). In 14 cases, no pathological difference was confirmed in the sample. In OcMMP patients, linear IgG deposition occurred most frequently (100%) in DIF tests. The IIF test was carried out in 11 cases and tested positive in 4 cases (36.4%). Conclusion: However, the low sensitivity and specificity of DIF does not enable us either the diagnosis or the exclusion of OcMMP based on a sole DIF test, but it brings the diagnosis and the right therapy up. Therefore, it is highly recommended to perform DIF in chronic conjunctivitis prior a commencing therapy. As an additional diagnostic test, the IIF test should also be performed.
Összefoglaló
Célkitűzés: Krónikus, hegesedő kötőhártya-gyulladás miatt gondozott betegcsoportban elvégzett immunfluoreszcens vizsgálatok eredményének felmérése. Betegek és módszerek: 23 krónikus, hegesedő kötőhártya-gyulladással jelentkező beteg immunfluoreszcens vizsgálatának eredménye került áttekintésre retrospektív módon. A betegeknél minden esetben direkt immunfluoreszcens vizsgálat (DIF) történt kötőhártyamintából. 11 esetben indirekt immunfluoreszcens vizsgálat, egy esetben pedig salt-split-skin vizsgálat is történt. Eredmények: A 23 betegen 30 alkalommal elvégzett DIF-tesztből 16 volt pozitív (53,3%). Ebből 13 esetben nyálkahártya pemphigoid (OcMMP) igazolódott, 4 esetben egyéb oculodermalis kórkép (pemphigus vulgaris, paraneoplasiás-pemphigoid, bullosus pemphigoid és lineáris IgA-betegség). 14 esetben a mintában kórjelző eltérés nem igazolódott. Az OcMMP-s betegek DIF-vizsgálata során lineáris IgG-lerakódás fordult elő a leggyakrabban (100%). Az IIF-teszt 11 esetben került elvégzésre és 4 esetben lett pozitív (36,4%). Megbeszélés: A DIF alacsony szenzitivitása és specificitása nem teszi lehetővé, hogy csupán DIF-teszt alapján megállapítsuk vagy kizárjuk az OcMMP-t, ugyanakkor közelebb visz a diagnózishoz és a megfelelő terápia kiválasztásához, ezért krónikus, hegesedéssel járó kötőhártya-gyulladásban mindenképp ajánlott a DIF elvégzése a terápia beállítása előtt. Kiegészítő diagnosztikus vizsgálatként az IIF-vizsgálatot is érdemes elvégezni.Keywords
ocular mucous membrane pemphigoid, blistering autoimmune disease, cicatrizing conjunctivitis, immunofluorescence, serology
Kulcsszavak
ocularis mucosus membrán-pemphigoid, hólyagképződéssel járó autoimmun betegség, hegesedéssel járó kötőhártya-gyulladás, immunfluoreszcencia, szerológia
Bevezetés
Az ocularis mucosus membrán pemphigoid (OcMMP) autoimmun betegség, amely a hegesedéssel járó kötőhártya-gyulladások közé tartozik. Az OcMMP a mucosus membrán pemphigoid (MMP) csoport tagja. Az MMP-n belül különböző altípusokat különítünk el a nyálkahártya-érintettség alapján. Érintheti az orális mucosát, az ocularis mucosát, a laryngealis mucosát, az oesophagealis mucosát, a trachealis mucosát, illetve a genitális és urogenitális mucosát. Előfordulhat monosite (egy terület), illetve multisite (több terület) érintettség is (16).
Az OcMMP incidenciája körülbelül 0,7-0,8/millió lakos/év (16). Az átlagéletkor a diagnózisakor 60,4–68,2 év. Az átlagos idő az első tünetektől a diagnózis megszületéséig 225 nap és 6,4 év között változik (16).
A fő antigének, amelyek kiváltják az immunválaszt a bazális membrán zónában találhatóak: a6-integrin, ß4-integrin, laminin 332, VII-es kollagén, BP180, BP230 (16). Az OcMMP immunpatológiai előrehaladása három elkülöníthető fázisból áll:
- a sérülés fázisa,
- az akut gyulladás és
- sejtosztódás fázisa, illetve a fibrózis fázisa (10).
Klinikailag gyakran nem specifikus krónikus kötőhártya-gyulladással kezdődik. Előrehaladott stádiumban már nem a gyulladásos tünetek dominálnak, hanem a kötőhártya hegesedése és ennek a következményei: entrópium, canthus elsimulása, fornixrövidülés, symblepharon, ankyloblepharon, trichiasis, következményes látásromlással és akár vaksággal (16).
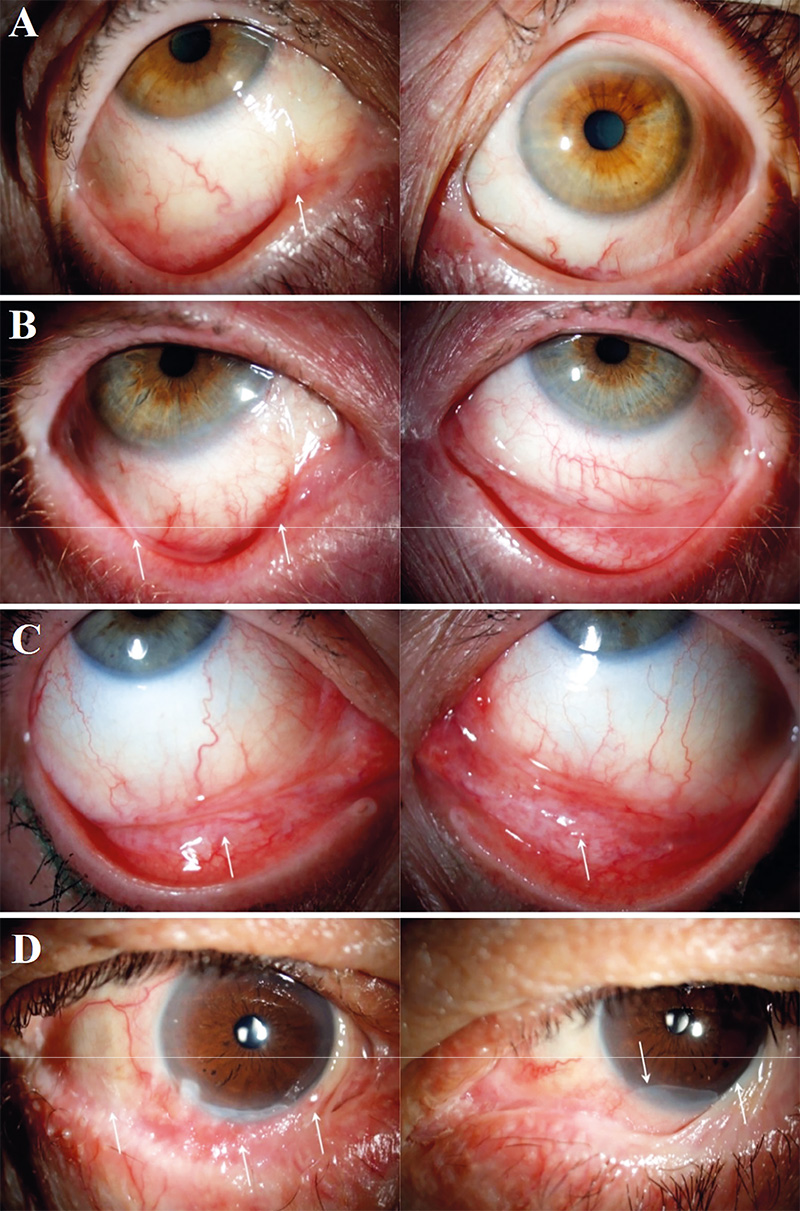
A diagnosztika a mai napig nem könnyű feladat. Klinikailag sok hasonló oculodermalis kórkép létezik (lineáris IgA-szindróma, pemphigus vulgaris, paraneoplasiás pemphigoid stb.) (1. ábra), és a mindennapi gyakorlatban elérhető diagnosztikai vizsgálatok szenzitivitása nem elég magas. A diagnosztikus késedelem miatt késve kapják meg a betegek a megfelelő terápiát, emiatt súlyosabb stádiumban kerülhetnek előszöri ellátásra (7). A pontosabb és gyorsabb diagnózisalkotáshoz hozzájárul az alapos anamnézisfelvétel, klinikai vizsgálat, szerológia, immunfluoreszcens vizsgálatok elvégzése, esetleg ABC immunhisztokémiai analízis és autoantitest-detektálás (17, 1). A direkt immunfluoreszcencia-vizsgálat (DIF) napjainkban az elsőként ajánlott kiegészítő diagnosztikai teszt (17). Ugyanakkor alacsony specificitása és szenzitivitása nem teszi lehetővé, hogy csupán DIF-teszt alapján megállapítsuk vagy kizárjuk az OcMMP-t (12). Az indirekt immunfluoreszcens vizsgálat ritkábban pozitív, mint a DIF-vizsgálat, ugyanakkor pozitivitás esetén felállítható a diagnózis, ezért kiegészítő vizsgálatként érdemes elvégezni (5, 17).
Célkitűzés
Jelen kutatás célja az intézetünkben hegesedő kötőhártya-gyulladás miatt gondozott betegcsoportokban elvégzett immunfluoreszcens diagnosztikai vizsgálatok eredményeinek felmérése.
Anyagok és módszerek
A Semmelweis Egyetem Szemészeti Klinikájának beteganyagából 23 beteg adatait vizsgáltuk 2008 márciusától napjainkig retrospektív módon, azonos feltételek szerint, akik diagnosztikus célból nyálkahártya-biopszián (kötőhártya alsó áthajlás, szájnyálkahártya) estek át hegesedő kötőhártya-gyulladás miatt.
Rögzítettük a nemek és az életkor megoszlását a biopszia idejében, valamint a betegség által érintett extraocularis nyálkahártya és bőr érintettségét. Összegyűjtöttük a direkt immunfluoreszcens vizsgálatok, az indirekt immunfluoreszcens vizsgálatok és amennyiben SSST is készült, annak eredményeit. Az adatok gyűjtésére az e-MedSolution rendszert használtuk. A réslámpás képeket a Szemészeti Klinika készítette és szolgáltatta. A DIF-tesztek a Bőr-, Nemikórtani és Bőronkológiai Klinika Immunfluoreszcencia laboratóriumában kerültek kiértékelésre. Az indirekt immunfluoreszcens vizsgálatok majomnyelőcső-szöveten készültek és szintén Bőr-, Nemikórtani és Bőronkológiai Klinika Immunfluoreszcencia laboratóriuma értékelte ki őket.
Biopsziafeldolgozás és analízis
Direkt immunfluoreszcens vizsgálat
A mintavételt a betegek előzetes tájékoztatása után, a beleegyező nyilatkozat aláírását követően végeztük, a Helsinki Deklarációnak megfelelően. Felszíni érzéstelenítés (Novesine 0,4%-os szemcsepp, Oxibuprocain, Novartis) és subconjunctivális lidocain (20 mg/ml, EGIS) injekció után minden esetben az alsó áthajlás hegmentes részéből történt a kötőhártya-mintavétel.
A mintát a feldolgozásig PBS (pH=7,4) transzportfolyadékban tároltuk 4 °C-on, maximum 24-48 óráig. Az immunológiai laboratóriumban a mintákat –20 °C-on kriogélbe (crymatrix) ágyaztuk. Feldolgozáskor az előkészített mintát 3 oldalról körbevágták és leválasztották a tárgylemezről, alumíniumlapra ragasztották, rögzítették a crytome-ban, majd 8 db, 2-10 mikrométer vastag szeletet vágtak –20 °C-on. Két-két metszet került egy tárgylemezre. Szárítás és jelölés után FITC-vel konjugált, nyúlban termelt humán IgA, IgG, IgM, C3 (kötőhártyaminta esetén IgG4 is) ellenes antitestekkel inkubálták 30 percig, sötétben, szobahőmérsékleten. PBS-es mosás után 1:1 arányú glicerines PBS-t cseppentettek a metszetre, majd ráhelyezték a fedőlemezt. Ezután mikroszkóp alatt kiértékelték a mintákat.
Indirekt immunfluoreszcens vizsgálat
A betegtől vett 2-5 ml teljes vérminta centrifugálása után a savót használták fel a vizsgálathoz, hogy azonosítsák a keringő antitesteket. Antigén-szubsztrátnak majomoesophagust használtak. Első lépésben a szubsztrátokat elárasztották 30 mikroliter 0,1-es és 0,01-os hígítású savóval, majd 30 percig inkubálták párakamrában szobahőmérsékleten, majd kétszer 10 percig leöblítették PBS-sel (TWEEN20). Ezt követően a mintát 30 percig, sötétben, szobahőmérsékleten inkubálták 30 mikroliter FITC-hez kötött másodlagos antitesttel (IgG). Ezután a szöveteket még kétszer lemosták 10 percig PBS-sel (TWEEN20), végül glicerines fedőréteg és fedőlemez került a mintákra, és mikroszkóp alatt kiértékelésre kerültek.
Salt-split skin technika
A vizsgálathoz majombőr-mintát használtunk, egy éjszakára 1M NaCl-oldatba áztattuk. A direkt immunfluoreszcens vizsgálat során a mintákat humán IgA-, IgG-, IgM-immunglobulin és C3-komplement elleni savóval reagáltattuk, amely antitestek FITC-hez voltak konjugálva.
A minta negatív amennyiben nem látunk festődést egyetlen antiszérum esetén sem, pozitív, amennyiben festődést látunk bármelyik antiszérum hozzáadása után. Előfordulhat lineáris festődés a BMZ-ben, intercelluláris festődés, „shaggy” festődés, szemcsés festődés, vaszkuláris festődés és egyéb. A festődésmintázat és a -lerakódás segít a diagnózis felállításában.
Eredmények
Kutatási populáció
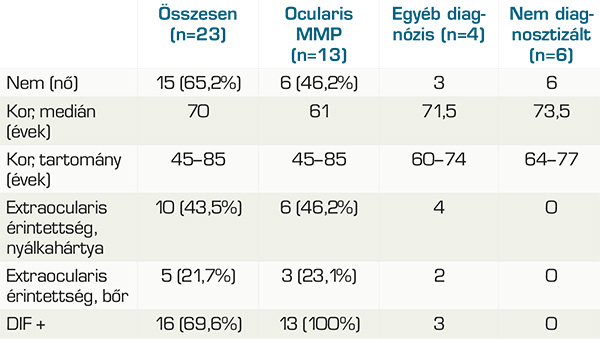
A 23 fős csoportból 15 nő volt (65,2%) és 8 férfi (34,8%). Az OcMMP-csoportban 6 nő volt (46,2%) és 7 férfi (53,8%). Azok között, akik esetében más diagnózis derült ki, 3 nő és 1 férfi volt. Az egyelőre diagnózis nélküli csoport tagjai (6 eset) mind nők.
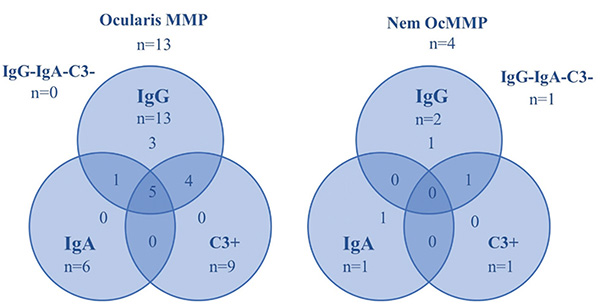
A medián életkor a mintavétel idejében 70 év volt (min. 45, max. 85), Az OcMMP-sek körében 61 év (min. 45, max. 85), az egyéb diagnózisú betegek között 71,5 év (min. 60, max. 74) és a nem diagnosztizáltak esetében 73,5 év (min. 64, max. 77). 13 páciens DIF-pozitivitással igazolt OcMMP-s (56,5%), 1 páciens pemphigus vulgarisos (4,3%), 1 páciens paranaoplasias pemphigoidos (4,3%), 1 páciens lineáris IgA-dermatosisos (4,3%), 6 beteg továbbra is diagnózisra vár (26,1%). Az ocularis MMP-populációból 5 betegnek volt szájnyálkahártya-érintettsége (38,5%), 2-nek orrnyálkahártya-érintettsége (15,4%), 1-1-1-1 betegnek, garat-, íny-, bél-, gége érintettsége (7,7-7,7-7,7-7,7%) és 3-nak bőr érintettsége (23,1%). A nem OcMMP diagnózisúak közül 4-nek volt szájnyálkahártya-érintettsége, 1-1-1-nek orrnyálkahártya-, íny- és hereérintettsége és 2-2-nek garat- és bőrérintettsége.
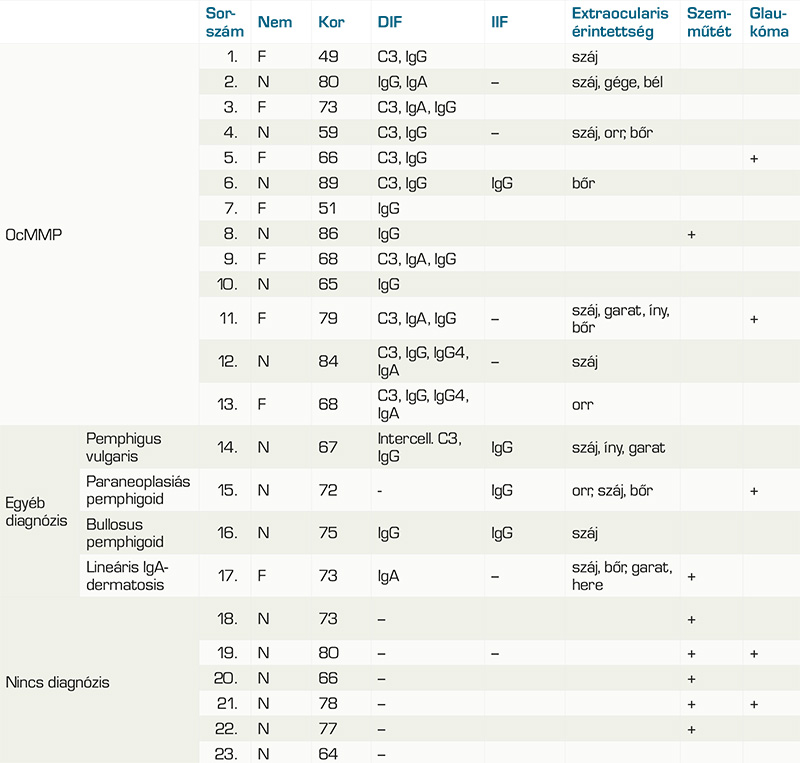
Akik esetében még nem született diagnózis semmilyen extraocularis érintettséggel nem rendelkeznek (1. táblázat és 2. táblázat). 22 betegnek volt kétoldali szemérintettsége (95,7%) és egynek féloldali (4,3%).
Direkt immunfluoreszcencia- eredmények
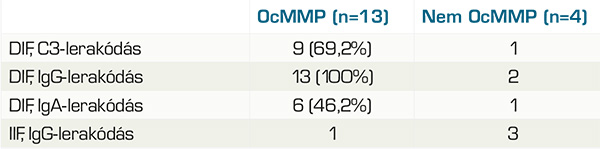
Minden betegnél készült direkt immunfluoreszcens vizsgálat, de 4 esetben ismételt vizsgálatra is szükség volt, 2 esetben kötőhártyából, 1 esetben szájnyálkahártyából, 1 esetben bőrből történt az ismételt mintavétel. A DIF-teszt összesen 30-szor került elvégzésre és 16-szor lett pozitív (53,3%). Ezek során a C3, IgG, IgA és IgM jelenlétét vizsgálták, egyes minták esetében az IgG4-et is.
Az OcMMP-s betegek tesztjei közül a bazális membrán zónában 13 esetben volt látható lineáris IgG-lerakódás (100%), 9 esetben volt lineáris C3-komplement-lerakódás (69,2%), 6 esetben volt lineáris IgA-lerakódás (46,2%) és 2 esetben volt lineáris IgG4-lerakódás (2. ábra).
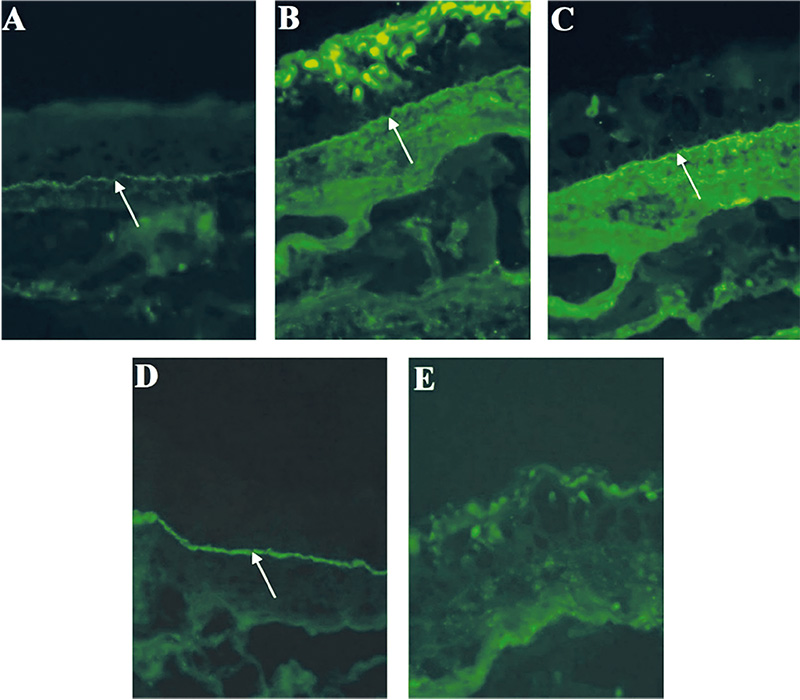
A 4 egyéb diagnózist kapott beteg DIF-vizsgálata is mutatott eltéréseket. A pemphigus vulgarisos beteg DIF-tesztjén tipikus intercelluláris IgG- és C3-lerakódás figyelhető meg. A paraneoplasiás pemphigoidos beteg tesztjén lineáris IgG-lerakódás volt észlelhető a bazális membrán mentén (3. ábra). A bullosus pemphigoidos beteg tesztjén lineáris IgG-lerakódás volt a bazális membrán zónában. Az IgA-dermatosissal rendelkező beteg tesztjén pedig lineáris IgA-lerakódás detektálható szintén a bazális membrán mentén (4. ábra, 1. táblázat, 3. táblázat).
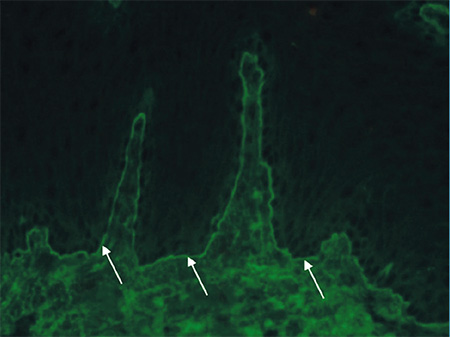
Indirekt immunfluoreszcencia-eredmények
Az IIF-teszt 11 esetben került elvégzésre és 4 esetben lett pozitív (36,4%), 1 esetben OcMMP-s betegnél, 3 esetben nem OcMMP-s betegnél. A 11 teszt 10 beteghez tartozik (1. táblázat és 3. táblázat).
Salt-split skin teszt eredménye
Salt-split skin tesztet 1 esetben végeztünk, a paraneoplasiás pemphigoidos beteg esetén. Lineáris epidermalis festődés figyelhető meg rajta (5. ábra).

Megbeszélés, következtetések
Az OcMMP egy látást veszélyeztető autoimmun betegség, amely hosszú távú szisztémás gyulladáscsökkentő terápiát igényel a progresszió mérséklése céljából. A betegség általában progresszív hegesedő kötőhártya-gyulladásként jelentkezik, és a differenciáldiagnózisa kihívást jelent a szemészek számára. Kötőhártya-biopszia szükséges (annak eredménytelensége esetén szájnyálkahártya-, esetleg bőrmintavétel) a diagnózis felállításához, továbbá a megfelelő terápia kiválasztásához. A szisztémás terápia számos mellékhatást okozhat, főleg idősebb korosztályban, ezért is ideális a biopszia által bizonyított diagnózis, amely megalapozottabb kezelést tesz lehetővé.
A vizsgálati csoportunkban a férfiak gyakrabban érintettek az OcMMP-ben (53,8%). Radford és munkatársai kutatásában szintén férfi többség volt (58%) (14). Az autoimmun betegségekben viszont általában női túlsúly figyelhető meg (13).
Ez a betegség többnyire az idősebb korosztályt érinti (14, 16), ebben a kutatásban a medián életkor az OcMMP-diagnózis felállításának idején 61 év volt, az életkori megoszlás pedig 45 és 85 év között változott.
Három csoportra osztottuk a 23 fős betegpopulációt a DIF-vizsgálat eredménye alapján: OcMMP-s betegek; nem OcMMP-s, egyéb oculodermalis kórképben szenvedő betegek; és a vizsgálat idejében definitív diagnózissal nem rendelkező betegek. Ez utóbbi csoportban továbbra is törekszünk diagnózisalkotásra. A felosztásunk oka az, hogy az OcMMP messze a leggyakoribb szemészeti érintettséggel járó kórkép az összes oculodermalis kórkép közül és önmagában is gyakoribb az előfordulása a többi kórképhez képest. Egy beteg mindaddig progresszívnak tekintendő, amíg az ellenkezőjét nem tudtuk igazolni. DIF-negativitás esetén ismételjük a mintavételt kötőhártyából. További negativitás esetén ismételjük szájnyálkahártyából. Ha ez sem vezet eredményre, elvégezzük az IIF- és SSST-vizsgálatokat (17).
Ebből a betegcsoportból, 23 esetből 13 betegnél lett OcMMP a végső diagnózis (56,5%), tehát a hegesedő kötőhártya-gyulladásért nagy százalékban az OcMMP tehető felelőssé.
A direkt immunfluoreszcencia-vizsgálat napjainkban az elsőként ajánlott kiegészítő diagnosztikai teszt (17). Ennek megfelelően a mi betegpopulációnkban is minden esetben elvégeztük. Összesen 30 DIF-teszt készült, amelyből 16 lett pozitív (53,3%). A DIF alacsony szenzitivitása és specificitása (12) nem teszi lehetővé, hogy csupán DIF-teszt alapján megállapítsuk vagy kizárjuk az OcMMP-t, ugyanakkor közelebb visz a diagnózishoz és a megfelelő terápia kiválasztásához, ezért krónikus kötőhártya-gyulladásban mindenképp ajánlott a DIF elvégzése a terápia beállítása előtt.
Ez a kutatás az OcMMP-s betegek körében azt találta, hogy az IgG-lerakódás fordult elő leggyakrabban (100%), majd következett a C3 (69,2%), végül pedig az IgA (46,2%). C3 komplement- és IgA-antitest-lerakódás nem fordult elő önmagában, csak IgG-antitesttel együtt, vagy mindhárom együttesen. IgG, C3-komplementtel együtt gyakrabban volt jelen, mint IgG-, IgA-antitesttel.
Frith és munkatársai lineáris IgG-, IgA-, IgM- vagy C3-lerakódást az esetek 46%-ában regisztráltak (9). Bernauer és munkatársai lineáris C3- vagy immunoglobulin-lerakódást az OcMMP-s betegek 50%-ában találtak. Továbbá azt figyelték meg, hogy IgA-lerakódás fordul elő a leggyakrabban (91%), majd a C3 (54%), végül az IgG (45%) (3). Chan és munkatársai szintén magasabb arányú IgA-lerakódást figyeltek meg, és kisebb arányú IgG-, C3-lerakódást (6). Mehra és munkatársai az IgG-lerakódást figyelték meg leggyakrabban (47,1%), ezután az IgA (25,5%), majd a C3-lerakódást (14,7%) (12).
A mintavétel helye (lézionális, nem lézionális) szintén befolyásolja a DIF-teszt pozitivitását, Mehra és munkatársai magasabb szenzitivitásúnak és specificitásúnak találták azokat a mintákat, amelyeket nem lézionális területről nyertek, és még magasabb értékeket kaptak nem lézionális bőrmintákra (12). Schmidt és munkatársai azt javasolják, hogy amennyiben lehetséges a biopsziát ne gyulladt kötőhártyából vegyük, mivel ez csökkenti a szenzitivitást (17). Dart és munkatársai azt találták, hogy a nem lézionális bőr hasonló eredményekkel szolgál, mint a nem gyulladt kötőhártya, továbbá a buccaból nyert minta pozitív lehet, amikor a kötőhártyaminta negatív (7).
Saját beteganyagunkban a 13 OcMMP-s betegből 11-nek elsőre pozitív lett a DIF-tesztje, 1 betegnek másodjára lett pozitív, 1 betegnek pedig csak negyedik alkalommal. Több egyidejű mintavétel, illetve a mintavétel ismétlése növelheti a diagnózis felállításának valószínűségét (18).
Az összes elkészített DIF-teszt közül, 6-ot nem lehetett megfelelően értékelni, mivel 3 esetben lízis volt megfigyelhető, 1 esetben nem tartalmazott hámot a minta, 2 esetben pedig túl kicsi volt a minta. Ebből 4 esetben rebiopszia történt, 2 esetben új mintavétel még nem történt, de a továbbiakban tervezett.
Egyes centrumok között különbségek figyelhetőek meg a DIF-teszt diagnosztikus relevanciája között, amely gyakran a mintavétel sebészi technikájának és a minta kezelésének különbségére vezethető vissza. A kötőhártya-epithelium egy nagyon finom szövet, könnyen roncsolható és leválasztható az alatta fekvő strómáról, értékelhetetlenné téve a mintát (1). Emellett a betegség természete szerint a bazális membrán széttöredezés miatt eleve hiányozhat a mintából (8). A minta tárolása hűtőben, 4 °C-on maximum 48 óráig lehetséges, mivel hosszabb idő alatt a sejtpusztulás mértéke olyan nagy, hogy az analízishez nem marad elegendő élő sejt. A minta analízise több okból lehet sikertelen. Lehetséges okok a nem megfelelő méretű vagy minőségű minta (elegendő epithelium és BMZ kell, hogy jelen legyen), a minta eltérő kezelése (gyorsfagyasztás, Michel-transzport médium, sós gézlapokra helyezés, majd késleltetett fagyasztás), továbbá nem megfelelő antitestek alkalmazása. A technika reprodukálhatósága elengedhetetlen a megbízható diagnózisalkotáshoz. A patológiai laboratórium szintén kulcsszerepet játszik a kötőhártya-biopszia feldolgozásában. A patológusoknak jártasnak kell lenniük ezeknek az apró és sérülékeny mintáknak a kezelésében, hogy megőrizzék az anatómiai integritást a megfelelő elemzéshez (1).
Anesi és munkatársai javasolják az avidin-biotin-komplex immunoperoxidáz (ABC) immunhisztokémiai analízis elvégzését, amely növeli a szenzitivitást diagnózisalkotás során, amikor a DIF-biopszia negatív vagy nem egyértelmű (1).
Az SSST szintén akkor használatos, ha bizonytalanság van, tovább növeli a diagnózishoz jutás esélyét. SSST során ép emberi bőrt, vagy majombőrt használunk, ellenben az IIF-teszthez majomoesophagust használunk szubsztrátként. Ez magyarázhatja a SSST szignifikánsan magasabb pozitivitását OcMMP-s pácienseknél, IIF-fel szemben (17).
Indirekt immunfluoreszcens vizsgálat 11 alkalommal készült és 4 esetben lett pozitív. Ebből 1 alkalommal OcMMP-s beteg szérumából, 3 alkalommal pedig más betegséggel diagnosztizált betegek szérumából (pemphigus vulgaris, bullosus pemphigoid, paraneoplasiás pemphigoid). Arbache és munkatársai az IIF-vizsgálat eredményeit kutatták és azt találták, hogy fontos diagnosztikus eszköz az autoimmun betegségek diagnosztizálásához. Pemphigusos betegeknél nagyobb arányban mutat pozitivitást, mint pemphigoidos betegeknél (2). Kiegészítő diagnosztikus vizsgálatként érdemes elvégezni.
A nem OcMMP-s betegcsoportban, arányaiban gyakrabban fordult elő bőr- és egyéb nyálkahártya-érintettség. Pemphigus vulgarisban a bőrérintettség hólyagokban vagy erythemás területekben nyilvánul meg, különösen a fejbőrön, arcon, hónaljban, törzsön és az ágyékon. OcMMP-ben a bőrléziók ritkák és a nyálkahártya-manifesztációk után jelennek meg, továbbá gyakrabban érintik a fejet, nyakat és a felsőtestet (15). A szájüreg, különösen a buccalis nyálkahártya, lágyszájpad és ajkak érintettek elsőként a pemphigus vulgarisos betegek 50-80%-ában, és az MMP-s betegek 90%-ában (4). Abban a csoportban, akiknél nem született diagnózis, egyáltalán nem fordult elő extraocularis érintettség. Monosite OcMMP-ben (csak a szemet érintő MMP) a negatív DIF-eredmények régóta problémát jelentenek (7).
Figyelemre méltó, hogy az OcMMP-s páciensek 7,7%-ának anamnézisében szerepel szemészeti műtét, illetve 15,4%-ban szerepel glaukóma. A betegcsoportunkban az egyik beteg anamnézisében szemészeti műtét mellett maródásos sérülés (hipós víz is fröccsent a szemébe) is szerepel. Ezek a betegség triggerelésében lehetnek fontosak. Felmerül ugyanis egy olyan mechanizmus, ahol a kötőhártya sérülése következtében, bazális membránepitópok szabadulnak fel, amelyek aztán neoantigénekként viselkednek, és autoimmun folyamatot indítanak be, MMP-t eredményezve (7). A szemműtétek direkt traumával járnak, a glaukómás betegeknél a tartósítószert tartalmazó készítmények állandó használata szintén károsíthatja a BMZ-t, illetve nehezítheti a differenciáldiagnózist (7). A kezelésben használatos lokális és szisztémás szteroid is mellékhatásként szekunder glaukómát okoz arra hajlamos betegekben (11).
Ennek a kutatásnak a korlátai, hogy retrospektív és alacsony a betegszám. Ennek ellenére, ha figyelembe vesszük az OcMMP alacsony incidenciáját, és Magyarország alacsony népesség számát, relatíve nem kevés betegről van szó.
Nyilatkozat
A szerzők kijelentik, hogy eredeti közleményük megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Anesi SD, Eggenschwiler L, Ferrara M, Artornsombudh P, Walsh M, Foster CS. Reliability of Conjunctival Biopsy for Diagnosis of Ocular Mucous Membrane Pemphigoid: Redetermination of the Standard for Diagnosis and Outcomes of Previously Biopsy-Negative Patients. Ocul Immunol Inflamm 2021; 29(6): 1106–1113.
https://doi.org/10.1080/09273948.2020.1716988
2. Arbache ST, Nogueira TG, Delgado L, Miyamoto D, Aoki V. Immunofluorescence testing in the diagnosis of autoimmune blistering diseases: overview of 10-year experience. An Bras Dermatol 2014; 89(6): 885–889.
https://doi.org/10.1590/abd1806-4841.20143221
3. Bernauer W, Elder MJ, Leonard JN, Wright P, Dart JK. The value of biopsies in the evaluation of chronic progressive conjunctival cicatrisation. Graefes Arch Clin Exp Ophthalmol 1994; 232(9): 533–537.
https://doi.org/10.1007/BF00181996
4. Buonavoglia A, Leone P, Dammacco R, et al. Pemphigus and mucous membrane pemphigoid: An update from diagnosis to therapy. Autoimmun Rev 2019; 18(4): 349–358. https://doi.org/10.1016/j.autrev.2019.02.005
5. Chan LS, Ahmed AR, Anhalt GJ, et al. The first international consensus on mucous membrane pemphigoid: definition, diagnostic criteria, pathogenic factors, medical treatment, and prognostic indicators. Arch Dermatol 2002; 138: 370–379.
https://doi.org/10.1001/archderm.138.3.370
6. Chan LS, Yancey KB, Hammerberg C, et al. Immune-mediated subepithelial blistering diseases of mucous membranes. Pure ocular cicatricial pemphigoid is a unique clinical and immunopathological entity distinct from bullous pemphigoid and other subsets identified by antigenic specificity of autoantibodies. Arch Dermatol 1993; 129(4): 448–455. https://doi.org/10.1001/archderm.129.4.448
7. Dart JK. The 2016 Bowman Lecture Conjunctival curses: scarring conjunctivitis 30 years on. Eye (Lond) 2017; 31(2): 301–332. https://doi.org/10.1038/eye.2016.284
8. Fodor E, Nagy ZZs. Az ocularis mucosus membrán pemphigoid legújabb vonatkozásai. Összefoglaló közlemény. Szemészet 2018; 155(1): 35–45.
9. Frith PA, Venning VA, Wojnarowska F, Millard PR, Bron AJ. Conjunctival involvement in cicatricial and bullous pemphigoid: a clinical and immunopathological study. Br J Ophthalmol 1989; 73(1): 52–56. https://doi.org/10.1136/bjo.73.1.52
10. Georgoudis P, Sabatino F, Szentmary N, et al. Ocular Mucous Membrane Pemphigoid: Current State of Pathophysiology, Diagnostics and Treatment. Ophthalmol Ther 2019; 8(1): 5–17.doi: https://10.1007/s40123-019-0164-z
11. Kersey JP, Broadway DC. Corticosteroid-induced glaucoma: a review of the literature. Eye (Lond) 2006; 20(4): 407–416. https://doi.org/10.1038/sj.eye.6701895
12. Mehra T, Guenova E, Dechent F, et al. Diagnostic relevance of direct immunofluorescence in ocular mucous membrane pemphigoid. J Dtsch Dermatol Ges 2015; 13(12): 1268–1274. https://doi.org/10.1111/ddg.12716
13. Ngo ST, Steyn FJ, McCombe PA. Gender differences in autoimmune disease. Front Neuroendocrinol 2014; 35(3): 347–369. https://doi.org/10.1016/j.yfrne.2014.04.004
14. Radford CF, Rauz S, Williams GP, Saw VP, Dart JK. Incidence, presenting features, and diagnosis of cicatrising conjunctivitis in the United Kingdom. Eye (Lond) 2012; 26(9): 1199–1208. https://doi.org/10.1038/eye.2012.119
15. Ramos-e-Silva M, Ferreira A, Jacques CD. Oral involvement in autoimmune bullous diseases. Clin Dermatol 2011; 29(4): 443–454.
https://doi.org/10.1016/j.clindermatol.2011.01.015
16. Rashid H, Lamberts A, Borradori L, et al. European guidelines (S3) on diagnosis and management of mucous membrane pemphigoid, initiated by the European Academy of Dermatology and Venereology – Part I. J Eur Acad Dermatol Venereol 2021; 35(9): 1750–1764. https://doi.org/10.1111/jdv.17397
17. Schmidt E, Rashid H, Marzano AV, et al. European Guidelines (S3) on diagnosis and management of mucous membrane pemphigoid, initiated by the European Academy of Dermatology and Venereology –Part II. J Eur Acad Dermatol Venereol 2021; 35(10): 1926–1948. https://doi.org/10.1111/jdv.17395
18. Shimanovich I, Nitz JM, Zillikens D. Multiple and repeated sampling increases the sensitivity of direct immunofluorescence testing for the diagnosis of mucous membrane pemphigoid. J Am Acad Dermatol 2017; 77: 700–705.e3.
https://doi.org/10.1016/j.jaad.2017.05.016
