Electrochemotherapy: present opportunities and future perspectives
doi: 10.55342/szemhungarica.2022.159.1.2
Original scientific paper
Summary
Continuous and dynamic expansion of oncotherapeutic options has resulted in a more efficacious local tumor control and improved patient’s life expectancies in many cases. Short term electric impulses applied during electrochemotherapy increase the permeability of cell membrane in a transient and reversible manner. The method therefore facilitates the entry of chemotherapeutic agents from the interstitium to the tumor cell in a high concentration resulting in a localized and maximized cell killer effect in the tumor tissue. The technology was developed originally for the treatment of superficial tumors, but it was applied recently for deep seated neoplasms. Optimalization of the method was also started for the treatment of intraocular tumors on an experimental level. Based on own results and outcomes of the literature authors review new therapeutic methods whether recently introduced in clinical practice or waiting for utilization based on their promising preclinical features.
Összefoglaló
Az onkoterápiás lehetőségek folyamatos és ugrásszerű bővülése számos daganattípus esetében teszi hatékonyabbá a lokális tumorkontrollt, és gyakran alapvetően változtatja meg a beteg életkilátásait. Az új innovatív technológiák között élenjáró elektrokemoterápia során alkalmazott rövid idejű elektromos impulzusok tranziensen és reverzibilisen permeabilizálják a sejtmembránt. Az eljárás ezáltal lehetővé teszi az intersticiálisan magas koncentrációban jelen levő kemoterapeutikumnak közvetlenül a tumorsejtbe való bejutását, és így a sejtölő hatás tumorra történő lokalizálását és maximalizálását. Az eredetileg felszíni elváltozások kezelésére alkalmazott eljárás fejlesztése ma már lehetővé teszi a technológia alkalmazását mélyebben elhelyezkedő és nagyobb szövettömeggel fedett daganatok esetében is. Kísérleti szinten pedig megkezdődött a módszer intraokuláris tumorok kezelésére optimalizált változatának vizsgálata. Jelen összefoglaló közlemény részben saját, részben pedig irodalmi adatok alapján áttekinti a klinikai gyakorlatban rendelkezésre álló elektrokemoterápiás lehetőségeket és ismerteti a bevezetésre váró új, ígéretes fejlesztéseket.Keywords
electrochemotherapy, electroporation, bleomycin, basocellular carcinoma, eyelid
Kulcsszavak
elektrokemoterápia, elektroporáció, bleomycin, bazocelluláris karcinóma, szemhéj
Bevezetés
Az emberi test napfény-expozíciónak leginkább kitett bőrterülete a fej-nyak régió, emiatt az ultraibolya fény által indukált malignus bőrelváltozások, elsősorban a bazocelluláris karcinómák (basocellular carcinoma: BCC) az utóbbi 2-3 évtizedben exponenciálisan növekvő gyakorisággal alakulnak ki ebben a lokalizációban (11, 37). A BCC-k mellett a laphámrák és a melanoma malignum incidenciájának növekedése is megfigyelhető, amely folyamatok egyre súlyosabb egészségügyi kihívást jelentenek. A BCC-k 75%-a a fej-nyak régióban alakul ki, kb. 20%-uk a periokuláris területet involválja (31, 39). Ez utóbbi terület a tumor recidíva szempontjából magas kockázatú lokalizáció. A fej-nyak régió malignus daganatainak közel kétharmada már lokálisan előrehaladott állapotban kerül diagnosztizálásra, így az agresszív, sokszor multimodális kezelési protokollok ellenére a lokális kiújulás – laphámrákok és melanomák esetén a távoli disszemináció – magas kockázatával is számolni kell (23, 38). A periokuláris bőrterületen kialakuló malignomák relatív incidenciáját alapvetően meghatározza a populáció földrajzi elhelyezkedése, valamint a beteg rasszbeli hovatartozása. A kezelés sikerességét és tolerálhatóságát számos faktor determinálhatja. A tumor mérete, lokalizációja és hisztológiai típusa mellett fontos tényező a beteg kora, társbetegségei és az általános állapota is (21, 35). A kiterjedt vagy recidiváló periokuláris BCC-k megfelelő kezelése bonyolult feladat, mivel nemcsak onkológiai, de funkcionális és kozmetikai szempontokat is figyelembe kell venni a terápia tervezése során. A periokuláris bőrterület és a szemhéj kiemelkedő fontossággal bír a szemfelszín védelmében és így hozzájárul a szem funkciójának megőrzéséhez. A nem megfelelően tervezett, kivitelezett terápia a látás elvesztését eredményezheti, a kezelés következtében kialakuló torzító hegek pedig jelentős mértékben ronthatják a beteg életminőségét (30, 36). A kezelés „gold standardja” a megfelelő módon – amennyiben lehetőség van rá, a kimetszés határainak intraoperatív hisztológiai kontrolljával (Mohs sebészet) – kivitelezett sebészi eltávolítás (28). A periokuláris régióban a nagy kiterjedésű daganatok sebészi eltávolítása és a szövethiány pótlása gyakran jelentős műtéti tehertétellel jár, emellett az onkológiai-kozmetikai eredmény is kérdéses lehet ezekben az esetekben. Inoperábilis daganatok (pl. csontérintettség) elsődleges kezeléseként, inkompletten eltávolított malignomák adjuváns terápiájaként vagy perineurális inváziót mutató tumoroknál a megfelelő módon tervezett sugárterápia igen jó hatásfokkal alkalmazható. A lokálisan előrehaladott és/vagy inoperábilis vagy sebészi eltávolítás/irradiáció után recidiváló BCC-k esetében az ultraibolya sugárzás hatására reaktiválódó, és a daganat kialakulásában szerepet játszó „hedgehog” reakcióutat gátló per os vismodegib kezelés indítható el. A fenti terápiás lehetőségek ellenére a nagy kiterjedésű és/vagy recidiváló periokuláris bőr malignomák kezelése nagy kihívást jelent, így kiemelt jelentőséggel bírhat újabb terápiás modalitások megjelenése és a klinikai gyakorlatba történő bevezetése.
Az elektrokemoterápia (ECT) az utóbbi időben vált a klinikai gyakorlatban rendelkezésre álló onkoterápiás eszköztár részévé (4, 16, 24, 25, 26). Kezdetben elsősorban a szuperficiális bőr és lágyszövet-metasztázisok, valamint nem reszekálható elsődleges bőrtumorok kezelésével dokumentáltak kiváló eredményeket, de a folyamatos fejlesztésnek köszönhetően a kezelhető tumorok köre exponenciálisan szélesedik (pl. mélyen ülő visceralis tumorok) (5). Bár a fej-nyak régióban alkalmazott ECT hatékonyságát egyre több tanulmány igazolja, szemhéj lokalizációjú BCC kezelésével kapcsolatban mindössze néhány publikáció lelhető fel. Az eljárást munkacsoportunk a világon elsőként kezdte el rutinszerűen alkalmazni a periokuláris régióban diagnosztizált nagy kiterjedésű és/vagy recidiváló BCC-k esetében, az eddigi legnagyobb esetszámú vizsgálat eredményét 2019-ben publikáltuk (14).
Közleményünkben az ECT elméleti alapjait, onkológiai-szemészeti indikációjú alkalmazásának jelenlegi lehetőségeit és a jövőbeni fejlesztési irányokat foglaljuk össze a hozzáférhető irodalmi adatok és saját tapasztalataink alapján.
Az ECT alapjai: elektroporáció és kemoterápia
Az ECT biofizikai alapjainak megértéséhez elengedhetetlen ismerni a sejtmembrán szerkezetét és alapvető működését (1). A sejtmembrán mindössze 5 nm vastagságú, folyamatosan változó, transzportfolyamatok sokaságát bonyolító struktúra. Felelős a sejt integritásának megőrzéséért, a dinamikus intracelluláris homeosztázis fenntartásáért, biztosítva ezzel a sejt túlélését. A sejtmembrán alapja a folyékony kettős lipidréteg, amelyhez részben olyan fehérje komponensek kapcsolódnak, amelyek a kettős réteg alapstruktúrájának megbontása nélkül nem vonható ki (integráns membránfehérjék), valamint olyanok, amelyeknek leválasztása az alapstruktúrát megőrző kíméletesebb módszerekkel is lehetséges (perifériás membránfehérjék). A folyékony lipid kettős réteg a foszfolipidek kettős tulajdonsága miatt jöhet létre: ezek egyik vége hidrofil, a másik vége hidrofób jellegű. Ebből következik, hogy a foszfolipidek hidrofil részei a membrán két oldalán található vizes fázisokhoz, míg a hidrofób részek (zsírsavláncok) hidrofób-hidrofób kölcsönhatással a membrán belsejében egymás felé orientálódnak.
Elektroporáció
Az ECT során alkalmazott ún. elektroporáció reverzibilis módon növeli a sejtmembrán permeabilitását. Ez a hatás rövid időtartamú, nagy intenzitású elektromos impulzusokkal érhető el (26, 27). Az elektromos impulzus hatására a foszfolipid kettős réteg tranziens átrendeződése következik be: pórusok képződnek, amelyekben a hidrofil komponensek befelé fordulnak, széles, vízmolekulákkal telítődő transzmembrán csatornát hozva létre. Ezeken a pórusokon átmenetileg drasztikusan megemelkedik a nagy molekulatömegű, poláros molekulák transzmembrán transzportja, lehetővé válik egyebek mellett a nagyméretű hidrofil molekulák terápiás célú bejuttatása a citoszolba.
A reverzibilis elektroporáció előfeltétele, hogy megfelelő erősségű és frekvenciájú impulzusok kerüljenek leadásra ahhoz, hogy átmeneti membránpermeabilizáció jöjjön létre, lehetővé téve a sejtközötti térbe juttatott kemoterápiás szer sejtmembránon történő átjutását és citoszolban történő feldúsulását. Ezen hatás elérése céljából általában 5000 Hz-es frekvenciájú és 100–1000 V amplitúdójú elektromos impulzusok kerülnek leadásra 100 mikroszekundum alatt, függően az elektródák közötti távolságtól és az elektródaelrendezés geometriájától. Az impulzusok leadása elektromos impulzusgenerátor használatával történik, ami a kezelés közben lehetővé teszi az áramerősség és a feszültség monitorozását, az áram amplitúdójának és frekvenciájának beállítását, valamint lehetőséget ad az adatok későbbi visszanyerésére és analizálására. A standard ECT során fix geometriájú, különböző típusú elektródák csatlakoztathatóak a készülékhez.
Kemoterápiás szerek
Számos szer esetében vizsgálták az elektroporáció citotoxicitást növelő hatását. Általánosságban elmondható, hogy elsősorban a nagy molekulatömegű, poláros kemoterapeutikumok citoszolba történő bejutását, és – az elektromos impulzus megszűnése után – a membránstruktúra helyreállásával a citoszolban történő „csapdázódását” teszi lehetővé az elektroporáció. A preklinikai vizsgálatok elsősorban a bleomycin és a cisplatin esetében igazolták az eljárás során észlelhető hatásnövekedést, ezért ma elsősorban ezek a szerek használatosak az ECT kezeléshez. A bleomycin citotoxicitása több százszorosára, a cisplatiné ugyan kisebb mértékben, de szignifikánsan növekszik az elektromos impulzusoknak kitett sejtekben (26, 27) A kezelés során olyan kis gyógyszeradagokkal sikerül a tumorok regresszióját elérni, amelyek önmagukban legfeljebb csak minimális antitumorális hatással bírnak, ezért jelentős mellékhatások nem kísérik a beavatkozást. A bleomycin tumorsejt-ölő hatásának formáját a citoszolba jutott molekulamennyiség befolyásolja. Kevesebb kemoterapeutikum koncentráció esetén lassabb, ún. mitotikus sejtpusztulás, nagyobb koncentrációnál pszeudoapoptózis jön létre a kettős szálú DNS törésén keresztül. Magas bleomycin koncentráció esetén a sejtbe jutott kemoterapeutikum molekulák hasítják a DNS-t, a kijavítatlan törések pedig megölik a sejtet. A citotoxikus hatás tehát abban rejlik, hogy a fragmentált kromoszómák miatt nem tud osztódni a károsodott sejt, ezért a mitotikusan aktív tumorsejtek szelektíven elpusztulnak, míg a tumorsejtek körül lévő, nem osztódó sejtek életben maradnak. Az elektrokemoterápia e sejtszintű szelektivitás miatt szövetkímélő, ezért alkalmas szerv-, és funkciómegtartásra.
Hatásmechanizmus
Az ECT tumorölő hatásának alapvetően két, biológiailag fontos mechanizmus az alapja: a citotoxikus hatás és a vaszkuláris reakció (19, 33). A fentebb részletezett citotoxikus hatás az elektroporáció révén megnövekedett intracelluláris kemoterapeutikum koncentrációnak köszönhető, hiszen az elektropermeabilizáció ideje alatt a sejtmembrán széles pórusain szinte szabad diffúzió útján tudnak bejutni a bleomycin molekulák a citoszolba. Az ECT lokális tumorellenes hatása a bleomycin provokálta sejthalálon alapszik, ugyanakkor a szer tumorellenes immunválaszt is kivált, ami már testszerte szelektíven ölheti a daganatos sejteket. Az ún. abszkopális hatást okozó immunválaszt a roncsolt sejtekből történő antigén-kiáramlásnak tulajdonítják, ami aktiválhatja a T-sejteket. Ezen feltételezések szerint az ECT a kezelt tumort „in situ” vakcinává alakítja át (34). A tumor komplett eradikációjához elengedhetetlen a szervezet immunkompetenciája, ezért immundeficiencia esetén kevésbé hatásos az ECT. Az ECT során kialakuló vaszkuláris reakció tovább növeli a módszer tumorellenes hatását. Az elektromos impulzusoknak kitett szövetekben azonnali vazokonstrikció, úgynevezett átmeneti vaszkuláris zár jön létre, ezért a kemoterápiás szer az elektroporált területen reked (33). A véráramlás ilyen változása előnyös a tumorellenes készítmény helyben tartására. Tekintettel arra, hogy a tumor vérellátását biztosító erek endothelsejtjei is mitotikusan aktívak, ezek pusztulásával is számolni lehet. Ez az antiangiogén hatás elsősorban a kapillárisok esetében figyelhető meg. A tumor vaszkulatúrájának roncsolódása részben a tumorölő hatást növeli, részben a recidíva esélyét is csökkenti. Mindezeken túl azonnali és tartós vérzéscsillapítást eredményez, ami vérző tumorok esetében különösen előnyös.
Standard elektrokemoterápia kivitelezése
A Standard Operating Procedure (SOP) kidolgozása mérföldkő volt az ECT történetében, klinikai alkalmazásának széles körű elterjedésében. A 2006-ban megjelent ESOPE tanulmányban bizonyították az eljárás biztonságosságát és hatásosságát, valamint kidolgozták az eljárás pontos lépéseit (22). A közelmúltban aktualizálásra került SOP az eddig összegyűlt nagy mennyiségű tapasztalatra alapozva ajánlásokat tartalmaz a betegszelekcióval, az anesztéziával, a kemoterápiás szer beadásával, az elektróda kiválasztásával, a pre- és posztoperatív ellátással kapcsolatban (13). A kemoterápiás szer beadási módját és az anesztéziát figyelembe véve többféleképpen végezhető a beavatkozás. Az ECT leggyakrabban bleomycin alkalmazásával, altatásban történik. A bleomycin 1500 IU/m2 dózisú intravénás bolusban kerül beadásra. A szer az injekciót követően 8 perccel éri el a kezeléshez szükséges intersticiális koncentrációt. Ekkor lehet megkezdeni az elektromos impulzusok tumorszövetre történő leadását. A farmakokinetikai vizsgálatok szerint az optimális szöveti koncentráció 40 percig tart, ezért a legújabb SOP szerint a beadást követően a 48. percig lehet kezelni, ami a kiterjedt daganatok ECT-jét is lehetővé teszi. Kevés és/vagy kis méretű tumor esetén a kemoterápiás szer intratumorálisan is adható. Az intratumorális alkalmazás során az ajánlott bleomycin-koncentráció 1000 IU/ml. Cisplatin beadása csak intratumorálisan történik (koncentráció: 2 mg/m2).
A kezelés szükség esetén ismételhető, jelenleg azonban nem rendelkezünk kellő információval arról, hogy mennyi az optimális kezelési szám és mennyi az optimális időintervallum két ECT-kezelés között. Nem ritka ugyanis, hogy egy beteg helyileg előrehaladott, nagyobb kiterjedésű léziók esetén akár 6-7 ECT kezelésen is átesik. A kezelési stratégia felállítása minden beteg esetében személyre szabott, egyedi, amelyet számos faktor, elsősorban az első kezelésre adott tumorválasz, a beteg preferenciája és az egyéb terápiákkal történő optimális kombináció határoz meg. Mivel a kezelt tumorok regressziója viszonylag lassú (tumormérettől és szövettani típustól függően egy-két hónap), legalább 4 hét intervallum javasolt két ECT-kezelés között.
ECT az onkológiai gyakorlatban
Napjainkban a felszíni tumorok (BCC-k, laphámrákok, kután melanoma-metasztázisok) adott protokollok szerinti ECT kezelése elterjedt terápiás lehetőség (13). Az indikációs kör folyamatosan bővül, eltérő hisztopatológiájú felszíni tumorok kezelése is jó eredménnyel kivitelezhető. Többek között parotis, pajzsmirigytumorok bőrre terjedő malignus folyamatai, sztómák körüli bőrt elérő daganatok, primer, bőrt érintő T- vagy B-sejtes lymphomák, vulvakarcinóma, benignus folyamatok közül például keloidok, kapilláris malformációk sikeres kezelésével kapcsolatban áll rendelkezésre egyre több adat (3).
Az ún. változtatható geometriájú elektródák, illetve újabb pulzusgenerátorok bevezetése lehetővé tette, hogy mélyebben elhelyezkedő tumorokat, illetve kényes lokalizációjú daganatokat érjenek el az elektródákkal (25). A legújabb elektródák nem csak egyszerűen hosszabbak lehetnek, így elérve a nehezebben megközelíthető mélyebb szöveteket, de kifejlesztettek többek között úgynevezett ujjelektródát, lapelektródákat, hajlítható rácselektródákat, endoszkópos elektródákat, esernyő-elektródákat stb., az anatómiailag behatárolt struktúrák elérésének megkönnyítésére, a minél pontosabb elektróda – daganatkontaktus, illetve a daganat teljes terjedelmében egyenletesen kialakítható elektroporációs hatás elérése céljából (3).
2011-ben Edhemovic és munkatársai laparotomia során végeztek ECT-t egy colorectalis karcinómának a vena cava inferior és a vena hepatica között elhelyezkedő májáttétén (7). Tarantino és munkatársai perihiláris colangiocarcinoma ECT kezelését végezték jó eredménnyel (41). Az ECT kezelés sikereket hozhat olyan irreszekábilis májdaganatok esetében, amelyek nagy erek közelében helyezkednek el, és ahol a termális ablatív módszerek hatékonysága lecsökken az úgynevezett hőelnyelési effektus miatt (40). Ígéretes eredményeket írtak le csontmetasztázisok, prosztata- és pancreascarcinoma, illetve agydaganatok ECT kezelésével kapcsolatban (12, 15, 17).
ECT a periokuláris régióban
Az ECT kezelés széles körben alkalmazott eljárás a különböző bőrterületeken kialakult primer, illetve metasztatikus malignomák esetében. Ezzel szemben igen kevés adat áll rendelkezésre az eljárásnak a periokuláris BCC-k kezelésében betöltött szerepéről. Landström és munkatársai két mediális szemzugi BCC sikeres ECT kezeléséről számoltak be, míg Salwa és kollégái három, primer periokuláris BCC ECT eljárással történt sikeres kezelését közölték (16, 32). A 2016-ban publikált „European Research on Electrochemotherapy in the Head and Neck Cancer (EURECA)” vizsgálatban 5 olyan ECT-vel kezelt daganatos esetet közöltek, amelyek a szemhéj-orbita régiót érintették, sajnos a léziók részletes leírása nélkül (2). Ez utóbbi közleményben mind a tumorok típusát, mind a feji és nyaki elhelyezkedésű eltérések kezelésre adott reakcióját összesítve közölték, így a periokuláris régió eltéréseinek kezelési eredményeiről nem vonhatók le következtetések.
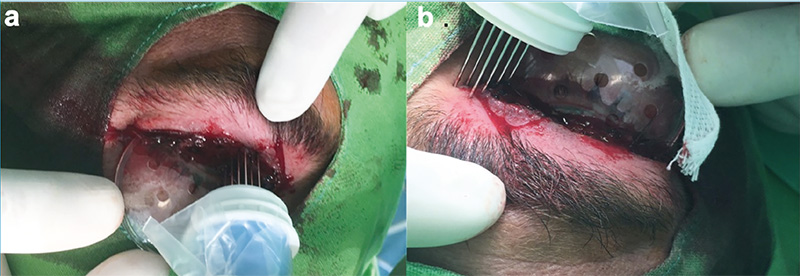
Munkacsoportunk 2014-ben – a világon az elsők között – kezdte el alkalmazni az ECT-t a szemhéj-periokuláris BCC-k szelektált, jelentős terápiás kihívást jelentő eseteiben (1–4. ábrák). Az összegyűlt tapasztalatokról, eredményekről 2019-ben publikáltuk az első közleményünket (14). A bleomycint a betegek 25%-ánál intratumorálisan, 75%-uk esetében pedig intravénásan alkalmaztuk. A bleomycin intratumorális dózisa a daganat méretének megfelelően került kiszámításra (250–1000 IU/cm3), a szisztémás dózis 15000 IU/m2 volt. A daganat körüli 4-5 mm-es biztonsági zónát minden esetben kezeltük (5. ábra). A bleomycin intravénás alkalmazása abban az esetben volt indokolt, ha multiplex tumorok voltak jelen a periokuláris régión kívül is. A beavatkozások eredményeként a kezelt BCC-k komplett remisszióját sikerült elérni lokálisan előrehaladott primer, valamint recidív tumorok esetében is. Egyik beteg esetében az alkalmazott vismodegib kezelés ellenére a tumor folyamatosan progrediált, valamint a beteg számára tolerálhatatlan mellékhatások is akadályozták a szer hosszabb távú alkalmazását. A vismodegib kezelés felfüggesztését követően alkalmazott két ECT kezelés ennél a betegnél is a tumor komplett remisszióját eredményezte. Az ECT kezeléseket követően néhány beteg esetében különböző mértékű hegképződést észleltünk. Amennyiben az alsó szemhéjon heges ektrópium alakult ki, azt sebészi úton korrigáltuk. Az eredmények alapján az ECT-eljárás jó eredménnyel alkalmazható a periokuláris régióban kialakuló BCC-k kezelésére. A módszerrel kiváló tumorkontroll volt elérhető megfelelő funkcionális és kozmetikai eredménnyel. A betegeknél szisztémás mellékhatás nem lépett fel. Az elmúlt időszakban részben folyamatosan növekedett a munkacsoportunk által kezelt betegek száma, részben jelentősen nőtt a követési idő. Következtetésként megállapítható, hogy kimagaslóan jó lokális tumorkontroll igazolható hosszabb (5 éven túli) utánkövetési idő esetén is (eredmények közlés alatt).
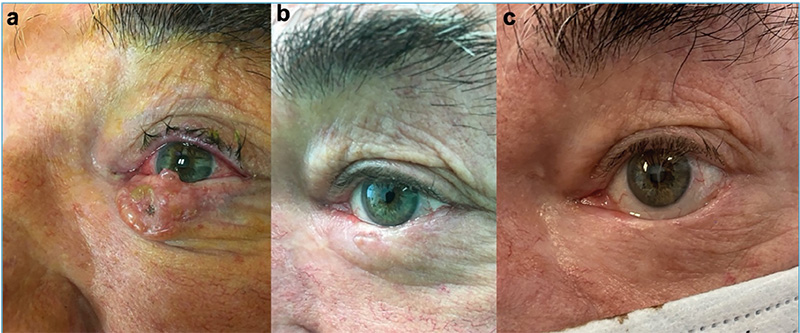
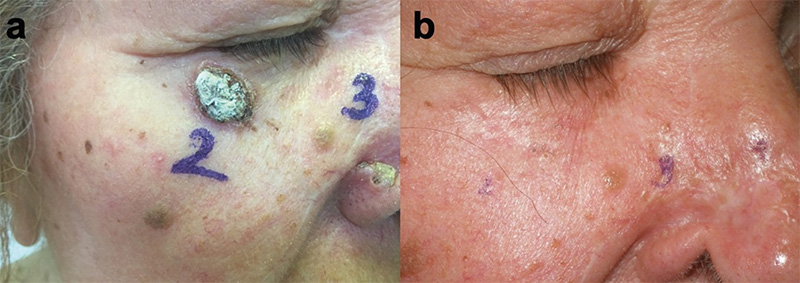
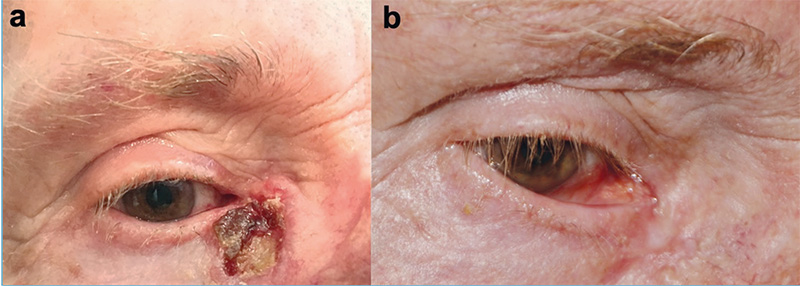
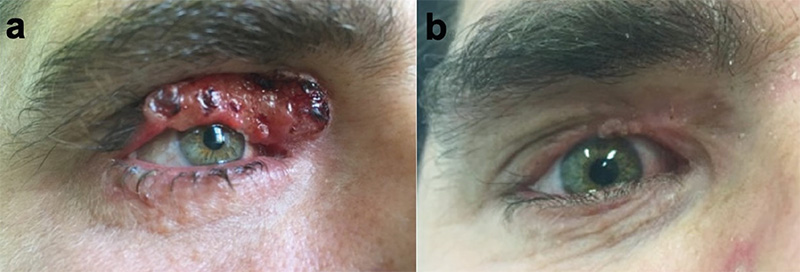
Fejlesztési irányok – kísérletes eredmények
Az ECT sikerét illetően alapvetően fontos a megfelelő indikáció, a modern és hatékony eszközpark alkalmazása, az egyénre szabott kezelési terv elkészítése, valamint szükség esetén az eljárásnak más daganatellenes kezelésekkel való kombinálása. Ezen elvárások határozzák meg az ECT-vel kapcsolatos kutatások irányát és a kezelés optimalizálásához szükséges újításokat.
Az ECT szemészeti alkalmazásával kapcsolatban folyó egyik legjelentősebb preklinikai kutatás az eljárás szerepének vizsgálata az okuláris melanomák kezelésében. A közelmúltban Fiorentzis és munkatársai 2D és 3D conjunctivalis, illetve uvealis melanoma szövettenyészeteken/sejtkultúra modelleken igazolták az ECT kezelés hatékonyságát (9, 10). A kísérletekben a bleomycin bizonyult a legoptimálisabb melanomasejt-ölő kemoterapeutikumnak. Az új és speciális kezelési irányok folyamatos fejlesztéseket igényelnek az elektroporációt közvetítő elektródák területén is. A daganatok pontos, biztonságos elérését a különböző elektróda konfigurációk kialakításán túl navigációs rendszerek, illetve a robottechnika fejlesztése és alkalmazása segítheti (6).
A kezelések sikere szempontjából – különösen a változtatható geometriájú elektródák alkalmazása esetén – kifejezetten fontos az egyénre szabott, pontos tervezés a tumor méretének, formájának, elhelyezkedésének, szöveti ellenállásának megfelelően (29). El kell érni, hogy a célterületben az alkalmazott kemoterápiás szer – általában bleomycin – egyenletesen és megfelelő koncentrációban legyen jelen, a leadott feszültség által generált elektroporáció a tumorszövet teljes egészében kialakuljon és mindez az éppen megfelelő időablakban történjen. A feladat megoldására alkalmas tervező és modellező szoftverek a Pulsar Software és Visifield Software (20).
Kutatások folynak az ECT- és más antitumor-kezelések kombinációban való alkalmazására a daganatellenes kezelés során. Ilyen terápiás kombinációk az ECT immunterápiával (elektroimmunoterápia), kalcium elektroporációval, sugárterápiával való együttes alkalmazása (8, 18).
Következtetések
A modern onkoterápiás eszköztárban az ECT szerepe és jelentősége egyre pontosabban körvonalazódik, a jó eredménnyel kezelhető tumoros elváltozások köre – a rapid fejlesztéseknek köszönhetően – exponenciálisan növekszik. Egyéb módszerekkel összehasonlítva az eljárás hatékony és biztonságos, külön kiemelendő előnye az ismételhetősége és az alacsony szisztémás terhelés mellett elért magas intratumorális kemoterapeutikum koncentráció. Az ECT szerv-, és szövetkímélő eljárás, amely relatíve kis műtéti tehertétellel, kuratív intencióval alkalmazható idős, egyéb eljárásokkal akár már nem kezelhető betegek esetében is. A szemészet, mint indikációs terület, napjainkban került a kutatás és eszközfejlesztés látókörébe. Munkacsoportunk a világon az elsők között kezdte el rutinszerűen alkalmazni az eljárást bizonyos, jelentős terápiás kihívást jelentő betegcsoportok esetében (lokálisan előrehaladott és/vagy recidiváló szemhéj – periokuláris BCC-k, laphámrákok). Kimagaslóan nagy arányban elért komplett remisszió mellett kiemelkedően jó hosszú távú tumormentes állapot, recidívamentesség volt elérhető a kezelt betegek esetében, bizonyítva az eljárás hatékonyságát. A periokuláris régió előrehaladott BCC-i esetében a funkció és ezzel összefüggésben a kozmetikai szempontok is kiemelt jelentőséggel bírnak. Saját tapasztalataink szerint az ECT ezen kitételeket figyelembe véve is jelentős szereppel bír a személyre szabott kezelési tervben, hiszen az onkológiai eredményesség és hatásosság kimagaslóan jó funkciómegtartás és kozmetikai eredmény mellett érhető el. A jelenleg folyó preklinikai kutatásokat tekintve reálisan várható, hogy az eljárás a közeljövőben az okuláris (conjunctiva, uvea) melanomák bizonyos eseteiben is a terápiás eszköztár részévé válhat.
Nyilatkozat
A szerzők kijelentik, hogy a referáló közlemény megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Alberts B, Johnson A, Lewis J, et al. Molecular biology of the cell. 4th edition, 2002. New York: Garland Science; ISBN 978-0-8153-3218-3.
2. Bertino G, Sersa G, De Terlizzi F, et al. European Research on Electrochemotherapy in head and neck cancer (EURECA) project: Results of the treatment of skin cancer. Eur J Cancer 2016; 63: 41–52. https://doi.org/10.1016/j.ejca.2016.05.001
3. Campana LG, Edhemovic I, Siden D, et al. Electrochemotherapy–emerging applications technical advances, new indications, combined approaches, and multi-institutional collaboration. Eur J Surg Oncol 2019; 45.2: 92–102. https://doi.org/10.1016/j.ejso.2018.11.023
4. Campana LG, Testori A, Curatolo P, et al. Treatment efficacy with electrochemotherapy: A multi-institutional prospective observational study on 376 patients with superficial tumors. Eur J Surg Oncol 2016; 42: 1914–1923. https://doi.org/10.1016/j.ejso.2016.06.399
5. Coletti L, Battaglia V, De Simon P, et al. Safety and feasibility of electrochemotherapy in patients with unresecable colorectal liver metastases: A pilot study. Int J Surg 2017; 44: 26–32.
https://doi.org/10.1016/j.ijsu.2017.06.033
6. Cornelis FH, Solomon SB. Image guidance in interventional radiology: Back to the future? Diagnostic and Interventional Imaging 2020; 101.7–8: 429–430. https://doi.org/10.1016/j.diii.2020.06.003
7. Edhemovic I, Gadzijev EM, Brecelj E, et al. Electrochemotherapy: a new technological approach in treatment of metastases in the liver. Technol Cancer Res Treat 2011; 10.5: 475–485.
https://doi.org/10.7785/tcrt.2012.500224
8. Falk H, Lambaa S, Johannesen HH, et al. Electrochemotherapy and calcium electroporation inducing a systemic immune response with local and distant remission of tumors in a patient with malignant melanoma – a case report. Acta Oncologica 2017; 56.8: 1126–1131. https://doi.org/10.1080/0284186X.2017.1290274
9. Fiorentzis M, Viestenz A, Siebolts U, et al. The potential use of electrochemotherapy in the treatment of uveal melanoma: in vitro results in 3Dtumor cultures and in vivo results in a chick embryo model. Cancers 2019; 11: 1344. https://doi.org/10.3390/cancers11091344
10. Fiorentzis M, Katopodis P, Kalirai H, et al. Conjunctival melanoma and electrochemotherapy: prelimirary results using 2D and 3D cell culture models in vitro. Acta Ophthalmol 2019; 97: e632–e640. https://doi.org/10.1111/aos.13993
11. de Gruijl FR, van Kranen HJ, Mullenders LH. UV-induces DNA damage, repair, mutations and oncogenic pathways in skin cancer. J Photochem Photobiol 2001; 63(1–3): 19–27.
https://doi.org/10.1016/s1011-1344(01)00199-3
12. Gasbarrini A, Campos WK, Campanacci L, et al. Electrochemotherapy to metastatic spinal melanoma: a novel treatment of spinal metastasis? Spine 2015; 40(24): E1340–E1346.
https://doi.org/10.1097/BRS.0000000000001125
13. Gehl J, Sersa G, Matthiessen LW, et al. Updated standard operating procedures for electrochemotherapy of cutaneous tumours and skin metastases. Acta Oncol 2018; 57: 874–82.
14. Kis EG, Baltás E, Ócsai H, et al. Electrochemotherapy in the treatment of locally advanced os recurrent eyelid-periocular basal cell carcinoma. Sci Rep 2019 Mar 12; 9(1): 4285. https://doi.org/10.1038/s41598-019-41026-2
15. Klein N, Gunther E, Zapf S, et al. Prostate cancer infiltrating the bladder sphincter successfully treated with Electrochemotherapy: A case report. Clinical Case reports, 2017; 5(12): 2127.
https://doi.org/10.1002/ccr3.1270
16. Landström FJ, Nillson CO, Crafoord S, et al. Electroporation therapy of skin cancer in the head and neck area. Dermatol Surg 2010; 36(8): 1245–1250. https://doi.org/10.1111/j.1524-4725.2010.01617
17. Linnert M. Treatment of brain tumors: Electrochemotherapy. In: Tumors of the Central Nervous System, Volume 12. Dordrecht: Springer; 2014. pp. 247–259.
18. Longo F, Perri F, Caponigro F, et al. Boosting the immune response with the combination of electrochemotherapy and immunotherapy. A new weapon for squamous cell carcinoma of the head and neck? Cancers 2020; 12, 2781. https://doi.org/10.3390/cancers12102781
19. Mali, B, Jarm T, Snoj M, et al. Antitumoral effectiveness of electrochemotherapy: A systematic review and meta-analysis. Eur J Surg Oncol 2013; 39: 4–16. https://doi.org/10.1016/j.ejso.2012.08.016
20. Marcan M, Pavliha D, Kos B, et al. Web-based tool for visualization of electric field distribution in deep-seated body structures and planning of electroporation-based treatments. Biomedical engineering online 2015; 14(3): 1–13. https://doi.org/10.1186/1475-925X-14-S3-S4
21. Martin I, Schaarschmidt MR, Glocker A, et al. Patients preferences for the treatment of basal cell carcinoma: importance of cure and cosmetic outcome. Acta Dermatol Venereol 2016; 96: 355–360. https://doi.org/10.2340/00015555-2273
22. Marty M, Sersa G, Garbay JR, et al. Electrochemotherapy – an easy, highly effective and safe treatment of cutaneous and subcutaneous metastases: Results of ESOPE (European Standard Operating Procedures of Electrochemotherapy) Study. Eur J Cancer 2006; S4: 3–13.
23. Marur S, Forastiere AA. Head and neck cancer: changing epidemiology, diagnosis, and treatment. Mayo Clin Proc 2008; 83: 489–501. https://doi.org/10.4065/83.4.489
24. Miklavcic D, Mali B, Kos B, et al. Electrochemotherapy: from the drawing board into the medical practice. BioMedical Engineering OnLine 2014; 13: 29. https://doi.org/10.1186/1475-925X-13-29.
25. Miklavcic D, Snoj M, Zupanic A, et al. Towards treatment planning and treatment of deep-seated solid tumors by electrochemotherapy. Biomedical engineering online 2010; 9(1): 1–12.
26. Mir LM. Bases and rationale of the electrochemotherapy. Eur J Cancer 2006; S4: 38–44. https://doi.org/10.1016/j.ejcsup.2006.08.005
27. Mir LM, Gehl J, Sersa G, et al. Standard operating procedures of the electrochemotherapy: Instructions for the use of bleomycin or cysplatin administered either systemically or locally and electric pulses delivered by the Cliniporator (TM) by means of invasive or non-invasive electrodes. Eur J Cancer Supplements 2006; 4: 14–25.
28. Monheit G, Hrynewycz K. Mohs surgery for periocular tumors. Dermatol Surg 2019; 45 (Suppl 2): S70–S78. https://doi.org/10.1097/DSS.0000000000002254
29. Pavliha D, Kos B, Zupanic A, et al. Patient-specific treatment planning of electrochemotherapy: Procedure design and possible pitfalls. Bioelectrochemistry 2012; 87: 265–273. https://doi.org/10.1016/j.bioelechem.2012.01.007
30. Puig S, Berrucal A. Management of high-risk and advanced basal cell carcinoma. Clin Trans Oncol 2015; 17(7): 497–503. https://doi.org/10.1007/s12094-014-1272-9
31. Saleh GM, Desai P, Collin JR, et al. Incidence of eyelid basal cell carcinoma in England: 2000–2010. Br J Ophthalmol 2017; 101(2): 209–212. https://doi.org/10.1136/bjophthalmol-2015-308261
32. Salwa SP, Bourke MG, Forde PF, et al. Electrochemotherapy for the treatment of ocular basal cell carcinoma; a novel adjunct in the disease management. Int J Surg Reconstruct 2013; 67: 403–406. https://doi.org/10.1016/j.bjps.2013.07.019
33. Sersa G, Jarm T, Kotnik T, et al. Vascular disrupting action of electroporation and electrochemotherapy with bleomycin in murine sarcoma. Br J Cancer 2008; 98: 388–98. https://doi.org/10.1038/sj.bjc.6604168.
34. Sersa G, Teissie J, Cemazar M, et al. Electrochemotherapy of tumors as in situ vaccination boosted by immunogene electrotransfer. Cancer Immunol Immunother 2015; 64: 1315–27. https://doi.org/10.1007/s00262-015-1724-2.
35. Shi Y, Jia R, Fan X. Ocular basal cell carcinoma: a brief literature review of clinical diagnosis and treatment. OncoTargets and Therapy 2017; 10: 2483–2489. https://doi.org/10.2147/OTT.S130371
36. Silverman N, Shinder R. What’s new in eyelid tumors? Asia-Pac J Ophthalmol 2017; 6: 143–152. https://doi.org/10.22608/APO.201701
37. Situm M, Buljan M, Bulat V, et al. The role of UV radiation in the development of basal cell carcinoma. Coll Antropol 2008; 32(Suppl 2): 167–170. PMID: 19138022
38. Steiwert TY, Cohen EEW. State-of-the-art management of locally advanced head and neck cancer. Br J Cancer 2005: 92: 1341–1348.
https://doi.org/10.1038/sj.bjc.6602510
39. Sun MT, Wu A, Figueira E, et al. Management of periorbital basal cell carcinoma with orbital invasion. Future Oncol 2015; 11: 3003–10.
https://doi.org/10.2217/fon.15.190
40. Tafuto S, von Arx C, De Divitiis C, et al. Electrochemotherapy as a new approach on pancreatic cancer and on liver metastases. Int J Surg 2015; 21: S78–S82. https://doi.org/10.1016/j.ijsu.2015.04.095
41. Tarantino L, Busto G, Nasto A, et al. Electrochemotherapy of cholangiocellular carcinoma at hepatic hilum: a feasibility study. Eur J Surg Oncol 2018; 44.10: 1603–1609. https://doi.org/10.1016/j.ejso.2018.06.025
