Case of bilateral panuveitis in a 59-year-old immunocompromised female patient
doi: 10.55342/szemhungarica.2022.159.1.16
Case report
Summary
The case of a 59-year-old female patient with bilateral visual loss is presented. She was admitted to our clinic 6 weeks after the onset of her visual complaints. Following ophthalmologic examination, she was diagnosed with bilateral panuveitis. Along with the massive bilateral vitreous haze, large, white infiltrates and haemorrhages were seen on the left retina. The retina on the right side was not visible. Beyond hypertonia and diabetes, the patient was diagnosed with a moderate malignant B-cell lymphoma one and a half years before her visual complaints. She received chemotherapy and biological therapy for the haematologic malignancy. Investigation revealed a CMV retinitis as the causative agent to the bilateral panuveitis. At the same time, an intestinal tumour was extirpated what proved to be a polypoid, CMV-associated vascular proliferation, histopathologically.
Összefoglaló
Az alábbiakban egy 59 éves nőbeteg esetét mutatjuk be, aki jobb szemének látásromlását követően 6 héttel jelentkezett a területi szakrendelőben, ahonnan klinikánkra utalták kétoldali panuveitis diagnózissal. Mindkét oldalon észlelt masszív üvegtesti homályok mellett a jobb szemen a retina nem vizsgálható, bal oldalon kiterjedt fehér infiltrátum és fundusszerte tócsás vérzések látszottak. A hipertóniával és 2-es típusú diabetes mellitussal kezelt nőbeteg anamnéziséből a látásromlást megelőzően másfél évvel diagnosztizált, majd kemoterápiával és biológiai terápiával kezelt mérsékelt malignitású B-sejtes non-Hodgkin-lymphoma emelendő ki. Kivizsgálása kezdődött, amely a látásromlás hátterében cytomegalovírus (CMV) retinitis fennállását igazolta. Ezzel egy időben vastagbél térfoglaló folyamatának eltávolítása történt, a tumor kórszövettani vizsgálata polipoid CMV-asszociált vaszkuláris proliferációt mutatott.Keywords
immunocompromised patient, panuveitis, CMV retinitis
Kulcsszavak
immunszupprimált állapot, panuveitis, CMV-retinitis
Bevezetés
A CMV-retinitis immunszupprimált páciensek körében az egyik legveszélyesebb, látást fenyegető kórkép. A retina minden rétegére kiterjedő gyulladás retinanekrózison, vérzésen, retinaleváláson keresztül vezet végleges látásromláshoz. Az alábbiakban kétoldali látásromlással jelentkező, 59 éves nőbeteg esetét mutatjuk be.
Esetismertetés
A páciens jobb szem látásromlását követően 6 héttel jelentkezett területi szakrendelőben, ahonnan klinikánkra utalták. Általános anamnéziséből kiemelendő 2018 júliusában felismert mérsékelt malignitású B-sejtes non-Hodgkin-lymphoma. Gyógyszerrel kezelt hipertónia, valamint 2-es típusú diabetes mellitusa ismert, amely orális antidiabetikum szedése mellett egyensúlyban van. Pajzsmirigyét 2004-ben medulláris karcinóma miatt eltávolították, 2004-ben és 2006-ban I-131 radioterápiát kapott, jelenleg pajzsmirigyhormon-szubsztitúciót szed. 2018 áprilisában kétoldali adnexectomia és hysterectomia történt, kórszövettani vizsgálattal cystadenoma ovarii igazolódott. Szemészeti panasza előtt másfél évvel, 2018 júliusában pleurális elváltozás biopsziája kapcsán diagnosztizáltak nála mérsékelt malignitású B-sejtes non-Hodkin-lymphomát. Látáspanasza előtt fél évvel (2019 februárjában) ért véget az alapbetegség kemoterápiás kezelése (R-Bendamustin), majd 2019-ben márciusban és májusban két alkalommal rituximab biológiai terápiában részesült. 2019 augusztusában coecumtumor eltávolítása céljából sebészeti beavatkozáson esett át, kórszövettan polipoid CMV-asszociált vaszkuláris proliferációt írt le, malignitás nem igazolódott. Szemészeti anamnézisében közeli korrekcióviselésen kívül egyéb gyulladásos, traumás vagy műtéti előzmény nem szerepel.
Látáspanaszát először 2019 októberében észlelte, 2019 novemberében klinikánkon réslámpával történt szemészeti vizsgálatán az elülső szegmentumban enyhe gyulladásos jelek, cornea harmatozottsága, valamint mindkét üvegtestben masszív homályok voltak láthatók (haze: jobb oldalon 4+, bal oldalon 3+). Jobb szemen az üvegtesti homályoktól a retinát nem lehetett vizsgálni. Bal oldalon nasalisan a retina felszínén kiterjedt fehér infiltrátumot, éles határú, jó színű papillát és fundusszerte tócsás vérzéseket találtunk. A fentiek alapján kétoldali panuveitis fennállását állapítottuk meg. Szemészeti ultrahangvizsgálat történt, amely mindkét szemen hátsó üvegtesti határhártya-leválást, a retrohyaloidealis térben alacsony reflektivitású, mobilis pontechokat (a retrohyaloidealis térben több echoforrás a jobb oldalon), körben fekvő retinát és körben egyenletes, normális hátsó falvastagságot mutatott. Ekkor legjobb korrigált látóélessége jobb szemen 0,4, bal szemen 0,9 volt. Az aktuálisan zajló kétoldali purulens conjunctivitis miatt a csarnokvíz-mintavételtől eltekintettünk.
Az uveitis differenciáldiagnosztikájában felmerült részben az alapbetegség szemészeti manifesztációja, másrészt anamnézis és klinikai kép alapján CMV-retinitis gyanúja, amely utóbbi miatt a Szt. László Kórházba irányítottuk esetleges szisztémás CMV-érintettség tisztázása céljából. Infektív szerológia panel HSV-1, Toxoplasma és CMV IgG-pozitivitást mutatott ki (1. táblázat). Laboreredményeiben az emelkedett süllyedésen kívül egyéb eltérés nem volt látható (We: 32 mm/h), vérképe normális volt. 2020. januárban onkológiai kontroll történt, és képalkotó vizsgálatok készültek az alapbetegséggel összefüggő kórállapotok kizárására. A hasi ultrahangon hepato-splenomegaliát, cysta hepatist és a jobb vese felső pólusában 3 cm átmérőjű, inhomogén szerkezetű szolid elváltozást írtak le. Ezt követően nyaki-mellkasi-hasi CT készült, amelyen jobb oldali hemicolectomia és totál thyreoidectomia utáni állapot volt látható, az anamnézisből ismert lymphoma manifesztációjára utaló eltérés nem volt kimutatható, azonban a jobb vesében lévő szolid képlet malignitás gyanúját felvetette. A jobb vesében észlelt malignus térfoglaló terime eltávolítására a jobb vesével együtt 2020 októberében került sor, a kórszövettan alapján világossejtes veserák volt igazolható.

Kivizsgálása során szemészeti státusza progrediált, legjobb korrigált látóélessége jobb szemen 0,15, bal szemen 0,5. Réslámpával történt szemészeti vizsgálata során az elülső és hátsó szegmentumban gyulladásos jelek észlelhetők. Cornea hátlapján hálózatos, csillag alakú precipitátumok, mindkét üvegtestben masszív homályok láthatók. Jobb oldalon a retina az üvegtesti homályoktól nem vizsgálható. Bal oldalon papilla éles szélű, nagyerek infiltráltak, nasalisan kiterjedt fehér színű retinalis infiltrátum és a hátsó póluson tócsás vérzések. Ekkor optikai koherencia tomográfia (OCT) vizsgálaton a makulákban cisztoid makulaödéma volt látható, ami az üvegtesti homályokkal együtt romló látóélességét magyarázta.
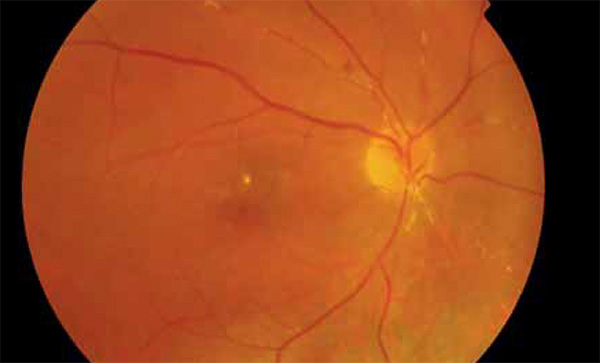
2020 februárjában részben a fokozódó üvegtesti homályok, részben diagnosztikus célból jobb szemen vitrectomiát végeztünk, amelynek során az üvegtesti térből mintavétel történt citológia, flow citometria és CMV, HSV, VZV és Toxoplasma PCR-vizsgálat céljából. A vitrectomiát követően készült szemfenéki felvételek láthatók az 1. és 2. ábrákon. A vizsgálatra elküldött üvegtesti mintában citológiai, illetve flow citometria vizsgálatokkal kóros sejtvonal nem volt detektálható. PCR-vizsgálat során a HSV, VZV, Toxoplasma-negatív, CMV-pozitív eredményű volt. 2020. február 7-én vett szérumban a CMV DNS nem volt detektálható.
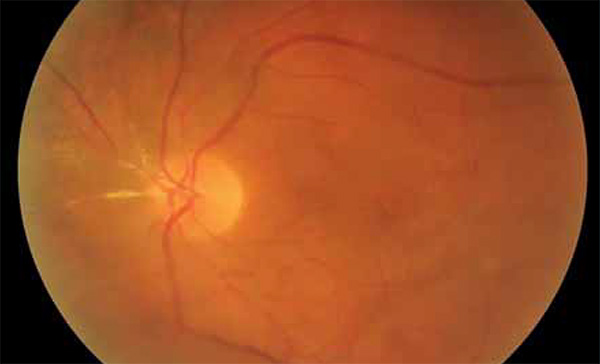
Ezt követően az onkológus kezelőorvossal való konzultációt követően 2020. február 25-étől a betegnél nagy dózisú antivirális kezelés kezdődött infektológiai osztályon; 14 napon át 2×450 mg intravenás ganciklovir terápiát kapott, majd a továbbiakban napi 2×450 mg valganciklovir per os szedését írták elő. 2020. februári vérképében a limfocita százalékos arány emelkedésén (47,8%), valamint csökkent MCV-n (73,8 fl) és MCH-n (24,6 pg) kívül egyéb eltérés nem volt. Kétirányú mellkasröntgen az alapbetegség mellkasi manifesztációjára utaló eltérést nem írt le.
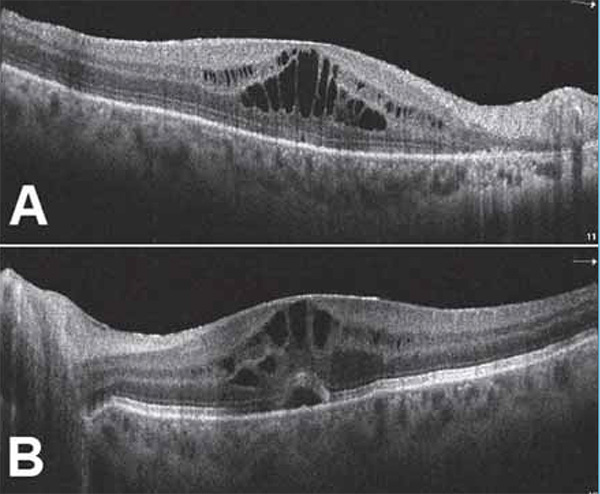
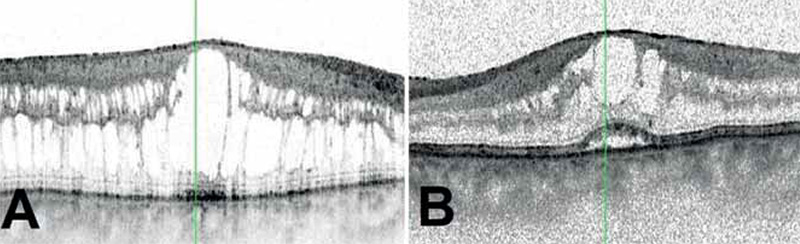
2020 márciusában történt szemészeti kontroll alapján az alkalmazott antivirális kezelés mellett szemészeti státusa javult, elülső szegmens, gyulladásos jelek megszűntek, az üvegtesti tér a vitrectomizált jobb szemen tiszta, bal szemen is tisztult. Mindkét szemen a papilla éles határú, kissé halványabb színű, fiziológiásan excavalt. A nagyerek közül az artériák több helyen elzáródtak, bennük embólus látható, a tócsás vérzések egy része felszívódott, makula fénytelen, a retina perifériáján atrófiás területek, friss gyulladásos aktivitás nem észlelhető. A legjobb korrigált látóélesség jobb szemen 0,4, bal szemen 0,5 decimálisan. A folyamat követésére makula-OCT, OCT-angiográfia és kék fundus autofluoreszcencia (BAF) vizsgálatokat végeztünk (3–4. ábra). Látóélességét a mérsékelt üvegtesti gyulladás, valamint a makulákban lévő cisztoid makulaödéma magyarázza (3. ábra).
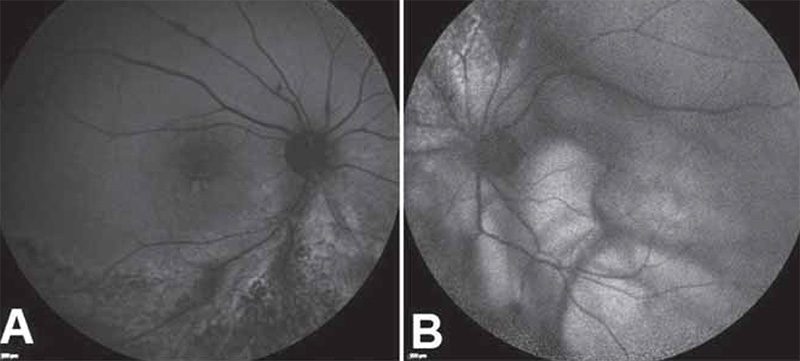
A gyulladás remisszióba kerülése nem járt együtt a látóélesség javulásával, a folyamat következtében hosszú távú szövődmények kialakulása vezetett a páciens látásromlásához. Az OCT-vel igazolható cisztoid makulaödéma kezelése céljából intravitrealis aflibercept injekciót adtunk mindkét szembe (jobb szembe 2021. januárban, bal szembe 2020. novemberben és 2021. májusban). Az intravitrealis injekciókat követően készített makula-OCT-n a makula rétegeinek súlyos dezintegrációja figyelhető meg, 2021 májusában a legjobb korrigált látóélesség jobb szemen 0,4, bal szemen 0,2 (5. ábra). Mindkét szemen másodlagos szürkehályog alakult ki. Jobb szem phacoemulsificatiora és hátulsó csarnoki műlencse-beültetésére 2021 januárjában került sor.
Megbeszélés
A CMV jellemzően egy opportunista kórokozó, ami többségében immunszupprimált egyéneknél okoz manifeszt fertőzést, de egészséges egyéneket is megbetegíthet (1, 2). Immunkompetens személyeknél a krónikus idiopátiás rekurrens elülső uveitis hátterében állhat CMV, amelyről döntően ázsiai szerzők számolnak be (3). Az egyik legveszélyesebb CMV okozta szemészeti kórkép a CMV-retinitis, amely látásvesztéshez vezethet a retina minden rétegére kiterjedő gyulladás, vérzés majd következményes retinaleválás folyamán (4).
A CMV a herpeszvírusok családjába tartozik, és a herpeszvírusokra jellemzően az elsődleges fertőzést követően élethosszig perzisztál a szervezetben, elsősorban a perifériás leukocitákban és a csontvelőben, ugyanakkor a vérből nem kimutatható (5). A CMV vélhetően a CD34+ progenitor sejtekben perzisztál, de helyileg is leírtak látenciát a tüdőben, agyban, nyálmirigyekben, szemben, ahonnan esetleges reaktivációkor képes keringésbe kerülni (6, 7, 8). A CMV reaktivációját a CD4+ és CD8+ T-sejtek képesek kivédeni, azonban az immundeficiens állapotokban ez a védekezés nem működik megfelelően (9). A herpeszvíruscsaládon belül a CMV a legnagyobb méretű, duplaszálú DNS-vírus, proteinkapszidja és kettős lipidburka teszi lehetővé a gazdasejtbe való invázióját (10). A CMV-infekció lehetséges intrauterin fertőzés formájában, perinatalisan anyatejjel vagy genitális váladékkal, postnatalisan testnedvekkel, vérrel, nyállal, ondóval, valamint szív-, tüdő-, csontvelő-transzplantációjával (11). Az átlagpopuláció mintegy 83%-a CMV-re nézve szeropozitív (11), Magyarországon ez mintegy 86%-ra tehető (12). Az egészséges felnőtt populációban ritka a szeropozitivitás melletti vírusfertőzés, mivel megfelelő immunstátusz mellett elhanyagolható mértékű a reaktiváció, ugyanakkor az immunrendszer legyengülésekor képes reaktiválódni (13). Az idősebb populációban, illetve immunszupprimált állapotban a CMV megjelenhet a testnedvekben (14). Valószínűsíthető, hogy a szem hematogén úton történő fertőzése is immunszupprimált státuszhoz kapcsolódik, amely a disszemináció hatására okoz retinitist (15). A szem aktív CMV-fertőzése az érhálózat endothelsejtjeit, valamint a retina pigmentepithelsejtjeit érinti (15), így alakul ki a vírusretinitis klinikai képe. Immunledált pácienseknél a CMV-fertőzés a gasztrointesztinális traktust is érintheti. A gasztrointesztinális szöveti invazív (TI-GI) CMV a komorbiditással is rendelkezdő immunszupprimált betegeket érintő kórkép, amely kialakulási helye leggyakrabban (94%) a colon (16). Bemutatott páciensnél 2019 augusztusában eltávolított coecumtumor kórszövettana a vastagbél CMV-asszociált elváltozását támasztotta alá.
A HAART (highly active antiretroviral therapy) éra előtt a CMV-retinitis elsősorban, mint HIV-pozitív betegekben kialakuló leggyakoribb opportunista szemészeti infekció, és AIDS-ben a látásvesztés leggyakoribb okaként volt ismert világszerte (17). Kockázat szempontjából a 200/mm3 alatti CD4+ sejtszám, az alacsony CD8+ sejtszám, illetve a már meglévő HIV okozta (nem infektív) retinopathia hajlamosító tényezők a CMV retinitis kialakulásában. A HIV-retinopathia nem infektív microangiopathia, amelyet a szemfenéken megjelenő cotton-wool gócok, intraretinális vérzések, mikroaneurizmák és exsudatumok megjelenése jellemez. Az állapot fennállásakor annak rendszeres kontrollja javasolt a vele esetlegesen szövődő CMV-retinitis korai diagnosztikája céljából (18).
Nem HIV-hez asszociált CMV-retinitis kialakulhat az immunszuppresszió különböző formáiban. Ezekhez tartozik a szolid szerv-, csontvelő- és haemopoeticus őssejttranszplantáció, vese-, szív-, tüdőtransztranszplantáció. Ezek kapcsán írtak már le CMV-retinitist, amelynek oka az allograft által okozott primer CMV-infekció vagy a transzplantáció miatt alkalmazott immunszuppresszió okozta reaktiváció (19). Limfoproliferatív betegség miatt autológ őssejt-transzplantációban részesült betegek vérplazmáját valós idejű PCR-rel vizsgálva a CMV-pozitivitás kétszeres gyakorisággal fordult elő a transzplantált betegcsoportban, azonban 68%-ukban a reaktiváció tünetmentes volt és spontán oldódott. Rutinszerű CMV-monitorozást nem tartanak szükségesnek autológ őssejt-transzplantáció után, azonban jól meghatározott betegcsoportban lehetséges a reaktiváció korai észlelése, korai kezelése, ezáltal a mortalitás csökkentése (20). A vérképzőszervi daganatokban az immunszupprimált státuszt maga az alapbetegség okozza, ennek része a csökkent T-sejt-szám (21).
Leukémiás és lymphomás intraocularis infiltráció differenciáldiagnosztikai nehézséget jelent CMV-retinitisben, ezekben az esetekben mindenképp intraocularis mintavételre van szükség (22). Az alacsony hemoglobinkoncentráció is hozzájárul a CMV-retinitis kialakulási kockázatához (25). Helyileg adott periocularis vagy intraocularis szteroidadást követően is írtak le CMV-retinitist immunkompetens személyek esetében (23). Szisztémás kortikoszteroid-terápia vagy a szteroidot kiváltó immunszuppresszív szerek mellett is kialakulhat CMV-retinitis (24).
A CMV-retinitis – nem HIV és HIV-asszociált esetekben egyaránt – a betegek mintegy felében tünetmentesen alakul ki, az esetek másik felénél látásromlás, úszkáló homályok, szikralátás és látótérkiesés jellemzi (25). A retinitis súlyosbodásával a makula és a látóideg is érintetté válik (26, 27). Felnőtteknél a CMV-retinitis 85%-ban a retina perifériáján jelenik meg, az izolált makulaérintettség ritka (5%). Gyermekeknél a makula gyakrabban érintett (28). Háromféle klinikai megjelenése lehet a CMV-retinitisnek. Első esetben főként a retina perifériáján alakulnak ki fehér színű, granulált, nekrotikus retinaterületek, kevés vérzéssel vagy anélkül. A második, fulmináns formát teljes vastagságú sárgásfehér léziók jellemzik, amelyeket szektorszerűen, perivaszkulárisan retinavérzések öveznek („cottage cheese and ketchup” vagy „pizza pie” fundusképnek is nevezik). A harmadik megjelenési forma „fagyott ág” rajzolatú érgyulladás („frosted branch angiitis”). HIV-vel szövődött CMV-retinitis esetén az érgyulladás jellegzetesen periphlebitis formájában alakul ki (29), bemutatott esetünkben ettől eltérően a nagy artériák gyulladása látható (1–2. ábra).
Legjellegzetesebb a CMV-retinitisben a léziókat övező elmosott szélű fehéres határ, amelyet a retinalis ödéma és nekrózis okoz (30). Ez az utóbbi fehér elmosott terület az immunstátusznak megfelelően különböző nagyságú lehet. A folyamat progressziójának következtében a retina atrófiássá válik, retinaszakadás alakulhat ki, és retinaleválás következhet be. Bár a CMV döntően a hátsó szegmentumot érinti, réslámpával megfigyeltek csillag alakú, cornealis depozitumokat is. Immunkompetens személyeknél a CMV okozója lehet elülső uveitisnek, ekkor a csillag alakú cornealis depozitumok és az elülső szemcsarnok gyulladása jellemző, retinitis nem alakul ki (31).
A CMV-retinitis diagnózisa döntően a klinikai jeleken alapul. Pupillatágítás mellett a retinitis jelei jellegzetesek. A klinikai jeleken túl az SD-OCT (spektrál-domain optikai koherencia tomográfia) és a fundus autofluoreszcencia hozzájárulnak a CMV-retinitis diagnózisához, a retina mikroszerkezetbeli változásainak követéséhez (32). Aktív CMV-retinitisben a leggyakoribb, OCT-vel látható jelek a premakuláris üvegtest enyhe beszűrtsége, epiretinalis membránképződés és a makulaödémája (33). Nem HIV-fertőzött immunszupprimált betegeknél kialakuló CMV-retinitisben – eltérően a HIV-nél látott serosus exsudatív makulafolyamattól – előfordulhat a cisztoid makulaödéma, amely bemutatott esetünkben is megfigyelhető volt (33).
A CMV-retinitis klasszifikációjának kritériumait gépi tanulás módszerével határozta meg 2021-ben a SUN-munkacsoport. Eszerint a CMV-retinitis klasszifikációjához szükséges három kritérium: a nekrotizáló retinitis, amely elmosott szélű a számos kisebb szatellita lézió jelenléte miatt; a gyengült szisztémás immunstátusz; valamint vagy a jellegzetes klinikai kép vagy az intraocularis minta PCR-pozitivitása (34). A csarnokvízből vagy az üvegtestből vett minta PCR-vizsgálata a differenciáldiagnosztikai nehézséget jelentő esetekben jelent segítséget, leginkább a CMV, Herpes simplex, Varicella zoster, Toxoplasma elkülönítését teszi lehetővé. A CMV kimutatása fehérvérsejtekből is lehetséges manifeszt kórkép esetén, azonban ennek pozitivitásáig akár hetek is eltelhetnek (35). A CMV-antigén a szérumban a fertőzést követően akár hónapokig is kimutatható lehet (35).
Aktív CMV-retinitis esetén nagy dózisú szisztémás antivirális kezelés bevezetése szükséges. Kezdetben 14-21 napon keresztül, majd a betegség lefolyásának függvényében alacsonyabb dózisban. A léziók elhelyezkedése meghatározza a kezelést is. Azokban a betegekben, ahol nincs közvetlenül látást fenyegető lézió, elegendő a szisztémás kezelés szoros obszervációval. Látást fenyegető esetekben az azonnali intravitrealis kezelés is szóba jön. Önmagában az intravitrealis kezelés nem elégséges, rövid távon a szisztémás kezelés kiegészítője lehet. A CMV-retinitis kezelésében alkalmazható gyógyszerek a valganciklovir, ganciklovir, foscarnet, cidofovir (monofoszfát nukleotid analóg), a legfontosabb tudnivalókat 2. táblázatban foglaltuk össze. Az aciklovir CMV kezelésére nem alkalmazható, mivel a gyógyszernek specifikus foszforiláción kell átesnie ahhoz, hogy hatással legyen a vírusra. A ganciklovir volt az elsőként alkalmazott gyógyszer CMV-retinitisre, azonban szájon át nem hasznosul (36). Per os valganciklovir adható, amely a szervezeten belül alakul át ganciklovirré (37). A ganciklovirrel és valganciklovirrel szemben hosszú távú alkalmazás mellett rezisztencia alakulhat ki, amelynek oka a vírus mutálódása (38). Intravitrealisan az FDA által elfogadott fomivirsen adható, off-label alkalmazásként szóba jön még intravitrealisan ganciklovir, foscarnet és cidofovir adása is. Intravitrealis fomivirsen javasolt azon esetekben, amelyek a többi elérhető vírusellenes szerre nem reagálnak (39).

HIV és nem-HIV okozta CMV-retinitisben egyaránt a retinalis beszűrődések felszívódása, illetve a helyükön kialakuló atrófia jelzik a folyamat gyógyulását, a CMV inaktivitását. Fennálló immunszuppresszív kezelés mellett a folyamat gyógyulását követően is szoros követés javasolt, az esetlegesen kialakuló reaktiváció felismerésére (40). Bemutatott esetünk példa a gyógyult CMV-retinitist követően is fellépő, rendkívül nehezen kezelhető szövődmények következtében kialakuló maradandó, súlyos látásromlásra.
Következtetések
A CMV az opportunista fertőzések jelentős hányadában részt vevő kórokozó. Az egyik legveszélyesebb, immunszupprimált egyéneket fenyegető CMV-okozta kórkép a CMV-retinitis, amely látásvesztéshez vezethet. Ismert immunszupprimált állapoton kívül minden CMV-okozta fertőzés esetében gondolnunk kell HIV-fertőzésre, mivel a CMV jellegzetes kísérő kórokozó a manifeszt AIDS tünetegyüttesben (41). Immunszupprimált állapot kialakulhat a HIV-fertőzésen kívül szervtranszplantáció, hematológiai daganat, immunszuppresszív gyógyszeres kezelés következtében (42). Hematológiai betegség és a következményes immunszuppresszív terápiát követően alakult ki kétoldali CMV-retinitis esetünkben bemutatott nőbetegnél. Az említett csoportokban tekintettel a folyamat sokszor tünetszegény megjelenésére, javasolt rendszeres szemészeti kontroll elvégzése a kórkép korai felismerése és az időben megkezdett vírusellenes kezelés céljából.
Nyilatkozat
A szerzők kijelentik, hogy az esetismertetés közlemény megírásával kapcsolatban nem áll fenn velük szemben pénzügyi vagy egyéb lényeges összeütközés, összeférhetetlenségi ok, amely befolyásolhatja a közleményben bemutatott eredményeket, az abból levont következtetéseket vagy azok értelmezését.
Irodalom
1. Spaide RF, Gaissinger A, Podhorzer JR. Risk factors for cotton-wool spots and for cytomegalovirus retinitis in patients with human immunodeficiency virus infection. Ophthalmology 1995; 102: 1860–1864.
https://doi.org/10.1016/s0161-6420(95)30783-x
2. Iu LP, Fan MC, Lau JK, Chan TS, Kwong YL, Wong IY. Long-term Follow-up of Cytomegalovirus Retinitis in Non-HIV Immunocompromised Patients: Clinical Features and Visual Prognosis. Am J Ophthalmol 2016; 165: 145–153. https://doi.org/10.1016/j.ajo.2016.03.015
3. Kongyai N, Sirirungsi W, Pathanapitoon K, et al. Viral causes of unexplained anterior uveitis in Thailand. Eye (Lond) 2012; 26(4): 529–534.
https://doi.org/10.1038/eye.2011.363
4. Song MK, Karavellas MP, MacDonald JC, Plummer DJ, Freeman WR. Characterization of reactivation of cytomegalovirus retinitis in patients healed after treatment with highly active antiretroviral therapy. Retina 2000; 20: 151–155.
5. Jean Beltran PM, Cristea IM. The life cycle and pathogenesis of human cytomegalovirus infection: Lessons from proteomics. Expert Rev. Proteomics 2014; 11: 697–711. https://doi.org/10.1586/14789450.2014.971116
6. Coclite E, Di Natale C, Nigro G. Congenital and perinatal cytomegalovirus lung infection. J Matern Fetal Neonatal Med 2013; 26: 1671–1675.
https://doi.org/10.3109/14767058.2013.794207
7. Arribas JR, Clifford DB, Fichtenbaum CJ, Commins DL, Powderly WG, Storch GA. Level of cytomegalovirus (CMV) DNA in cerebrospinal fluid of subjects with AIDS and CMV infection of the central nervous system. J Infect Dis 1995; 172: 527–531. https://doi.org/10.1093/infdis/172.2.527
8. Koizumi N, Yamasaki K, Kawasaki S, Sotozono C, Inatomi T, Mochida C, Kinoshita S. Cytomegalovirus in aqueous humor from an eye with corneal endotheliitis. Am J Ophthalmol 2006; 141: 564–565. https://doi.org/10.1016/j.ajo.2005.09.021
9. Howard RJ, Najarian JS. Cytomegalovirus-induced immune suppression. I. Humoral immunity. Clin Exp Immunol 1974; 18: 109–118.
10. Reeves M, Sinclair J. Aspects of human cytomegalovirus latency and reactivation. Curr. Top Microbiol Immunol 2008; 325: 297–313.
https://doi.org/10.1007/978-3-540-77349-8_17
11. Zuhair M, Smit GSA, Wallis G, Jabbar F, Smith C, Devleesschauwer B, Griffiths P. Estimation of the worldwide seroprevalence of cytomegalovirus: A systematic review and meta-analysis. Rev Med Virol 2019; 29: e2034. https://doi.org/10.1002/rmv.2034
12. Varga M, Görög D, Kári D, Környei E, KisÉ, Túryné HJ, Jankovics I, Péter A, Toronyi É, Sárváry E, Fazakas J, Reusz G. Cytomegalovirus seroprevalence among solid organ donors in Hungary: correlations with age, gender, and blood group. Transplant Proc 2011 May; 43(4): 1233–5.
https://doi.org/10.1016/j.transproceed.2011.03.067
13. Bosamiya SS. The immune reconstitution inflammatory syndrome. Indian J Dermatol 2011; 56: 476–479. https://doi.org/10.4103/0019-5154.87114
14. Gulick RM, Mellors JW, Havlir D, Eron, JJ, Gonzalez C, McMahon D, Richman DD, Valentine FT, Jonas L, Meibohm A, et al. Treatment with indinavir, zidovudine, and lamivudine in adults with human immunodeficiency virus infection and prior antiretroviral therapy. N Engl J Med 1997; 337: 734–739. https://doi.org/10.1056/NEJM199709113371102
15. Carmichael A. Cytomegalovirus and the eye. Eye (Lond.) 2012; 26: 237–240.
16. Patra S, Samal SC, Chacko A, Vadakenadayil I, MMM M. Cytomegalovirus infection of the human gastrointestinal tract. Journal of Gastroenterology and Hepatology 1999; 14(10): 973–976. 2. táblázat: CMV-fertőzésben alkalmazott antivirális szerek. Forrás: American Academy of Ophthalmology https://www.aao.org/focalpointssnippetdetail.aspx?id=8f182331-5b2e-4199-a851-a682b283222c
https://doi.org/10.1038/eye.2011.327
17. Jabs DA, Ahuja, A, Van Natta, ML, Lyon, AT, Yeh, S, Danis R. Long-term Outcomes of Cytomegalovirus Retinitis in the Era of Modern Antiretroviral Therapy: Results from a United States Cohort. Ophthalmology 2015; 122: 1452–1463. https://doi.org/10.1016/j.ophtha.2015.02.033
18. Spaide RF, Gaissinger A, Podhorzer JR. Risk factors for cotton-wool spots and for cytomegalovirus retinitis in patients with human immunodeficiency virus infection. Ophthalmology 1995; 102: 1860–1864.
https://doi.org/10.1016/s0161-6420(95)30783-x
19. Cadogan M, Dalgleish AG. HIV immunopathogenesis and strategies for intervention. Lancet Infect Dis 2008; 8: 675–684.
https://doi.org/10.1016/S1473-3099(08)70205-6
20. Piukovics K, Terhes G, Bereczki Á, Borbényi Z, Gurbity Pálfi T, Kővári B, Urbán E. Monitoring cytomegalovirus infection and reactivation using quantitative real-time polymerase chain reaction in patients with haematological malignancies during chemotherapy and after autologous stem cell transplantation. Orv Hetil 2016 Aug; 157(35): 1403–9.
https://doi.org/10.1556/650.2016.30516
21. Miao H, Tao Y, Jiang YR, Li XX. Multiple intravitreal injections of ganciclovir for cytomegalovirus retinitis after stem-cell transplantation. Graefes Arch Clin Exp Ophthalmol Graefes Arch Clin Exp Ophthalmol 2013 Jul; 251(7): 1829v33. https://doi.org/10.1007/s00417-013-2368-6
22. Derzko-Dzulynsky LA, Berger AR, Berinstein NL. Cytomegalovirus retinitis and low-grade non-Hodgkin’s lymphoma: Case report and review of the literature. Am J Hematol 1998; 57: 228–232. https://doi.org/10.1002/(sici)1096-8652(199803)57:3<228::aid-ajh9>3.0.co;2-x
23. Hodge WG, Boivin JF, Shapiro SH, Lalonde RG, Shah KC, Murphy BD, Diaz-Mitoma F. Laboratory-based risk factors for cytomegalovirus retinitis. Can J Ophthalmol 2004; 39: 733–745.
https://doi.org/10.1016/s0008-4182(04)80067-x
24. Delyfer MN, Rougier MB, Hubschman JP, Aouizerate F, Korobelnik JF. Cytomegalovirus retinitis following intravitreal injection of triamcinolone: Report of two cases. Acta Ophthalmol Scand 2007; 85: 681–683. https://doi.org/10.1111/j.1600-0420.2007.00915.x
25. Kulshrestha MK, Goble RR, Murray PI. Cytomegalovirus retinitis associated with long term oral corticosteroid use. Br J Ophthalmol 1996; 80: 849–850. https://doi.org/10.1136/bjo.80.9.849-a
26. Lai TY, Wong RL, Luk FO, Chow VW, Chan CK, Lam DS. Ophthalmic manifestations and risk factors for mortality of HIV patients in the post-highly active anti-retroviral therapy era. Clin Exp Ophthalmol 2011; 39: 99–104. https://doi.org/10.1111/j.1442-9071.2010.02400.x
27. Kuppermann BD, Petty JG, Richman DD, Mathews WC, Fullerton SC, Rickman LS, Freeman WR. Correlation between CD4+ counts and prevalence of cytomegalovirus retinitis and human immunodeficiency virus-related noninfectious retinal vasculopathy in patients with acquired immunodeficiency syndrome. Am J Ophthalmol 1993; 115: 575–582.
https://doi.org/10.1016/s0002-9394(14)71453-9
28. Wei LL, Park SS, Skiest DJ. Prevalence of visual symptoms among patients with newly diagnosed cytomegalovirus retinitis. Retina 2002; 22: 278–282. https://doi.org/10.1097/00006982-200206000-00004
29. Wren SM, Fielder AR, Bethell D, Lyall EG, Tudor-Williams G, Cocker KD, Mitchell SM. Cytomegalovirus Retinitis in infancy. Eye (Lond.) 2004; 18: 389–392. https://doi.org/10.1038/sj.eye.6700696
30. Rabb MF, Jampol LM, Fish RH, Campo RV, Sobol WM, Becker NM. Retinal periphlebitis in patients with acquired immunodeficiency syndrome with cytomegalovirus retinitis mimics acute frosted retinal periphlebitis. Arch Ophthalmol 1992 Sep; 110(9): 1257–60.
https://doi.org/10.1001/archopht.1992.01080210075028
31. Geng S, Ye JJ, Zhao JL, Li TS, Han Y. Cytomegalovirus retinitis associated with acquired immunodeficiency syndrome. Chin Med J (Engl.) 2011; 124: 1134–1138.
32. Walter KA, Coulter VL, Palay DA, Taravella MJ, Grossniklaus HE, Edelhauser HF. Corneal endothelial deposits in patients with cytomegalovirus retinitis. Am J Ophthalmol 1996; 121: 391–396.
https://doi.org/10.1016/s0002-9394(14)70435-0
33. Gupta MP, Patel S, Orlin A, Marlow E, Chee RI, Nadelmann J, Chan RVP, D'Amico DJ, Kiss S. Spectral domain optical coherence tomography findings in macula-involving cytomegalovirus retinitis. Retina 2018 May; 38(5): 1000–1010. https://doi.org/10.1097/IAE.0000000000001644
34. Maguire AM, Nichols CW, Crooks GW. Visual loss in cytomegalovirus retinitis caused by cystoid macular edema in patients without the acquired immune deficiency syndrome. Ophthalmology 1996 Apr; 103(4): 601–5. https://doi.org/10.1016/s0161-6420(96)30646-5
35. Standardization of Uveitis Nomenclature (SUN) Working Group. Classification Criteria for Cytomegalovirus Retinitis. Am J Ophthalmol 2021 Aug; 228: 245–254. https://doi.org/10.1016/j.ajo.2021.03.051
36. Drenaggi D, Pauri P, Sigismondi C, Nuzzo MM, Mariwan I, Schimizzi AM, Cerioni O, Brugia M, Scalise G. Observations about the treatment of Cytomegalovirus retinitis in patients with HIV infection using Ganciclovir and Foscarnet. InfezMed 1998; 6: 148–152.
37. Vadlapudi AD, Vadlapatla RK, Mitra AK. Current and emerging antivirals for the treatment of cytomegalovirus (CMV) retinitis: An update on recent patents. Recent Pat Anti-Infect Drug Discov 2012; 7: 8–18.
https://doi.org/10.2174/157489112799829765
38. Martin DF, Sierra-Madero J, Walmsley S, Wolitz RA, Macey K, Georgiou P, Robinson CA, Stempien MJ. A controlled trial of valganciclovir as induction therapy for cytomegalovirus retinitis. N Engl J Med 2002; 346: 1119–1126. https://doi.org/10.1056/NEJMoa011759
39. Lurain NS, Chou S. Antiviral drug resistance of human cytomegalovirus. Clin Microbiol Rev 2010; 23: 689–712.
https://doi.org/10.1128/CMR.00009-10
40. Roehr B. Fomivirsen approved for CMV retinitis. J Int Assoc Physicians AIDS Care 1998 Oct; 4(10): 14–6.
41. Iu LP, Fan MC, Lau JK, Chan TS, Kwong YL, Wong IY. Long-term Follow-up of Cytomegalovirus Retinitis in Non-HIV Immunocompromised Patients: Clinical Features and Visual Prognosis. Am J Ophthalmol 2016; 165: 145–153. https://doi.org/10.1016/j.ajo.2016.03.015
42. Kim DY, Jo J, Joe SG, Kim JG, Yoon YH, Lee JY. Comparison of Visual Prognosis and Clinical Features of Cytomegalovirus Retinitis in Hiv and Non-Hiv Patients. Retina 2017; 37: 376–381.
https://doi.org/10.1097/IAE.0000000000001144
